Method Article
in vitroおよびin vivoモデルでは血管壁の下でフローの状況に細菌付着を研究するために、
要約
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
要約
血管内感染症および感染性心内膜炎を引き起こすために、細菌は、血液の流れのせん断応力にさらされながら、血管壁に付着することができる必要があります。
微生物の血管接着に寄与する細菌と宿主因子を同定するために、生理学的剪断条件下で、これらの相互作用を研究する適切なモデルが必要とされています。ここでは、細胞外マトリックスの異なるコンポーネントに細菌の付着を調査するか、内皮細胞を可能にするインビトロフローチャンバーモデル、およびin vivoで直接内臓循環への細菌の初期接着を可視化するために開発された生体顕微鏡のモデルを記述します。これらの方法は、流れの下の細菌の付着のために必要な細菌と宿主因子を同定するために使用することができます。我々は、せん断応力の妥当性とStaphyの接着のためのフォンビルブランド因子の役割を示していますlococcus球菌の両方のin vitroおよびin vivoモデルで使用して。
概要
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
プロトコル
動物実験は、ルーヴェンカトリック大学の倫理委員会によって承認されました。
インビトロ灌流およびin vivo実験 1.準備細菌
- 我々はSを使用しましたこの原稿に記載されているすべての実験のための黄色ブドウ球菌株ニューマン。S.黄色ブドウ球菌 Newmanのを-80℃で10%グリセロールにブレインハートインフュージョン(BHI)中に保存しました。
- (3 OD 600>)、37℃でO / N凍結細菌を掻き落としおよび5に接種するために滅菌ループを使用mlのトリプシン大豆ブロス(TSB)。
- 遠心分離によって細菌を洗浄し(2600グラム、室温、5分)、5mlのPBS(リン酸緩衝生理食塩水)中に細菌ペレットを再懸濁します。
- エタノール中の5(6) - カルボキシフルオレセインN-ヒドロキシエステル(カルボキシ - フルオレセイン)の1 mg / mlの溶液を調製します。実験室グレードの水で150μgの/ mlに1 mg / mlのカルボキシフルオレセイン溶液( 例えば、ミリQ水)で希釈します。光からチューブを守ります-20℃でアルミ箔とストアと。
- (2,600×gで、室温、5分)細菌を遠心します。 800μlのPBS中に細菌ペレットを再懸濁し、200μlまたは150 / mlのカルボキシ-フルオレセイン溶液を400μl(最終濃度in vivo実験のために50μg/ mlの)(灌流実験のための30μg/ mlの最終濃度)を追加します。アルミホイルで光からチューブを保護し、シェーカー上で室温で30分間インキュベートします。
- 標識後、PBS中に6%のウシ血清アルブミン(BSA)溶液でブロック。
- 光学密度測定を用いて細菌(OD)、OD in vitro実験のための0.65の600を希釈し(とOD インビボ実験のための1.8の600(約3×10 8コロニー形成単位(CFU) 黄色ブドウ球菌用/ mlに相当します) PBS中の黄色ブドウ球菌では約1×10 9 CFU / mlの)に対応します。アルミホイルで光からチューブを保護し、氷の上に残します。
2. インビトロ灌流実験
- ガラスカバースリップのコーティング
- 実験室グレードの水でフォン·ヴィレブランド因子(VWF)(Haemate P、ストック濃度2,400μgの/ ml)に希釈し、50μg/ mlの最終濃度まで(蒸留脱イオン)。
- 160 / mlの最終濃度まで(製造業者によって供給されるSKF液、pHを2.7から2.9)、等張グルコース溶液中のコラーゲンを希釈。
- パラフィルム上のコーティングの200μLを滴下し、液滴の上にカバースリップを置くことにより、VWFまたはコラーゲンでコートしたカバーガラス(24×50ミリメートル)。液滴は、カバーガラスの表面に沿って拡散します。
- 室温で4時間、加湿容器にカバースリップをインキュベートします。慎重に鈍い針でパラフィルムからカバーグラスを持ち上げます。フローチャンバーの底部にカバースリップをマウントします。
- プラスチックのコーティングは、内皮細胞でスリップ
- コートプラスチックスリップPBS中の1%ゼラチン溶液1ml(1ウェルPCA細胞培養チャンバー、ザルスタット、ドイツ)を、37℃で30分間インキュベートします。ゼラチンコーティングされたプラスチック製のスリップ上シードヒト臍帯静脈内皮細胞(HUVEC)および70〜80%の密集度にそれらを成長させます。フローチャンバーの底部にあるプラスチック製のスリップをマウントします。
- かん流実験
注: インビトロ灌流モデルの概略図を図1に示されています。- 異なる生理学的流れの条件をシミュレートするために2.5ダイン/ cm 2で20ダイン/ cm 2の間に層状剪断応力でマイクロ平行プレートフローチャンバーインビトロ細菌付着試験を行います。
- フローチャンバー(社内の設計)は、金属フレーム及びプレキシガラスで作られた灌流チャンバー(ポリ(メチル)メタクリレート(PMMA))からなります。高精度の注入ポンプ(PHD 2000輸液、ハーバード装置、USA)に接続することによって、我々は、RAの流れを生成することができ0.0001マイクロリットル/分、220.82ミリリットル/分のTES。
- フローチャンバーの上部にチューブを接続し、チューブに培地を注入します。静かに底部の上にフローチャンバの上部に配置し、フローチャンバーを組み立てます。気泡がないように注意してください。室内に漏れていないことを確認すると、過剰な塗布液を除去するために、チャンバを通って培地1mlを注入します。気泡を避けます。
- 顕微鏡トレイに37℃の熱制御加熱パッドの上にマウスを置きます。これは、端末の手順であるため、厳密な無菌の手順は必要ありません。頸静脈の近くの切開を行い、そっと子宮頸部筋肉の右側を削除し、周囲の組織から頸静脈を分離します。
- 輸液ポンプや蛍光顕微鏡を設定します。輸液ポンプの設定は、シリンジの直径と所望の流量(2.4節を参照)に依存しています。これからは、暗い部屋で働いています。
- VWFコーティング:
- 蛍光標識された細菌と注射器を記入し、入口管に接続します。気泡を避けます。 10分間の注入ポンプを起動します。注入時間は、使用されるせん断速度およびコーティング、細菌やメディアに依存し、密着性の安定した状態を表している必要があります。
- 10分後、導入管にPBSで注射器を接続し、輸液ポンプを起動して、非結合細菌を洗い流します。
- 洗浄工程の後に異なる場所で少なくとも15画像や動画を取ります。細菌は小さく、集中することが潜在的に困難です。 インビトロ流動実験の前に、適切な焦点面をカバースリップ上で蛍光標識された細菌の滴を配置し、フローチャンバー内にカバースリップを配置することによって取得することができます。次に、適切な焦点面を検索し、設定を保存します。
注:in vitroでの流動実験中に、洗浄工程(開始後±5分)の間に画像を捕捉することだけを保証します付着細菌のための信号が捕捉されます。
- コラーゲンコーティング:
- ただ灌流を開始する前に、蛍光標識された細菌に60 / mlののVWFを追加します。 60 / mlのVWFを補充した蛍光標識細菌または蛍光標識された細菌を注射器を記入し、入口管に接続します。気泡を避けます。繰り返しの手順は2.3.5.3に2.3.5.2
- 内皮細胞:
- のCa 2+ -ionophore A23187の0.1 mM溶液で灌流による内皮細胞を活性化して灌流によって10分間細菌灌流と同じせん断速度でDMEM中(ストック溶液をジメチルスルホキシド(DMSO)に溶解した10mMの) 0.1 mMの。繰り返して、2.3.5.3に2.3.5.2を繰り返します。
- 次のようにせん断速度とせん断応力を計算します。
せん断速度= 6Q / WH 2
:Q:流量W ml /分での速度、:センチ幅、H:cm単位の高さ
せん断応力(τ)=せん断ラット元粘度(μ)
どこμ:ミディアム:0.01ダインのx秒/ cm 2であり、全血:0.04ダインのx秒/ cm 2の - 画像解析
- 白黒カメラと倒立蛍光顕微鏡を使用してライブ画像を取得し、画像化ソフトウェアを使用して開発します。 1.5秒の露光時間を使用してください。ランダムフローチャンバーのコーティングされた表面上に広げ、適切なファイル形式で保存(少なくとも15)複数のスナップショットを取ります。
- ImageJので画像解析を実行します。と関心のある特徴にグレースケール画像をセグメント化、下側および上側のしきい値を設定するしきい値を定義 - 画像(Substractバックグラウンド·プロセス)からのスムーズな連続バックグラウンドを除去するためのバックグラウンドを減算します。閾値に制限された領域を測定します。
- 細菌の付着を比較し、統計分析ソフトウェアを用いて、例えば 、蛍光領域として表さ。一方向ANOVAまたはTを使用してグループを比較しますWO-両側スチューデントt検定を。平均値の平均値±標準誤差(SEM)としてすべての値を報告します。重要な<0.05のp値を考えてみましょう(* P <0.05; ** P <0.01; *** P <0.001)。
インビボ腸間膜灌流モデル3.
- マウスの作製/手術
- 便通を制限するために、実験前の夜、マウスを絶食。
- ブプレノルフィンの皮下注射手術前に(0.1 mg / kg体重(BW))20〜30分まで6〜8週齢のマウス(C57BL / 6)手術前鎮痛を与えます。
- ケタミンの腹腔内注射(125 / kg体重)およびキシラジン(12.5 / kg体重)で、マウスを麻酔。ペダル反射により確認してください。乾燥を防ぐために、獣医軟膏を適用します。
- 顕微鏡トレイに37℃の熱制御加熱パッドの上にマウスを置きます。これは、端末の手順であるので、厳密asceptiを必要としませんCプロシージャ。頸静脈の近くの切開を行い、そっと子宮頸部筋肉の右側を削除し、周囲の組織から頸静脈を分離します。
- 蛍光標識された細菌または他の溶液の注入のための右頸静脈に2フランス語静脈カテーテルを挿入します。腹部正中切開により腹腔を開き、腸間膜を広げるために綿棒を使用し、腸間膜動脈と細静脈循環を可視化します。
- 透明板の右側にマウスを置き、テープでカニューレを固定します。低体温症を防ぐためにホットパックを使用してください。組織の脱水を防ぐために、腸に500μlの0.9%のNaClをドロップします。
- 腸間膜循環への細菌付着の蛍光顕微鏡
- 暗い部屋で働いています。船を固定し、倒立顕微鏡下でそれらを視覚化するために綿棒を使用してください。
- 局所的に10 mM溶液oの5μLを適用FのCa 2+ -ionophore A23187は、DMSOに溶解しました。 10秒後、頸静脈カテーテルを介して(ステップ1を参照)100μlの標識された細菌を注入します。タイムラプス画像を撮影します。実験が終了した後、機関承認ガイドラインに従ってマウスを安楽死させます。
- 画像解析
- 倒立蛍光顕微鏡を使用してライブ画像を取得し、白黒カメラを用いて捕捉され、任意の画像処理ソフトウェアを使用して開発しました。自動露光時間と使用する機器に固有のコントラストの最適化を適用します。
- 千枚/秒の40サイクルを使用して - ツールバー(時間多次元買収)の「取得」ツールを使用してタイムラプス画像を取得します。適切な画像ファイル形式で画像を保存します。
- 画像あたりの蛍光シグナルの面積を測定するためにImageJの解析ソフトウェアを用いて処理画像。 Fにグレースケール画像をセグメント、下側及び上側のしきい値を設定するしきい値を定義します興味の特長。金利(血管)の領域を特定し、しきい値と関心領域に制限された領域を測定します。細菌の付着を比較し、いずれかの統計やグラフ作成ソフトウェアを使用して蛍光領域として表現。
結果
VWFへの黄色ブドウ球菌の接着、内皮下マトリックスおよび内皮細胞は、せん断応力に依存する現象であります
S.との間の相互作用におけるせん断応力の役割を強調するために、 黄色ブドウ球菌およびVWF、我々 は、in vitro灌流モデルを図1に示されているの概略図(異なるせん断速度でVWFの上にコーティングされたカバースリップを灌流を行った。 黄色ブドウ球菌の付着VWFに250秒からせん断速度を増加させる-1 2,000に伴って増加しました秒-1( 図2)、高剪断力は、VWFへの細菌の付着を阻害するが、強化しないことを示します。
コラーゲンへの内皮下マトリックスの主成分を細菌付着に対するVWFの寄与を調べるために、我々は、蛍光標識されたS.を潅流VWFの存在下または非存在下でのコラーゲンの上に黄色ブドウ球菌 。 VWF、S.の付着がない場合Aコラーゲンへのureusはせん断速度の増加に伴って減少しました。しかし、VWFは、Sの密着性媒体中に存在したとき黄色ブドウ球菌は、剪断速度を( 図3)の増加とともに増加しました。
in vitroでのフローモデルはまた、私たちは流れの下で内皮細胞への細菌の付着を調べることができます。我々は、蛍光標識されたSでのHUVECを灌流せん断速度で500〜2000秒球菌 -1。示される場合には、HUVECをVWFの放出を引き起こすためにはCa 2+ -ionophoreで活性化しました。内皮細胞の活性化およびその後のVWFのリリース、Sの増加接着リニア延伸VWF分子に沿って細菌の結合を示唆し、せん断力( 図4B)の方向に整列した細菌のクラスタを蛍光標識の典型的な「紐状」パターンを形成球菌 ( 図4A)。
生体内での最初の内臓静脈内細菌の付着はVWFによって媒介されます
S.ので、 生体内で活性化され、血管壁への細菌の付着を調査するために( - - / VWF)球菌は VWFに付着することができ、我々は(VWF + / +)とVWF欠損マウス野生型マウスを使用していました。内臓血管のリアルタイムビデオ顕微鏡は、蛍光標識されたS.循環のインビボでの可視化を可能にしました球菌(in vivoでの灌流モデルの概略図を図5に示されています)。
のCa 2+ -ionophoreによる内皮の薬理学的活性化の後、我々は、WTマウスの血管壁への個々の細菌や細菌の凝集体の迅速な局所的蓄積を観察した(補足ビデオ1及び2)。ほとんどの細菌の付着は、VWF -deficieの活性化血管壁に見られませんでした。NTマウス(補足ビデオ3)WTマウスにおける接着と比較した( 図6)。 VWFの非存在は、Sの能力を低下させます活性化した血管壁に付着する黄色ブドウ球菌 。
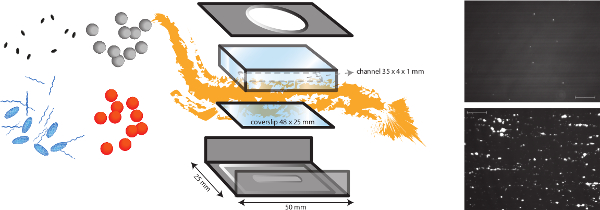
図1. インビトロ流モデルの略図。 インビトロ流モデルは、内皮下マトリックスへの細菌の付着などの異なるせん断依存機構の研究を可能にするだけでなく、形成を血栓多機能モデルです。マイクロパラレルフローチャンバーは、タンパク質および内皮細胞の異なるコーティングを有するカバースリップ(プラスチックまたはガラス)上に配置されます。異なる細菌(オレンジ、グレードット)の付着を分析することができ、血漿タンパク質、血小板、全血の存在の影響を評価することができます。血小板のための蛍光マーカー(青楕円)またはfibrinogEN(青ストリング)は、細菌と宿主因子を区別するために別の阻害剤(黒色楕円)と組み合わせて使用することができます。 Sの細菌付着の代表的な画像VWFの存在(下)中のコラーゲンコーティングまたは非存在下(上)に黄色ブドウ球菌が (スケールバーは100μmである)が示されている。 この図の拡大版を表示するには、こちらをクリックしてください。
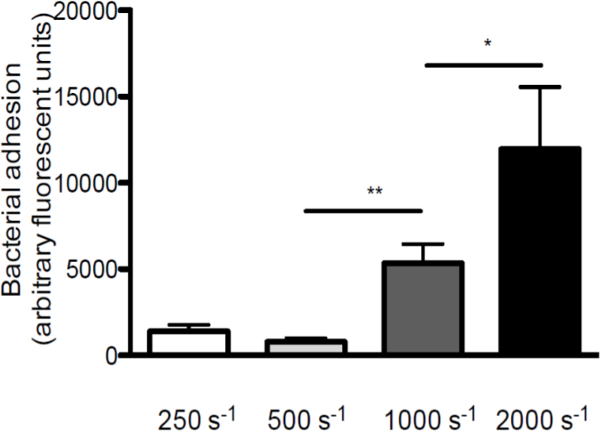
Sの図2.接着増加せん断速度とVWFの増加に黄色ブドウ球菌。S.蛍光標識でコーティングされたVWF(50μg/ mlの)上のマイクロパラレルフローチャンバー灌流250〜2,000秒-1培地中で(秒-1)(N> 5)のせん断速度で球菌ニューマン。全ての結果は平均±SEMとして表されます。 * P <0.05、** p <0.01。
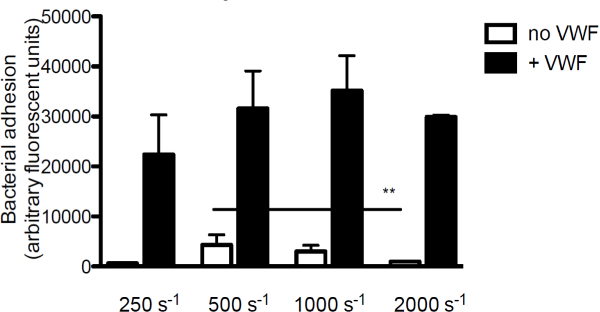
S.図3接着内皮下層への黄色ブドウ球菌は 、せん断およびVWF依存している。と、蛍光標識したS.コーティングされたコラーゲン(160 / mlの)上のマイクロパラレルフローチャンバー灌流培地中の250秒〜2000 -1のせん断速度(nは> 5)で球菌ニューマン。示されている場合VWF(60μgの/ ml)を培地中に存在しました。全ての結果は平均±SEMとして表されます。 ** P <0.01。
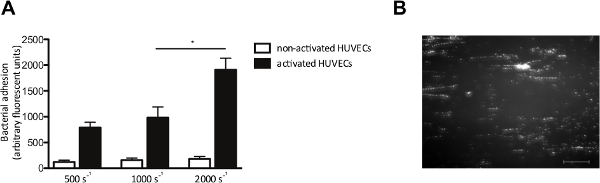
Sの図4.接着活性化内皮細胞へ球菌は、内皮細胞上の依存せん断。マイクロパラレルフローチャンバー灌流あります 。 (A)ヒト臍帯静脈内皮細胞のCa 2+を-ionophore Aで活性化しましたS.蛍光標識の10分間の灌流に続いて23187(0.1ミリモル)培地中の500秒〜2000 -1のせん断速度(nは> 5)で球菌ニューマン。全ての結果は平均±SEMとして表されます。 * p <0.05。 S.と活性化されたHUVECを超えるマイクロパラレルフローチャンバー灌流の(B)イメージ千秒-2。S.のせん断速度で、 黄色ブドウ球菌黄色ブドウ球菌は、VWF多量体との密着性を(スケールバーは100μmである)を示唆し、±200ミクロンの長さの文字列を形成している。 この図の拡大版を表示するには、こちらをクリックしてください。

図5 の生体内腸間膜灌流モデルの概略図。右頸静脈カテーテルは、(黄色の線)フッ素を投与するために挿入され、escently標識された細菌(オレンジドット)、追加の麻酔薬またはそのような医薬阻害剤および抗体などの他のコンポーネント。腹腔を開き、腸間膜は、蛍光顕微鏡下での血管(静脈および動脈)を可視化するために広がっています。 VWFの放出を誘導したCa 2+ -ionophoreによる内皮細胞の薬理学的活性化の後、細菌は、頸静脈カテーテルを介して注入することができます。リアルタイム血管内ビデオ顕微鏡は、蛍光標識された細菌や細菌血小板血栓の形成得られた循環の in vivo可視化を可能にする。 この図の拡大版を表示するには、こちらをクリックしてください。
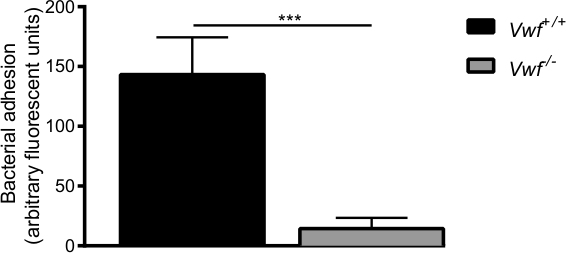
図6. Sの初期接着球菌in vivoでの活性化内皮にはVWFが介在する C57BL / 6 VWF + / +およびC57BL / 6 VWFとのインビボ静脈腸間膜灌流モデル- / -マウス。蛍光標識されたSの接着局所的に活性化された血管壁に球菌VWFに有意に低い- / -マウス。全ての結果は平均±SEMとして表されます。 *** P <0.001、n>は7。
ビデオ1:Sのリアルタイム接着VWF + / +マウスにおいて、活性化された血管壁に黄色ブドウ球菌 。 このビデオを見るにはこちらをクリックしてください。
キープtogether.withinページ
ビデオ2:Sのリアルタイム凝集体形成および塞栓VWF + / +マウスにおける黄色ブドウ球菌 。 このビデオを見るにはこちらをクリックしてください。

ビデオ3:Sのリアルタイム接着 - / -マウス- / - 。VWF + / +およびVWFを有するマウス においてインビボ腸間膜灌流モデル球菌VWF中の活性化血管壁へ 。のCa 2+ -ionophore(10ミリモル)の5μlをアプリでした可視化血管床の領域とエド。カルボキシ-フルオレセイン標識Sのサスペンション黄色ブドウ球菌は、頸静脈カテーテルを介して注入しました。腸間膜循環が倒立顕微鏡下で可視化した。 このビデオを見るにはこちらをクリックしてください。
ディスカッション
せん断応力は、血管壁への早期細菌付着および血管内または心臓内植生および転移性の感染症4,5の次の世代のための重要な要因です。我々は、生理的せん断応力下の血管内感染の病因を研究するためのin vitroおよびin vivoモデルで相補します。これらのモデルは、私たちは、主要なSとフォンビルブランド因子結合タンパク質(vWbp)を識別することができました球菌タンパク質はVWF 4を露出させ 、損傷した血管壁と流れの下で対話します。
血管内感染症、特に感染性心内膜炎は、だけでなく、ため、ローカルおよび遠隔( '転移')合併症の、ためだけでなく、敗血症誘発性の臓器不全と死の懸念されます。感染性心内膜炎および転移性の感染症を引き起こす細菌は、血管壁に付着し、したがって、血流の剪断応力に抵抗しなければなりません。最も細菌の研究が要因が静的な条件で行われてきた病原性。しかし、これらの確立された相互作用は、細菌宿主の相互作用に新たな、以前に認識されていない要因を明らかにすることができる流動条件下で剪断力と研究に耐えられない可能性があります。
マイクロパラレルフローチャンバーを用いて、他のものは血管接着用VWFの重要性を示しています。せん断応力下では、VWFは、次第にその静止球状構造から展開、およびそののGPIb受容体6を介して血小板と相互作用するA1ドメインを公開します。フローチャンバーは、広く血小板機能7を研究するために使用されています。
驚くべきことに、またS.流下球菌の付着は、剪断時に露出されるA1ドメインをVWFを必要とし、特に。我々は結合VWFを媒介するvWbpを同定しました。 vWbpは、Sに貢献コアグラーゼですホストのプロトロンビンを活性化することにより、 黄色ブドウ球菌の病態生理。 Staphylothrombin、RES細菌コアグラーゼとプロトロンビンとの複合体をulting、不溶性フィブリン8,9をフィブリンに変換します。我々の研究はvWbpがプロトロンビンを活性化するが、流れ4,10,11の下の血管への接着性を向上させる細菌フィブリン-血小板凝集物の形成をトリガするだけでなくことを示しました。
in vitroでのフローチャンバーモデルは、細胞またはマトリックスの構成要素に細菌付着で別の選手を研究することができます。細菌の毒性因子は、特定の表面タンパク質を発現する変異体または無害な細菌を用いて研究することができます。代替的に、薬理学的阻害剤または遮断抗体は、フローチャンバ内の培地に添加することができます。そのような細胞外マトリックスの種々の成分のような宿主因子の役割は、異なるコーティングでカバーガラスを使用して研究することができます。カバースリップは、また、活性化状態は、特定の刺激物質を添加することによって調節することができるそれらの内皮細胞で覆うことができます。アパ血管壁からのRTは、宿主の血液細胞および血漿タンパク質の寄与は流動媒体にこれらの要素を追加することによって調べることができます。したがって、複雑化の異なる条件は、細菌がin vivoで血管壁に付着することを可能にする相互作用を解明するために、層流の標準化された条件の下で研究することができます。
in vitroモデルで同定された相互作用は、その後、複雑な生物で、その妥当性をテストするために、動物モデルで研究されています。流れの下で動的な相互作用を研究するために、他のin vivoモデルは、ハムスターの背側皮下脂肪チャンバー12と精巣挙モデル13として、記載されています。対照的に、ここで説明する腸間膜灌流モデルは、可能性はマウスの遺伝的背景をホスト変えるためにおよび薬理学的介入を評価するために、その使いやすさのいくつかの利点を提供しています。
結論として、説明したモデルS.だけでなく表面タンパク質を研究する可能性を提供黄色ブドウ球菌が、別のホストの背景には多くの他の微生物の、より良い血管感染症の病因を理解します。
開示事項
著者らは、開示することは何もありません。
謝辞
この作品は、フォンVOOR Wetenschappelijk Onderzoek(FWO)ブラーンデレンG0466.10、11I0113Nによってサポートされていました。小児循環器、UZルーヴェン、ベルギーのための「エディ·メルクス研究助成」と「Sporta研究グラント」(JC)。分子および血管生物学のためのセンターは、ルーベン大学の「Geconcentreerde Onderzoeksacties」(GOA 13分の2009)とベーリンガーインゲルハイムからの研究助成金によって、Programmafinanciering KUルーベン(PF / 10/014)でサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
参考文献
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved