Method Article
内皮細胞接着性の定量
要約
We report an in vitro method that allows the quantitation of the actual number of adhesive cells within an endothelial cell monolayer.
要約
炎症の基本的プロセスの1つが、周囲の組織への血管の内腔からの免疫細胞の浸潤です。これは、内皮細胞、線血管は、例えば、単球などの免疫細胞の循環への接着性になったときに発生する。この接着性のインビトロ測定は、これまで、直接カウントとして内皮層に付着した単球の数を定量することによって行われていますまたは接着性単球の蛍光を間接的に測定することによって。このような測定は、内皮細胞集団の平均密着性を示す行うが、それらは、細胞の数などの要因の数によって混乱しており、実際に接着剤である内皮細胞の割合を明らかにしません。ここでは、説明し、内皮単層の試験された集団内の接着細胞の列挙を可能にする方法を示しています。内皮細胞はカバーガラス上で増殖させ、所望の次の治療は、(蛍光標識することができる)、単球で攻撃しています。インキュベーション後、浸漬および排水の複数ラウンドを含むすすぎ手順は、細胞が固定されています。単球によって囲まれている接着性内皮細胞は、容易に識別され、接着剤である集団内の内皮細胞の実際の割合を明らかに密着度を与えて、列挙されています。
概要
このような血管を裏打ちする内皮細胞層を横切る単球などの免疫細胞の浸潤は、炎症1のプロセスの重要なステップです。これは、損傷部位への免疫細胞(免疫細胞)のホーミングを可能にします。例えば、冠状動脈と頸動脈などの他のインスタンスと場所において、内皮層を介して単球の浸潤は、潜在的にプラーク2の形成をもたらす、動脈壁におけるこれらの細胞の望ましくない長期居住につながることができます。免疫細胞浸潤のすべての場合において、最初のステップは、血管の局所領域における内皮細胞の活性化を伴います。内皮細胞は、内皮細胞表面3に免疫細胞の動員および取り付けを容易VCAM、ICAMおよびE-セレクチンなどの細胞表面タンパク質の発現を増加させるために、このようなTNF-α及びIL-6などの炎症性サイトカインによって活性化されます6。
最初に、内皮細胞の接着の測定は、単層7内皮に接着単球を計数することにより行いました。精度の点で、この方法の制限は、リンパ球または単球の接着4に相当する放射性物質の定量化に続いて放射性標識されたリンパ球や単球の使用につながりました。この方法は、最終的に目的の免疫細胞は、蛍光色素で標識し、代わりに、放射能の蛍光を測定することが8である差分と、上記と同様の操作を行ったことにより、蛍光ベースの方法、取って代わられました。現在、この方法が最も便利なとして浮上している、いくつかの商業的供給業者によってキットの形態で販売されています。このアッセイは、対照と実験サンプルとの密着性の相対的レベルを測定することができますが、それは蛍光の変化は、全体の電子全体の密着性が均一な変化によるものであるかどうかを明らかにしませんndothelial細胞集団または変化は、細胞の亜集団内の接着性の差である場合。これは、洗浄のストリンジェンシーは、結果に大きな影響を及ぼし、さらに重要なことには、別の内皮細胞単層との間に結合していない単球をオフすすぎの均一性は、サンプル間の結果の複製からの結果の近さと再現性に大きく影響することも明らかです。より最近では、内皮細胞単層を横切る媒体に単球ポンプいくつかのシステムでは、この問題9に対処するために使用されました。また、これらのフローシステムはまた、内皮細胞上の剪断力の影響を再現します。このようなシステムの利点は明確で非常に魅力的であるが、急性炎症の場合のように、そのようなそのような電離放射線などのTNFα、いくつかの他の活性剤、などの要因によって、内皮細胞の接着性を大幅に増強することができるがことを理解することも重要です10惹起は、Tを変更します帽子は容易にこれらの非常に厳格なシステムによってin vitroで実験的な時間枠内で検出されていません。内皮細胞の接着性の微小な変化を容易に見逃しまたはインビトロで却下されているが、それは、慢性炎症の特徴であるライフタイム内でこのような小さな変化は、非常に重要な成果を発揮することができる生体内で必ずしも良性ではありません。従って、内皮細胞の接着性を検出し、測定するための堅牢な、まだ感受性、及び具体的な方法が必要とされます。
ここでは、直接内皮細胞の接着性を測定するための方法を報告しています。この方法は、内皮細胞の接着性の間接的な代理指標として蛍光測定には依存しません。これは、接着性の変化はすべてのセルにわたって均一変化に起因または亜集団に限定されているかどうかを明らかにする。さらに、このような老化関連β-ガラクトシダーゼ、細胞生存率擦傷などのマーカーとの内皮細胞の共染色を可能にしますKER、Calcien AMと特定の細胞状態または特定のタンパク質の発現の個々の接着剤、内皮細胞の結合を可能にする細胞表面および細胞内タンパク質に対する抗体。
プロトコル
ガラスカバースリップの調製
- エタノールへのすべてのカバーガラスの総曝露を確実にするために、時々撹拌しながら少なくとも10分間、70%エタノールでそれらを浸漬することにより直径12mm円形カバーガラスを滅菌します。滅菌細胞培養皿(6 cm以上直径10cmのいずれか)にカバーガラスとエタノールを注ぎます。
- 無菌微細5B鉗子のペアで、ピックアップし、24ウェルクラスタープレートのウェルに各個々のガラスカバースリップを配置。カバーガラスは、ウェルの側面に触れて、ウェルのほぼ中央にあるされていないことを保証するために注意してください。
- フローキャビネット中で乾燥するカバーガラスと未覆わ24ウェルクラスタープレートにしておきます。これは、約10分かかります
- この期間中に、0.1 mg / mlでのハンクス平衡塩溶液(HBSS)中に10mg / mlのヒトフィブロネクチンを希釈してコーティング混合物を調製します。
- カバーガラスを乾燥しているときは、各ガラスコ上に塗布液をピペットを100μlverslipその解決策は、ウェルの外側にプールすることなく、ガラスのみをカバーしています。少なくとも1時間、細胞培養インキュベーター中で覆われた24ウェルクラスタープレートを置きます。
- 使用直前に、塗布液を除去します。同じコーティング溶液を滅菌チューブに移し、有効性の目に見える損失で3回まで使用することができます。
内皮細胞単層の調製
- 37℃、5%二酸化炭素で培養培地中のヒト冠状動脈内皮細胞(EC)を。
- 吸引オフ培地、10mlのHBSSでEC単層をリンス
- HBSSを吸引除去し、2mlの0.5%トリプシン、0.2%EDTA溶液を加えます。約5分間、室温でインキュベートします。
- ECはフラスコの側にタップで追い出さできる場合には、大豆トリプシン阻害剤の5ミリリットルを追加し、ピペットでさらに細胞を除去するために、フラスコの表面に噴出。
- 15mlチューブ遠心チューブに細胞を移します5分間、200×gで。
- 上清を吸引除去し、メディア5mlのECペレットを再懸濁します。血球計数器を用いて細胞を数え、EC培地1mlあたり50,000 ECに細胞濃度を調整します。
- コーティングされたカバーガラスを含む24ウェルプレートの各ウェルに細胞懸濁液1mlを分配します。 37℃+ 5%二酸化炭素で、細胞培養インキュベーター中で細胞をO / Nインキュベートします。
- コンフルエントな単層を3日以内に、形成されている場合、細胞を実験に使用するための準備ができています。
単球の調製
- RPMI中で培養される転送HL-60細胞は、15ミリリットルチューブに、懸濁培養物として、10%ウシ胎児血清を補充しました。 5分間200×gで細胞を遠心。
- 5ミリリットルの培地で上清と再懸濁細胞を除去および2百万個の細胞/ mlに培地と細胞濃度を調整します。 HL-60の蛍光標識が所望される場合、血清およびPRなしRPMI中で細胞を再懸濁セクション4で説明したようにoceed。
- 1と3の間の時間の選択された一定期間のためのEC単層を含む24ウェルクラスタープレートの各ウェルにHL-60細胞懸濁液0.5 mlを加え、37℃、5%二酸化炭素で、細胞培養インキュベーター中でプレートをインキュベート時間。ほとんど差が結合飽和が達成され、1時間、3時間の時点との間で観察されます。
- 細胞洗浄/収穫の準備:HBSS 100mlで120ミリリットルチューブを埋めます。新鮮な24ウェルプレートの各ウェルにホルマリンの1ミリリットルを分注します。
- 触れないように注意しながら、インキュベーション期間の後、鋭利なピンセットを使用して、ウェルからカバーガラスをピックアップし、垂直方向のカバーガラスを保持し、3秒間ベンチに組織片にカバースリップの端を軽くたたきます組織とカバーガラスの細胞で覆われた表面。
- ピンセットでしっかりとカバーガラスを保持し、5回におよびHBSSからカバースリップをダンク。
- 第ダンク後のHBSS中で、3秒のための組織上のカバーガラスの縁を軽くたたきます。
- 液体につけることを繰り返し、DABに続く5ダンクの3セットの合計を作り、3.6および3.7に記載されている手順を軽くたたきます。
- 室温で細胞を固定することは、十分に含有する10%ホルマリンにカバースリップを転送します。カバーガラスは、列挙のため、長期保存のために以下に記載する他の手順に供される準備ができています。
セル·トラッカー(オプション)とHL-60細胞の4ラベリング
- 15mlの遠心管にHL-60細胞( 例えば、10百万円)の適切な量をカウントし、転送します。 5分間200×gで遠心HL-60細胞。上清を取り除きます。
- 100万細胞/ mlの濃度で、血清を含まないRPMI培地中で細胞トラッカーで再懸濁した細胞ペレット。 1時間、細胞培養インキュベーター中で細胞をインキュベートします。
- 200×gで遠心し、細胞を5分間、上清を捨てます。 200万Cの濃度にメディアでの再懸濁細胞ペレットells / mlの。
- カバーガラス上で増殖させ、各ウェルを含む内皮細胞への細胞トラッカーで標識されたHL-60の0.5ミリリットルを追加します。 3.3に進みます。
接着内皮細胞の5列挙
- マウントは、個々の細胞を識別するためのDAPI対比染色して顕微鏡スライド上にカバースリップ。
- 4Xまたは10X目的とした倒立顕微鏡を用いて、いくつかのフィールド( 例えば、5フィールド)の画像を取得し、未照射内皮細胞(これは、通常、3〜5であるべきである)に集約し、単球の最高数をカウントします。
- クラスタとして定義されていることであることが内皮細胞の単球の閾値として2回数を設定します。必要であれば、別の基準は、実験の性質に応じてクラスタを定義するために使用することができます。
- クラスタ数とフィールドでの内皮細胞の数をカウントします。接着内皮細胞の割合を取得するために前者を後者で割ります。スコア多数のフィールドは、カウントの平均値と標準偏差を得ました。
抗体6.対比
- カバーガラス上の接着アッセイ、細胞を室温で15分間、10%ホルマリンで固定された後、標準的な手順10と、選択した抗体を用いて免疫蛍光にカバーグラスをかけます。
- 内皮細胞に結合している単球を取り除く避けるために非常に優しく、様々なソリューションを追加し、削除します。
老化関連ベータガラクトシダーゼ活性の7対比
- カバーガラス上の接着アッセイ、細胞は老化関連ベータガラクトシダーゼ活性のために15分間、染色のためにホルマリンで固定された後に染色キットに付属の説明書に記載されているように。内皮細胞に結合している単球を取り除く避けるために非常に優しく、様々なソリューションを追加し、削除します。
結果
この方法は、集団内の個々の接着剤の内皮細胞の検出を可能にします。例えば、非照射内皮細胞の単層が単球でのインキュベーションの前に7日でポスト10Gy照射をインキュベーションおよび洗浄後数散発的なHL-60の単球、内皮単層を保持しながら、個々の内皮細胞(周りのクラスター中の単球によって結合させました図1)。この現象は、位相差顕微鏡下で容易に観察可能であるが、蛍光顕微鏡は、単球のクラスターであっても鮮明な画像を明らかにする。
説明接着アッセイを行った後、それは、標準的な免疫蛍光法で適切な抗体を用いて膜、細胞質または核( 図2)のために、タンパク質を細胞の染色に進むことが可能です。さらに、このような老化関連β-ガラクトシダーゼ( 図3)のような酵素ベースのアッセイはまた、PEとすることができますrformed。
各単球のクラスターは、個々の内皮細胞に対応するので、クラスタの列挙は、単層内の接着剤の内皮細胞の実際の数( 図4)、したがって集団内の接着剤の内皮細胞の割合( 表1、図6)を明らかにする。これは、内皮細胞の接着性のような定量化を可能にこれまでの唯一の方法です。なお、ここでの実験で使用した内皮細胞は、接触阻害され、合流を達成した後の数が増加しないことは注目に値します。これは、後の時点で増加した内皮細胞の数によってもたらされる潜在的な複雑さを排除します。所望であれば、内皮細胞単層に付着した単球(3.9の代わりに固定)、0.5%トリプシン0.2%EDTA溶液により取り除かすることができ、現代の方法における場合( 図5)と同様に、それらの蛍光は、プレートリーダーを用いて測定します。
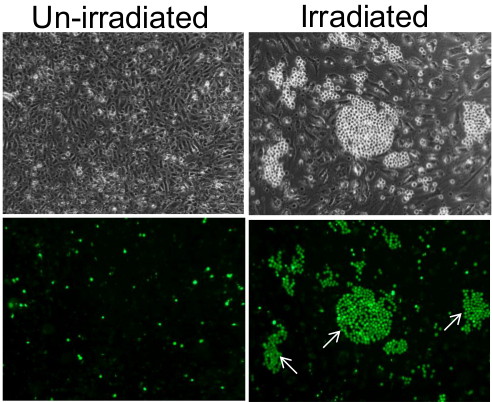
内皮細胞の単層上の単球の図1.接着。未照射内皮細胞、散発的およびランダムに個々の細胞として付着した単球(左パネル)で7日後に10 Gyの照射の個々の内皮細胞上のクラスター中単層(右パネル)。下のパネルは、位相コントラストの下で可視小さく、明るい球状の細胞が実際にセル·トラッカー·グリーンで予め標識した単球であることを確認し、トップパネルの蛍光画像です。単球のクラスターのいくつかは、白い矢印で示されています。画像は、10倍の対物レンズを用いて撮影した。 この図の拡大版を表示するには、こちらをクリックしてください。
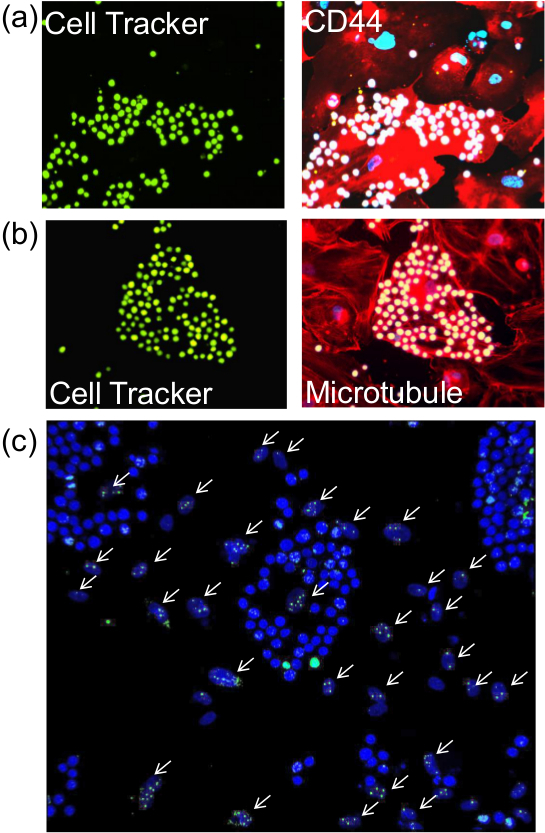
に記載接着アッセイを行った後、カバーガラス上の細胞を、(A)膜タンパク質(CD44)の検出のための免疫蛍光を行ったタンパク質ポスト接着アッセイのために、内皮細胞の図2染色 、B)細胞質タンパク質(チューブリン)またはc)核タンパク質(γ-H2AX)。 (A)およびshow単球細胞トラッカーグリーン、右のパネルに類似した画像で予め標識した(20X対物レンズで見られる)(B)の左パネルは、CD44と微小管(赤)およびDAPI染色された核(青)を明らかにしました。 (C)中の白矢印は、γ-H2AXに対する抗体で染色した照射内皮細胞核を指します。 DAPIによって明るい青色に染色される単球の核は、内皮細胞の楕円形の核から容易に区別されます。画像は、20X対物レンズで撮影しました。 jove.com/files/ftp_upload/52924/52924fig2large.jpg「ターゲット= "_空白">この図の拡大版を表示するには、こちらをクリックしてください。
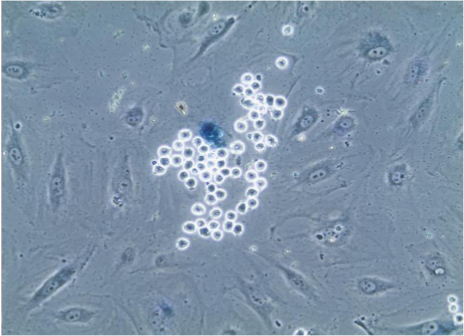
図3内皮細胞の老化関連β-ガラクトシダーゼ染色。接着アッセイの後、カバーガラス上の細胞は、その内皮細胞で明らかなように、老化細胞のリソソームが青色にさせる老化関連β-ガラクトシダーゼのための染色に供しました選択、それらのサイズが小さく、球状に容易に同定された多数の単球、により結合されます。 20Xの対物レンズを通して見た画像。 この図の拡大版を表示するには、こちらをクリックしてください。
2924 / 52924fig4.jpg "/>
個々の内皮細胞上の単球のクラスターの図4.列挙。接着アッセイの後、細胞の画像は、識別された、いくつかの異なる位置と単球のクラスターから採取し、(緑色)丸で囲みました。クラスタは、内皮細胞上の10以上の単球の凝集と定義しました。画像中の単球のクラスターと12日後に照射する内皮細胞の数の数(赤の点線)をカウントしたと計算された接着性内皮細胞の割合は10倍の対物レンズを介して撮影した表1。画像に示すように表示するにはこちらをクリックしてくださいこの図の拡大版。
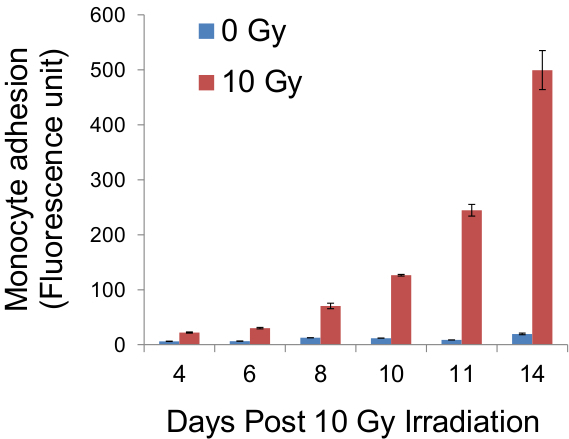
図接着性単球の蛍光の5定量 。次ののadhEシオンアッセイは、ガラスカバースリップ上の細胞をトリプシン処理し、CellTrackerグリーンで事前に標識された単球の蛍光は、内皮単層の密着性の間接的な指標として、蛍光プレートリーダーを用いて測定しました。述べ日照射後にそのような測定の結果を得て、上記のグラフにplattedました。
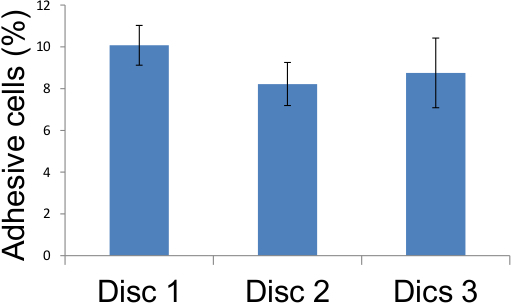
3カバーガラス上の5つの異なる場所に表1の接着内皮細胞からの接着アッセイスコアの図6.表現を図4で説明したように記録し、結果は、12日10 Gyの照射後に実証上に表にし、照射の8から10パーセントました内皮細胞が接着剤となりました。
内皮細胞
| ディスク1 | ディスク2 | ディスク3 | |
| フィールド1 | 8.65 | 8.29 | 8.21 |
| フィールド2 | 10.44 | 7.27 | 7.21 |
| フィールド3 | 9.63 | 9.05 | 8.33 |
| フィールド4 | 11.11 | 7.09 | 8.41 |
| フィールド5 | 10.55 | 9.4 | 11.61 |
| 平均 | 10.07 | 8.22 | 8.75 |
表1接着アッセイのスコア 。 Fで説明したように、3つのガラスカバースリップ上の5つの異なる場所に接着内皮細胞は、採点しましたigure 4と12日10 Gyの照射後、照射された内皮細胞の百分の8から10は、接着剤になったことを実証している上に集計した結果。
ディスカッション
上述の単球接着アッセイは、内皮単層10の上に電離放射線の生物学的効果を研究するために設計された実験に首尾よく使用されました。これは内皮単層の密着性を評価するために利用可能な唯一の方法ではありませんが、それは接着剤である、単層内の内皮細胞の割合またはパーセンテージの定量化を可能にする唯一の方法です。他の方法により測定されるような単球の接着のグローバル量的変化は、内皮単層の全ての細胞の接着性の一般的上昇または内皮細胞の亜集団の増加接着性のいずれかに起因することができますので、これは重要な違いです上記の例に示すように、単分子層内にあります。この情報を有する値は照射後の密着性強化を示した内皮細胞のパーセンテージを定量化する能力は、INESにつながっているという事実が挙げられます接着した細胞の割合が大きく(1,000倍以上)の上にその用量でX線による遺伝子のランダム突然変異から予想されるものであったように、この効果は、特定の遺伝子の遺伝的変異によるものではないことが可能な結論。
結果の良好な再現性を可能にする要因は、洗浄政権です。洗浄手順は、組織に押し当て、続いて洗浄バッファーにカバーガラスを浸漬することを含むように、必然的に十分に洗浄緩衝液のピペット操作の古い方法に起因するバッファ乱流の変動が回避されます。実際、洗浄工程から変動要素を削除した洗浄手順を考案するために私達を強要ピペット操作方法を用いて得られた複製の間、過度の変動を観察しました。
確かに、n個の操作を行い、単球のクラスターの手動カウントを実行する必要があり、このアッセイ嘘の限界、OTは、ハイスループット分析のためにそれを適合させることを可能にします。第二に、クラスタを構成する方法の多くの単球上の決定は、半任意に決定する必要があり、レベルが高すぎると、いくつかの本物のクラスターの排除をもたらすことができます。この方法では剪断力の欠如は、内皮細胞の接着性が著しく増強され誘導される実験の限界( 例えば、+TNFα)と見なすことができます。それは、接着性の少ない誇張増強の検出を可能にするように他の状況ではしかし、せん断力の欠如は、利点です。単球の接着性の適度な増加は、特に重要と関連する可能性がある。in vivoで 、単球は(典型的な実験時間で)主にせん断力との密着性に適度な増加と内皮細胞に大きな数字に添付することが期待されないであろう。時間におけるしかしながら、いくつかの単球は、おそらくなり、これは、慢性炎症の環境を表現する可能性が高いです。など、それは粘着性のわずかな増加は、せん断応力下で観察することを可能にするのに一般的に短く、おそらくあまりにもつかの間である実験的な時間枠で明らかにされる内皮細胞の接着性の小さい増加の機会を提供するようにせん断力の欠如は有利であることができます。
上で示したように、特定の細胞タンパク質または細胞状態に特異的な内皮細胞の接着性の会合を可能にするような老化アッセイおよび免疫蛍光染色などの他の分析には、このアッセイ後に細胞を供する能力は、機能をこの方法の有用性を増加させます古い接着アッセイでは使用できません。
この方法はEST2不死化ヒト冠状動脈内皮細胞と同様の結果を伴って使用されてきたが、またそれだけで特定の細胞株に特異的でないことを実証し、初代ヒト冠状動脈内皮細胞10を得ました。また、ADO内皮細胞の接着性を分析するこの方法のptionは、標識された免疫細胞の蛍光を測定する標準的な接着アッセイに同じ細胞を施す排除するものではありません。一緒に、この報告書は、この方法は、包括的、汎用性と標準接着アッセイよりもはるかに多くの情報を提供することを示しています。
開示事項
著者らは、開示することは何もありません。
謝辞
We are very grateful to Simon Bouffler for his full support and to Public Health England for infrastructure support. This work was supported by Public Health England throughthe National Institute for Health Research (NIHR) grant. This report is work commissioned by the NIHR. The views expressed in this publication are those of the authors and not necessarily those of the NHS, NIHR or the Department of Health. The funders had no role in study design, data collection and analysis, decision to publish, or preparation of the manuscript.
資料
| Name | Company | Catalog Number | Comments |
| Hepes Buffered Saline Solution (HBSS) | Sigma | H6648 | |
| Glass coverslips Round 12 mm Diameter | Menzel-Glaser | CB00120RA1 | |
| 24-well cluster plate | Costar | 3526 | |
| Meso-Endo Cell media | Cell Applications | 212-500 | |
| Trypsin-EDTA | Sigma | T4174 | |
| Soybean trypsin inhibitor | Life Technologies | 17075-029 | |
| Cell Tracker Green | Life Technologies | C7025 | |
| RPMI | Sigma | R8758 | |
| Foetal Calf Serum | Life Technologies | 10500064 | |
| Beta glasctosidase Assay kit | CellSignaling | 9860 | |
| Fibronectin | Sigma | F0895 |
参考文献
- Ortega-Gomez, A., Perretti, M., Soehnlein, O. Resolution of inflammation: an integrated view. EMBO Mol Med. 5 (5), 661-674 (2013).
- Libby, P. Inflammation and cardiovascular disease mechanisms. Am J Clin Nutr. 83 (2), 456S-460S (2006).
- Ikuta, S., Kirby, J. A., Shenton, B. K., Givan, A. L., Lennard, T. W. Human endothelial cells: effect of TNF-alpha on peripheral blood mononuclear cell adhesion. Immunology. 73 (1), 71-76 (1991).
- Watson, C., et al. IL-6 acts on endothelial cells to preferentially increase their adherence for lymphocytes. Clin Exp Immunol. 105 (1), 112-119 (1996).
- Sans, M., et al. VCAM-1 and ICAM-1 mediate leukocyte-endothelial cell adhesion in rat experimental colitis. Gastroenterology. 116 (4), 874-883 (1999).
- Su, Y., Lei, X., Wu, L., Liu, L. The role of endothelial cell adhesion molecules P-selectin, E-selectin and intercellular adhesion molecule-1 in leucocyte recruitment induced by exogenous methylglyoxal. Immunology. 137 (1), 65-79 (2012).
- Hallahan, D., Kuchibhotla, J., Wyble, C. Cell adhesion molecules mediate radiation-induced leukocyte adhesion to the vascular endothelium. Cancer Res. 56 (22), 5150-5155 (1996).
- Vaporciyan, A. A., Jones, M. L., Ward, P. A. Rapid analysis of leukocyte-endothelial adhesion. J Immunol Methods. 159 (1-2), 93-100 (1993).
- Prabhakarpandian, B., Shen, M. C., Pant, K., Kiani, M. F. Microfluidic devices for modeling cell-cell and particle-cell interactions in the microvasculature. Microvasc Res. 82, 210-220 (2011).
- Lowe, D., Raj, K. Premature aging induced by radiation exhibits pro-atherosclerotic effects mediated by epigenetic activation of CD44 expression. Aging Cell. 13 (5), 900-910 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved