このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
マイクロパターン血管筋薄膜の拡張文化ためのマイクロ流体ゲニピン堆積技術
要約
We present a method for microfluidic deposition of patterned genipin and fibronectin on PDMS substrates, allowing extended viability of vascular smooth muscle cell-dense tissues. This tissue fabrication method is combined with previous vascular muscular thin film technology to measure vascular contractility over disease-relevant time courses.
要約
The chronic nature of vascular disease progression requires the development of experimental techniques that simulate physiologic and pathologic vascular behaviors on disease-relevant time scales. Previously, microcontact printing has been used to fabricate two-dimensional functional arterial mimics through patterning of extracellular matrix protein as guidance cues for tissue organization. Vascular muscular thin films utilized these mimics to assess functional contractility. However, the microcontact printing fabrication technique used typically incorporates hydrophobic PDMS substrates. As the tissue turns over the underlying extracellular matrix, new proteins must undergo a conformational change or denaturing in order to expose hydrophobic amino acid residues to the hydrophobic PDMS surfaces for attachment, resulting in altered matrix protein bioactivity, delamination, and death of the tissues.
Here, we present a microfluidic deposition technique for patterning of the crosslinker compound genipin. Genipin serves as an intermediary between patterned tissues and PDMS substrates, allowing cells to deposit newly-synthesized extracellular matrix protein onto a more hydrophilic surface and remain attached to the PDMS substrates. We also show that extracellular matrix proteins can be patterned directly onto deposited genipin, allowing dictation of engineered tissue structure. Tissues fabricated with this technique show high fidelity in both structural alignment and contractile function of vascular smooth muscle tissue in a vascular muscular thin film model. This technique can be extended using other cell types and provides the framework for future study of chronic tissue- and organ-level functionality.
概要
血管のような脳血管攣縮1,2、3高血圧、アテローム性動脈硬化症および4のような疾患、徐々に開発、自然界に一般的に慢性的であり、血管平滑筋細胞(VSMC)の機能不全の力の生成を伴います。我々は、in vivoモデルよりも実験条件をより詳細に制御を用いたin vitroの方法で使用して、これらの遅い進行血管機能障害を研究することを目指しています。我々は以前のin vitroの機能的収縮を測定するために、血管、筋肉薄膜(vMTFs)を開発した心血管組織5を設計しますが、この方法は、比較的短期間の研究に限定されていました。ここでは、長期的な測定のために私たちの前のVMTF技術を拡張基板修正手法を提示します。
内皮は、全体の血管機能でも重要であるが、人工動脈ラメラは、血管の変化を評価するための有用なモデルシステムを提供します疾患の進行中に収縮。機能性血管疾患の組織モデルを設計するために、動脈ラメラの構造と機能、血管の収縮基本ユニットの両方が、忠実に再現されている必要があります。動脈ラメラ、エラスチン6のシートによって分離された収縮のVSMCの円周方向に整列されたシート同心です。ポリジメチルシロキサン(PDMS)基板上に細胞外マトリックス(ECM)タンパク質のマイクロコンタクト印刷は、予め整列心臓血管組織5,7-10を模倣するために、組織の組織のガイダンスキューを提供するために使用されています。しかし、マイクロコンタクト印刷を使用してパターン化組織が慢性試験でその適用を制限し、培養液中の3-4日後に整合性を失う可能性があります。このプロトコルは、新しいマイクロ流体堆積技術を用いて、前のマイクロコンタクト印刷技術を置き換えることによって、この問題に対する解決策を提供します。
Genchi らゲニピンとfにPDMS基板を改変ound文化11で1月に筋細胞の生存率を延長しました。ここでは、PDMS上にパターン血管平滑筋細胞の培養物を拡張するために同様のアプローチを使用します。ゲニピン、クチナシ果実の自然加水分解誘導体は、同様の架橋剤および組織修復12,13とECMの変更14の分野における生体材料としての使用の増加に比べ、その比較的低い毒性のために、基板の修正のための望ましい候補であります15。このプロトコルでは、フィブロネクチンは、前のマイクロコンタクトプリント法のように、細胞のガイダンスキューとして利用されます。しかしながら、ゲニピンは、フィブロネクチンのパターニングの前にPDMS基板上に堆積されます。細胞がパターン化されたマトリックスを分解するとしてこのように、添付のVSMCから新たに合成されたECMは、ゲニピンでコーティングされたPDMS基板に結合することができます。
このプロトコルは、2段階ゲニピンとECM沈着のためのマイクロ流体送達装置を利用します。マイクロ流体デバイスの模倣体の設計microco以前の研究16において操作動脈ラメラに使用ntact印刷パターン。従って、我々は、このプロトコルが正常に生体内の構造と動脈ラメラの収縮機能に高度に整列を再現動脈ラメラ模倣を得ことを期待しています。我々はまた、ゲニピンは、インビトロ血管疾患モデルにおける長期的に適した基板修飾化合物であることを確認するために、組織の収縮性を評価します。
Access restricted. Please log in or start a trial to view this content.
プロトコル
注意:このプロトコルの目的は、PDMS基板上に血管平滑筋細胞(VSMC)の延長培養中に収縮性を評価するために、図1に示す構造の血管の筋肉薄膜(VMTF)を構築し、利用することです。 VSMCの生存率を延長するために、我々は、架橋剤化合物のゲニピンを利用します。これらvMTFs用基板はGrosberg らによって開発された組織の収縮性を分析するために設計されている。8その他VMTF方法5に提示基板製造プロトコルに微妙な変化にも使用され得ます。
1.基板製造
- カバーガラスクリーニング
- カバーガラスの染色ラックに直径25mmのカバーガラスを配置します。大きなビーカーや容器にラックを置き( 例えば 、空の100 - 1,000μlのピペットチップ容器)。
- 完全にカバーガラスを浸漬する容器に70%エタノールを追加します。少なくとも30分のためにそれらを超音波処理。
- エタノール溶液からカバースリップラックを削除します。 1〜2時間(カバーガラス上の粒子の蓄積を防ぐために)無菌培養フードにラックを吊り下げ空気乾燥にカバースリップを許可します。
注:カバースリップの前は、次の手順に完全に乾燥していなければなりません。
- カバースリップ上のポリ(N-イソ - プロピル)(PIPAAm)ストリップの分離
- カバーガラス( 図1A)を中心に露出したストリップを残し、洗浄カバーグラスの側面から粘着テープ、テープを使用しました。アプリケーションおよび/またはマイクロ流体設計に基づいて、この露出したストリップの幅を変更します。
- マーク後で参照( 図1A)のための研究室マーカーを使用して、カバースリップ上のテープストリップの縁。
- 皿( 図1A、赤い点線)から解放するためにカバーガラスの周囲にカットします。
- ポリ(N-イソ - プロピル)(PIPAAm)コーティング
- 化学天秤を使用して、PI 1gを秤量PAAM粉末。発がん性物質である未重合N - イソ - プロピルを、使用しないでください。
- 50ミリリットルの遠心管にPIPAAmを転送します。 10%のw / v溶液を得るために、化学フード内部に1-ブタノールを10mlを加えます。注意:1-ブタノールの引火点は37℃。です可燃性のキャビネットで得られた溶液を保存し、加熱を避けます。
- PIPAAmを10分間溶解させます。粉末がまだ表示されている場合は、すべての粉末が溶解するまでボルテックスミキサーを用いて、溶液を混合します。
注:次の手順は、スピンコーターを使用する必要があります。各カバースリップのための: - 鉗子でスピンコータチャックのテーピングカバーガラスを配置します。
- カバースリップの中央に露出したガラスに沿って液滴を配置することにより、カバースリップ上にPIPAAm液150μlのを転送します。露光領域を完全にカバーを確認してください。
- 以下のレシピを使用して、スピンコートPIPAAm:
- 3000rpmで10秒をランプアップします。 5秒放置します。
- ランプ10秒6,000 RPM。 60秒間放置します。
- 3000rpmで10秒をランプアップします。 5秒放置します。
- PIPAAmを上に向けて覆われたペトリ皿にカバースリップを置きます。少なくとも15分間風乾させます。
- 慎重中央ストリップでPIPAAmコーティングの薄い層で露出したフルカバースリップを残して、すべてのカバーガラスから粘着テープを削除します。
- PDMSコーティング
- 混合し、10にPDMSの15グラムを脱ガス:1ベース:架橋剤比。混合する前に超音波処理し、0.2μmの蛍光マイクロビーズの8滴 - 7を追加します。 PDMSを汚染埃や他の粒子を防止するために、使用しないときはアルミ箔でPDMSのカップをカバーしています。
注:次の手順は、スピンコーターを使用する必要があります。各カバースリップのための: - 鉗子でスピンコータチャックのPIPAAmコーティングされたカバーガラスを置きます。
- カバーガラス面積の3分の1以上をカバーし、カバースリップ上にPDMSを転送します。
- 次RECIPを用いたスピンコートE:
- 500rpmで5秒をランプアップします。 5秒ドウェル。
- 1000rpmで5秒をランプアップします。 5秒ドウェル。
- 3000rpmで10秒をランプアップします。 10秒のドウェル。
- 4,000rpmで10秒をランプアップします。 60秒のドウェル。
- 2,000rpmで10秒をランプアップします。 15秒のドウェル。
- 1000rpmで10秒をランプアップします。 10秒のドウェル。
- 500rpmで5秒をランプアップします。 5秒ドウェル。
- PDMSを上に向けて覆われたペトリ皿にカバースリップを置きます。カバーガラスをスピンコートした時間を記録します。 PDMS基板の厚さを決定する際に後で使用するために、実験を通じて各カバースリップに関連した時間を追跡します。
- 適切なPDMS硬化を確実にするために、少なくとも1.5時間、90℃のオーブンでカバーガラスを含むペトリ皿を置きます。オーブンは使用できない場合は、カバースリップを室温で少なくとも48時間硬化してみましょう。
- オーブンからカバースリップを削除し、使用する準備ができるまで暗い引き出しの中に保管してください。
- すべての第四のカバーガラスのF脇に置きますまたはプロフィルを有するスピンコーティング時間の関数としての基板厚、それ以降の測定。
- 混合し、10にPDMSの15グラムを脱ガス:1ベース:架橋剤比。混合する前に超音波処理し、0.2μmの蛍光マイクロビーズの8滴 - 7を追加します。 PDMSを汚染埃や他の粒子を防止するために、使用しないときはアルミ箔でPDMSのカップをカバーしています。
エンジニアリング組織2.マイクロ流体パターニング
- マイクロ流体デバイスの作製
- 組織マイクロ流体フォトマスクの設計
- マイクロ流体のパターンを設計するために、任意の適切なコンピュータ支援設計プログラムを使用します。ヒト臍帯動脈血管平滑筋細胞から成る動脈ラメラについて、10μmの壁と10ミクロンのチャネルの交互のパターンを使用しています。
- 可能ならば17、分岐バイナリチャンネルを使用し、他の分岐の設計を使用してもよいです。 (壁やチャネル、 図1B)を間隔所望の組織パターンを達成するまで、各分岐反復のためのチャネルの幅と長さを減らします。
- 表面処理液の配置と真空の適用のための単一の出口のための単一の入口を持つようにデバイスを設計します。
- ファブ以前18に記載されているように、マイクロ流体設計(複数可)を含むフォトマスクをricate。
- フォトリソグラフィウェーハ製造
注:適切なクリーンルーム又は類似の施設で、フォトリソグラフィを実行します。組織のマイクロ流体デバイス(〜20から25ミクロンのチャネル高さ)のソフトリソグラフィー製造するためのパターンを有するシリコンウェーハを作るために用いたフォトリソグラフィ:- 1分ごとに、アセトン、メタノール、イソプロピルアルコールでシリコンウエハを清掃してください。窒素銃でウェハを乾燥させます。
- 余分な水分を除去するために115℃で5分間、ホットプレート上のウエハをプリベーク。
- :高さ25ミクロン - スピンコート得るために以下のレシピを使用して、SU-8 3025フォトレジストでウェーハ20を備えています
- 500rpmで5秒をランプアップします。 5秒ドウェル。
- 4,000 rpmで15秒をランプアップします。 15秒のドウェル。
- ソフトベーク15分間95℃のホットプレート上のウエハ。
- フォトマスクをロードし、Tを公開彼は、コンタクトマスクアライナ上に真空吸着プログラムを使用して16秒間ウェハ。
- ハード4分間95℃のホットプレート上にウエハを焼きます。
- 現像液中の6分間ウェーハを開発します。そして、新鮮な現像液で2秒間回ウエハを洗浄し、イソプロピルアルコールでウェハをすすぎます。
- 真空デシケーター内で空の皿にトリデカフルオロトリクロロシランの3滴 - 2を配置することによって、パターン化されたウエハーO / NをSilanate。ウェハの底部と頂部の両方が露出されるように、ペトリ皿を用いてウエハを支えます。
注意:Tridecafluro-トリクロロシランは、可燃性および腐食性の液体です。適切な個人用保護具や局所排気を使用するために必要です。
- 組織マイクロ流体デバイスの製造
- ペトリ皿にシラン化、パターンウェーハの機能側を配置します。
- 混合し、10とPDMSの100グラムを脱ガス:1ベース:架橋剤比。完全かつ均等にウェハをカバーする、皿にPDMSを注ぎます。
- すべての気泡が未硬化PDMS、約30分から除去されるまで、真空デシケーター中で皿を置きます。少なくとも1.5時間、90℃で皿の中のPDMSを治します。完全な硬化を得るために、製造指針によって指示されるように時間と温度を調整することができます。
- PDMSが硬化したら、かみそりの刃でウエハの周りにPDMSをカットし、慎重に皿からPDMSに覆われたウェハをリリース。ウエハの下に過剰PDMSを取り外し、ゆっくりとウェハの上面からPDMS剥離。
- きれいな皿にPDMSディスク機能側を配置し、使用後の光から離れたウエハを格納します。
- カミソリの刃を使用して、パターンの周囲から過剰PDMSを切り取ります。後工程での基板からデバイスの剥離を容易にするために長方形の形状( 図1C)にデバイスをカット。正確なカットは限り十分なスペースは、入口、出口、および組織パターン領域( 図1C)のために存在するように、必要ありません。
- パンチ1ミリメートルの外科的生検パンチを使用して入口及び出口孔( 図1C)。
- 組織マイクロ流体フォトマスクの設計
- マイクロ流体デバイスの堆積
注意:このプロトコルでは、マイクロ流体配送をパターニングゲニピン、長期の組織培養のためのキーの架橋剤、ならびにフィブロネクチンを堆積するために使用されます。前ペニシリン/ストレプトマイシン滅菌(2.2.3)へのステップは、無菌状態で行われる必要はありませんが、汚れやほこりの収集を制限するプロトコルを通じて奨励されています。ペニシリン/ストレプトマイシン(2.2.3)とカバーガラスの滅菌後に発生したすべてのステップは、無菌技術を利用すべきです。注:プロトコルのこの部分は、従来の細胞播種に1日に開始する必要があります。- 基板とマイクロ流体デバイスの作製
- 少なくとも30分間、70%エタノール中でマイクロ流体デバイスを超音波処理。
- 加圧された空気や窒素を用いて、超音波処理したマイクロ流体デバイスを乾燥させ、そしてペトリ皿のwiに配置します番目のチャンネルは、機能上の不要な摩耗を防止するためにフェイスアップしています。
- 8分間のUVOクリーナー(表面が官能化されているので、カバーを皿に削除)で10 VMTF基板カバーガラスにまで配置します。
- UVO処理したカバースリップを外し、(向きは図1(c)のようになります)時にダウンし、各すべり1の上にマイクロ流体デバイスの機能側に配置します。 PDMSでコーティングされたカバーガラスに密封を確実にするためにしっかりと押し込みデバイス上のプレス。
- ゲニピンとフィブロネクチンの沈着
- 凍結乾燥ゲニピン5mgの容器に無菌のddH 2 Oの1ミリリットルを追加することで、5 mg / mlのゲニピン溶液を調製します。ボルテックスミキサーを用いて、溶液を混ぜます。少なくとも室温で30分間置いておきます。
注:粉末はそう少なくとも分間繰り返し混合がしばしば必要であり、室温で可溶化することが困難です。 - すぐに、デバイスのプライミングのための各装置の入口で70%エタノールのドロップを置きます。注:ETHをノールは、デバイスを介して芯する必要があります。
- 5後 - 10分間、慎重に直ちに入口の1×リン酸緩衝生理食塩水(PBS)で置き換え、入口で過剰のエタノールを吸引します。この点から前方に、入口は、デバイスへの空気の導入を回避するために、完全に乾燥しないようにしてください。
- 各装置の出口で真空吸引チップを置きます。エタノールを洗い流すためにデバイスを介して1×PBSを描画します。入口で1×PBSを少量のままにしておきます。注意:入口はほぼ乾燥表示された場合は、より多くの1X PBSを加えます。
- 少量のゲニピン溶液の塗布に先立って入口に残るように過剰1X PBSを吸引除去します。
- 各入口( 図1D)で5 mg / mlのゲニピン溶液60μLを入れます。アウトレット( 図1D)の真空吸引チップを配置することによって、デバイスを介して、ゲニピン溶液を描画します。入口に少量の溶液を残して、を通じてソリューションのすべてを描画しないように注意してください。
- 場所は、インキュベーション中に濡れを維持するために、入口と出口の両方での1X PBS(約ダイムサイズ)に低下します。 37℃に設定し(無菌環境は必要ありません)、加湿オーブンまたはインキュベーターにデバイスを含む皿を移動し、4時間インキュベートします。シャーレをカバーする必要はありません。
- インキュベーションの間、前のマイクロ流体デバイスへの適用に少なくとも30分間氷上で滅菌のddH 2 O中50μg/ mlの濃度にフィブロネクチンを再懸濁します。
- ゲニピンのインキュベーションの後、デバイスの店舗で、残りのすべての1X PBSを吸引します。入口で、残りの1×PBSを介して引っ張り、各デバイスの出口で真空吸引を適用し続けます。
- 入口の残りの1×PBSの最小量( 図1D)に追加して、各入口で50μg/ mlのフィブロネクチン溶液100μlを置きます。
- (出口で真空吸引チップを使用してデバイスを介してフィブロネクチンソリューションを描きます図1D)。を通じてソリューションのすべてを描画しないように注意してください。注:フィブロネクチン低下が表面張力の違い1X PBSおよびゲニピンよりも異なります。
- 37℃に設定したオーブンまたはインキュベーターにデバイスを含む明らかに皿を移動し、24時間インキュベートします。注:フィブロネクチンステップは、1X PBSで入口と出口の湿潤を必要としません。入口でのフィブロネクチンの残りのプールが完全に乾くます。これは予想されます。
- 凍結乾燥ゲニピン5mgの容器に無菌のddH 2 Oの1ミリリットルを追加することで、5 mg / mlのゲニピン溶液を調製します。ボルテックスミキサーを用いて、溶液を混ぜます。少なくとも室温で30分間置いておきます。
- 細胞播種のための滅菌と準備
- パターン化VMTFカバースリップの滅菌のためのペニシリン/ストレプトマイシン溶液を調製します。滅菌1×PBSを500 mlに、ペニシリン/ストレプトマイシンの5ミリリットル(10,000 / mlの万単位/ ml)を追加します。
- 無菌バイオセーフティーフード内でデバイスを含む皿を置きます。
- 軽く反対側の手でカバースリップを把握しながら慎重に、ゆっくりとコーナーでデバイスを剥離することによりカバーガラスからデバイスを削除します。注:このステップは除去プロセスでカバースリップダメージを減少させるために練習が必要。代替案は、デバイスのリリースを支援するために、入口および/または出口に1X PBSを注入する注射器を使用しています。
- 滅菌6ウェル皿にカバースリップを置きます。各ウェルに、ペニシリン/ストレプトマイシン溶液を少なくとも5ミリリットルを追加します。少なくとも37℃で30分間滅菌インキュベーターで皿を置きます。
- 滅菌後、ペニシリン/ストレプトマイシン溶液を吸引し、培養したヒト臍帯動脈血管平滑筋cells19( 図1D)でカバースリップをシード。 VSMCをのための播種濃度は〜cm 2の 80,000細胞です。各サンプルのために必要な細胞の数を減少させるために、播種面積を減少させるために減速を使用します。減速機の一例は、播種前に滅菌真空グリースでカバースリップに取り付けられた15ミリリットルコニカルチューブの切断先頭です。
- 37℃、5%CO 2で無菌培養器に播種したカバースリップをインキュベートと播種した細胞が付着し、整列動脈ラメラを模倣O / N( 図2A-B)を形成することができます。
- 長期VMTF組織培養
- ある日播種後、細胞培地と減速を削除します。 1X PBSで組織をすすぎます。 VSMCを20に収縮性の表現型を誘導するために、無血清細胞培地4mlを加えます。
- 長期培養のため必要に応じて、一日おきに1×PBSでリンスし、新鮮な無血清培地の添加を繰り返します。
- 基板とマイクロ流体デバイスの作製
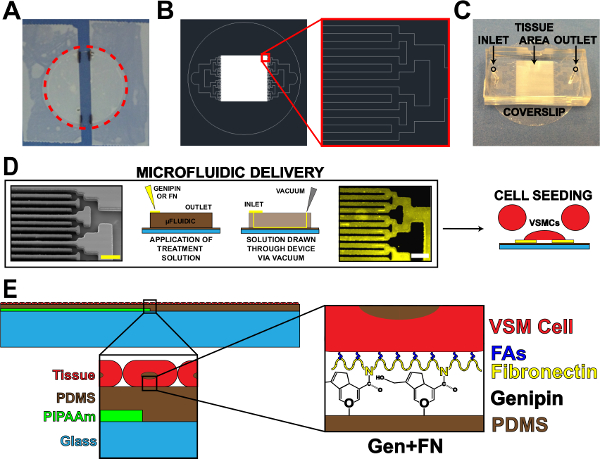
図1.マイクロ流体タンパク質送達デバイス。 (A)は、PIPAAmコーティング用カバーガラスをオフにテーピング。赤点線円:カバースリップを解放するために、パスをカット(B)組織のマイクロ流体マスクパターンの代表的なAutoCAD図面。挿入図:alternバイナリ分岐の詳細入口及び出口を有するカバーガラス基板上にマイクロ流体デバイスの10ミクロン×10ミクロンの組織パターン(C)の配置をレーティングすることが示された。マイクロ流体タンパク質パターニングおよび送達の(D)回路図。左から右へ:マイクロ流体チャネルの走査型電子顕微鏡像(スケールバー:50ミクロン)。タンパク質堆積のための方法の詳細な概略図。免疫組織化学染色したフィブロネクチン(スケールバー:50μm)を、血管平滑筋細胞と細胞播種。作製した組織の(E)の回路図。 1 回目の挿入図:層状構造物の詳細。 2 番目の挿入図:マイクロ流体堆積後PDMS基板のゲニピン変更の詳細。 ©IOP出版。再現および/または許可を変更しました。すべての権利を保有。19は、 この図の拡大版を表示するには、こちらをクリックしてください。
VMTF収縮アッセイ3.組織機能の解析
注:ここで紹介するMTF収縮アッセイはGrosberg らに開発された技術をモデルにして8。
- VMTF収縮実験
- 100ミリメートル皿に組織サンプルを置きます。 pH7.4の滅菌1Xタイロードsolution8追加サンプルをカバーするために37℃に温めました。
- PIPAAmエッジに垂直な複数の並列カットを作るためにカミソリの刃を使用してください。薄いストリップ( 図3A、サイドカット)と交互に(〜2ミリメートル幅)vMTFsなり、より広い組織切片が得られるようにしてカットを行います。 、きれいなカットを行い、サンプルと接触したカミソリの刃を配置し、しっかり側にドラッグします。
- 皿を90°回転させて、組織の中央に2つの直線、平行カットを行い、PIPAAmのストリップ( 図3A、エンドカット)に平行です。削除し、これらのカットの間の組織の緩みストリップを処分接触することから、隣接するフィルムを防止するために、sおよびvMTFs(前のステップでカット)との間で薄いストリップ。
- サンプルは室温で10分間休ま許可、またはすべてのPIPAAmが溶解するまで。注:PIPAAmは今後段階的に残っている場合、サンプルは、残留PIPAAmを溶解させるために切断皿に戻してもよいです。必要に応じてVMTFの下の穏やかなスクレイピングは、PIPAAmの除去を助けることができます。
- きれいな35ミリメートルペトリ皿に真空グリースの小さなドットを配置します。 37℃で新鮮な、滅菌1×タイロード溶液5mlを追加します。カバーガラスの移動を防止するために、真空グリースにカット35mm皿100 mmディッシュからフィルム、およびプレスでカバースリップを転送します。
- 実体顕微鏡のステージ上で温度制御されたプラットフォームで皿を置きます。
- 治療アッセイを通じて任意の間隔( 例えば 、30秒)で、時間経過透過した蛍光画像をキャプチャします。
- シリアル(20分間、50 nmのエンドセリン-1でvMTFsの治療誘導された収縮)、30分(組織弛緩のための100μMのHA-1077)。 5ミリリットルの体積に所望の治療濃度をもたらす、特定の時点での滅菌1Xタイロード溶液5 mlを含む実験的な皿に、各処理の濃縮溶液を追加します。画像内のピペットをキャプチャ避けるためにタイムラプス画像収集間隔の間に治療の追加を行います。
- VMTF収縮解析
- 1.4.8に確保されたカバーガラスを使用して、profilometer21とPDMS基板の厚さを測定します。カバーガラスの各セットのためのスピン対時間曲線の厚さを作成します。収縮実験で使用される各カバースリップのためVMTF厚さを推定するために、このカーブを使用します。
- 実験中の各時点についてVMTF突起長を測定し、以前に報告された方法8を用いて曲率半径の関連( 図3B)を計算します。
- 毎回、経口でVMTF応力を計算します以前VMTF方法5を使用してint型。
注:3.2.1から算出した推定VMTF厚を使用してください。以前に9を報告したように、共焦点画像を用いたVSMCの厚さを測定します。会社のデータシートからPDMSのヤング率を取得します。
Access restricted. Please log in or start a trial to view this content.
結果
この研究の主な目的は、疎水性のPDMS基板上にマイクロパターンのVSMCの生存を延長することでした。これは、PDMS(図1)上にパターンゲニピンおよびフィブロネクチンを堆積させるために、マイクロ流体送達システムを組み込むことによって達成されました。マイクロ流体送達を用いECMタンパク質の沈着は、ゲニピンおよびフィブロネクチン(図1D)のライン間の裸の...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ここでは、慢性血管疾患経路1,23,24の拡張実験時間は、より一般的なことができ、以前に開発VMTF技術に基づいて構築されたプロトコルを提示します。これを達成するために、我々は、以前にMTF収縮実験で使用するための改良された血管組織の生存率で操作動脈ラメラを得るために、マイクロ流体堆積技術を用いて、PDMS基板11の長期的な官能化を提供することが示されているゲ?...
Access restricted. Please log in or start a trial to view this content.
開示事項
The authors have nothing to disclose.
謝辞
We acknowledge financial support from the American Heart Association Scientist Development Grant, 13SDG14670062 (PWA) and the University of Minnesota Doctoral Dissertation Fellowship (ESH). We also acknowledge the microfabrication resources of the Minnesota Nano Center (MNC) and the image processing resources of the University Imaging Centers (UIC), both at the University of Minnesota. Parts of this work were carried out in the Characterization Facility, University of Minnesota, which receives partial support from NSF through the MRS program.
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Coverslip staining rack | Electron Microscopy Sciences | www.emsdiasum.com/ | 72239-04 |
| Microscope cover glass - 25 mm | Fisher Scientific, Inc. | www.fishersci.com | 12-545-102 |
| Poly(N-iso-propylacrylamide) (PIPAAm) | Polysciences, Inc. | www.polysciences.com/ | #21458 |
| 1-butanol | Sigma-Aldrich | www.sigmaaldrich.com | 360465 |
| Spincoater | Specialty Coating Systems, Inc. | www.scscoatings.com | |
| Polydimethylsiloxane (PDMS) | Ellsworth Adhesives (Dow Corning) | www.ellsworth.com | 184 SIL ELAST KIT 0.5KG |
| Fluorescent microbeads | Polysciences, Inc. | www.polysciences.com/ | 17151 |
| Silicon wafers | Wafer World, Inc. | www.waferworld.com | 2398 |
| Photoresist | MicroChem Corp. | www.microchem.com | |
| Contact mask aligner | Suss MicroTec | www.suss.com | |
| Developer | MicroChem Corp. | www.microchem.com | |
| Tridecafluro-trichlorosilane | UCT Specialties, Inc. | www.unitedchem.com | T2492 |
| Surgical biopsy punch | Integra LifeSciences Corp. | www.miltex.com | 33-31AA-P/25 |
| Genipin | Cayman Chemical | www.caymanchem.com | 10010622 |
| 1X phosphate buffered saline | Mediatech, Inc. | www.cellgro.com | 21-031-CV |
| Fibronectin | Corning, Inc. | www.corning.com | 356008 |
| Penicillin/streptomycin | Life Technologies, Inc. | www.lifetechnologies.com | 15140-122 |
| Umbillical artery smooth muscle cells | Lonza | www.lonza.com | CC-2579 |
| Tyrode's solution components | Sigma-Aldrich | www.sigmaaldrich.com | various |
| Stereomicroscope | Zeiss | www.zeiss.com | 4350020000000000 |
| Temperature-controlled platform | Warner Instruments | www.warneronline.com | 641659; 640352; 641922 |
| Endothelin-1 | Sigma-Aldrich | www.sigmaaldrich.com | E7764-50UG |
| HA-1077 | Sigma-Aldrich | www.sigmaaldrich.com | H139-10MG |
参考文献
- Humphrey, J. D., Baek, S., Niklason, L. E. Biochemomechanics of cerebral vasospasm and its resolution: I. A new hypothesis and theoretical framework. Ann. Biomed. Eng. 35, 1485-1497 (2007).
- Hald, E. S., Alford, P. W. Smooth muscle phenotype switching in blast traumatic brain injury-induced cerebral vasospasm. Transl. Stroke Res. 5, 385-393 (2014).
- Olivetti, G., Anversa, P., Melissari, M., Loud, A. V. Morphometry of medial hypertrophy in the rat thoracic aorta. Lab. Invest. 42, 559-565 (1980).
- , Atherosclerosis. Nature. 407, 233-241 (2000).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Rhodin, J. A. G. Architecture of the vessel wall. Physiol. Rev. ed, B. erne,R. ., , American Physiology Society. (1979).
- Balachandran, K., et al. Cyclic strain induces dual-mode endothelial-mesenchymal transformation of the cardiac valve. Proc. Natl. Acad. Sci. U. S. A. 108, 19943-19948 (2011).
- Grosberg, A., Alford, P. W., McCain, M. L., Parker, K. K. Ensembles of engineered cardiac tissues for physiological and pharmacological study: heart on a chip. 11, 4165-4173 (2011).
- Alford, P. W., Nesmith, A. P., Seywerd, J. N., Grosberg, A., Parker, K. K. Vascular smooth muscle contractility depends on cell shape. Integr. Biol. (Camb). 3, 1063-1070 (2011).
- Win, Z., et al. Smooth muscle architecture within cell-dense vascular tissues influences functional contractility). Integr. Biol. (Camb). , (2014).
- Genchi, G. G., et al. Bio/non-bio interfaces: a straightforward method for obtaining long term PDMS/muscle cell biohybrid constructs). Colloid Surface B. 105, 144-151 (2013).
- Fessel, G., Cadby, J., Wunderli, S., van Weeren, R., Snedeker, J. G. Dose- and time-dependent effects of genipin crosslinking on cell viability and tissue mechanics - Toward clinical application for tendon repair. Acta Biomater. , (2013).
- Lima, E. G., et al. Genipin enhances the mechanical properties of tissue-engineered cartilage and protects against inflammatory degradation when used as a medium supplement. J. Biomed. Mater. Res. A. 91, 692-700 (2009).
- Madhavan, K., Belchenko, D., Tan, W. Roles of genipin crosslinking and biomolecule conditioning in collagen-based biopolymer: Potential for vascular media regeneration. J. Biomed. Mater. Res. A. , (2011).
- Satyam, A., Subramanian, G. S., Raghunath, M., Pandit, A., Zeugolis, D. I. In vitro evaluation of Ficoll-enriched and genipin-stabilised collagen scaffolds. J. Tissue Eng. Regen. Med. , (2012).
- Alford, P. W., et al. Blast-induced phenotypic switching in cerebral vasospasm. Proc. Natl. Acad. Sci. U. S. A. 108, 12705-12710 (2011).
- Song, H., Tice, J. D., Ismagilov, R. F. A microfluidic system for controlling reaction networks in time. Angew. Chem. Int. Ed. Engl. 42, 768-772 (2003).
- Whitesides, G. M., Ostuni, E., Takayama, S., Jiang, X., Ingber, D. E. Soft lithography in biology and biochemistry. Annu. Rev. Biomed. Eng. 3, 335-373 (2001).
- Hald, E. S., Steucke, K. E., Reeves, J. A., Win, Z., Alford, P. W. Long-term vascular contractility assay using genipin-modified muscular thin films. Biofabrication. 6, 045005(2014).
- Han, M., Wen, J. K., Zheng, B., Cheng, Y., Zhang, C. Serum deprivation results in redifferentiation of human umbilical vascular smooth muscle cells. Am. J. Physiol. Cell Physiol. 291, C50-C58 (2006).
- Feinberg, A. W., et al. Muscular thin films for building actuators and powering devices. Science. 317, 1366-1370 (2007).
- Volfson, D., Cookson, S., Hasty, J., Tsimring, L. S. Biomechanical ordering of dense cell populations. Proc. Natl. Acad. Sci. U. S. A. 105, 15346-15351 (2008).
- Intengan, H. D., Schiffrin, E. L. Vascular remodeling in hypertension: roles of apoptosis, inflammation, and fibrosis. Hypertension. 38, 581-587 (2001).
- Kayembe, K. N., Sasahara, M., Hazama, F. Cerebral aneurysms and variations in the circle of Willis. Stroke. 15, 846-850 (1984).
- McCain, M. L., Agarwal, A., Nesmith, H. W., Nesmith, A. P., Parker, K. K. Micromolded gelatin hydrogels for extended culture of engineered cardiac tissues. Biomaterials. 35, 5462-5471 (2014).
- Weir, B., Grace, M., Hansen, J., Rothberg, C. Time course of vasospasm in man. 48, 173-178 (1978).
- McCain, M. L., Sheehy, S. P., Grosberg, A., Goss, J. A., Parker, K. K. Recapitulating maladaptive, multiscale remodeling of failing myocardium on a chip. Proc. Natl. Acad. Sci. U. S. A. 110, 9770-9775 (2013).
- Agarwal, A., Goss, J. A., Cho, A., McCain, M. L., Parker, K. K. Microfluidic heart on a chip for higher throughput pharmacological studies. Lab. Chip. 13, 3599-3608 (2013).
- Huh, D., Torisawa, Y. S., Hamilton, G. A., Kim, H. J., Ingber, D. E. Microengineered physiological biomimicry: organs-on-chips. Lab. Chip. 12, 2156-2164 (2012).
- Meer, A. D., van den Berg, A. Organs-on-chips: breaking the in vitro impasse. Integr. Biol. (Camb). 4, 461-470 (2012).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved