このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
II-45同系ラット中皮腫モデルにおける同所移植と末梢免疫細胞の監視
要約
免疫適格ラットの胸膜腔にII-45中皮腫細胞の移植による胸膜悪性中皮腫の同所性ラットモデルの生成が示されています。 25μlの血液試料から、これらの動物において7の免疫細胞サブセットを分析するためのフローサイトメトリー方法も記載されています。
要約
このようなワクチンおよび免疫チェックポイント阻害剤として癌の免疫ベースの治療に関心の巨大な盛り上がり、一括前臨床試験のための免疫適格同所モデルの必要性を指し、治療応答における腫瘍微小環境の役割の理解を増加これらの新しい治療法の。本論文では、胸膜悪性中皮腫の同所性免疫能のラットモデルを確立する方法を示しています。同所性モデルで監視疾患の進行は、腫瘍の内部の位置によって混乱されます。縦方向に疾患の進行およびこれと他の癌のラットモデルにおける免疫細胞の循環に及ぼす影響を監視するために、単一のチューブは、全血が記載されているだけで25μLを必要とするフローサイトメトリーアッセイ。総リンパ球、単球および好中球、ならびにT細胞サブセット、CD4およびCD8、B細胞およびナチュラルキラー細胞:これは7免疫パラメータの正確な定量化を提供します。別の潜水艦これらのパラメータのETSは、中皮腫モデルにおける疾患の進行をモニタリングするための最大の有用性を有するリンパ球の比率に好中球で、異なる状況やモデルにも有用です。この単一チューブ法を用いて、免疫細胞の循環レベルの分析はまた、免疫系の治療に対する応答をモニターし、治療の成功または失敗を引き起こす根底にあるメカニズムを理解することを助けることができます。
概要
悪性中皮腫(MM)は、膜(中皮)で形質転換された細胞から生じる攻撃的な悪性腫瘍であることライン肺や腹腔、心と内部生殖器官、および肺の空洞または胸膜1,2の最も一般的な原発腫瘍であります。アスベスト繊維への暴露は、全てのMMの80%を占め、およびアスベスト使用の禁止は、ほとんどの西洋諸国で数十年前に導入された一方で、地域社会での広範な使用は、致命的な遺産を残しています。世界保健機関(WHO)は、107,000人が世界的に死亡率が増加し続けると、アスベスト関連疾患から毎年死亡していると推定しています。新しい非職業入射波も浮上している、これは3のピークを迎えたとき、どのようなレベルでのほとんど理解があります。
全身化学療法が唯一の現実的な選択肢4のいずれかを表したとき、MMを持つ人々の大多数は遅く診断されています。最もeffecti化学療法と(シスプラチン5とともにペメトレキセド)現在の「標準治療」をVEのは、10年以上前に同定されました。しかし、この治療の失敗は避けられないと何の実績のある二行目のオプションは、12ヶ月の2の厳しい予後や生存期間の中央値の患者を残して、ありません。したがって、より効果的な治療が緊急に満たされていない必要性が存在します。臨床試験なしでの新しい治療法の数の検査にもかかわらず、実際に変化をもたらしました。これは、一般に、臨床的設定6-8に、異種移植マウスモデルにおいて行わ前臨床結果の低い(5%)転移に一部起因します。このようなモデルを忠実にしばしば機能する免疫系9の非存在下で、非生理的な場所で発生する腫瘍微小環境の複雑な側面を再現しません。
同系同所モデルはCよりもかなり現実的な腫瘍環境を作成します腫瘍が無傷の免疫系10,11で正しい生理場所で起こるようommonly皮下異種移植モデルを使用していました。ラットの大きなサイズは、特にシリアル血液は治療応答および毒性12を評価するために必要とされる描画薬物研究において、齧歯類疾患モデルとしての使用を強化します。さらに、疾患の進行をモニタリングすることにより(例えば、胸腔のように)腫瘍の場所に困難であるモデルにおいて、循環中に見出さ因子を用いて疾患の進行をモニターする能力は、非常に魅力的です。免疫コンピテントラットを用いた胸膜中皮腫の同系同所性モデルの生成について説明します。加えて、循環する免疫細胞を測定することにより、胸膜疾患の進行をモニタリングするための簡単で、比較的非侵襲性の方法も記載されています。
Access restricted. Please log in or start a trial to view this content.
プロトコル
動物に関わるすべての手順は、科学的な目的のための動物の管理と使用に関する実践オーストラリアの規範の勧告に従って実施しました。この研究のためのプロトコルは、ロイヤル・ノースショア病院動物実験倫理委員会によって承認されました。女性のフィッシャー344ラット(F344、150〜200グラム)を標準条件(12時間の明/暗サイクルと食料と水を自由に)下カーンズ施設、Kolling研究所で維持しました。
注:すべての実験手順のフローチャートを図1に示されています。
移植用の細胞の調製
- RPMI 1640(RPMI)培地は、10%ウシ胎児血清(FBS)を補充し、標準的な条件で増殖(37°、培養(クロシドライトアスベストの腹膜導入することによって誘導される、またIL-45としても知られる)は、ラット中皮腫II-45細胞株を5%CO 2でC加湿インキュベーター)。 Mainta75cm 2のフラスコに週二回、約1時50分で継代およびサブ培養することによってインチ
- 37℃で細胞培養と暖かいアリコートための試薬を準備します。必要な試薬は、10%のFBS、リン酸緩衝生理食塩水(PBS)および0.5%トリプシン-EDTAを用いて無血清RPMI培地(SFM)、RPMIが含まれます。
- 約70〜80%コンフルエンスに移植のための培養細胞。これは、線形成長段階にある保証します。
- 、培地を捨て、滅菌PBS 5mlで1回洗浄した後、3 mlの0.5%のトリプシン-EDTAを添加することにより、収穫細胞。
- すべての細胞が非接着性になるまで約5分間インキュベーターにフラスコを返します。
- 細胞は非付着したら、トリプシンを不活性化するために10%FBSを含むRPMIの3ミリリットルを追加します。 3分間300×gで細胞を収集し、遠心します。
- 3分間300×gで再びSFMと遠心の10mlに細胞ペレットを洗浄します。
- 上記のようにSFMと遠心の10mlで再び洗浄細胞ペレット。
- SFM 10mlに細胞を再懸濁し、血球計または類似の機器を用いて細胞数を実行します。
- 100μlを注入する細胞の量を含むように細胞を希釈します。
注:腫瘍の成長は、100μlの100個の細胞という低用量で実証されているが、標準用量は100μl中500,000個の細胞です。 - プライミングおよび針のデッドボリュームによる損失を補償するために余分に移植されるように、ラットの数( すなわち、100μL/ラット)、プラス少なくとも0.5ミリリットルのメディアで十分な細胞を準備します。
- 余分なコントロールラット( すなわち、100μL/ラット)、プラス少なくとも0.5ミリリットルに移植する(細胞なし)十分なSFMを準備します。
注:細胞とSFMが今移植のための準備ができています。彼らは、37 O℃に維持し、生存を維持するために、収穫の2時間内に移植されるべきです。
細胞の生体移植2.
- 誘導室へのF344ラット(> 13週齢)を配置し、1.4%イソフルラン吸入(または施設で使用されている方法)を使用して麻酔。ラットは(流れて1.4%イソフルランで)ノーズコーンに室から眠って動きそれであることが表示されたら、(腹ビュー)を上に向け、胸と背中の上に置きます。これは、内部の臓器が胸腔から離れて決済することができます。ラットが完全に麻酔をかけていることを確認するために制度的プロトコルに従って反射神経をチェックしてください。
- 毛皮を除去する権利レジオの肋骨(胸)の領域を剃ります。
- 80%(v / v)のエタノールで剃っエリアを清掃してください。
- 注射部位を特定します。右側に、頭蓋を開始する2番目の腺を見つけます。注射部位は、胸郭の尾の端から3番目と4番目の肋骨の間に、この0.5〜センチ近位です。 ( 図2A)。
- 静かに再懸濁し、II-45細胞を混ぜます。ゆっくりと1 mlの&に(対照ラットまたはSFM)細胞懸濁液を描きます#160;取り付けられた針のない注射器。針が細胞の描画アップに接続されている場合は、細胞が、針注入ラインに沿って成長するための可能性があります。 23Gのx 1.25針を取り付けます。プライム針と任意の気泡を除去。
- 注射器と針がプライミングされると、針軸の上に長さ20mmと直径5mmのスペーサーを配置します。これは、注入中の胸腔内に深く浸透する針を防ぐために使用されます。露出した針の約5mm、12 mmの任意の器官に損傷を与えることなく、リブを貫通するのに十分です。
- ゆっくりと、リブの間に針を挿入して血管が(何の血液が注射器に表示されないはずです)、その後、100μlの細胞やSFMを注入パンクチャーされていない保証するために、注射器に戻って描画します。 ( 図2B)。
- 針を外し、ゆっくりと胸腔内のセルを広めるために左右にラットをロールバックします。
- ケージにラットを置き、回復のために確認してください。目Eラットは、1分以内に起きてもよく、周りに移動を開始する必要があります。
- 新しい針を用いて各ラットについて、この手順を繰り返します。同じ針を再利用すると、針の注入ラインに沿って細胞の成長になります。
- 毎日の動物の幸福を監視します。
- 制度的動物倫理委員会によって支配されるよう倫理的に定義されたエンドポイントで、動物を安楽死させます。これらの実験におけるラットについての倫理的エンドポイントは、10%以上、又は呼吸困難の体重減少でした。
3.尾静脈採血
- 血液はすぐに後細胞移植を収集する場合は、麻酔したラットを保ちます。別の時点で血液をサンプリングした場合、1.4%イソフルラン吸入を用いてラットを麻酔。ラットが完全に麻酔をかけていることを確認するために制度的プロトコルに従って反射神経をチェックしてください。
- その側にラットを置き、外側尾静脈を探します。
- 80%エタノールで尾部を消毒し、0.5 mlのEDTA cをラベル付けollectionチューブ。
- 血液を収集するには、常に(沿った道の約3分の1)、尾の尾方端から始まります。これは最初の試みが失敗した場合の尾の頭蓋最後にさらに試み近づくことができます。これは血液凝固を引き起こすことができるように尾側にリサンプリングすることはありません。
- 横静脈に23Gのx 1.25針を平行に配置し、それが約10mm( 図3A)を貫通するように浅い角度で静脈の中にスライドさせます。
- 注意:静脈が正常にパンクしてきた場合、血液が針( 図3B)の取り付け端に表示されます。
- 一滴の血液は、針穿刺部位の尾に形成することになります。ラベル0.5ミリリットル(以下)のEDTA収集チューブにピペットと転送を使用して、この血液を収集します。免疫細胞アッセイ25μlのに十分です。出血が止まるまでサイトを穿刺する圧力とガーゼを適用します。
- PRするために、血液およびEDTAを混合するために血液チューブをフリックイベント凝固。採血と血液凝固を防ぐためにできる限り短く、EDTAと混合の間の時間をおいてください。
- 複数のラットから血液を収集する場合、分析まで室温でラックにEDTA-血液サンプルを保存します。コレクションの2時間内のプロセスの血液。
ビーズベースの方法を使用した免疫細胞のプロファイリング4.サンプル調製
注:この単一プラットフォーム方法は、各サンプルのビーズの既知の数を持っている市販の絶対計数管を使用することに依存しています。これらの管は、ビーズを放出する、サンプル調製中に溶解し、凍結乾燥ペレットを含みます。ビーズは、蛍光標識されたビーズ集団に対してゲーティングすることによって、絶対数を算出することができます。
- EDTA全血試料は、数分間ゆっくりとロータリーミキサー上に配置することにより十分に混合することを確認します。各サンプルごとに1絶対計数管にラベルを付けます。ビーズを含むペレットは、Tの下に表示されるはずですチューブの底にある彼は、金属製のビーズホルダー。
- ラベル絶対計数管にEDTA全血25μlのを転送します。ビーズペレットは、血液の添加時に溶解します。
- 各チューブに抗ラットT / B /ナチュラルキラー(NK)細胞カクテル20μlの、抗ラットCD8a PE10μlの、抗ラットCD4(ドメイン1)FITC及び抗ラット10μlの10μlのを追加CD45 PE / Cy7の( 図4A)。フルオロフォアは 、表1に定義されています。
- 抗体および細胞がチューブの底にあり、チューブの側面に貼り付けていない確実にするために遠心チューブに簡単に(300 XG)。渦は、混合し、室温で15分間インキュベートします。
- 赤血球を溶解するには、10 mMトリス、0.15Mの塩化アンモニウム緩衝液(pH 7.5)と混合する渦の400μlを添加します。サンプルは半透明で曇りのない( 図4BおよびC)が表示されたときに溶解は完了です。サンプルを溶解しないと、完全な増加につながりますDの背景とフローサイトメトリーで分析するときに誤ってカウントを上昇。
サンプルの5フローサイトメトリーの処理
注意:フローサイトメーター4色に実行します。
- 取得モードと、図5に示すように8プロットで新しいテンプレートのソフトウェアを開きます。
- 表1に記載されているものに機器の設定を調整し、蛍光ビーズをカウントするゲートR1(APC [FL-4] 対 FITC [FL-1])、 図5Ai)を設定 。他のゲートは、この買収段階で同様に重要ではありませんが、分析のために必要とされます。このプロトコルで使用される絶対計数ビーズは蛍光色素を含み、青のチャネルで最も弱いもののいずれかのチャネルで検出することができます。
- 調製した対照血液サンプル、渦を使用して、フローサイトメーター上にロードして、データ収集ゲートを調整することができるので、セットアップモードの低速(12μL/分)で動作します。
- 買収に設定しますR1ビーズゲート10,000イベントを収集。
- データを記録するフォルダを設定し、取得メニューのファイル番号とラベルサンプルファイルを設定します。
- サイトメーター上で分析されるべきサンプルをロードし、メディアに流量を設定します(35μL/分)。同じ流速で各サンプルを実行します。流量が低い(12μL/分)または高(60μL/分)に変化させることが必要になることがありますが、中には、一般的に適切です。このレートでは、各サンプルを10,000ビーズイベントを取得するために、約90〜120秒かかります。
- サンプルがロードされるとすると、必ずイベントをR1ビーズゲートに登場されていることを確認するために散布図を見ます。最初は散布図にドリフトを引き起こすサンプル圧力のいくつかの不安定性がある場合もあります。これが安定するのを待ちます。
- 安定したら、取得をクリックして、サンプルを実行することができます。サイトメーターサイトメーターを取得停止し、すべてのデータが保存され、R1 10,000ビーズイベントを取得完了したら。
- サンプルを削除し、TUを流す捨てますこと。サイトメーターは現在、次のサンプルの準備ができています。すべてのサンプルを実行してから、分析モードに進みます。
前記免疫細胞分析
注:ゲーティング戦略とブール代数は、各細胞集団を定義するために使用されます。ブール代数は、単一の定義に複数の操作を可能にするロジックベースの分析方法です。フローサイトメーター(例えば、BD CellQuestソフト)の解析ソフトウェアは、ブール代数の使用を可能にします。方程式は、より具体的に各細胞集団を同定するために、セルを定義するのに役立つ重要な負の反応のために積極的に考慮するために使用されます。 「領域」は「ゲート」を定義するために使用されます。 ( - 、 表2に定義された+、*、)ゲートは代数演算子で接続多数の領域から構成することができ、一方の領域は、2次元空間を定義します。
- 分析モードにソフトウェアを切り替えます。分析テンプレートが一致するように生成されるべきですプロットとゲートを有する図5に示します。
- 個別に個々のファイル( すなわち、それぞれの個々のサンプル)を分析します。 表2で定義されるように設定し、ゲートR1 R9を介して、その後に(また、図5に示されている)は、各細胞型のためのアルゴリズムを設定します。
- ゲートとアルゴリズム( 表2および図5)で定義された個々の細胞集団を計算するために、セルの統計カウンタを使用してください。アルゴリズムは、セル統計カウンタに自動的に細胞数を調整します。
- 以下の式を使用して、細胞サブセットを計算します。
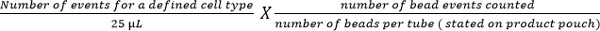
注:細胞計数事象の数(例えば、CD4 T細胞のイベント)は、血液1μl当たりの細胞数を得るために上記の式を使用して列挙されています。例としては、 図5に示されています。
Access restricted. Please log in or start a trial to view this content.
結果
II-45細胞を用いた胸膜中皮腫の同所性モデルを生成するために、本論文で使用した方法には、ラットは、注入法のために死んでいないで、再現性と迅速な時間枠内で中皮腫に屈した動物をもたらしました。 1×10 3個の細胞が完全に浸透モデル(100%生着)に必要な最小数であると判断した移植細胞の数の滴定。ラットに移植された細胞の異なる数は、疾患の重症度に影響を与えるよう...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
本論文では、胸膜中皮腫のラット同系同所モデルと縦採血を介して疾患の進行をモニタリングするための簡単な方法を生成するための方法を詳述します。
II-45モデルは、アスベスト繊維13にフィッシャー344ラットを暴露することによって開発されました。この暴露は、中皮腫の病因のためのホスト - アスベストの免疫系の相互作用の真のダイナミクスを表し?...
Access restricted. Please log in or start a trial to view this content.
開示事項
The authors have nothing to disclose.
謝辞
The syngeneic rat mesothelioma II-45 cell line was a kind gift from A/Prof. Emanuela Felley-Bosco, Zurich University.
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| EDTA Collection tube (0.5 ml) | Greiner Bio One GmbH | 450480 | |
| Rat T/B/NK Cell cocktail | BD Pharmingen | 558509 | anti-Rat CD3 APC (IgM clone 1F4), anti-Rat CD45RA Fitc (IgG1 clone OX-33), anti-Rat CD161a PE (IgG1 Clone 10/78) |
| anti-RAT CD8a PE | Biolegend | 200608 | (IgG1vClone G28) |
| anti-Rat CD4 FITC (Domain 1) | Biolegend | 203406 | (IgG1 Clone OX-38) |
| anti-Rat CD45 PE/Cy7 | Biolegend | 202214 | (IgG1 Clone OX-1) |
| TruCount Tubes | Becton Dickinson | 340334 | Box of 50 absolute counting tubes |
| RPMI 1640 media | Life Technologies | 11875-119 | |
| foetal bovine serum (FBS) | Scientifix | FBS500-S (lot# 010101-1) | |
| trypsin-EDTA | Life Technologies | 15400-054 | |
| PBS tablets | Medicago AB | 09-9400-100 | |
| 23Gx1¼ Needle | Becton Dickinson | 302008 | |
| 1 ml Syringe | Becton Dickinson | 302 100 | |
| Fischer 344 Rat | Animal Resources Centre, Perth Australia | F344 | |
| I.S.O (Isoflurane USP) | Veterinary Companys Australia (VCA) | B7058 | |
| II-45 Rat Mesothelioma line | Zurich University | Note: The cell line was given as a gift and is not commercially available at the ATCC | |
| FACSCalibur 4 color | Becton Dickinson | 342975 | |
| TRIS-HCL | SIGMA | T3253 | |
| Ammonium Chloride | SIGMA | 9718 | |
| Anaesthetic Machine (The stinger) | Advanced Anaesthesia specialists | #00449 |
参考文献
- Kao, S. C., et al. Malignant mesothelioma. Intern Med J. 40 (11), 742-7450 (2010).
- Zucali, P. A., et al. Advances in the biology of malignant pleural mesothelioma. Cancer Treat Rev. 37 (7), 543-558 (2011).
- Olsen, N. J., et al. Increasing incidence of malignant mesothelioma after exposure to asbestos during home maintenance and renovation. Med J Aust. 195 (5), 271-274 (2011).
- Zucali, P. A., et al. Thymidylate synthase and excision repair cross-complementing group-1 as predictors of responsiveness in mesothelioma patients treated with pemetrexed/carboplatin. Clin Cancer Res. 17 (8), 2581-2590 (2011).
- Vogelzang, N. J., et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol. 21 (14), 2636-2644 (2003).
- Lowenstein, P. R., Castro, M. G. Uncertainty in the translation of preclinical experiments to clinical trials. Why do most phase III clinical trials fail? Curr Gene Ther. 9 (5), 368-374 (2009).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Yakisich, J. S. An Algorithm for the Preclinical Screening of Anticancer Drugs Effective against Brain Tumors. ISRN Pharmacol. 2012, 513580(2012).
- Basu, D., Herlyn, M. Defining microenvironments within mouse models that enhance tumor aggressiveness. Cancer Biol Ther. 8 (4), 380-381 (2009).
- Abolhassani, M., et al. Screening of well-established drugs targeting cancer metabolism: reproducibility of the efficacy of a highly effective drug combination in mice. Invest New Drugs. 4 (4), 1331-1342 (2011).
- Hudson, A. L., et al. Establishing a panel of chemo-resistant mesothelioma models for investigating chemo-resistance and identifying new treatments for mesothelioma. Sci Rep. 4, 6152(2014).
- Iannaccone, P. M., Jacob, H. J. Rats! Dis Model Mech. 2 (5-6), 206-210 (2009).
- Craighead, J. E., et al. Characteristics of tumors and tumor cells cultured from experimental asbestos-induced mesotheliomas in rats. Am J Pathol. 129 (3), 448-462 (1987).
- Hunter, S. D., et al. Lymphocyte subset analysis by Boolean algebra: a phenotypic approach using a cocktail of 5 antibodies and 3 color immunofluorescence. Cytometry. 15 (3), 258-266 (1994).
- Brando, B., et al. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42 (6), 327-346 (2000).
- Schnizlein-Bick, C. T., et al. Evaluation of TruCount absolute-count tubes for determining CD4 and CD8 cell numbers in human immunodeficiency virus-positive adults. Clin Diagn Lab Immunol. 7 (3), 336-343 (2000).
- Gajkowska, A., et al. Flow cytometric enumeration of CD34+ hematopoietic stem and progenitor cells in leukapheresis product and bone marrow for clinical transplantation: a comparison of three methods. Folia Histochem Cytobiol. 44 (1), 53-60 (2006).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: the next generation. Cell. 144 (5), 646-674 (2011).
- Kao, S. C., et al. High blood neutrophil-to-lymphocyte ratio is an indicator of poor prognosis in malignant mesothelioma patients undergoing systemic therapy. Clin Cancer Res. 16 (23), 5805-5813 (2010).
- Kao, S. C., et al. Validation of prognostic factors in malignant pleural mesothelioma: a retrospective analysis of data from patients seeking compensation from the New South Wales dust diseases board. Clin Lung Cancer. 14 (1), 70-77 (2013).
- Burt, B. M., et al. Circulating and tumor-infiltrating myeloid cells predict survival in human pleural mesothelioma. Cancer. 117 (22), 5234-5244 (2011).
- Weir, C., et al. Streptavidin: a novel immunostimulant for the selection and delivery of autologous and syngeneic tumor vaccines. Cancer Immunol Res. 2 (5), 469-479 (2014).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved