このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
水剥奪、サッカリンフェージングまたは拡張アクセストレーニングなしでラットにおけるエタノールの補強性を評価するための方法
要約
このプロトコルは、すぐに水の欠乏または応答を開始するフェージングサッカリン/ショ糖を必要としない標準的な方法とは逆に、ラットでのエタノールの応答をオペラントを開始するための新規かつ効率的な方法を説明します。
要約
オペラント経口自己投与方法は、一般に、動物におけるエタノールの補強性を研究するために使用されます。しかし、標準的な方法は、ラットでの応答オペラントを開始するために、サッカリン/ショ糖フェージング、水の欠乏および/または拡張訓練を必要とします。本論文では、すぐに実験者のために便利であるため、エタノールオペラント自己投与試験で甘味料を使用しての潜在的な交絡を排除し、水の欠乏またはサッカリン/ショ糖フェージングを必要としないエタノールの応答をオペラントを開始するための新規かつ効率的な方法を説明します。この方法では、Wistarラットは、典型的には、取得して訓練の2週間以内に20%エタノール溶液の自己投与を維持します。また、血中のエタノール濃度および報酬は正に30分自己投与セッションに相関しています。また、ナルトレキソン、エタノール自己投与を抑制することが示されているアルコール依存症のためのFDA承認薬げっ歯類では、用量依存的にこのようにしてラットにアルコールの補強性を研究するために、この新しいメソッドを使用することを検証し、アルコール摂取とラットの自己投与し、20%エタノール用のアルコールを消費する意欲を低下させます。
概要
薬物の強化効果を研究するための動物モデルの開発は、ヒトの薬物嗜癖を研究するための重要なツールであることが証明されました。より具体的には、オペラント自己投与は、経口消費エタノール溶液の正の強化効果を評価するための最も有効な手段の一つであり、広く使用されている行動モデルです。このようなモデルを開発するとともに、早期の問題は、ほとんどのげっ歯類のためのエタノールの高濃度の主要な嫌悪味、アルコールも1とほとんど、またはまったく経験を持つヒトで共有されている現象でした。この障壁を克服するための標準プロトコルは、水の剥奪を必要とする、および/またはサッカリンまたはスクロースは、自己投与の獲得と維持のために退色します。しかし、これら2つのアプローチが有利ではありません。彼らは単にエタノールの応答を開始し、買収の相対的な成功率を得るために、トレーニングの長い期間を必要とします。甘味料の使用はまた、潜在的なバイアスを紹介します自己投与データの解釈。これらの制限は、以下のプロトコルには適用されません。
簡単に言うと、サムソンや同僚2は 20%のショ糖の甘い溶液にエタノールを溶解した後、訓練の4週間にわたって甘さをフェードアウトすると、水中の10%エタノールの応答を開始するために必要とされることが示されています。また、信頼性の高いエタノール摂取は、通常6〜8週間1-3で達成されます。このアプローチは、非常に問題があります。研究者はエタノール自己投与を測定するために開始する前にまず、それは訓練の長時間を必要とします。食物制限された動物での食品配送レバーの薬物前研修の1日、および薬剤の応答を安定は、多くの場合、10で達成される- -対照的に、コカインやヘロインの静脈内自己投与は、0を必要とする12日間4,5。この方法の別の制限は、サッカリンおよびスクロースは、ラットへの非常にやりがいであり、脳の活性化パターンのを誘発するという事実でありますこのようにエタノール自己投与に交絡の可能性を導入する乱用薬物へのimilarは、6-9を研究します。最後に、一貫して失敗した取得および/または不十分な応答速度に起因した実験から除外したラットのかなりの割合で、取得および応答率1,10このメソッドショーの変動を用いて、エタノール溶液の自己投与を獲得したラット。
これとは対照的に、このプロトコルでは、我々は水の欠乏、ショ糖/サッカリンのフェージングまたは拡張アクセス訓練を必要としない水溶液中の20%エタノールの経口自己投与の獲得と維持のためのシンプルで効率的な方法を提示します。最近の研究は、経口エタノールこと自己投与は、このように我々のexperim中の20%エタノール溶液を選択するための理論的根拠を提供し、20%のエタノール濃度で自己投与時の最高エタノール摂取と逆U字型の用量反応曲線を表示見出さ内部のデザイン11。
プロトコル
すべての手順は、実験動物の管理と使用に関するNIHガイドに従って行われています。
1.動物実験住宅
- 逆に12時間の明暗サイクルで、温度(21℃)と湿度が管理された環境でペアで到着時に225グラム - コロニーで到着すると、家のWistar系雄性ラットは200の重量を量ります。
注:実験の理論的根拠によって、ラットは、単一収容されてもよいです。 - ラットは、実験を開始する前に、少なくとも1週間飼育し、光サイクルに順応し、毎日それらを処理することを可能にします。週一回、動物を計量。
- (水の欠乏が12応答を開始する必要はありません)ラットを実験の期間のために水を固形飼料および水道への無料アクセスを提供します。暗い試験室での明暗サイクルの暗期中にすべての行動試験を実施します。
注:私たちは日常的に若年成人Wistar系雄性ラット(生後日62から65)を使用していますが、このPをrotocolは、理論的には他のラットの系統だけでなく、性別および/または年齢の違いを調査するために適切であり得ます。
2.オペラントトレーニング
- 30.5×29.2×24.1センチメートルを測定し、寝具を敷いたグリッドの床と廃棄物のパンを含む同一のオペラントチャンバー内のすべての行動訓練とテストを実施する換気用排気ファンを装備した音減衰キュービクルに収納され、(臭気の手がかりを減らすために、動物の間で変更されました) 。
注意:ラットを訓練の1日目からオペラントコンディションによって訓練されている+ 1時間と暗サイクルの+ 8時間の間(レバー上の応答は、補強材を得ることが必要です)。アルコールのトレーニングの前にアルコール、また食品や流体整形への前露光はありません。 - 刺激が点灯し、シリンジポンプと液体カップレセプタクルに横方向に配置された2つの格納式のレバーで各オペラントチャンバーを装備。適切なソフトウェアを用いてコンピュータによる界面室と制御。
注意:ほとんどのベンダーは、チャンバを制御するために必要な自己投与の必要なすべてのコンポーネントを含むパッケージだけでなく、ソフトウェアおよびインタフェースを提供します。 - 製造元の指示に従って20%エタノール補強材の固定比率(FR)スケジュール(応答が応答のみ指定した数の後に強化されたオペラントスケジュール)を開始オペラントコンディショニングプログラムを書きます。例えば、固定比1において、ラット(FR1プログラムの一例の補助コードファイルのセクションを参照)、補強材を得るために1つの応答を生成しなければなりません。以下のコマンドを実行します。
- セッションの開始をマークするとアルコールの可用性を通知するために2つのレバーを拡張します。
注:エタノールに関連付けられたレバー上の1つのレバーを押して(アクティブ)だけでなく、隣接する飲料中の水に20%のエタノールを100μLの容量の送達によって報わとによって合図5-S付随するタイムアウト時間を開始され、の照明レバー上記キューライト。キュー光が研修の1日目に導入されます。 - それはスケジュールされた結果を持っていないが、タイムアウト期間中に、レコードが応答します。レコードの応答は、他のレバー(非アクティブ)に彼らは行動の結果を持っていることはありませんが、。注:非アクティブレバーは、非特異的挙動を評価するための対照として役立ちます。
- アクティブレバー(応答速度)での応答の数と獲得した20%エタノール報酬の数を記録します。
- 30分が経過した後に、セッションの終了を知らせるとアルコールの可用性の終わりを知らせるために2つのレバーを撤回。
- すべてのデータを保存し、アーカイブします。
- セッションの開始をマークするとアルコールの可用性を通知するために2つのレバーを拡張します。
- トレーニングセッションを開始する前に、各オペラントチャンバー内のすべてのデバイスの適切な機能(リトラクタブルレバー、流体ディスペンサー)を確認します。
- 190プルーフ(95%)を水道水で希釈し、エタノールから20%(v / v)のエタノール溶液を調製します。
注意:エタノール溶液を室温で維持することができます。応じて製造元、在庫エタノール溶液は、最大99.98%であってよいです。また、ほとんどの公開写本で、エタノールの濃度は、通常、ボリューム/ボリュームとして提示されている間、いくつかは、重量/容積としてそれらを提示することができる、ということに注意してください。 - 20%エタノール溶液で注射器を記入し、輸液ライン内に漏れや気泡がないことを確認してください。手動エタノールが正しく最初の補強応答からレセプタクルに配信されることを確認するために、輸液ラインを介してエタノールの小容積を押してください。ペーパータオルで容器を乾燥し、それがセッションを開始する前に空であることを確認してください。
- 20%エタノール補強のFRスケジュールを制御するソフトウェアをロードします
- 30分のセッションの間の水の欠乏のない自己投与の20%エタノールにFR1スケジュールの下operant-訓練および薬物ナイーブラット。
- 輸送ケージを使用して、試験室へのビバリウムからラットを輸送。
- 1室に各ラットを割り当てます。輸送ケージからそれぞれ個々のラットを取り、割り当てられた自己投与室内に置きます。
- 毎日一貫実験の条件を保つようにしてください。そのため、常に毎日同じ自己投与室にほぼ同時にラットをテストします。
- 20%のエタノール補強のFR1スケジュールを開始するソフトウェアを起動します。
- セッションの最後に、自己投与室からラットを削除し、飼育器に戻します。
- 手動で、アルコール溶液は、動物によって消費されていることを確認ペーパータオルを使用し、容器が乾燥しているかどうかを確認するために。代替的に、1または2 mLの注射器を使用して、消費されない体積を推定するために容器内に残留する液体を集めます。
注:より正確な測定(だけでなく、より高価な)のために、それはなめるの正確な数を可能にする液体カップコンセントに接続lickometerシステムで各チャンバを装備することが可能です自己投与セッションの間にラットによって生成sです。 - 表面消毒剤で各チャンバの壁と格子床を清掃してください。
- 使用後、70%エタノール溶液でそれらを洗浄することにより、注入ラインを維持します。使用しないときは、カビやほこりを避けるためにキャップを挿入します。
- 各セッションの後、生成されたデータを収集して分析。具体的には、アクティブレバーを押すの平均数、得られたアルコールの報酬の平均数だけでなく、非アクティブレバー押しの平均数を計算します。
注:ほとんどの論文では、アルコール消費はまた、グラム/キログラム(体重)でのエタノール摂取として提示されています。エタノール摂取は、以下の式を用いて計算することができます。
消費量と(ミリリットル) - 0.789グラム/ mLの - 室温で単一のボリューム/報酬およびエタノールの密度±獲得した報酬の数。
例えば、400グラムの重さのラットは20 REWAを獲得した場合20%(v / v)のエタノール溶液のRDS。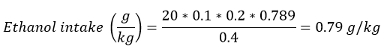
- (15セッションの最小値と最後の3セッション中に獲得した報酬の合計数の15%を超える変化なしとして定義される)性能の安定化までのセッションを5/6週を行っています。
注:ラットはFR1に安定なベースラインに達すると、オペラント条件付けプログラムは、アルコールの報酬を得るために必要な応答の数を増加させるために、製造者の指示に従って変更することができます。固定比は、例えば、偶発的な補強を最小限に抑えるために、FR2またはFR3に増加させることができます。 - 血中エタノール濃度を測定します。
- 自己投与セッションで得た報酬はラットによって消費されていることを確認するために、自己投与後の血中エタノール濃度を測定します。ラットは、安定なベースラインに達した後、直ちに次の外側尾静脈から血液を採取セッション。血管内に23 G針を挿入し、毛細管を使用して、50μLの血液サンプルを収集します。
- 10 mLのヘッドスペースバイアルに、50μLの血液サンプルを移し、1の50μL追加:内部標準として千イソプロピルアルコールを。エタノール標準から300ミリグラム/ dLの標準曲線10を準備します。メーカーの設定に応じてクロマトグラフィーカラム13とヘッドスペースサンプラによるプロセスのサンプル。
- 累進比率
- 報酬14を消費する動物のモチベーションを評価するために、累進比率(PR)スケジュールを使用してください。 PRは、補強材を得るために、応答の数が徐々に増加しているオペラントスケジュールである(他の点では、ラットは、連続する各報酬のために懸命に働くする必要があります)。
注:セッションをFRに反して、PRのセッションがタイムアウトされておらず、わずか30分で完了比ずに経過した一旦終了されます。- 自分に割り当てられたオペラント箱にラットを置き、許可それらは、補強のPRスケジュール下で20%のエタノールのために応答する:内セッション応答の要件やコストを増大させる( すなわち 、レバー押しの数を除いて、(ステップ2.3参照)FRスケジュールで使用されるものと同一のすべての実験条件をキープ単一エタノール報酬を受信するためにアクティブレバーに必要)以下の式に従って:1、2、3、4、6、8、10、12、16、20、24、28、32 ...注:例PRプログラムは補足コードファイルのセクションで提供されています。
- 30分には報酬なしで経過するとPRのセッションを終了します。
注:ブレークポイントをPRセッション中に最後に完了応答要件として定義されています。
- 報酬14を消費する動物のモチベーションを評価するために、累進比率(PR)スケジュールを使用してください。 PRは、補強材を得るために、応答の数が徐々に増加しているオペラントスケジュールである(他の点では、ラットは、連続する各報酬のために懸命に働くする必要があります)。
3.テストアルコール自己投与のオペラントモデルの予測妥当性
注:ラットは、安定な自己投与のベースラインを取得した後(ステップ2を参照)、モデルの予測的妥当性を評価することが可能ですナルトレキソンの効力を試験する、20%のエタノール自己投与を減少させるのにアルコール依存症のための現在のFDA承認薬。応答が確実に高いときに我々は、トレーニング(FR2)の間に達成された最高FR上でこのテストを行うことをお勧めします。予測的妥当性が確立されると、モデルは、新しい薬物候補を評価するために使用することができます。
- 試験日前に、ラットに皮下生理食塩水の注射を与える二つの連続自己投与セッションの最小中またはエタノールの応答をするまで注入にそれらを慣らすために先立って自己管理セッションへの30分は、生理食塩水の注射によって影響されない(変化なしとして定義最後の2つのセッション中に獲得した報酬の合計数の15%以上)。
- 生理食塩水にナルトレキソンを溶解し、動物に注射を容易にするための中立性に到達するためにpHを調整します。 1.0ミリリットルの体積に薬物を注射/投与の皮下経路を使用して、セッションの30分前にkgです。注:リットルatureは0.1の範囲との間の用量の選択のための十分な証拠を提供 - は1mg / kgであり、そのように0.1、0.3および1mg / kgのは、このプロトコルで使用されています。
注:その効力は皮下注射が30倍より強力腹腔内注射15ということでと異なる場合がありますけれども研究は、ナルトレキソンの管理の両方の皮下および腹腔内経路の使用を示しています。ナルトレキソンの注射のために、このルートを使用することが検証され、0.1及び1mgの間の濃度の範囲内で様々な研究室によって複製されているようにこのような理由から、我々は皮下経路を使用することをお勧めします/ 12,15,16を kgです。 - 試験日の間、30分自己投与セッションの前に4ナルトレキソン投与サイクル(0、0.1、0.3および1mg / kg)を1渡って被験者間デザインでバランス/ランダムな順序でラットを注入します。
- 各投与サイクルの間、ラットは、2つの連続した自己管理セッションの最小またはのために応答するまで、薬物をウォッシュアウトすることができますエタノールは、ベースラインに戻るです。注:その結果、試験の終了時に、全てのラットは、4つの用量のそれぞれに注入されました。
- この段階の後、最も効率的な用量(1 mgの/キログラム)を選択し、プログレッシブ比スケジュールを使用してアルコールを消費する動物の動機にナルトレキソンの効果をテストする(ステップ2.12参照)。
結果
図1は、水の欠乏またはサッカリン/スクロースフェージングのない自己投与の20%エタノールにFR1スケジュールで訓練を受けoperant-および薬物ナイーブWistarラット(239ラットの合計に相当する8つの異なるコホート)の代表的な自己投与挙動を示しています30分のセッション中。このプロトコルでは、ラットは、すでに最初のセッション( 図1A)
ディスカッション
このプロトコルでは、我々は、拡張アクセストレーニングをエタノール自己投与の古典的なモデルとは反対に、水の剥奪の使用を必要としない、ことをラットで20%エタノールの安定した経口自己投与を獲得し、維持するための新しい方法を提示していますまたはサッカリン/スクロースが12フェージング 。さらに、ナルトレキソン、アルコール依存のため、現在、FDA承認薬は、正常?...
開示事項
著者らは、開示することは何もありません。
謝辞
この作品は、スウェーデンの研究評議会によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| Extra Tall MDF Sound Attenuating Cubicle, Interior: 22"W x 22"H x 16"D | Med Associates Inc. | ENV-018MD | |
| Extra Tall Modular Test Chamber with modified Top, Waste Pan and Photobeam | Med Associates Inc. | ENV-007CT-PH | |
| Stainless Steel Grid Floor for Rat or Small Primate | Med Associates Inc. | ENV-005 | |
| Retractable Lever | Med Associates Inc. | ENV-112CM | 2 by SA chambers |
| Stimulus Light, 1" White Lens, Mounted on Modular Panel | Med Associates Inc. | ENV-221M | 2 by SA chambers |
| Dual Cup Liquid Receptacle with 18 ga Stainless Steel Pipes | Med Associates Inc. | ENV-200R3AM | |
| Single Speed Syringe Pump, 3.33 rpm | Med Associates Inc. | PHM-100 | |
| Liquid Delivery Kit | Med Associates Inc. | PHM-122-18 | |
| SmartCtrl 8 Input / 16 Output Package | Med Associates Inc. | DIG-716P2 | |
| MED-PC software | Med Associates Inc. | SOF-735 | |
| http://www.mednr.com/ | Med Associates Inc. | A website that is open-source and has been created to offer researchers a place to exchange MEDState Notation code | |
| Kendall Monoject 20 cc Syringes, Regular Luer Tip | VWR International | MJ8881-520657 | |
| Ethanol, Pure, 190 Proof (95%), USP, KOPTEC | Decon Labs | 2801 | |
| 0.9% Sodium Chloride Injection, USP | Hospira | 0409-4888-50 | |
| Naltrexone hydrochloride | Sigma Aldrich | N3136-1G | |
| 23 G BD PrecisionGlide Needles | BD | 305145 | |
| Minivette POCT 50 µL, K3EDTA | Sarstedt | 17.2113.150 | For capillary blood collection |
参考文献
- Koob, G. F., et al. Animal models of motivation for drinking in rodents with a focus on opioid receptor neuropharmacology. Recent developments in alcoholism : an official publication. of the American Medical Society on Alcoholism, the Research Society on Alcoholism, and the National Council on Alcoholism. 16, 263-281 (2003).
- Samson, H. H. Initiation of ethanol reinforcement using a sucrose-substitution procedure in food- and water-sated rats. Alcoholism, clinical and experimental research. 10, 436-442 (1986).
- Weiss, F., Mitchiner, M., Bloom, F. E., Koob, G. F. Free-choice responding for ethanol versus water in alcohol preferring (P) and unselected Wistar rats is differentially modified by naloxone, bromocriptine, and methysergide. Psychopharmacology. , 178-186 (1990).
- Koya, E., et al. Role of ventral medial prefrontal cortex in incubation of cocaine craving. Neuropharmacology. 56, 177-185 (2009).
- Karlsson, R. M., Kircher, D. M., Shaham, Y., O'Donnell, P. Exaggerated cue-induced reinstatement of cocaine seeking but not incubation of cocaine craving in a developmental rat model of schizophrenia. Psychopharmacology. , 45-51 (2013).
- Augier, E., Vouillac, C., Ahmed, S. H. Diazepam promotes choice of abstinence in cocaine self-administering rats. Addiction biology. 17, 378-391 (2012).
- Cantin, L., et al. Cocaine is low on the value ladder of rats: possible evidence for resilience to addiction. PloS one. 5, (2010).
- Lenoir, M., Serre, F., Cantin, L., Ahmed, S. H. Intense sweetness surpasses cocaine reward. PloS one. 2, (2007).
- Spangler, R., et al. Opiate-like effects of sugar on gene expression in reward areas of the rat brain. Brain research. Molecular brain research. , 134-142 (2004).
- Rassnick, S., Pulvirenti, L., Koob, G. F. SDZ-205,152, a novel dopamine receptor agonist, reduces oral ethanol self-administration in rats. Alcohol. 10, 127-132 (1993).
- Carnicella, S., Yowell, Q. V., Ron, D. Regulation of operant oral ethanol self-administration: a dose-response curve study in rats. Alcoholism, clinical and experimental research. 35, 116-125 (2011).
- Augier, E., et al. Wistar rats acquire and maintain self-administration of 20 % ethanol without water deprivation, saccharin/sucrose fading, or extended access training. Psychopharmacology. , (2014).
- Macchia, T., et al. Ethanol in biological fluids: headspace GC measurement. Journal of analytical toxicology. 19, 241-246 (1995).
- Hodos, W. Progressive ratio as a measure of reward strength. Science. 134, 943-944 (1961).
- Williams, K. L., Broadbridge, C. L. Potency of naltrexone to reduce ethanol self-administration in rats is greater for subcutaneous versus intraperitoneal injection. Alcohol. 43, 119-126 (2009).
- Czachowski, C. L., Delory, M. J. Acamprosate and naltrexone treatment effects on ethanol and sucrose seeking and intake in ethanol-dependent and nondependent rats. Psychopharmacology. , 335-348 (2009).
- Stromberg, M. F., Volpicelli, J. R., O'Brien, C. P. Effects of naltrexone administered repeatedly across 30 or 60 days on ethanol consumption using a limited access procedure in the rat. Alcoholism, clinical and experimental research. 22, 2186-2191 (1998).
- Stromberg, M. F., Casale, M., Volpicelli, L., Volpicelli, J. R., O'Brien, C. P. A comparison of the effects of the opioid antagonists naltrexone, naltrindole, and beta-funaltrexamine on ethanol consumption in the rat. Alcohol. 15, 281-289 (1998).
- Gonzales, R. A., Weiss, F. Suppression of ethanol-reinforced behavior by naltrexone is associated with attenuation of the ethanol-induced increase in dialysate dopamine levels in the nucleus accumbens. The Journal of neuroscience : the official journal of the Society for Neuroscience. 18, 10663-10671 (1998).
- Biggs, T. A., Myers, R. D. Naltrexone and amperozide modify chocolate and saccharin drinking in high alcohol-preferring P rats. Pharmacology, biochemistry, and behavior. 60, 407-413 (1998).
- Beczkowska, I. W., Bowen, W. D., Bodnar, R. J. Central opioid receptor subtype antagonists differentially alter sucrose and deprivation-induced water intake in rats. Brain research. 589, 291-301 (1992).
- Cooper, S. J. Effects of opiate agonists and antagonists on fluid intake and saccharin choice in the rat. Neuropharmacology. 22, 323-328 (1983).
- Samson, H. H., Pfeffer, A. O., Tolliver, G. A. Oral ethanol self-administration in rats: models of alcohol-seeking behavior. Alcoholism, clinical and experimental research. 12, 591-598 (1988).
- Koob, G. F., Weiss, F. Pharmacology of drug self-administration. Alcohol. 7, 193-197 (1990).
- Schank, J. R., et al. The Role of the Neurokinin-1 Receptor in Stress-Induced Reinstatement of Alcohol and Cocaine Seeking. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. , (2013).
- Avena, N. M., Bocarsly, M. E., Rada, P., Kim, A., Hoebel, B. G. After daily bingeing on a sucrose solution, food deprivation induces anxiety and accumbens dopamine/acetylcholine imbalance. Physiology. 94, 309-315 (2008).
- Avena, N. M. The study of food addiction using animal models of binge eating. Appetite. 55, 734-737 (2010).
- Morgan, D., Sizemore, G. M. Animal models of addiction: fat and sugar. Current pharmaceutical design. 17, 1168-1172 (2011).
- Lenoir, M., Cantin, L., Vanhille, N., Serre, F., Ahmed, S. H. Extended heroin access increases heroin choices over a potent nondrug alternative. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 38, 1209-1220 (2013).
- Augier, E., et al. The mGluR2 Positive Allosteric Modulator, AZD8529, and Cue-Induced Relapse to Alcohol Seeking in Rats. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology. 41, 2932-2940 (2016).
- Bice, P. J., Kiefer, S. W. Taste reactivity in alcohol preferring and nonpreferring rats. Alcoholism, clinical and experimental research. 14, 721-727 (1990).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved