Method Article
強化された暗視野顕微鏡とハイパースペクトルマッピングにより組織学的試料中の金属酸化物ナノ粒子の同定
要約
Enhanced darkfield microscopy and hyperspectral imaging with spectral mapping enable screening, localization, and identification of nanoscale materials in histological samples with improved speed and accuracy over traditional methods. The goal of this paper is to provide methods for darkfield imaging and hyperspectral mapping of metal oxide nanoparticles in histological samples.
要約
Nanomaterials are increasingly prevalent throughout industry, manufacturing, and biomedical research. The need for tools and techniques that aid in the identification, localization, and characterization of nanoscale materials in biological samples is on the rise. Currently available methods, such as electron microscopy, tend to be resource-intensive, making their use prohibitive for much of the research community. Enhanced darkfield microscopy complemented with a hyperspectral imaging system may provide a solution to this bottleneck by enabling rapid and less expensive characterization of nanoparticles in histological samples. This method allows for high-contrast nanoscale imaging as well as nanomaterial identification. For this technique, histological tissue samples are prepared as they would be for light-based microscopy. First, positive control samples are analyzed to generate the reference spectra that will enable the detection of a material of interest in the sample. Negative controls without the material of interest are also analyzed in order to improve specificity (reduce false positives). Samples can then be imaged and analyzed using methods and software for hyperspectral microscopy or matched against these reference spectra in order to provide maps of the location of materials of interest in a sample. The technique is particularly well-suited for materials with highly unique reflectance spectra, such as noble metals, but is also applicable to other materials, such as semi-metallic oxides. This technique provides information that is difficult to acquire from histological samples without the use of electron microscopy techniques, which may provide higher sensitivity and resolution, but are vastly more resource-intensive and time-consuming than light microscopy.
概要
ナノ材料は、ますます産業や様々な用途で使用されているように、このような電子顕微鏡のような伝統的な様式、より多くの、手頃な価格の迅速、かつ便利なナノスケール画像化および特徴付けの方法が必要です。細胞、組織、および生物系でナノ粒子(NP)の相互作用を可視化するために、多くの光学技術は、微分干渉コントラスト(DIC)顕微鏡1と、このような全反射(TIR)又は近などのエバネセント場ベースのアプローチを含め、使用されていますフィールド走査光学顕微鏡(NSOM)2,3。しかし、これらはほとんどの非専門家のラボ4の手の届かないところに、ハイエンドの分析手法です。透過型電子顕微鏡(TEM)などの電子顕微鏡は、また、細胞5,6,7,8-とNPの相互作用を研究するために使用されています。高角度環状暗視野(HAADF)走査型透過電子顕微鏡は、NPの相互作用を研究するために使用されていますウイルス9と。共焦点顕微鏡は、NP-細胞の相互作用10を研究するために使用される別の人気の技術です。
近年では、暗視野ベースのハイパースペクトルイメージング(HSI)技術は、生物学的マトリックス11内のNPを研究するための有望な分析ツールとして使用されてきました。 HSIシステムは、超立方体またはデータキューブ12として知られている空間およびスペクトルデータの三次元表現を生成します。スペクトル変化の空間的なマップは、材料識別のために使用されます。既知の物質のスペクトルプロファイルを生成し、未知試料との比較のための参照ライブラリとして使用することができます。 HSIシステムの主な利点の一つは、それによって、知られており、同様の組成物の別の基準粒子にそれらをリンクするだけでなく、 インビボまたはエクスビボでの位置及び未知のNPの分布を確立する分光法とイメージングを結合する能力、です。
のいくつかの利点があります従来の撮像技術よりHSIシステムを使用して:最小限のサンプル調製が必要です。試料調製は、本質的に、典型的には非破壊的です。画像収集と分析が高速です。技術は費用対効果の高い13です。そして、混合された組成物および/ または複雑なマトリックス中の化合物の空間分布及び分析がより容易に達成される14。
貴重なサンプルを含むナノ材料の研究のために、最も重要な検討事項の一つは、潜在的に繰り返して1つ以上の方法により試料を検査することを可能にする非破壊イメージング法の利用可能性です。反復または複数の分析は、単一のメソッドから利用できないでしょう包括的なデータセットを開発することが望まれます。この点には、その光学的性質を研究することは、サンプルを分析するための最も安全な方法です。強化された暗視野顕微鏡(EDFM)とHSIシステムを使用することにより、試料の光学応答を研究するために - すなわちリフレctanceだけでなく、吸光度と透過率-特徴識別および特徴付けは、15を行うことができます。潜在的な特性評価のエンドポイントは、相対的な大きさや形状のナノ粒子または凝集体のサンプル中のナノ粒子の分布の評価が含まれます。
本稿では、スペクトルアングルマッパー(SAM)と呼ばれるピクセルのスペクトルマッチアルゴリズムに基づいて、HSIシステムを使用して、死後組織中の金属酸化物ナノ粒子のために特別にマッピング方法を説明します。それは動物モデルは工業ナノ材料への曝露の健康への影響を評価するために使用される生体 nanotoxicology調査で 、現在および将来を補完する可能性があるので、私たちは、この特定のアプリケーションを選択しました。この方法の適用はまた、組織または動物モデルを利用したナノスケールの薬物送達研究を知らせることができます。 Oを通して、特に、ナノ粒子の吸収、分布、代謝、および排泄rgansや組織は、このシステムで調査することができます。多種多様なアプリケーションには、生物医学研究11で使用するために検討されています。
この方法は、元素組成16-19の種々のナノ粒子に曝露されている(例えば、種々の組織型、気管支肺胞洗浄試料、血液塗抹標本など)異なる生物学的試料の評価のために利用することができます。さらに、この方法は、 インビボおよびナノスケールの薬物送達研究のために適切である11 インビトロでのナノ粒子の生体内分布の研究に有用です。生物学的試料を越えて、EDFMとHSIは、廃水20のような環境試料中のナノ粒子を評価するために使用することができます。これは、ナノ粒子の侵入を防止するのに個人用保護具の有効性を評価するために使用することができるので、職業暴露評価は、同様にこの技術を使用することによって容易にすることができます。さらに、研究テ午前は、現在、職業暴露評価から集めたナノ粒子のフィルター媒体サンプルの評価のための同様のEDFMとHSIプロトコルを開発しています。 EDFMとHSIのためのこれらの種々のサンプルタイプの製剤は変化し得るが、それは彼らが容易に光学系によって視覚化することができるような方法で製造されることが重要です。それは従来の明視野顕微鏡を介して可視化されることになるかのように一般的に、サンプルを用意する必要があります。 11市販のいくつかのハイパースペクトルイメージングシステムがあります。
プロトコル
動物のプロトコルは、研究者」協力機関、ストーニーブルック大学の施設内動物管理使用委員会によって承認されました。この論文に使用される特定の材料及び装置のリストは 、表1に見出すことができます。
組織の1。サンプルの調製
- 前述の方法21-23ごとに組織学的または免疫組織化学的染色のために、金属酸化物ナノ粒子に曝露した動物の組織を準備します。
2.イメージング
- 顕微鏡の初期化
注:この研究では、研究グレードの顕微鏡は、高性能暗視野光源を装備し、使用された電動XYステージコントローラ、14ビット深度ハイパースペクトルカメラ、および複数の対物レンズ(10倍の空気、40X空気、100X油浸) 。ここで使用されるシステムは、100X(油浸)倍率で64ナノメートルの空間分解能を有しています。このスタッドに使用するコンデンサーyはケーラーとクリティカル照明の両方の機能を持っており、試料上の斜めの角度で高度にコリメート光を集光します。- プラグインでは、光源、XYステージコントローラ、(暗視野イメージングのための)光学カメラ、ハイパースペクトルカメラ、およびコンピュータシステムの電源をオンにします。 75%の電力に光源を設定します。最大の高さに、ステージを上げます。強化された暗視野イメージングのためまたは反射明視野イメージングのための顕微鏡の背面にコリメータに凝縮器に光ガイドを接続します。
注:75%パワーに光源を設定することにより、依然として鈍いと明るいピクセル間のコントラストを可能にしながら鈍くピクセルを高め、視野全体内の全画素の十分な、均一な照明があります。 - 動作位置にコンデンサーを上げます。任意の気泡の形成を回避し、慎重に集光レンズに型イマージョンオイルの3~5滴を適用します。気泡が形成すべきである場合、油を拭き取り、それを再適用します。
- スライドOを置きステージをn個。液浸油は、スライドに接触するまでゆっくりとコンデンサーを上げます。これは、オイルがスライドと接触する照明の急速に明るくリングを介して顕著になります。
- プラグインでは、光源、XYステージコントローラ、(暗視野イメージングのための)光学カメラ、ハイパースペクトルカメラ、およびコンピュータシステムの電源をオンにします。 75%の電力に光源を設定します。最大の高さに、ステージを上げます。強化された暗視野イメージングのためまたは反射明視野イメージングのための顕微鏡の背面にコリメータに凝縮器に光ガイドを接続します。
- 所定の位置に10倍の対物レンズを入れてください。フォーカスと接眼レンズを通して調べることでコンデンサーを揃えます。
- 輝度が最大になるまで粗客観フォーカスノブを経由して上下にステージを移動します。
- 最大輝度が見つかるまで、コンデンサ調整ノブを経由して上下に集中コンデンサーを移動します。視野内の可能な最も明るい中心スポットを作成しようとしました。
- 必要に応じて、明るいスポットを中心に、必要に応じて、コンデンサの配置のノブを調整します。
- 焦点に明るいスポットをもたらすために細かい客観フォーカスノブを使用してください。異なる倍率を得るために目的を変更する場合は、焦点面を再調整。 100倍対物レンズを使用する場合、目を強化するためにカバースリップ上にイマージョンオイルの滴を適用します電子イメージと対物レンズへの損傷を避けます。
- キャプチャ画像
- 関心領域を見つけるために、ステージコントローラを使用してください。この領域は実験の必要性によって決定されます。金属酸化物ナノ粒子に満ちた領域は、多くの場合、それらのない領域よりも明るく見えるような典型的なインジケータは、周辺地域との高コントラストとなります。
- 照明を平衡化するために、必要に応じて、コンデンサのフォーカスを調整し、微客観フォーカスノブを使用して焦点に地域を持参してください。視野内の高コントラスト、明確に定義された領域を得ます。
- (光学カメラ用)画像または(ハイパースペクトルカメラ用)datacubesがキャプチャされるかを決定し、どのような順序です。典型的には、光学像は10倍の空気対物レンズ、40倍空気対物レンズ、および100X油浸対物レンズ及び100X油浸対物レンズを有する対応するHSIのデータキューブを用いて得られます。
- 光学イメージングソフトウェアを開きます。設定」をクリックして”メニューバーインチ「捕獲イベントのイメージキャプチャボタン」を選択します。 (TIFFは、この実験のために使用された)記憶されている画像形式を選択します。ファイル名を割り当てます。保存された画像フォルダを参照し、選択します。デフォルトタイムラプスを保ちます。 「OK」をクリックします。
- 「露出」メニューで最高のコントラスト画像を作成して露出設定を選択します(この研究では、0.0%のレベル、3.0デシベルのゲイン、および35ミリ秒のシャッターのために使用されました)。
- メニューバーの「画像」ボタンをクリックして画像をキャプチャします。コンテキストを提供するために、顕微鏡対物レンズを変更することによって、高倍率でのものに加えて、いくつかの低倍率の暗視野画像を取り込みます。
注:これらの光学像は、広い視野と後で目視検査のためのより良い美的外観を有する傾向があるとして、ハイパースペクトルカメラで撮影される任意のdatacubesと同じ倍率で光学像をキャプチャします。これは、任意のDATACことが不可欠ですそれは目的の変更が捕捉されたスペクトルを変更する、顕微鏡光学素子の透過スペクトルを変化させ、したがって、スペクトル角マッパー(SAM)の精度が低下する可能性があるように、後にスペクトル使用一貫した倍率を分析するubes。 1データキューブが別の目的で取得した別のデータキューブと比較されている場合は、SAM機能が動作しない場合があります。
- ハイパースペクトルカメラに顕微鏡の光源ノブをリダイレクトすることによって、ハイパースペクトルカメラの画像検出器を選択します。光は、ハイパースペクトルカメラに向けられている場合は、画像を光学カメラソフトウェアに表示されません。ステップ2.4.4で指定されたように、1つは、それを必要とするかもしれないように、最小化したが、光学イメージングソフトウェアのウィンドウを閉じないでください。
- Datacubesのキャプチャ
- HSIのdatacubesを取得するためのハイパースペクトルイメージングソフトウェアを開きます。ライトガイドは、ハイパースペクトルカメラに向けられていることを確認してください。
- オープン "のHyperspectral顕微鏡「メニューバーに選択し、「HSI顕微鏡コントロール」。
- 客観的な倍率を設定して、パスを保存します。だから何の上書きが発生していない独特のすべての画像やファイルの名前を指定するようにしてください。より広い領域を捕捉するために必要な追加の時間のかなりの量で、ビューまたは行数(この研究のために720行を使用)のフィールドを調整することにより、設定内の領域の取り込みを変更します。最後に、露光時間(この研究のために0.25秒)を設定します。デフォルトに他のすべてのままにして、画像を表示するには、「プレビューHSI」をクリックします。
注意:表示された強度のグラフは横軸に記録されますHSIのデータキューブを示しています。縦軸は、HSIのデータキューブで捕捉されるスペクトルの波長を表しています。スペクトル波長に応じた強度のグラフ上の任意の位置にカーソルを置くと、図示されるように、その波長で、画像全体のすべての点の強度を生じます。 - はこのイメージにピークをシャープに罰金客観フォーカスを調整することにより、このプレビューに基づいてフォーカス。これはあまりにも困難な場合には、光学カメラの焦点距離がかなり似ているので、光学イメージングソフトウェアをロードし、光学カメラ、焦点にスライドバーをシフトした後、ハイパースペクトルイメージングソフトウェアに戻り、ハイパースペクトルカメラにスライドバーを返します。
- 光源の明るさ、コンデンサのフォーカスを調整することによって、または露出時間を調整するために、プレビューをキャンセルすることによって、このプレビューからの強度を調整します。後者は、最良の結果が得られたが、増加した露光時間が画像に時間がかかることがあります。目的は、より顕著なピークが十分に大きいが、検出器の最大強度を超えないようにするためのものです。ここで、理想的な範囲は1,000〜16,000単位です。
- 「キャプチャ」をクリックしてください。顕微鏡は、暗電流の画像を取ることが要求されます。整列を乱さないように、慎重に(上のスライドバーや絞りをリダイレクトおよびその他の光学系のいずれかのフォーカス)、「OK」をクリックします。正しい位置にスライドバーや絞りを復元し、表示されたときに、プロンプト画像にもう一度「OK」をクリックしてください。約5分の時間がより一般的であるもののイメージングは、30分ほどかかります。より長い露光時間が長い撮像時間をもたらします。進行状況インジケータが存在します。進行状況インジケータが完了する前に、物理的にスコープを乱さないように注意してください。
- 「利用可能なバンドのリスト」、「#の1zoom」、「#の1scroll」と「#1のRGBバンド」:名前を持つ4つの新しいウィンドウを確認します。これは、すべての将来の参照のためのデータキューブであるとして、「#1RGBバンド "ウィンドウを最大化します。
- 右データキューブをクリックして、TIFFとして保存し、「OK」をクリックします。場合は終了イメージング。すべてのサンプルを片付けます。水中の70%イソプロパノールで全油露出表面を洗浄。最大の高さに、ステージを上げます。非作動位置に最小の高さとプレスに低いコンデンサー。シャットダウンしているか、光源、ステージコントローラ、およびカメラを抜いてください。
リファレンススペクトルライブラリの作成3。
- リファレンススペクトルの選択
- HSIスペクトルプロファイルは、マトリックスに依存しているため、実験試料と同じマトリックスに含まれる関心の材料を含むことが知られているポジティブコントロールを選択します。
- この研究では、局所暴露試験からの実験ブタ皮膚組織と比較するための陽性対照として、金属酸化物ナノ粒子の高用量を注射したブタの皮膚を使用しています。懸濁液中の金属酸化物ナノ粒子のスペクトルプロファイルは、異なるマトリックスに生成され、検査および組織学的実験サンプルのために不適切ポジティブコントロールであることが見出されました。
- ステップ2.4で説明したようにポジティブコントロールからデータキューブを取得し、ハイパースペクトルカメラを使用。
- 特に注意してください時にSEこれは内部の粒子フィルタは、材料を識別するために使用する主要な測定基準であるとして、強度をめの設定。検出器(ここでは、16,000台)の飽和点以上の任意の強度は、(2.4.5のステップを参照してください。)無効なデータになります。
- 画像ウィンドウで右クリック、左クリック、「Z-プロファイルスペクトル」。ポップアップスペクトルプロファイル]ウィンドウが表示されます。自信を持って関心の材料を表すものとして識別することができるデータキューブ上の注目画素、特に明るいものまたはそれらの上に左クリック。関連するスペクトルを示すスペクトルプロファイルウィンドウを確認します。特に彼らの最低値と最高値をメモを取り、どの波長がそれに対応しています。
- 周囲の組織に非常に明るい比較して、容易に識別粒子と特にある関心領域をクリックすることで、陽性対照サンプル、調査を調査する場合。これらの粒子は、母校である可能性が最も高いです特に金属の場合の関心のIALS、。
- データキューブに存在する粒子を識別するために、「粒子解析」メニューの「パーティクルフィルタ」ツールを使用します。新しいポップアップウィンドウで、「スペクトルマックスが超えなければならない」観察します。これはステップ3.1.3での観察によって決定されます。それは興味のある材料よりも背景ピクセルよりも高いが、低いので、この値を設定します。 「有効なデータが最大」は最大強度(ここでは、16,000単位)です。
- デフォルトに他のパラメータを残すが、「サイズ閾値」のボックスを調整することで、サイズに基づいてオブジェクトを除外します。この時点で、または分析を実行した後のいずれか、このデータを保存します。この実験のために、次のパラメータを使用します。スペクトルマックスは越えなければならない:5,000;有効なデータが最大:16000;サイズのしきい値(ピクセル):400一旦、全てのパラメータが設定されている、「OK」をクリックします。
- の詳細と結果のグラフを観察示された強度閾値内で検出された粒子;このデータはエクスポートすることができます。興味のある材料の特性最大反射率の波長が既知であれば、同様の「マックスWL」の値を持つ粒子を選択します。それ以外の場合は、「すべてを選択」をクリックします。次に、「エクスポート」をクリックしてください。 「スペクトルライブラリへ」。その後、ファイル名を選択して「OK」をクリックします。
- HSIスペクトルプロファイルは、マトリックスに依存しているため、実験試料と同じマトリックスに含まれる関心の材料を含むことが知られているポジティブコントロールを選択します。
- 偽陽性スペクトルを削除します
- 負の対照となるサンプルを選択します。このようなサンプルを調製し、全ての実験サンプルが関心のある材料と類似または同一のナノ粒子の存在しないことが保証されていることを保存すると同じように扱われている必要があります。
注:これは、HSIスペクトルプロファイルは、マトリックスに依存しているように、負の制御マトリックスは、実験試料の行列と同じであることが重要です。この研究のために、我々は負のような金属酸化物ナノ物質にさらされていなかったブタの皮膚を使用しましたコントロール。 - ハイパースペクトルカメラを使用して、ステップ2.4.7で説明したように、陰性対照から数datacubesを取得します。少なくとも一方が(これはいくつかの汚染物質は、基準スペクトルであってもよいした場合に特に重要である)が必要であるが、より選択性を増加させるために捕捉することができます。
- 以下の手順で指示されるように、連続的ステップで取り込ま3.2.2(陰性対照)を各データキューブに対してステップ3.1(陽性対照)で収集したスペクトルライブラリをフィルタリングするために、ハイパースペクトルイメージングソフトウェアを使用します。
注:別のファイルに、その結果、フィルタスペクトルライブラリを保存して、興味のある材料について基準スペクトルライブラリとして使用します。- メインプログラムのツールバーにあるAnalysisメニュー、下の「フィルタスペクトルライブラリ」をクリックしてください。 「開く」をクリックしてください。 「新規ファイル」とは、ステップ3.1で作成したスペクトルライブラリを選択します。入力ファイルとしてポジティブコントロール用。 「OK」をクリックします。
- Eのxternalソース、スペクトルデータボックスの下にある「イメージ」を選択します。処理パラメータ]ボックスの下に、デフォルトの設定のまま。フィルタリングされたライブラリの出力名を(これはオリジナルよりも異なっている必要があります、または収集された生スペクトルライブラリが失われます)を選択します。 「OK」をクリックします。
- 「開く」をクリックしてください。 「新規ファイル」とは、ソースイメージを選択するように求められ、陰性対照、ステップ3.2.2でキャプチャ最初のデータキューブを選択します。
注:このソフトウェアは、スペクトルライブラリを分析し、陰性対照データキューブの任意のスペクトルと一致した各スペクトルを削除します。選択基準から背景を削除すると、それによって偽陽性の可能性を低減します。これが行われると、概要が(この要約は自動的に保存されていないことに注意してください)利用できるようになります。 - ステップ3.2.3.3その後、得られた(最後に作成されたフィルタのスペクトルライブラリを選択し、ステップ3.2.3.2コ:追加のフィルタリングを希望する場合は、を除いて、ステップ3.2.3.1から繰り返します。mpletes);ステップ3.2.3.3で、ステップ3.2.2から次のデータキューブを選択します。
注:サンプルは、光(例えば、カーボンナノチューブ)のかなりの量を散乱場合、ランプのスペクトルを補正し、正規化が必要になる場合があり、および/ または陰性対照に対する陽性対照スペクトルライブラリをフィルタリングするときゼロスペクトルが残っている場合。このような状況は、私たちの研究のために発生していなかったので、この補正は行いませんでした。
- 負の対照となるサンプルを選択します。このようなサンプルを調製し、全ての実験サンプルが関心のある材料と類似または同一のナノ粒子の存在しないことが保証されていることを保存すると同じように扱われている必要があります。
4.画像解析
- スペクトル角度マッピング
- すべての実験datacubesは、ステップ2.4以下に取得された後、ハイパースペクトルイメージングソフトウェアを使用して、スペクトルメニュー、マッピングメソッドサブメニューから「スペクトルアングルマッパー」(SAM)を開きます。スペクトル角度マッパが幾何学的に、波長の関数としての強度の変化を解析することによって、スペクトルを比較する( すなわち、それはそれらの強度を正規化し、角度を再比較することにより、2つのスペクトルを比較します24)各スペクトルのグラフをトレースするquired。
- オープンデータキューブを使用すると、ポップアップウィンドウの実験データキューブの名前を選択し、「OK」をクリックします。何のファイル名がリストされていない場合は、「開く」をクリックします。 「新規ファイル」、実験データキューブを選択し、「OK」をクリックします。
- SAM:エンドメンバーコレクションと呼ばれる新しいポップアップウィンドウを確認します。メニューバーの「インポート」をクリックし、「スペクトルライブラリファイルから」を選択します。名前のスペクトルライブラリ入力ファイルが表示されるポップアップウィンドウ。ステップ3.2.3で作成された参照のスペクトルライブラリを開きます。 「OK」をクリックします。 「入力スペクトルライブラリ "という名前の新しいポップアップウィンドウを確認します。
- 「すべての項目を選択」をクリックします。 「OK」右「カラー」をクリックして選択をクリックし、「すべてにデフォルトの色を適用します。」をクリックして "適用"に続いて "、すべてを選択」して、出力ファイル名のANを選択「OK」をクリックしますdが。スペクトル角マッパーはデータを分析し、保存するために数秒かかります。
- ハイパースペクトルイメージングソフトウェアでデータキューブを開きます。画像ウィンドウのオーバーレイメニューの「分類」を選択し、ファイル名に移動して、「OK」をクリックします。ユーザーは今、彼らは、画像でにマップ場所を確認するために、ライブラリから任意のスペクトルをオーバーレイすることができます。
- ステップ4.2で説明したように統一されたカラースキームは、(そのような他のソフトウェアで簡単に分析するためとして、所望される場合、画像ウィンドウでオーバーレイメニューから開いた「インタラクティブクラスツール」のオプションメニューから「クラスのマージ」オプションを選択します。)。
- (「ベースにマージするクラス」リストで「未分類」を除いて一般的に、すべてのもの)を組み合わせて、「ベースクラス」リストから単一のスペクトルを選択するために、すべての分類を強調表示して、「OK」をクリックします。その色は今represます選択したすべてのスペクトルをENT。
- 選択した色をクリックして、一致するすべてのスペクトルは、その色で表示されます。
- デフォルトでは黒です「未分類」色のボックス、上の黒い背景、cIickオーバーマッチングスペクトルが表示されます二色画像を得るために。二色画像を観察します。この手順は、「未分類」色ボックスをもう一度クリックして反転させることができます。
- 右現在アクティブな任意のオーバーレイを含む、TIFFなどの画像を保存します。
注:将来の撮影処理については、二色画像が使用されます。 - マッピングの統計情報を取得するために「対話型クラスツール」ウィンドウで、オプションメニューから「クラスの配布」を選択します。このデータは、多くのピクセルがマップされていないであった(未分類)とどのように多くの関心の材料として同定されたかを表します。画素数がマッピングされた粒子の数と一致しないことに注意してください。この情報は自動的にRではありませんecorded。
- ハイパースペクトルにおける粒子解析は、画像をマップされました
- NIH ImageJソフトウェアで画像を開きます。
- サブメニュー、「しきい値」機能を調整し、イメージメニューを使用します。他のすべての物質から関心のある粒子を区別するパラメータを選択します。この研究については、次のしきい値パラメータを使用します。デフォルトのしきい値法、カラーの赤、色空間HSBは、色相、彩度、明度のためのパスのチェックボックスをチェックし、暗い背景のチェックボックスをチェックしました。
注:これは、場合に大きく異なる場合があります。マッピングされたデータキューブを分析するとき、これは、単一の色に関連するすべてのクラスを統合し、(4.1.8に4.1.4ステップ)画像を生成する前に、すべての未分類の色でその色を重ねることによって簡略化することができます。 - 、地域の情報を取得意味する機能、最小値と最大値を「粒子の分析」、分析メニューを使用します。サイズ0の無限の円形:この研究のために、ここでパラメータを使用します0-1、何を示していないが、表示結果のチェックボックスをチェックしました。
- 統計分析のために、同様のコントロールサンプルに位置する粒子の数と大きさとの統計的比較を可能にする他のソフトウェアプログラムにこのデータをエクスポートします。私たちは、ImageJのデータの分析のためにスプレッドシートを使用してお勧めします。ステップ4.2.4の後に結果テーブルに表示されるデータは、スプレッドシートにコピーする必要があります。 AVERAGE関数は、粒子の平均の大きさを決定するために、エリアカラム上で使用することができながら、MAX関数は、粒子の数を決定するために、最初の(タイトルなし)カラム上で使用することができます。将来的には、実験的な検証は(例えば、TEM)をサイジングするための確立された標準に対する平均サイズを決定する際に、この機能を調査するために追求されます。
結果
ハイパースペクトル顕微鏡は、分光光度法と同様の方法で物質を同定する能力のために有用です。 図1に示されるように、各材料は、いくつかの特徴的なスペクトル及びユニークで、その反射率の全体的な形状を有しています。また、 図1は、スペクトルプロファイルのマトリックス依存性を示す図である:組織学的組織サンプル中の3つの金属酸化物のそれぞれ(上のパネル)のスペクトルプロファイルは、水性懸濁液中で3つの金属酸化物の各々についてスペクトルプロファイル(異なります下のパネル)。同じマトリックス中に未知の試料の特徴的なスペクトルプロファイルをマッピングすることによって、この技術は、材料の有無を決定するために有用であり、また、半定量的サンプル中の物質の相対量を比較することができます。
陽性対照皮膚サンプルから作成した基準スペクトルライブラリーは実験的にマッピングするために適切です皮膚サンプル。 図2に見られるように、基準スペクトルのライブラリは、対応する陽性対照にうまくマッピングし、対応する負のコントロールにマップされません。
技術の最も重要な利点は、試料中の目的の物質の低いレベルを検出するため、ならびに汚染物質と区別するために、その能力です。例えば、個々のナノチューブ20〜30グラムのラット25で40μgのほど低用量の吸入の間に肺に観察することができる。図3は、組織学的皮膚サンプルでこれを示しています。いくつかの粒子は、暗視野光学像で容易に明らかであるが(コラム2)他のものは明視野顕微鏡(カラム1)、または他の方法を使用して、見逃されている可能性があり、ハイパースペクトルイメージング(列3)を用いて検出されます。暗視野HSIの使用はまた、単純な明視野顕微鏡上の特異性を改善するのに役立ちます。これらの画像は、その後、n分析のより定量的な形態を受けることができますImageJの経由otably粒子分析。
強化された暗視野顕微鏡でもハイパースペクトルイメージングの非存在下では、いくつかの異なる用途を有します。最初は、高品質、高コントラストの画像を生成する能力です。これは、最もよくする目的の粒子は、それらの明視野の対応と比較して容易に識別され、 図3に示されています。ハイパースペクトルマッピングが存在しない場合には、注意が関心のある粒子からの汚染物質の粒子を混乱を避けるために必要があるが、これらの画像はまた、定量的な粒子分析を受けることができます。
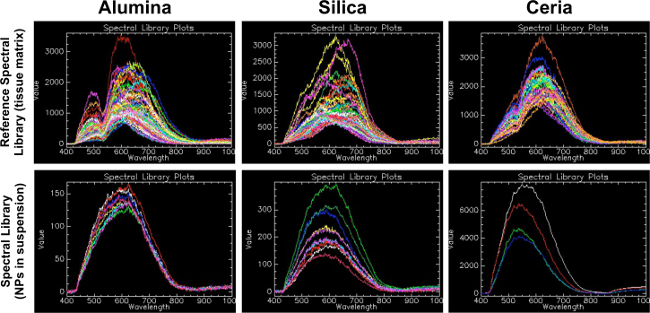
スペクトルライブラリ(懸濁液中のナノ粒子)に比べて、図1の参照スペクトルライブラリ(組織マトリックス)。この図はナンから基準スペクトルライブラリーを生成することの重要性を実証します実験試料と同じマトリックスに関心のomaterials。最初の行は、この研究(アルミナ、シリカ、セリア)の各材料のための参照スペクトルライブラリ(RSL)を示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
このRSLは、陽性対照組織サンプルは、陰性対照組織サンプルに対して濾過したこのプロトコールに記載の方法によって作成されました。 2行目は、スライドガラス上の液体懸濁液中の関心のナノ粒子から作成されたスペクトルライブラリ(SL)を示しています。より多くの湾曲の少ない独特のピークはシリカの周りを600でアルミナNPサスペンションSLで見られたのに対し、アルミナの場合は、500と650の波長における二峰性ピークは、RSLで発見された、周りの650の波長でピークがありましたより多くの湾曲の少ない独特のピークはarouでシリカNPサスペンションSLで見られたのに対し、RSLに存在します少ない独特のピークが周りの560でセリアNPサスペンションSLで見られたのに対し、NDセリアの場合600は、二峰性のピークは、RSLに520と620の波長で発見されたこれは、NPのが埋め込まれたマトリックスが作成されますことを示唆していますなどの特定の実験のためのSLを作成するためのコントロールを選択するときに、かなりのことができるスペクトルのシフト。
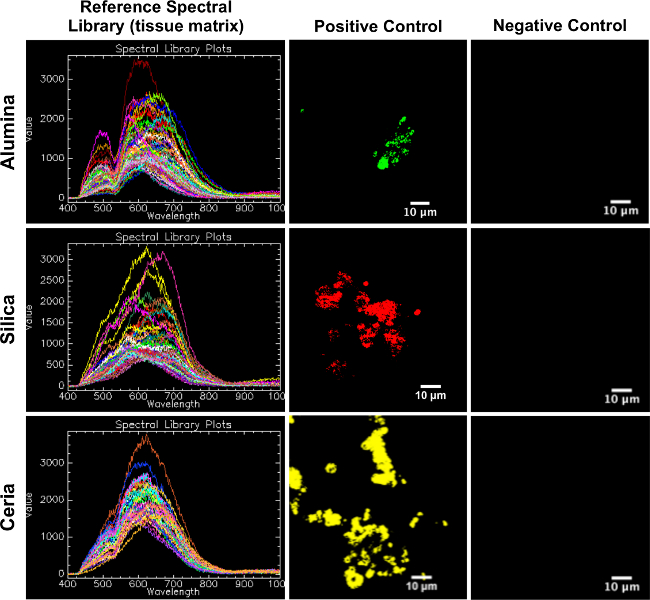
図2の参照スペクトルライブラリ(組織マトリックス)を陽性対照および陰性対照ブタ皮膚組織にマッピング 。各RSL(左の列)は、その対応する陽性対照(中央の列)にもマッピングし、それに対応するネガティブコントロール(右列)にマッピングされていないという点で、この図は、実験試料へのマッピングに適したとしてのRSLの確認として機能してください。時間をクリックしますこの図の拡大版を表示するには、ERE。
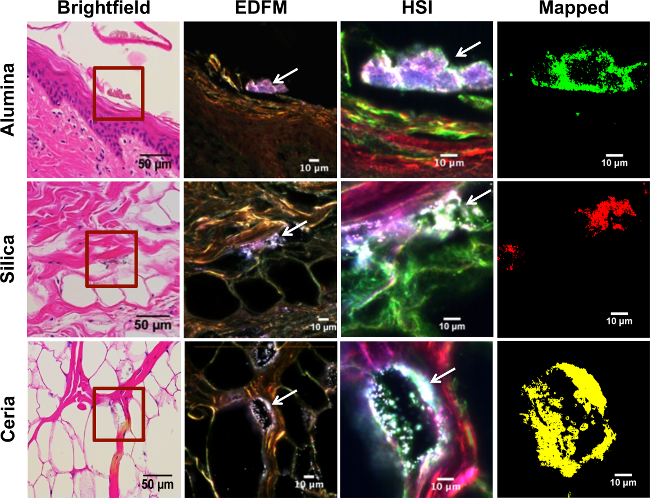
金属酸化物ナノ粒子にさらされる実験ブタ皮膚組織の図3ハイパースペクトルマッピング 。それぞれ、表皮、真皮、皮下組織、:上から下への行は、表層から最も深い層に皮膚の異なる層に対応しています。最初の行は、懸濁液中のアルミナのNPに曝露された皮膚試料の表皮の角質層を示す図です。 2行目は、懸濁液中のシリカのNPに曝露しました。 3行目は、懸濁液中でのNPをセリアします。各列は、異なる技術を用いて画像化皮膚の同じ領域を示しています。強化された暗視野顕微鏡(EDFで、最初の列は、明視野顕微鏡赤い四角で囲まれた領域が拡大された(40X MAG;スケールバー=50μm)を、(スケールバー=10μmの100XのMAG)に対応白い矢印は、高コントラストのNPを指している第二カラム、中のM)。 3列目は同じ高コントラストのNP(白矢印)を示す、ハイパースペクトルカメラ(HSI)を得ました。 EDFMおよびHSI画像は、100Xの倍率で撮影しました。 =10μmのスケールバー。 4番目の列は、それぞれイエローの各アルミナのNPが緑で表示されている曝露群、赤中のシリカのNP、およびセリアのNPに対するそれぞれのRSLに対してマッピングされたHSI画像を示している。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
従来の組織学的染色、金属酸化物ナノ粒子の同定および分析を受けた組織サンプルはEDFM、HSIマッピング、及び画像解析技術の組み合わせによって達成することができるために。 、それはサンプルが最適な可視化のために5〜10ミクロンの厚さに区分されることが重要であり、組織学または免疫組織化学のための試料調製における柔軟性(汚れの種類例えば 、固定または凍結組織を用いた)がありますが。ここで使用されるサンプルは、ヘマトキシリンおよびエオシンで染色し、カバーガラスを、ガラス顕微鏡スライド上に取り付けられた、ホルマリン固定およびパラフィン包埋の前6μmの厚さにロータリーミクロトームで切片にしました。 ex vivoでの皮膚浸透毒性コラボレーションからブタの皮膚組織をこの研究に使用しました。組織は、水性懸濁液中の金属酸化物ナノ粒子(アルミナ、シリカ、セリア)に曝露しました。関心領域(複数可)の検出(高コントラストelemeNTS)EDFMとその後のHSIマッピングおよび分析を容易に重要な最初のステップです。陽性および陰性対照サンプルを画像化し、参照用スペクトルライブラリを作成するために最初に分析しなければなりません。陽性対照から収集されたスペクトルは、正の対照スペクトルライブラリに輸出されています。その後、負の対照画像からすべてのスペクトルは、特異性を改善するために、陽性対照のスペクトルライブラリから減算される(偽陽性を減少させます)。得られた濾過したスペクトルのライブラリーは、目的の物質の分析に役立つRSLと見なされます。すべての組織サンプルは、同じ撮像処理を受け、RSLに対してマッピングされます。結果の画像は、黒の背景の上に興味の要素を持つ領域のみが含まれます。この画像は、視野当たりのマッピングされた粒子の面積を求めるために、その閾値と粒子解析関数を使用してImageJを用いて分析することができます。 ImageJのから得られた数値データをエクスポートすることができますさらなる分析のためにスプレッドシートにエド。
それは、生物学的サンプルは、互いに本質的に異なっており、および染色方法はEDFMとHSIを介して可視化に影響を与えることができるように、露出設定は、サンプルの特定のタイプに最適な高コントラスト画像を生成するものに応じて決定されるべきであることを考慮することが重要です。偽陽性の低減は、スペクトルライブラリーのろ過によって達成することができるが、この汚染に対応するスペクトルが潜在的に陽性対照のスペクトルライブラリから濾過することができるように、それは、興味の要素による汚染を回避している信頼性のネガティブコントロールを得ることが重要です、偽陰性率が増加します。 SPを生成蓄積した粒子数の多いエリア:また、ハイパースペクトルイメージングソフトウェアで検出可能であるスペクトル強度の範囲は、特定のソフトウェア(この研究のために、それは16,000単位である)の上限を超えることはできません強度限界を超えるectral強度が偽陰性の数を増加させる危険性に起因し、スペクトルライブラリの外に残っています。
HSIシステムは、従来の方法に比べて多くの利点を与える一方で、考慮すべきいくつかの欠点と制限があります。一つは、収集した光大量のデータが実質的な計算能力を必要とするかもしれないということです。もう一つは、基準スペクトルのライブラリが作成されているときHSIは、特に初期段階で、時間がかかることができるということです。また、撮像時間は、単純な暗視野像よりも、それが遅くなって、画像キャプチャごとに数分かかることがあります。しかしながら、それは依然として電子顕微鏡でサンプル調製および可視化を行うよりも高速です。さらに、複雑なシステムは、高度に専門的なコントロールの開発を必要とする複数の特性スペクトル、をもたらし、26難しい標準化、ユニバーサルリファレンスライブラリの確立を行うことができます。最後に、ハイテク個々の原子を解決することができ、このような原子間力顕微鏡や透過型電子顕微鏡などのプローブ - 又は電子顕微鏡技術は、より低い解像度でnique結果。この技術の分解能が原因で、ナノメートルレベルまたは正確にサブミクロンレベルでの材料を配置するための粒子サイズを測定するための高精度なツールであることから、それを防止するその光の性質が、これらに限定されます。技術は、特定の組織区画または細胞小器官内(例えば、細胞核など)1μm以上の粒子を特定することができるかもしれないが、小さい細胞小器官または特徴は、この方法で正確に視覚化するために挑戦しています。また、その空間分解能与えられたノートの、この方法は、単一のナノ粒子と凝集体11を区別することはできません。
その他の考慮事項は次のとおりです(例えば貴金属など)特定の材料は、非常に高い反射率と異なるスペクトルのプロファイルを持つ、ANALYにそれらを容易にすることができますZEこのツールを使用して、スペクトルマップ。このような半金属のこの研究で調査酸化物と炭素系ナノ材料24、27、などの他のものは、それらの元素組成、形状により困難であること、およびマトリックスに依存することができます。マーサーによってら二つのマウス吸入試験では、本研究で用いたものと同様のシステムは、肺内および周囲組織との著しく高いコントラストに基づいて、二次臓器にカーボンナノチューブを配置するために使用しました。炭素繊維のユニークな形状は、識別のための十分な特性だったのでしかし、ハイパースペクトルマッピングは、いずれの試験ではそう実証されていません。通常の生物物理学的プロセスを経て特定の臓器への関心のナノ粒子を堆積する(多くの場合、自身の研究の対象)予測不可能であるため、該当するポジティブコントロールの決意が困難であることができ、制御メートルのどの世代の配慮が必要です。もう1つの考慮事項は、組織に特異的に関連します興味のある材料の状態に影響を与えるIGHT。スペクトルライブラリが関心の自然のままのナノ粒子から作成されている場合、それが原因で変更することにより、 例えば粒子(の変化に起因するスペクトルの変化に組織または細胞におけるこれらの同じナノ粒子にライブラリをマップすることが困難な場合がありますpHは、溶解、凝集、結合タンパク質)および全体的な微小環境または行列。最後に、技術は、その半定量的性質に制限される:それは、それが容易にそのような材料の全器官の負担を特徴付けるなどのタスクを実行するために使用することができないことを意味同様の解像度の他の二次元顕微鏡技術のように定量することができます。
全体的に、EDFMとHSIは、TEM、HAADFやDICなどの従来のナノ材料のイメージングと特性評価技術、いくつかの利点を提供します。 EDFM / HSIはより集中Convenとに比べて時間とコストを節約するより高速画像収集と分析を可能にします的な技術。さらに、EDFM / HSIための試料調製は、時間を節約し、また、それは、他の技術のために使用することができるので、与えられたサンプルのより柔軟な分析を可能にする、一般的に最小で非破壊の両方です。さらに、HSIは、多くの組成物のナノスケール物質の分析のためおよびマトリックスの様々な可能、汎用性があります。研究チームは、技術の特異性の詳細な評価を含め、他の材料とサンプルタイプのためにここに記載された方法を改善するために取り組んでいます。研究チームによる調査の下で重要な次のステップは、目的の材料や組織タイプのための伝統的な金の基準に対するこれらの技術の検証(例えば、ラマン、TEM、SEM)です。
開示事項
The authors have nothing to disclose.
謝辞
The authors thank Günter Oberdörster, DVM, PhD and Alison Elder, PhD (University of Rochester) and Mary Frame, PhD (Stony Brook University) for animal research collaborations resulting in tissue samples for analysis. Additionally, the authors thank: Christina Rotondi (Albany Medical College Histology Core); Rani Sellers, DVM, PhD and Barbara Cannella, PhD (Albert Einstein College of Medicine Histology and Comparative Pathology Facility); Leonardo Bezerra and Ahlam Abuawad (Brenner research team members); and Leslie Krauss, Byron Cheatham and Elyse Johnson (CytoViva). This work was supported in part by CDC-NIOSH grant OH-009990-01A1 and the NanoHealth and Safety Center, New York State, awarded to S.B.
資料
| Name | Company | Catalog Number | Comments |
| CytoViva 150 Unit (condenser) | CytoViva (Auburn, AL) | mounted to Olympus BX43 microscope | |
| Olympus BX43 Microscope - Analyzer Slot - HSI with 10x and 40x air objectives and 100X oil immersion objective | obtained through CytoViva (Auburn, AL) | for use with CytoViva 150 Unit condenser | |
| Dagexcel-M Digital Firewire Camera - Cooled; includes Exponent 7 software | obtained through CytoViva (Auburn, AL) | enhanced darkfield camera and software | |
| CytoViva Hyperspectral Imaging System 1.4; includes Pixelfly hyperspectral camera, XY stage controller, ENVI hyperspectral imaging software | obtained through CytoViva (Auburn, AL) | hyperspectral camera and software | |
| cleanroom cleaned glass microscope slides (glass B slides) | Schott NEXTERION | 1025087 | reduced debris and artifacts compared to conventional glass microscope slides for optimal imaging |
| cleanroom cleaned glass microscope coverslips (#1.0; 22 mm x 22 mm x 1.45 mm) | Schott NEXTERION | custom | reduced debris and artifacts compared to conventional glass coverslips for optimal imaging |
| type A microscopy immersion oil | Fisher Scientific | 12368B | multiple suppliers |
| 70% isopropanol in water | multiple suppliers | ||
| ImageJ software | National Institutes of Health (NIH) | free open-source software online download | |
| metal oxide nanoparticles | supplied to the research team by industrial partners | alumina, silica, and ceria nanoparticles in aqueous suspensions. Due to a Non-Disclosure Agreement between the authors and industry partners, further product information cannot be disclosed. |
参考文献
- Sun, W., et al. Endocytosis of a single mesoporous silica nanoparticle into a human lung cancer cell observed by differential interference contrast microscopy. Anal Bioanal Che. 391 (6), 2119-2125 (2008).
- Anselme, K., et al. The interaction of cells and bacteria with surfaces structured at the nanometre scale. Acta Biomate. 6 (10), 3824-3846 (2010).
- Anshup, A., et al. Growth of gold nanoparticles in human cells. Langmui. 21 (25), 11562-11567 (2005).
- Weinkauf, H., et al. Enhanced dark field microscopy for rapid artifact free detection of nanoparticle binding to Candida albicans cells and hyphae. Biotechnol. 4 (6), 871-879 (2009).
- Sondi, I., et al. Silver nanoparticles as antimicrobial agent: a case study on E coli as a model for Gram negative bacteria. J Colloid Interface Sc. 275 (1), 177-182 (2004).
- Berry, C. C. Possible exploitation of magnetic nanoparticle cell interaction for biomedical applications. J Mater Chem. 15 (5), 543-547 (2005).
- Chithrani, B. D., et al. Elucidating the mechanism of cellular uptake and removal of protein coated gold nanoparticles of different sizes and shapes. Nano Lett. 7 (6), 1542-1550 (2007).
- Chithrani, B. D., et al. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells. Nano Lett. 6 (4), 662-668 (2006).
- Elechiguerra, J. L., et al. Interaction of silver nanoparticles with HIV 1. J Nanobiotechnol. 3 (6), 1-10 (2005).
- Carlson, C., et al. Unique cellular interaction of silver nanoparticles size dependent generation of reactive oxygen species. J Phys Chem. 112 (43), 13608-13619 (2008).
- Roth, G. A., et al. Hyperspectral microscopy as an analytical tool for nanomaterials. WIREs Nanomed Nanobiotechnol In Press. , (2015).
- Williams, P., et al. Maize kernel hardness classification by near infrared (NIR) hyperspectral imaging and multivariate data analysis. Anal Chim Act. 653 (2), 121-130 (2009).
- Ziph Schatzberg, L. Hyperspectral imaging enables industrial applications. Industrial Photonic. , (2014).
- Sun, D. W. . Hyperspectral imaging for food quality analysis and contro. , (2010).
- ElMasry, G., et al. Hyperspectral imaging for nondestructive determination of some quality attributes for strawberry. J Food En. 81 (1), 98-107 (2007).
- Mortimer, M., et al. Potential of hyperspectral imaging microscopy for semi quantitative analysis of nanoparticle uptake by protozoa. Environ Sci Techno. 48, 8760-8767 (2014).
- Sarlo, K., et al. Tissue distribution of 20 nm 100 nm and 1000 nm fluorescent polystyrene latex nanospheres following acute systemic or acute and repeat airway exposure in the rat. Toxico. 263, 117-126 (2009).
- Husain, M., et al. Pulmonary instillation of low doses of titanium dioxide nanoparticles in mice leads to particle retention and gene expression changes in the absence of inflammation. Toxicol Appl Pharmacol. 269, 250-262 (2013).
- Meyer, J. N., et al. Intracellular uptake and associated toxicity of silver nanoparticles in Caenorhabditis elegan. Aquatic Toxicol. 100, 140-150 (2010).
- Badireddy, A. R., et al. characterization and abundance of engineered nanoparticles in complex waters by hyperspectral imagery with enhanced darkfield microscopy. Environ Sci Technol. 46 (18), 10081-10088 (2012).
- Dettmeyer, R. F. . Staining techniques and microscopy Forensic histopathology fundamentals and perspectives. , 370 (2011).
- Titford, M. Progress in the development of microscopical techniques for diagnostic pathology. J Histotechnol. 32 (1), 9-19 (2009).
- Kumar, G. L. . Special stains and H&E. , (2014).
- Manolakis, D., et al. Hyperspectral image processing for automatic target detection applications. Lincoln Laboratory Journal. 14 (1), 79-116 (2003).
- Mercer, R. R., et al. Pulmonary fibrotic response to aspiration of multi walled carbon nanotubes. Part Fibre Toxicol. 8 (1), 21 (2011).
- Kim, M. S., et al. Hyperspectral reflectance and fluorescence imaging system for food quality and safety. T Am Soc Ag En. 44 (3), 721-730 (2001).
- Mercer, R. R., et al. Extrapulmonary transport of MWCNT following inhalation exposure. Part Fibre Toxico. 10 (1), 38 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved