Method Article
用中空糸バイオリアクター
要約
培養中の細胞の機能的な動作は、3次元培養環境16-21様インビボでより中で培養することによって改善することができます。この原稿は、in vivo様の哺乳動物組織培養のための中空繊維バイオリアクターシステムのセットアップと操作について説明しています。
要約
Tissue culture has been used for over 100 years to study cells and responses ex vivo. The convention of this technique is the growth of anchorage dependent cells on the 2-dimensional surface of tissue culture plastic. More recently, there is a growing body of data demonstrating more in vivo-like behaviors of cells grown in 3-dimensional culture systems. This manuscript describes in detail the set-up and operation of a hollow fiber bioreactor system for the in vivo-like culture of mammalian cells. The hollow fiber bioreactor system delivers media to the cells in a manner akin to the delivery of blood through the capillary networks in vivo. The system is designed to fit onto the shelf of a standard CO2 incubator and is simple enough to be set-up by any competent cell biologist with a good understanding of aseptic technique. The systems utility is demonstrated by culturing the hepatocarcinoma cell line HepG2/C3A for 7 days. Further to this and in line with other published reports on the functionality of cells grown in 3-dimensional culture systems the cells are shown to possess increased albumin production (an important hepatic function) when compared to standard 2-dimensional tissue culture.
概要
組織培養物は、100年以上1,2のために利用されている細胞の増殖および/ または維持のために確立された技術です。研究細胞および応答のex vivoでの利便性がはるかに、そうでなければ不可能ではないにしても非常に困難なことであろう実験を可能にする利点に到達している、例えば、遺伝子操作された細胞株の発生と高スループットスクリーニングアッセイ3におけるレポーター細胞の使用。より最近では、組織培養は、in vitroモデルを生成するための再生医療のために、組織工学の分野に上昇を与えています。これらのアプリケーションでは、動的な3次元(3D)培養系への関心が大幅に成長してきました。
(3D培養基質および/ または方向の動的流れの導入として定義)は、3D培養法は、より良好な達成のための重要な、 インビボ細胞環境のアーキテクチャを再現しますより生理様の機能。患部や損傷を受けた組織を修復する目的で、抽出成長、分化し、移植細胞能力は、患者の利益や商業機会のための巨大な可能性を秘めている研究分野です。火傷を治療するための自己ケラチノサイトの使用(4を参照)、脳卒中の治療のための細胞ベースの療法の使用は、例えば、(5を参照)。同様に、in vitroモデルの市場は成層医学アプリケーションに薬物の発見に及びます。組織培養における規則は、組織培養フラスコの2次元(2D)表面上に付着または足場依存性細胞型の成長です。現在、研究設定におけるゴールドスタンダードとして受け入れながら、組織工学アプリケーションの最近の関心は、現在の2D組織培養環境は、セル生産6で必要なスケールアップのために不十分であるという事実を強調しています。
接着細胞タイプscaffolのためDは、化学組成および機械的特性の両方の観点から、最終用途に応じて変わるであろう、必要とされます。一部のシステムでは、従来の2D培養技術から最小の適応を必要とする(8を参照)高内相エマルションテンプレート(7を参照)または電界紡糸繊維から形成された高多孔性マトリックスからなる足場が同様にプレートインサートを採用しています。細胞は、様々な組成のマイクロキャリア上に播種し、栄養素およびシグナル伝達分子を送達攪拌槽中で増殖させ、そしてダイナミックよく混合環境9を通じて廃棄物(質量輸送)を運び去ることができます。しかしながら、これらのシステムは、それらのインビボ様環境及び更なる改善が制限され、スケールアップの費用に関して行うことができます。中空繊維バイオリアクター(HFBs)は、典型的には繊維の内腔を通して送達多孔質繊維と媒体の外側に播種した細胞とモジュールに固定繊維から成る3D培養系である(1に概説0)( 図1)。 HFBsは、必要に応じて定義された剪断側ポートを介して流体の流れを介して細胞に適用させながら、毛細血管を模倣し、ダイナミックなメディア配信に関連したせん断応力から細胞をシールド繊維を用いたin vivo様の環境を提供します。これは、高い細胞密度が11に到達することができる優れた大量輸送で汎用性の高い培養系を作成します。 HFBシステムは、足場依存性細胞型のメンテナンスに最適で、文化にランゲルハンス12、マウスβ-TC-3インスリノーマ細胞ライン12、一次ヒト肝細胞13、人間の骨のラット膵島 を含む種々の細胞使用されています。骨髄単核細胞14、マディン・ダービーイヌ腎臓細胞(MDCK)15とのCaco-2細胞16は、いくつかの名前を付けます。
物質移動およびスケールアップのシステムの利点に加えて、細胞は、3D TIS中で増殖させ訴える培養系は、形態や実験の合図に対してより反応によりin vivoで様になる傾向があります。例えば、ラット初代肝細胞は、より多くの立方形形態、増加した生存性、チトクロームP450酵素活性のより大きな誘導を示すと2D文化17で増殖した細胞と比較して、市販のポリスチレン足場で増殖させた場合、パラセタモール毒性に対する感受性を増加させました。肝細胞癌細胞株HepG2はまた、アルブミンの生産18を増加させ、2D培養細胞19と比較して、メトトレキサートに応じ様in vivoでより多くを表示することが示されている同じ足場を使用します。初代ヒト肝細胞は、より高いチトクロームP450活性を遅延した脱分化を実証し、灌流培養システム20において試験した4/5の化合物のためのクリアランスを増加させました。市販のポリスチレン足場で培養したニューロンおよびグリア由来のヒト神経幹細胞は、高い(活動電位)と低freque両方を呈しNCY(ローカルフィールド電位)なしニューロンの活動に対し、自発的な活動は、2D培養細胞21で検出されました。 Caco-2細胞が増加し、アルカリホスファターゼ、γグルタミルトランスフェラーゼ及びP糖タンパク質の活性およびF-アクチンと透明帯のより高い発現occludens-1タンパク質16によって測定された2D文化に比べHFBで強化された分化を示しました。利点にもかかわらず、3D細胞培養を引用刊行数は過去10年間で(8倍の増加を成長しているが、2D組織培養フラスコの表面以外のシステムにおける細胞のルーチン培養はまだ、多くの研究室で実施されていない。ソース:「3D文化」)でプローブしたツールPubMedの「年度別結果」。
この原稿は、哺乳動物細胞培養用のHFBシステムの設定および動作条件を説明し、肝細胞癌細胞株HepG2 / C3Aを培養することで、その有用性を示します。この方法の目的は、培養物に細胞であります十分なシンプルさを保持し、よりin vivoでの様培養システムは、3D培養系に慣れていない人にはそれが受け入れられるようにします。アプリケーションにHFBsを使用して論理的根拠の肝臓モデルの予測可能性を改善することである、ここで記述は、HFB環境22内の肝臓シヌソイドを模倣することは理論的に可能であることです。これは、現在、他の培養系では不可能です。
プロトコル
1.繊維
- 位相反転スピンキャスト(スピニング)によって繊維を製造しています。この方法の詳細は23,24で見つけることができます。
注:この作業のために、繊維は、非生分解性独自のポリマーを使用して、社内で製造され、NMP溶媒および非溶媒としてH 2 Oとして。他の適切なポリマーの詳細は議論中に見出すことができます。ここに記載されているシステムで使用される繊維は、600から700ミクロンのルーメン径1.05ミリメートル外径です。繊維は、2.28ミクロン±1.5ミクロン(平均±標準偏差)を測定する細孔径を有する多孔質です。これは、他の組織の肝臓シヌソイドまたは脈管構造を複製する、繊維内腔におけるメディアフィードから細胞を分離するように設計されています。繊維はまた、ポールのような膜の供給業者から購入することができます。
2.モジュールの試作
注:この研究で使用されるモジュールは、2つのサイドポートを厚さ1mmのホウケイ酸ガラスから作られています( 図2A)。ここで説明するモジュール内の繊維は、6ウェルプレートのウェルの約半分に相当し4.95 cm 2の外表面積を有します。
- シグマコート( 表1)で内面を被覆し、ドラフト内で乾燥させることによって、最初の使用前にシリコーンを塗るモジュール。オートクレーブ(121℃、1気圧、20分)処理の寿命を増加させます。
- メスを使用すると、75ミリメートル、長繊維をカットし、各端( 図3A)で〜7ミリメートル余分な長さを残して、各モジュールに3繊維を挿入します。
- 場所〜秤量ボートにシリコーン接着剤( 表1)0.5 mlです。繊維3-5ミリのプラグ( 図3B)を形成するために周りのシリコーンの少量をピックアップし、モジュールの両端に接着剤を仕事にP200のピペットチップを使用してください。 > 3時間乾燥することができます。
- メスを使用して、ガラスモジュールを終了する( 図3C)を有するシリコーンフラッシュを切りました。
- ラップポリテトラフルオロエチレン(PTFE)の少量(〜4層)1側ポート周りのテープ。
3.システムの設定と滅菌
注:繊維とポンプチューブとモジュールはオートクレーブされず、70%エタノールを用いて滅菌されます。著者らは、ポンプとポンプチューブを使用するキャリブレーションをお勧めします。以下の手順は、層流フード中で実施されます。
- (セクション2.1など)をオートクレーブアップを設定する前に、すべてオートクレーブ可能コンポーネント。
- セットアップ
- 、Qシリーズのキャップ、フィードチューブ、ポンプとポンプチューブ( 表1)、 図4のように 、リザーバボトルとセットアップリザーバーボトルに10ミリリットルの70%エタノールを置きます。
- ゆるくPTFE-テーピング側ポートを介してエンドキャップを配置します。モジュールが終了し、自由側ポートを介してL / S16モジュールコネクタの両端をスライドさせます。 図2Bのようにキャップされたサイドポート最寄りのモジュールコネクタへのL / S13チューブ( 表1)の40ミリメートルのセクションを接続します栄。
- キャップされたサイドポートは、ポンプの最も近くにあるように、モジュールを配向するために確保し、ポンプチューブにモジュールを接続します。
- モジュールコネクタとL /リザーバーボトルにYコネクタのS14( 表1)に透過液ラインと保持液ラインを接続します。セットアップは、図4に回路図に似ていることを確認してください。
- 殺菌
- (; 25を参照して 、他の滅菌方法が使用される場合、時間を調整)> 30分間unautoclaved成分を治療するのに十分な時間、800μL/時間(繊維あたり267マイクロリットル/時間)でモジュールを介してエタノールをポンプ。
- ウォッシュ
- システムからエタノールを洗浄するために、最初にポンプをオフにして、チューブをドレイン。まず、モジュールアダプタチューブからポンプチューブを外します。バックリザーバーボトルに、繊維および保持液ラインの外にエタノールを排出する空中モジュールを持ちます。目を排出するモジュールからのサイドポートのエンドキャップを取り外しモジュール自体、および透過液ラインから電子エタノール。サイドポートエンドキャップを取り付けます。ポンプチューブとエタノールの供給ラインを排出するポンプのメディアの流れを逆にします。ポンプの電源を切り、モジュールアダプタにポンプチューブを再接続します。
- 蓋からエタノールボトルを外し、血清を含まない(例えばEMEM、GMEM、DMEMまたはRPMIなど)の細胞増殖培地10mlの入ったボトルと交換してください。保持液ラインは、メディアの一杯になるまで800μlの/ hrでシステムを介してメディアをポンプ。モジュールを洗浄するためにファイバを介してメディアの浸透を強制的に保持液ラインをクランプします。 〜2時間洗浄します。
4.種まき
注:このプロトコルで使用されるメディアやサプリメントは、所望の細胞型のために確立されたものでなければなりません。詳細については文献、欧州細胞培養コレクション(ECACC)とアメリカン・タイプ・カルチャー・コレクション(ATCC)を参照してください。これより前の方法に細胞がmaintaでなければなりませんINED所望の細胞型のために確立されたプロトコルに従いました。この作業のために肝細胞癌細胞株HepG2 / C3Aのサブクローンは、代理店の推奨(ATCC)に従って維持しました。
注:また、以下に示す播種プロトコルは、細胞増殖の前に細胞培養培地でモジュールを培養を事前に役立ちます。より広範な前培養が必要とされるべきで、これは、システムから洗浄媒体を排出する増殖培地と交換し、数時間のためのモジュールを介してこれを透過することによって、モジュールを播種する前に行われるべきです。システム内のメディアの交換の詳細については、セクション7.5.2.1を参照してください。
- 所望の細胞型のために確立されたプロトコールに従ってトリプシン処理により単一細胞懸濁液を準備します。次のようにT75培養のための一般的なプロトコルは、次のとおりです。
注:播種工程で使用する細胞の数は経験的にあなたの所望の細胞型のために決定されるべきです。ここで説明するバイオリアクターは、35倍高いセルで接種します7日間の培養のための2D組織培養プラスチックに使用されるよりも、LS密度(セル/ cm 2で)。- その後、(細胞をカバーするのに十分な3)3 mlの0.05%トリプシンエチレンジアミン四酢酸(EDTA)を添加し、37℃、5分間、5%CO 2でインキュベートし、吸引10mlのリン酸緩衝生理食塩水(PBS)を添加することによって細胞を洗浄します。
- 7 mlの増殖培地中で収穫細胞は、トリプシンを中和するために10%ウシ胎児血清(FBS)を補充しました。よく混合し、血球計数器のチャンバーに10μlを添加し、細胞をカウントします。
- 細胞をペレットに5分間200×gで遠心分離します。
- 所望の細胞型のために、必要に応じて補充した増殖培地中に4×10 6 / mlで上清と再懸濁細胞を吸引します。
- ポンプの電源をオフにして、3.4.1のように供給チューブとモジュールをドレイン。
- フリー片側ポートを残して、モジュールのコネクタからモジュールを切り離し、70%エタノール中で予め滅菌モジュールのエンドキャップ( 表1)を取り付けます。
- 繊維を損傷する気泡の形成を避けるように注意しながらではなく、18 G針と1ミリリットル注射器を使用して、モジュールへの細胞懸濁液(2×10 6細胞)(4.1.4)の〜500μlのを転送します。
- エンドキャップを使用してサイドポートキャップ。 180°毎に5分によってモジュールの手動ターニングで2-4時間、37℃、5%CO 2で細胞をインキュベートします。あるいはモジュールは、断続的に混合設定( 表1)を用いて、チューブ回転装置に取り付けることができます。
- 播種後、70%エタノールで予め滅菌注入口( 表1)上にエンドキャップを取り付け、PTFE-テーピング側ポートにこれを取り付けます。他側ポートエンドキャップを外し、ゆっくりと27 G針と1ミリリットル注射器を用いて取り付け注入口に空気を注入することにより、細胞を排出します。
- エンドキャップに注入口を交換してください。ゆっくりと自由側ポートと1ミリリットルのシリンジで18 G針を使用してメディアを持つモジュールを埋めます。レモモジュールのエンドキャップをVEのモジュールコネクタを使用してチューブにモジュールを取り付けます。
- 7.5.2.1で詳述した手順以下の50ミリリットルの増殖培地とサプリメントを含有するもので洗浄培地ボトルを交換してください。 800μlの/ hrでシステムを介して増殖培地をポンプ。
5.増殖
注:ここで説明する研究システムで使用される繊維は、800μL/時間の供給速度で、80μL/時〜に浸透するように設定されています。
- 37℃、5%CO 2に設定し、加湿インキュベーター内で7日までの期間のための細胞を成長させるために、繊維を使用してください。
注:増殖期の栄養素および代謝産物のモニタリングは、増殖に有用な情報、培地中の細胞および栄養および代謝物レベルの代謝取り込みと出力を提供することができます。たとえば、使用状況や乳酸産生をグルコース。キットは、メディアからこれらの要因を定量することができ、様々な供給業者から入手可能である(参照本研究で使用したものについては、表1)。注入ポートは、透過液と保持液チューブ27 G針とシリンジを介してサンプリングされた培地に添加することができ、メディアは、メディアリザーバボトルからサンプリングすることができます。これは、入力と、両方の出力ストリームのための栄養と代謝の情報を提供します。サンプリングは、層流フード内で行われるべきです。 > 30秒のポートに対するエタノールに浸しブルーロールを保持することによって、サンプリングの前に注入口を滅菌します。
6.切除
注:繊維は、分析のために、実験の終了時にモジュールから切除することができます。
- HFBを抜いて、ドレイン。
- ガラスとシリコーンとの間のメス/マイクロナイフ( 表1)のブレードを挿入します。ガラスからシリコンを離れて切断するようにモジュールをオンにします。モジュールの両端に、この手順を繰り返します。
- 一方の端部からシリコーンプラグ外刃のフックを使用し、慎重に引き抜いてください。繊維は、それが付属していることを確認してください。
- 細胞数
注:成長率は、実質的にこの期間中に達成された細胞密度にわたって変化しないように、この研究で使用C3A細胞の7日間の成長期間中の任意の時点で、この計算に使用するのに適しています。- 切除(第6節)した後洗浄し、0.5ミリリットルのトリスEDTA(TE)緩衝液を含む1.5mlチューブにそれらをカットするためにPBSに繊維を浸し。 -80℃の冷凍庫で2回の凍結融解サイクルの対象とこれを。ピコグリーンを使用してDNA含量を測定し、所望の細胞型26で作られた標準曲線とこの値を比較することにより、細胞数を決定します。
- 細胞増殖率
- 2つの異なる時点で計算する計算された細胞数を用いて比増殖速度μ(式1)のLn(X1)は、最初の時点とのLn(X2)での細胞数の自然対数であり、細胞の自然対数であります第二の時点での番号。
μ=(LN(X2)-Ln(X1))/時間(時間)(1)
このことからμは比増殖速度である集団倍加時間(DT)(式2)を計算します。
dT = LN2 /μ(2)
- 2つの異なる時点で計算する計算された細胞数を用いて比増殖速度μ(式1)のLn(X1)は、最初の時点とのLn(X2)での細胞数の自然対数であり、細胞の自然対数であります第二の時点での番号。
- 細胞の生存
- 切除(第6節)した後洗浄し、500μlの0.05%トリプシンエチレンジアミン四酢酸(EDTA)を含む1.5 mlチューブにそれらをカットするためにPBSに繊維を浸し。 37℃で10分間インキュベートします。
- 混合し、10μlのトリパンブルーに10μlの細胞懸濁液を追加します。負荷10μlの血球計数器へと死んで(青)と生きた細胞の数を数えます。
- イメージング
- 切除した後に洗浄し、24ウェルプレートに小さい長さにそれらをカットするはさみを使用するようにPBSに繊維を浸し。 (PBS中)400μlの4%パラホルムアルデヒドを添加し、室温で20分間インキュベートします。
- オンとオフを400μlをピペットでPBSで洗浄します。繰り返しティ新鮮なPBSでのステップ。
- 約にPBSで希釈した400μlの4 '、6-ジアミジノ-2-フェニルインドール(DAPI)を加えます。 100ng / mlの、20分間室温でインキュベートします。光から保護します。
- H 2 Oで二回(7.3.2など)およびPBSで一回洗浄乾燥試料の前にデータを収集するために、直ちに繊維や画像をカバーするために、蛍光マウンティング培地を追加します(DAPIの元/全角; 461分の359 nm)を。
- 異なる焦点面で画像を撮影し、「焦点合成」ソフトウェアを使用する( 例えば 、下記のImageJのスタックフォーカサープラグインは、)フィールドの大幅に拡大深さを示す合成画像を作るために。繊維は平らではないので、これが必要です。
- ImageJの(http://imageJ.nih.gov/ij/)と「スタック接眼」プラグイン(http://rsb.info.nih.gov/ij/plugins/stack-focuser.html)をダウンロードします。
- ImageJのに積層する画像を開きます。 「スタックにイメージ ' - 次に「イメージ」メニューで「スタック」にアクセスしてください。 「プラグイン」メニューで「スタックフォーカサーに行きます'。 n×nのカーネル用のnを指定します。 「N」と試行錯誤が少ない「ノイズ」を有する画像を生成するために必要とされ得ます。 11&77の間の値はうまく機能する傾向があります。
- アルブミン分泌
注:これは、肝細胞機能のテストではなく、細胞機能の一般的な試験です。- 種細胞(HepG2細胞/ C3A)10667 / cm 2での2D組織培養プラスチック上に6日間増殖させました。第4章で説明し、6日間生育としてシードのHFBs。
- この増殖期間の後、1×グルタミン、および24時間の1xペニシリン/ストレプトマイシンを補充した無血清ウィリアムズE培地に組織培養プラスチックとHFBのための培養培地(EMEM + 10%FBS、1×グルタミン&1×ペニシリン/ストレプトマイシン)を変更します。
- 3.4.1に記載された手順に従って、チューブとHFBモジュールを排出します。リザーバーボトルを外し、ウィリアムズE培地を含むボトルに置き換えてください。 8でHFBを介してこれをポンプ00μL/ hrでした。
- 24時間後、培地サンプルを取ります。製造者の指示( 表1)に記載のELISAによって分泌アルブミンを定量します。標準曲線の範囲内のアルブミン濃度をもたらすために、使用前に10〜40における1のメディアサンプル1を希釈します。
7.細胞解析
結果
細胞播種は重要なステップです。 3Dセットアップ中の繊維に付着する細胞の能力は、2D組織培養プラスチックに見られるよりもかなり小さいです。これは、セルと基板との間の減少した接触時間に可能性が高いです。 HFBにおいて、細胞は、播種の静的フェーズでモジュールを介して落下します。これらは、2Dで使用される一つの連続静的位相に比べて時間がかなり短くなっています。細胞は、この時点での基板への接続を行う必要があります。また、起因繊維の湾曲した性質のために、細胞を休まおよび2D培養で存在するような接続を行うためには平らな面がありません。これは、繊維の化学的性質によって配合することができる一方で、我々は、これが本研究で使用されるポリマーの場合であることを知らない使用(データは示さず)。播種時と細胞播種密度を増加させると、高速rにおける静的フェーズモジュールを介して落下する細胞凝集体の形成をもたらします単一細胞よりも食べ、さらに細胞と基板との間の接触時間を減少させます。細胞の高密度のこの工程の間にないメディアの交換があるような時間を増加させると、メディアの黄変をもたらします。 15%〜の第4節細胞播種率に記載の条件を使用することは一貫したHepG2 / C3A細胞( 図5A)で達成されます。これは低い画分と見なすことができる一方日( 図5B及び6)の問題でよく人口繊維を生成するために十分な細胞が存在します。 7日間の増殖期間後HFBに達する細胞密度が3×10 5 / cmで2に近づいています。これは、肝細胞を利用する多くのアッセイのために適切な密度で、コンフルエンスに到達されると考えることができます。
2D細胞培養( 図5C)で達成されたものと比較した場合、HFBで達成増殖速度が遅くなります。これはアンですこの:メディア内の細胞数は、(コンフルエンスで24時間あたり3674細胞±20343細胞、全細胞の4%であるSEM±平均)低いとして起因するシステムの動的な流れの中の細胞の損失になる可能性が高いです透過率は、400μL/時間にまでになっているときに増加しない(データは示さず)。 (下の図5Dとを参照)も、生存率および細胞のその後の損失が減少するためになることはほとんどありません。これは、事実、この細胞株はクローンHepG2細胞に由来し、細胞増殖の接触阻止を表示する能力で選択された、少なくとも部分的に、説明することができます。 HFB中の細胞を6倍に遅い増殖速度につながる可能性が2D細胞の密度を播種します。
生存率は> 90%を示す細胞とHFBを通して高いままです。入口に比べて出口端での生存率のわずかな減少がある一方で、これは有意(t検定Pであることが見出されていませんでした = 0.22)。
グルコース消費のモニタリング及び乳酸生産は、システム内のメディアの送り速度とメディアの音量調整するために使用されてきました。 800μL/時間とグルコースと乳酸レベルは、以下の(それぞれ)以上に維持され、50mlの総培地容積標準的な組織培養プラスチック培養で見られたものを使用。
アルブミン分泌は肝細胞によって行わキー肝機能です。それは輸送およびホメオスタシスにおいていくつかの役割を果たしている、血清中に分泌されます。 HFBで増殖させた細胞によるアルブミンの分泌は、2D( 図7)上で増殖させた細胞に比べて15倍高いです。これは、細胞がHFBに機能的であり、少なくともアルブミンの分泌の場合、この関数はHFBで上昇を示しています。
JPG "/>
図1 HFBの in vivo 様の環境。細胞は、多孔質繊維の外側に播種されています。メディアが毛細血管を模倣し、繊維の内腔を介して配信されます。 (A)繊維の縦断面図(正確な縮尺ではありません)。 (B)3ファイバー反応器のクロスセクション。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2 HFBモジュール。(A)本研究で使用されるモジュールの寸法。寸法は3繊維にフィットし、現在の研究プロジェクトのニーズを満たすように選択しました。異なるサイズを製造し、個々のシステムおよび繊維のために調整することができます。 (B)Mの写真接続されたエンドキャップとモジュールコネクタの付いたodule。 この図の拡大版をご覧になるにはこちらをクリックしてください。
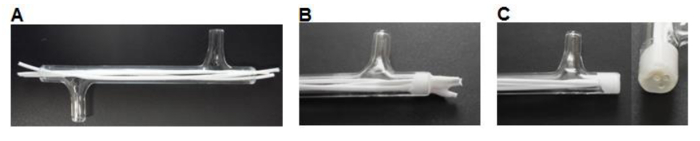
図3モジュールの製造。(A)繊維のサイズに切断し、モジュールに挿入されます。 (B)繊維を乾燥させたモジュールに接着されます。 (C)の端部がガラスと同一平面にカットされている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
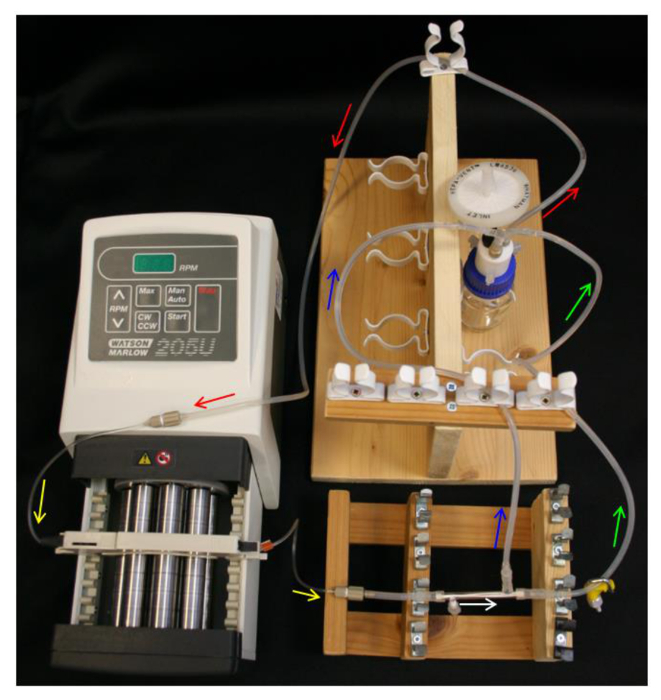
図4 HFBシステムセットアップ。矢印は、メディアフローの方向を示しています。赤=供給管。黄=ポンプTUです。白= HFBモジュール。グリーン=クランプで保持液チューブ。青=チューブを浸透。 この図の拡大版をご覧になるにはこちらをクリックしてください。
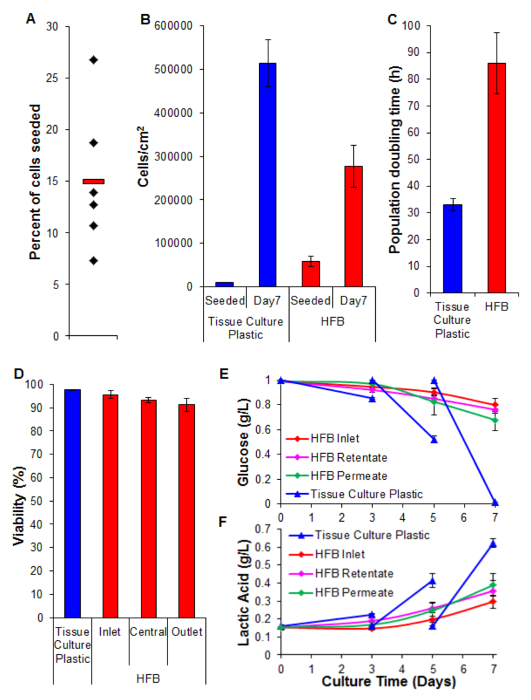
図5.播種、増殖、生存率および生化学的解析。播種した細胞の(A)の割合。ブラックダイヤモンドは、個々のHFBsを表します。赤いバーは平均値です。 (B)細胞が播種時と7日間の増殖期間後密度。 2D細胞数は、血球計数器を用いてトリプシン処理し、計数することによって決定しました。 HFB細胞数は、ピコグリーンアッセイおよびC3A細胞26から生成した標準曲線を用いて決定しました。 N = 5-6。バー= SEM。 (C)回の集団倍加。 N = 5-7。バー= SEM。トリップによって決定(D)生存率7日間の増殖の終わりにブルー排除。入口は、中央および出口はHFB内の領域を表します。 N = 3-5。バー= SEM。 (E&F)グルコース消費と乳酸生産。レベルは、リザーバボトル(入口)と同様に濃縮液でモニターし、コンセントに浸透し、組織培養プラスチック上のルーチン培養にcomperedた(メディアが3日目&5に変更しました)。 N = 3-5。バー= SEM。 この図の拡大版をご覧になるにはこちらをクリックしてください。
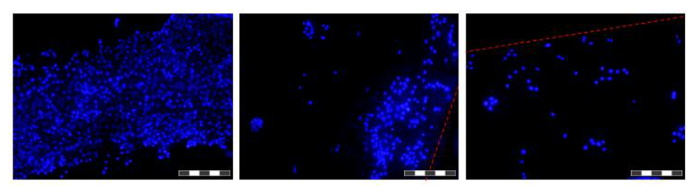
図6 HFBに繊維上で増殖した細胞の写真。細胞をPBS及びDAPIで染色された核中で洗浄し、4%パラホルムアルデヒドで固定し、PBS中で洗浄し、播種し、繊維が切除される前に48時間増殖させました。各画像は12 '焦点積み重ね」、IMAの複合体であります結果として得られる画像の被写界深度を増加させるためにGES。より高いおよびより低い細胞密度の領域は、この時点でファイバに沿って見られると示されています。存在する場合、繊維境界は赤の点線で示されています。画像は、倒立蛍光顕微鏡で撮影しました。画像= 10X対物レンズ。バー=200μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
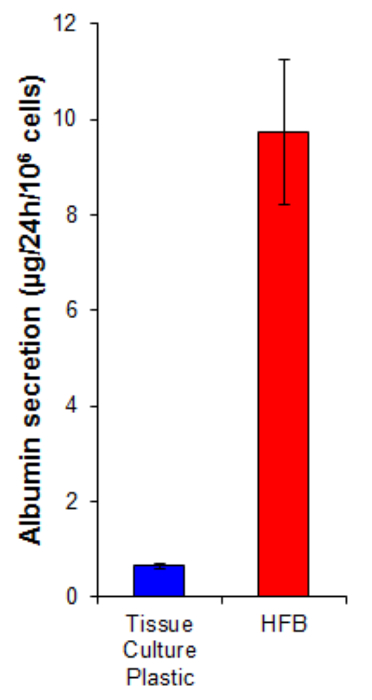
4.細胞を6日間増殖させたセクションで説明したように、図7アルブミン分泌。細胞を、10667 / cm 2に及びHFBで組織培養プラスチック上に播種しました。この増殖期間の後、組織培養プラスチックとHFB培地は、グルタミンおよびペニシリン/ streptomyciを補充した無血清ウィリアムスE培地に変更しました。24時間のn。培地試料を採取し、アルブミンは、命令( 表1)の製造に従ってELISAによって定量しました。 N = 5-6。バー= SEM。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| セクション | 機器の名前 | 会社 | ネコ。いいえ。 | ノート | 画像 |
| 2 | グラスHFBモジュール | Soham科学 | --- | カスタム項目。 | |
| 2.1 | Sigmacote® | シグマアルドリッチ | SL2 | ||
| 2.3 | Silicoset 151 | Intertronics | ACCSS151 | ケイ1接着剤。 | |
| 2.5 | PTFEテープ | シグマアルドリッチ | Z104388 | ||
| 3.2.1 | 貯水池ボトル | フィッシャー | 11972619 | ||
| Qシリーズキャップ | キネシス | 00932Q-3V | PTFEアダプタおよび継手ナットのねじ山。 Qシリーズのキャップに取り付けます。 1ミリメートルアダプタと3ミリメートルアダプタ下で4センチセクションの下に供給されたPTFEチューブ8.5センチセクションを取り付けます。 |  | |
| アダプタ、男性、1.0ミリメートルのID | キネシス | 008NB10-KD5L | |||
| アダプタ、男性、3.0ミリメートルのID | キネシス | 008NB30-KD5L | |||
| フィッティングナット | キネシス | U-350 | |||
| ネオプレンチューブ | フィッシャー | 10366344 | ネオプレンチューブ6 cmのHEPAフィルターを取り付け、「継手ナット」にこれを取り付けます。 Yコネクタの上の2つのバーブと下部にL / S16チューブ3cmの部分にL / S14チューブの2倍の30ミリメートルのセクションを取り付けます。 3ミリメートルのIDアダプタのバーブにこれを取り付けます。 (3.2.1項) |  | |
| HEPA-ベント | フィッシャー | 11374634 | |||
| Yコネクタ、とげ | コールパーマー | OU-06295から10 | |||
| L / S16シリコンチューブ | コールパーマー | OU-96410から16 | |||
| L / S14シリコンチューブ | コールパーマー | WZ-96410から14 | |||
| L / S13シリコンチューブ | コールパーマー | OU-96410から13 | ポンプ槽にQシリーズのキャップに1.0ミリメートルとげアダプタを接続するための80センチメートルる=フィードチューブ。 | ||
| WM 205U / CAポンプ | フィッシャー | 1248-6300 | |||
| WMポンプチューブ、PVC、青、オレンジ、0.25ミリメートルの穴 | フィッシャー | 12416310 | PTFEオスアダプターのねじ山とメスアダプターを接続します。とげのうちの1つを介してポンプチューブを働きます。チューブのもう一方の端にこのセットアップを繰り返します。 (3.2.1項) |  | |
| アダプタ、男性、1.0ミリメートルのID | キネシス | 008NB10-KD5L | |||
| アダプタ、女性、1.0ミリメートルのID | キネシス | 008NB10-KD2L | |||
| 3.2.2 | 雌型ルアーキャップ | コールパーマー | WZ-45508から64 | サイドポートエンドキャップ。 | blefig4.jpg "/>  |
| L / S13シリコンチューブ | コールパーマー | OU-96410から13 | モジュールコネクタにポンプチューブを接続するための40ミリメートルのセクション。 | ||
| L / S16シリコンチューブ | コールパーマー | OU-96410から16 | 3×Lの30ミリメートル/ S16は、減速=モジュールのコネクタを3倍に取り付けられました。 (3.2.2項) | ||
| とげの減速1/8 "×1/16" | コールパーマー | 30616から43 | |||
| 3.2.4 | L / S13シリコンチューブ | コールパーマー | OU-96410から13 | QシリーズのキャップにL Yコネクタの/ S14に保持物を接続するための55センチメートルセクション。 |  |
| L / S13シリコンチューブ | コールパーマー | OU-96410-13 | QシリーズのキャップにL Yコネクタの/ S14に透過物を接続するための45センチメートルセクション。 | ||
| ストレートとげ組合 | コールパーマー | WZ-30612から43 | YコネクタのL / S14に接続しますL / S13の最後に接続します。 | ||
| 3.4.2 | クランプ | VWR | 229-0609 | ||
| 4.3 | 4ミリメートルのシリコンチューブ | フィッシャー | FB68858 | チューブの40ミリメートルの部分を2つ折りにし、ケーブルタイ=モジュールのエンドキャップで固定します。 (4.3節) |  |
| ケーブルタイ | フィッシャー | 12326377 | |||
| 4.4 | MACSmixチューブローテーター | ミルテニーバイオテク | 130-090-753 | 適応は、ATTACに必要になることがあります時間モジュール。 | |
| 4.5 | ルアー注入ポート | シスル科学 | IB-10820 | 注入口にエンドキャップを取り付けます。 (4.5節) | |
| 雌型ルアーキャップ | コールパーマー | WZ-45508から64 | |||
| 5 | L-乳酸キット | メガザイム | K-LATE | ||
| 5 | D-グルコースキット | メガザイム | K-GLUC | ||
| 6.2 | メス/マイクロナイフ | InterFocus | 10315から12 | ||
| 7.4.3 | アルブミンELISA | BETHYLラボ | E80-129 |
表HFBセットアップの1コンポーネント。 各コンポーネントに関連するテキストセクションは、カラム1に示されています。
ディスカッション
この原稿は、哺乳動物細胞培養用の中空糸バイオリアクター(HFB)システムのセットアップと操作を説明し、その有用性は、肝細胞株HepG2 / C3A増殖で実証されています。システムは、標準のインキュベータの棚の上にフィットするように設計されており、そのセットアップは、無菌技術に精通している任意の有能な細胞生物学者によって行われるのに十分シンプルです。
ここで説明する研究システムで使用される繊維は、非生分解性独自のポリマーを使用して(回転)を鋳造位相反転スピンにより家で製造されます。例えば、細胞培養に適した、両方の生分解性および非生分解性材料の様々な紡糸によって繊維を作ることが可能です。ポリカプロラクトン(PCL)27、ポリ-L-ラクチド酸(PLLA)28、ポリ(乳酸-コ-グリコール酸)(PLGA)29、ポリスルホン(PSU)12およびポリエーテルエーテルケトン(PEEK)13。それぞれが異なる特性がありNDシステムのニーズに基づいて選択されるべきです。滅菌工程で使用されるエタノールを用い繊維の互換性を確認してください。 PLGAは、抗生物質/抗真菌剤溶液中25などの代替治療を必要とエタノールで可塑化することが知られています。
ここで使用されるガラスモジュールの寸法は、現在の研究の必要性に基づいて選択しました。異なるサイズは、任意の評判の良いガラス発泡会社によって製造することができます。モジュールサイズの考慮は、モジュール内の繊維、おそらく流量の数にリンクされているセルの数です。多くの細胞は、より高い流量がバイオリアクターの流出端に好ましい培養条件を維持するためにあることが必要となるモジュールです。これは、いくつかの点と限界に到達すると、いくつかの試行錯誤は、モジュール透過メディア状態を監視して必要とされ得ます。数学的モデリングは、必要なモジュールDIMENにいくつかの洞察を提供することができますsions及び流量22。
ここで使用される装置の寸法は、インキュベータの棚の上にフィットするように設計されています。チューブの長さも、セットアップと操作を可能にするためにコンポーネントの十分な移動を可能にしながら、コネクタ間に達するのに必要な長さによって決定されます。経時サンプリングモジュールの透過液中の培地条件のモニタリング、例えば、必要とされる場合、注入ポートを保持液に添加し、これを容易にするために線を透過することができます。
任意の細胞培養系のための前提条件は、生きている細胞を維持することであり、ほとんどの場合、成長します。三次元培養系で増殖させた細胞において表現型様インビボでよりを実証研究に照らして、また、密接に細胞が遭遇するインビボ環境を模倣する環境を提供するために重要と思われます。この最後の点は、多くの場合、この培養システムが提供する利便性を優先して2次元細胞培養では無視されます。 T彼は、繊維の内腔を通って細胞に栄養を供給することにより、in vivo毛細血管網における模倣をHFB。廃棄物は、また、動的流れによってシステムから除去されます。これは、細胞培養と密接にこれらの細胞を培養するための2D組織培養プラスチックに比べて、このシステムより良い選択をする、肝細胞で見られる生体内環境を模倣するもののためのインビボ様のシステムを作成します。これは、細胞が、2D組織培養プラスチック上で増殖させたものに比べHFB培養系において、アルブミンの15倍量の、重要な肝機能を分泌するという事実によって裏付けられます。
HFBシステムは、ほとんどのに適していない場合は、すべての足場依存性細胞型であるが、機能を培養することができるようにするため、実際の必要性があるため、ここでの例では、肝細胞のための製薬業界による薬剤開発で使用するための、よりin vivoの様肝細胞であります体外サポートのためのバイオ人工肝臓デバイスで肝不全患者の。複数の機能セルの必要性は、再生医療の分野は、翻訳作業の段階に入り、特にように、これらの実施例を越えて延びています。より多くのインビボ様培養環境の利点を見落としてはなりません。
開示事項
MJE is a founder and director of Cellesce Ltd which aims to provide bioprocessing solutions for tissue engineering-based research and industry.
謝辞
This work was funded by the National Centre for the Replacement, Refinement and Reduction of Animals in Research (NC3Rs) CRACK IT funding.
資料
| Name | Company | Catalog Number | Comments |
| Glass HFB Module | Soham Scientific | --- | Custom Item. (Section 2) |
| Sigmacote | Sigma-Aldrich | SL2 | (Section 2.1) |
| Silicoset 151 | Intertronics | ACCSS151 | Silicone Glue. (Section 2.3) |
| PTFE tape | Sigma-Aldrich | Z104388 | (Section 2.5) |
| Reservoir bottle | Fisher | 11972619 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Q-series cap | Kinesis | 00932Q-3V | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 3.0 mm ID | Kinesis | 008NB30-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Fitting Nut | Kinesis | U-350 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Neoprene tubing | Fisher | 10366344 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| HEPA-vent | Fisher | 11374634 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| Y-connector, barbed | Cole Parmer | OU-06295-10 | Attach the Hepa filter to 6 cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S14 Silicone tubing | Cole Parmer | WZ-96410-14 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 80 cm to connect the 1.0 mm barbed adapter on the Q-series cap to the pump tubing = Feed tube. (Section 3.2.1) |
| WM 205U/CA pump | Fisher | 1248-6300 | (Section 3.2.1) |
| WM pump tubing, PVC, blue-orange, 0.25 mm bore | Fisher | 12416310 | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw thread of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Female, 1.0 mm ID | Kinesis | 008NB10-KD2L | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Side port end caps. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 40 mm section to connect the pump tubing to a module connector. (Section 3.2.2) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| Barbed reducer 1/8"x1/16" | Cole Parmer | 30616-43 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 55 cm section to connect the retentate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 45 cm section to connect the permeate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| Straight barbed union | Cole Parmer | WZ-30612-43 | Attach to the end of the L/S13 that will connect with the L/S14 of the Y-connector. (Section 3.2.4) |
| Clamp | VWR | 229-0609 | (Section 3.4.2) |
| 4 mm Silicone tubing | Fisher | FB68858 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| Cable tie | Fisher | 12326377 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| MACSmix tube rotator | Miltenyi Biotech | 130-090-753 | An adaptation may be required to attach the modules. (Section 4.4) |
| Leur Injection port | Thistle Scientific | IB-10820 | Attach the end cap to the injection port. (Section 4.5) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Attach the end cap to the injection port. (Section 4.5) |
| L-lactic acid kit | Megazyme | K-LATE | (Section 5) |
| D-glucose kit | Megazyme | K-GLUC | (Section 5) |
| Scalpel / micro knife | InterFocus | 10315-12 | (Section 6.2) |
| Albumin ELISA | Bethyl Labs | E80-129 | (Section 7.4.3) |
参考文献
- Lewis, W. H. Experimental evidence in support of the theory of outgrowth of the axis cylinder. American J Anat. 6 (1), 461-471 (1906).
- Harrison, R. G. The development of peripheral nerve fibers in altered surroundings. Wilhelm Roux Arch Entwickl Mech Org. 30 (2), 15-33 (1910).
- Ding, L., et al. A genome-scale RNAi screen for Oct4 modulators defines a role of the Paf1 complex for Embryonic Stem Cell identity. Cell Stem Cell. 4 (5), 403-415 (2009).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering -In vivo and in vitro applications. Adv Drug Deliv Rev. 63 (4), 352-366 (2011).
- Sinden, J. D., Vishnubhatla, I., Muir, K. W. Prospects for stem cell-derived therapy in stroke. Prog Brain Res. 201, 119-167 (2012).
- Ouyang, A., Yang, S. -. T. A two-stage perfusion fibrous bed bioreactor system for mass production of embryonic stem cells. Expert Opin Biol Ther. 8 (7), 895-909 (2008).
- Carnachan, R. J., Bokhari, M., Przyborski, S. A., Cameron, N. R. Taloring the morphology of emulsion-templated porous polymers. Soft Matter. 2 (7), 608-616 (2006).
- Deshpande, P., et al. Simplifying corneal surface regeneration using a biodegradable synthetic membrane and limbal tissue explants. Biomaterials. 34 (21), 5088-5106 (2013).
- Storm, M. P., Orchard, C. B., Bone, H. K., Chaudhuri, J. B., Welham, M. J. Three-dimensional culture systems for the expansion of pluripotent embryonic stem cells. Biotechnol Bioeng. 107 (4), 683-695 (2010).
- Wung, N., Acott, S. M., Tosh, D., Ellis, M. J. Hollow fibre membrane bioreactors for tissue engineering applications. Biotechnol Lett. 36 (12), 2357-2366 (2014).
- Ellis, M., Jarman-Smith, M., Chaudhuri, J. B., Chaudhuri, J., Al-Rubeai, Bioreactor systems for tissue engineering: A four-dimensional challenge. Bioreactors for tissue engineering; principles, design and operation. , 1-18 (2005).
- Silva, A. I., Mateus, M. Development of a polysulfone hollow fibre vascular bio-artificial pancreas device for in vitro studies. J Biotechnol. 139 (3), 236-249 (2009).
- De Bartolo, L., et al. Human hepatocyte functions in a crossed hollow fiber membrane bioreactor. Biomaterials. 30 (13), 2531-2543 (2009).
- Schmelzer, E., Finoli, A., Nettleship, I., Gerlach, J. C. Long-term three-dimensional perfusion culture of human adult bone marrow mononuclear cells in bioreactors. Biotechnol Bioeng. 112 (4), 801-810 (2015).
- Tapia, F., et al. Production of high-titer human influenza A virus with adherent and suspension MDKC cells cultured in a single-use hollow fiber bioreactor. Vaccine. 32 (8), 1003-1011 (2014).
- Deng, X., Zhang, G., Shen, C., Yin, J., Meng, Q. Hollow fiber culture accelerates differentiation of Caco-2 cells. Appl Microbiol Biotechnol. 97 (15), 6943-6955 (2013).
- Schutte, M., et al. Rat primary hepatocytes show enhanced performance and sensitivity to acetaminophen during three-dimensional culture on a polystyrene scaffold designed for routine use. Assay Drug Dev Technol. 9 (5), 475-486 (2011).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Novel cell culture device enabling three-dimensional cell growth and improved cell function. Biochem Biophys Res Commun. 354 (4), 1095-1100 (2007).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge. J Anat. 211 (4), 567-576 (2007).
- Vivares, A., et al. Morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device. Xenobiotica. 45 (1), 29-44 (2015).
- Smith, I., et al. Human neural stem cell-derived cultures in three-dimensional substrates form spontaneously functional neuronal networks. J Tissue Eng Regen Med. , (2015).
- Davidson, A. J., Ellis, M. J., Chaudhuri, J. B. A theoretical approach to Zonation in a bioartificial liver. Biotechnol Bioeng. 109 (1), 234-243 (2012).
- Mulder, M. . The basic principles of membrane technology. 2nd ed. , (1996).
- Ellis, M. J., Chaudhuri, J. B. Poly(lactic-co-glycolic acid) hollow fibre membranes for use as a tissue engineering scaffold. Biotechnol Bioeng. 96 (1), 177-187 (2007).
- Shearer, H., Ellis, M. J., Perera, S. P., Chaudhuri, J. B. Effects of common sterilization methods on the structure and properties of poly(D,L lactic-co-glycolic acid) scaffolds. Tissue Eng. 12 (10), 2717-2727 (2006).
- Forsey, R. W., Chaudhuri, J. B. Validity of DNA analysis to determine cell numbers in tissue engineering scaffolds. Biotechnol Lett. 31 (6), 819-823 (2009).
- Williamson, M. R., Coombes, A. G. A. Gravity spinning of polycaprolactone fibres for applications in tissue engineering. Biomaterials. 25 (3), 459-465 (2004).
- El-Salmawy, A., et al. Preparation and properties of pronectin F-coated biodegradable hollow fibres. J Artif Organs. 8 (4), 245-251 (2005).
- Meneghello, G., et al. Fabrication and characterization of poly(lactic-co-glycolic acid)/polyvinyl alcohol blended hollow fibre membranes for tissue engineering applications. J Memb Sci. 344 (1-2), 55-61 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved