このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
精製とのアミロイド線維にリフォールディング(彼)
要約
A two-step chromatographic method is described for the purification of recombinant Shadoo protein expressed as inclusion bodies in Escherichia coli, as well as a protocol to fibrillate purified Shadoo into amyloid structures.
要約
大腸菌発現系は、組換え真核生物のタンパク質の産生のための強力なツールです。我々はそれがShadoo、プリオンファミリーに属するタンパク質を産生するために使用します。 (His)6の精製の ためのクロマトグラフィー法は、封入体が記載されているように、組換えShadooが発現-タグ。封入体は、8M尿素で可溶化し、イオンアフィニティークロマトグラフィーを実行するようにNi 2+ -chargedカラムに結合されています。結合したタンパク質を、イミダゾールの勾配により溶出されます。 Shadooタンパク質を含有する画分を高度に精製されたタンパク質を得るために、サイズ排除クロマトグラフィーに供されます。最後のステップで精製Shadooで塩、尿素およびイミダゾールを除去するために、脱塩します。組換えShadooタンパク質はプリオン病に存在するタンパク質の立体構造の障害の生物物理学的および生化学的研究のための重要な試薬です。多くのレポートは、プリオンの神経変性疾患を刺すの沈着に由来することを実証しましたル、アミロイド線維を命じました。酸性および中性/基本的なpHでアミロイド線維にShadooをフィブリル化する方法を説明するサンプル・プロトコルが提示されています。それは、迅速かつ低コストな方法でタンパク質の大量生産を可能にするためShadooを生成し、フィブリル化する方法についての方法は、プリオン病の作業を実験室での研究を容易にすることができます。
概要
牛で牛海綿状脳症を含むプリオン神経変性疾患、ヒトでの羊とクロイツフェルト・ヤコブ病におけるスクレイピーは、致命的と不治です。プリオン病は、クロスβシートに、主にαヘリックスから成る細胞性プリオンタンパク質の立体構造変化によって特徴付けられる1,2の配座異性アミロイドを豊かに。クロスβ-構造が密に充填し、非常に規則正しい結晶のようなβシートは、水素結合3,4で安定化されています。プリオンアミロイドが原因募集し、単量体タンパク質ユニットを変換するためのテンプレートを提供し、成長エッジにおけるβ鎖に自己複製することができます。
「タンパク質のみ」の仮説によると、プリオンタンパク質のアミロイドコンフォーマーは唯一の感染性病原体です。しかしながら、いくつかの他の生体分子は、プリオン疾患に必須であることが提案されています。例えば、細胞膜は場所conversiであると考えられています上で行われ、いくつかの負に荷電した脂質は、変換プロセス5,6を増強することが示されています。加えて、いくつかのタンパク質はまた、プリオン病態に関与し得ます。ドッペルとShadoo 7,8:具体的には、プリオンタンパク質ファミリーの他の二つのメンバーがあります。ドッペルはジスルフィド橋で安定化し、比較的剛直な構造を有しており、アミロイド線維9に自己重合し、集計に失敗します。対照的に、プリオンタンパク質と同様に、Shadooは、アミロイド原線維構造にβシートに富む構造と自己会合を採用することができます。それはShadooがネイティブの条件下または負に帯電した膜10,11を結合する際にフィブリル化できることが示されました。アミロイド様繊維へShadooの変換は、病理に関連してもよいです。実際、アミロイド様構造は、疾患を引き起こすメカニズムはよく理解されていません。
Shadooが疎水性ドメイン(HD)とタンデムのArg /グリシンのシリーズを負い同様のトンを繰り返し、プリオンタンパク質( 図1A)のN末端 部分、O。プリオンタンパク質のN末端 部分として、Shadooは高度に正に荷電し、ネイティブ非構造タンパク質であると思われる11,12れます。 Shadooは、直接プリオンタンパク質に結合することができるので、プリオン疾患に関連した機能的であると思われます。また、その発現がダウンプリオン病理13,14の間に調節されます。しかし、プリオン病におけるShadooの役割は未だ確立されていません。
我々は、マウスShadoo遺伝子のコード配列を有するプラスミドを開発しました。プラスミドを大腸菌を形質転換しました N末端His 6融合Shadooタンパク質の産生のための大腸菌 。この発現系はよく我々の研究室で確立され、一般的に我々の進行中のプロジェクトで使用されている6,15,16。 Shadooの発現のための重要な問題は、Eの選択であります大腸菌菌株。コンピテントBL21細菌株は、一般的に、組換えプロの発現のために使用されますteins Shadooが正常にのみ変換さSoluBL21細菌株から発現および精製しました。 SoluBL21 コンピテントE. 大腸菌は、その発現が、 親BL21中に検出可溶性生成物は得られなかったタンパク質の産生のために開発さBL21宿主株の改良された変異体です。 SoluBL21 大腸菌における Shadooの高レベルの発現大腸菌は、封入体中のタンパク質の蓄積をもたらします。非天然タンパク質を高大腸菌で発現される一般的な特徴として、 大腸菌は 、このタンパク質は、不溶性の封入体中に蓄積する傾向があります。 Shadooはおそらく様々な程度に折り畳まれたタンパク質によって形成された高濃縮動的構造体に非共有結合、疎水性またはイオン性相互作用(またはその両方の組み合わせ)を介して集約します。 (I)変性媒体の他の生体分子からのタンパク質の選択的分離、および(ii)精製されたタンパク質の再生は 、in vitroフォールディングに用いた:結果として、精製は、少なくとも二つの工程を含みます技術。
Shadooの選択的分離は、8M尿素(または6Mグアニジン-HCl)を含む緩衝液中で達成されました。 Shadoo重合を得るために、pHを≥7の溶液中で構造化されていない単量体Shadooタンパク質、または(ii)の再生を得るために酸性pHの溶液中で(I)再生:尿素の除去及びタンパク質の再生は、様々なプロトコルを適用することによって行うことができます特徴的なクロスβシートモチーフを有する安定したアミロイド繊維へ。
プロトコル
プラスミドとShadoo式の1世代
注:遺伝子をコードするネズミShadooタンパク質(Shadoo 25から122)を 、発現ベクターpET-28 11にサブクローニングしました。このクローンは大腸菌に形質転換しました大腸菌 SoluBL21細菌株、11前述したように、N末端 ヘキサヒスチジンタグ、(HHHHHHHHHHSSGHIDDDDKHMKGGRGGARGSARGVRGGARGASRVRVRP APRYGSSLRVAAAGAAAGAAAGVAAGLATGSGWRRTSGPGELGLEDDENGAMGGNGTDRGVYSYWAWTSG)でShadooタンパク質を発現します。プラスミドは、作者から要求することができます。そのアミノ酸配列から算出Shadooの分子量は12,243.2ダあります。
注意:板状流フードの下や近くにブンゼン炎に細菌を持つすべての操作を実行します。
- 標準の熱ショックプロトコルを使用して、PET-28-Hisの6 -Shadooプラスミドで有能SoluBL21菌を変換します。プラスミドの1〜5μlのこのミックスのために(通常は10 PGに100チューブ中の細菌を50μlにNG)。 45秒間、42℃で熱ショックを実行します。
- 培養物は、40 mg / mlのカナマイシン( 図1B)を補充したルリア-ベルターニ培地中で0.5〜0.7の600まで37℃で細菌を形質転換しました。
- 培養物に、240 / mlのイソプロピルβ-D-チオガラクトピラノシド、ITPGを加えることによってShadoo発現O / Nを誘導します。 37℃で150rpmで振とうしながら培養菌。注意:一般的に、細菌培養は3 O / Nの600に達しました 。
注:形質転換された細菌は、将来のタンパク質産生のために-80℃で保存することができます。このために、細菌培養物のアリコートに10%を50%(v / v)の滅菌グリセロールを添加し、-80℃で、それらを凍結します。

Shadoo発現構築物の図1のスキーム、Shadoo発現の細菌形質転換および誘導(ステップ1で説明したように)。 NG>(A)Shadooための発現構築物は、タンパク質、NtとのN末端 に融合したヘキサヒスチジンタグをコードします。スキームはShadooタンパク質がC末端(CT)、続いて基本的なアルギニン/グリシン反復(緑シリンダ)、疎水性ドメイン(HD)、および単一のN-グリコシル化部位(CHO)を含むことを示します。 (B)をpET-28-Hisの6 -Shadooプラスミドを42℃で45秒間熱ショックによってSoluBL21の細菌に形質転換されます。形質転換された細菌は、40 / mlのカナマイシンを含む選択寒天上にプレーティングされています。プレートからの単一コロニーを、1000〜3000 mlの振盪フラスコ培養を接種するために使用されます。組換えタンパク質の発現は、1 mMのIPTGで誘導される。 この図の拡大版をご覧になるにはこちらをクリックしてください。
低圧液体クロマトグラフィーによるShadooタンパク質の2精製(LPLC)
- 細胞溶解とはclusionの体の準備
- 細菌懸濁液を収集し、遠心分離管( 図2)にそれを転送します。
- 4℃で20分間、2,500×gでスピン。細胞培養500mlの由来各ペレットのために15ミリリットルバッファー(50 mMトリス、10mMのEDTA、抗プロテアーゼカクテルでpH8)にペレットを再懸濁し、デカンテーションにより上澄み液を除去します。
注:再懸濁したペレットを凍結し、数日間-20℃で保存することができます。凍結は、細菌細胞の溶解を容易にします。 - SDS-PAGE分析し、クーマシー染色によって、粗製細菌ペレットを用いた組換えタンパク質の過剰発現を確認してください。
- このために、細胞をペレット化するために遠心分離機の細菌培養1ミリリットル。 100μlのLaemmliの変性溶液を加える(277.8 mMのトリス-HCl、pH6.8の、4.4%SDSを、44.4%W / Vのグリセロール、0.02%ブロモフェノールブルー)で5分間100℃でペレットを加熱します。
- 12%アクリルアミドゲルに負荷10μlのサンプルを、実行し、SDS-PAGEおよびVISUアリゼは、クマシー染色によりタンパク質を分離しました。
- )2.1.2から完全に再懸濁したペレットに0.5%の最終濃度になるように、トリトンX-100を追加します。
- 30分間37℃の水浴中で懸濁液をインキュベートします。
- 細菌細胞を溶解する氷冷水で6-12ミクロンのピーク・ツー・ピーク振幅を5分間懸濁液を超音波処理します。
- 転送は、クリーン50ミリリットル遠心チューブにサスペンションを超音波処理しました。
- 4℃で15分間、15,000×gで遠心分離管。
- デカンテーションにより上清を除去し、チューブ当たり結合バッファー(20 mMトリス - 塩酸緩衝液、pH 7.4、0.5 MのNaCl、8M尿素、5mMのイミダゾール)の5ミリリットルを追加します。
- 回転ホイールのO / Nの上に置いてチューブが完全に封入体からタンパク質を再懸濁します。
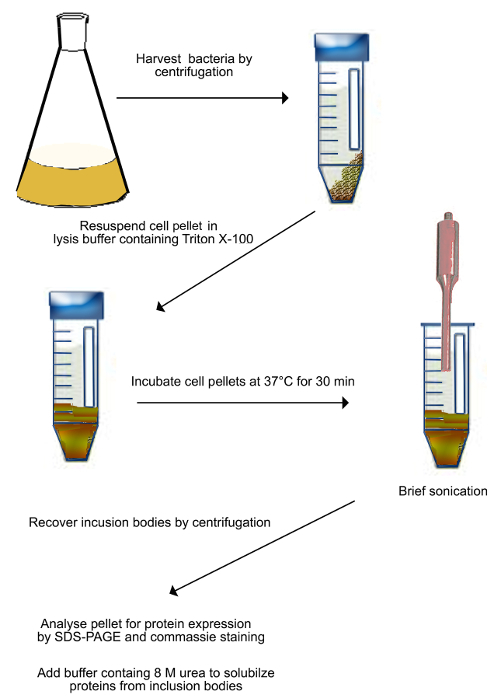
インクルージョンの精製図2のスキームShadoo体を発現する(ステップ2.1に記載のように)形質転換された細菌を遠心分離により回収し、溶解緩衝液中に再懸濁します。懸濁液を37℃で30分間インキュベートし、次いで機械的に、細菌細胞を破壊するために超音波処理されます。超音波処理は、サンプルの加熱を防止するために氷の上で行われます。壊れた細胞を遠心分離により回収し、封入体からタンパク質を可溶化する8 M尿素を含む緩衝液中に再懸濁されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。 - ニッケル2+ -アフィニティークロマトグラフィー
注:クロマトグラフィーは、5 mlのキレートセファロースカラム( 図3A)はNi 2+ -charged用いてFPLCシステム上で実行されます。全ての溶液は、1ml /分の流速でカラム上にロードされます。- それを充電するためにセファロースカラムに0.2 MのNiSO 4水溶液を10mlを注入Ni 2+ -イオンを持ちます。
- イミダゾールの低濃度(20 mMトリス-塩酸緩衝液、pH 7.4、0.5 MのNaCl、8M尿素、5mMのイミダゾール)を含む結合緩衝液の30-50 mlのを注入したNi 2+ -イオンを充填したカラムを平衡化します。
- 50ミリリットル注入ループと尿素可溶化したタンパク質をロードします。
- 完全に非結合タンパク質の最大値を除去するために10 mlの低イミダゾール結合緩衝液(20mMのTris-HCl緩衝液、pH 7.4、0.5 MのNaCl、8M尿素、5mMのイミダゾール)でカラムを洗浄することにより、フロースルー画分を回収カラムから。
- 非特異的にカラムに結合したタンパク質を溶出するために、洗浄緩衝液(20mMのTris-HCl、pH7.4の、0.5MのNaCl、8M尿素、80 mMイミダゾール)50〜mlのカラムを洗浄。
- 20 mMトリス - 塩酸、pH7.4の、0.5MのNaCl、8M尿素を含有する緩衝液中で80から800 mMのイミダゾールの15分の直線勾配を適用します。勾配適用中に1mlの画分を収集します。注意:Hisタグ - タンパク質は、ウィットに溶出されます(競争相手として使用される)、イミダゾール含有緩衝液の勾配ヘクタール。
- (2.1.3.1を参照)各画分の8μlのアリコートを取り、4μlの4倍レムリ変性溶液を加えます。 5分間、100℃での熱溶液。
- 12%アクリルアミドゲルに負荷タンパク質サイズマーカー10μlの各サンプルを10μl、実行SDS-PAGEおよびクーマシー染色によって分離したタンパク質を可視化します。注意:計算されたShadooの分子量は、そのアミノ酸配列は12,243.2ダで形成します。
- Shadooを含む全ての画分をプール。
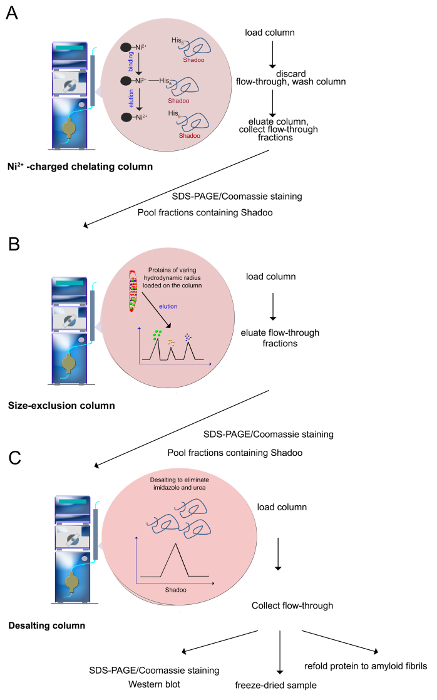
図3 の精製手順(工程2.2から2.4に記載のように)。 (A)のNi 2+ -イオンはポリヒスチジンタグ融合タンパク質の選択的な精製を可能にするヒスチジン残基によって調整することができます。イミダゾールを介して、タンパク質を溶出するために使用されますニッケル2+ -イオンとの調整と結合したタンパク質を置換する能力。(B)サイズ排除カラム上に分離されている-カラムのNi 2+に保持された様々な流体力学的半径のタンパク質。タンパク質は、最も小さいものに最大から溶出される。(C)使用前に、Shadooを含有する画分をプールし、尿素、イミダゾールおよび塩を除去するために脱塩されます。品質管理アッセイは、SDS-PAGE /クマシー染色、ウエスタンブロッティングを含みます。精製Shadooは、凍結乾燥することができます。 -20℃で保存した場合凍結乾燥Shadooはヶ月間安定である。 この図の拡大版をご覧になるにはこちらをクリックしてください。 - サイズ排除クロマトグラフィー
注:第二の精製工程は、第1の精製工程の間に他のタンパク質を同時溶出Shadooからタンパク質を分離するサイズ排除クロマトグラフィーからなります( 図3B)。- 1.5ml /分の流速で、20mMのトリス塩酸緩衝液、pH 7.4、0.5 MのNaCl、8M尿素を250mlを注入することによって、総床体積120 mlとスーパーデックスカラムを平衡化。
- ロード平衡化したカラムに2.2.9からShadooを含む画分をプールしました。上記緩衝液の一定流量に応じて40ミリリットルのカラム空隙容量後に1mlの画分を収集します。
- 各画分の10μlアリコートを取り、上記のようにShadooを含有する画分を見つけるために、SDS-PAGE分析およびクマシー染色を行います。
- Shadooを含むプール画分。
- 脱塩
注意:脱塩手順は、さらに生物物理学的および生化学的研究( 図3C)のために適切な緩衝液中の組換えShadooタンパク質を得るために、塩、イミダゾールおよび尿素を除去します。同様の結果は、緩衝液に対して試料を透析することによって得ることができます。- 150ミリリットルと53ミリリットルの脱塩カラムを平衡化/ minで5 mlの流速で10mMの酢酸アンモニウム緩衝液、pH 5の。
- ロードは、列にShadoo画分をプールしました。酢酸アンモニウム緩衝液の注入時に手動でUV検出器の出力で280nmでの信号の増加を示す画分を収集します。
- 凍結乾燥脱塩Shadooを、-20℃で保管してください。
- そのような使用前に10mMの酢酸ナトリウム緩衝液、pH 5、などの適切な緩衝液中で凍結乾燥Shadooを溶解します。
注:ポリヒスチジンタグ、エンテロキナーゼを用いて除去することができます。
生理的pHでのアミロイド線維にShadoo のインビトロ組立3.
注意:自発的にShadooのタンパク質凝集体とは、pH≥7 11で原線維を形成しています。

descriとしてアミロイド線維にリフォールディングShadooの 図4. スキーム(ステップ3のベッド)酸 性溶液では、pH≥7の緩衝液に溶解したとき。精製Shadooが自発的にアミロイド線維に変換し、振盪しながら、Shadooは1 M GDN-HClでのインキュベーション時にアミロイド線維に変換します。品質管理アッセイは、電子顕微鏡とのThT蛍光染色が含まれています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 20mMのTris-HCl緩衝液、pH7.4中2μMの最終濃度までShadooを希釈。 280 nmでの溶液の光学密度を測定すると20970のShadooアミノ酸組成から推定される吸光係数を用いて濃度を測定します。
- アミロイド構造( 図4)への自発的なタンパク質の変換を可能にするために、数週間のカップルのために4℃で円錐形のプラスチックチューブ内の溶液500μlをインキュベートします。
- 最終conceにT(ThTの)チオフラビン新たに調製追加Shadoo溶液100μlのアリコートに、10μMのntration。 RTで5分間溶液をインキュベートします。アミロイド構造体17の存在を確認するために、435 nmでの励起波長を使用して、460から520 nmの蛍光発光を測定します。
酸性pHでのアミロイド線維にShadoo のインビトロ組立4.
- 2μMの最終濃度になるように1 M GdnHCl、20mMの酢酸ナトリウム緩衝液、pH 5でShadooを希釈します。
- 3-7日のために、37℃で連続的に振盪しながら円錐管で、この溶液500μlをインキュベートします。
- 3.3のように溶液の一部にのThTを追加することにより、アミロイド線維の存在を確認してください。
- Shadooアミロイド原線維を精製し、10mMの酢酸ナトリウム緩衝液、pH 5.0に対して得られた懸濁液を透析します。
- 4℃で精製した原線維を保管してください。

SDS-PAGEおよびクーマシー染色を用いて分析した図5 の代表的な結果。のNi 2+から溶出したタンパク質画分は、キレートカラム(A)及びサイズ排除カラム(B)を -charged。精製Shadooの同定はSPRN抗Shadoo抗体(C)を用いて評価した。 この図の拡大版をご覧になるにはこちらをクリックしてください。
結果
精製Shadooタンパク質の約5〜10 mgの細菌培養1リットル当たり得られます。二段階の精製は、高純度の組換えShadooを得るために必要とされます。最初のステップは、Hisタグタンパク質を保持したNi 2+ -chargedカラムを用いたアフィニティークロマトグラフィーによって行われます。溶出した画分をSDS-PAGEに付し、クーマシーブリリアントブルー( 図5A)で染色します。 Shadoo...
ディスカッション
組換えマウスShadooタンパク質の大量の発現および精製の双方のための簡単で効率的なプロトコルが提供されます。記載されている方法は、成功した可溶化および(彼6)タグ付き組換えShadooタンパク質の精製を可能にします。 、タイトルに指摘したようにそれは、重要なことは、原核生物細菌大腸菌で発現された場合大腸菌 Shadooは、封入体に蓄積します。 Shadoo精製?...
開示事項
The authors have nothing to disclose.
謝辞
The authors would like to acknowledge Natalie Doude and David Westerway (University of Alberta) for providing us Sho cDNA, Christophe Chevalier (INRA) for plasmid construction, Michel Brémont (INRA) for providing us BL21Sol bacteria; Christine Longin (INRA) for TEM assistance and Edith Pajot-Augy (INRA) for comments and proofreading.
資料
| Name | Company | Catalog Number | Comments |
| AKTA FPLC | GE, Amersham | # 1363 | |
| HiLoad 16/60 Superdex | GE Healthcare | 17-1069-01 | |
| HiTrap IMAC | GE Healthcare | GE17-0920-05 | |
| HiPrep26/10 Desalting column | GE Healthcare | GE17-5087-01 | |
| SoluBL21 Competent E. coli | Genlantis | C700200 | |
| pET-28b+ | Novogen | 69865-3 | |
| IPTG | Sigma-Aldrich | I6758 | |
| LB-Broth medium | Sigma-Aldrich | L3022 | |
| Eppendorf Biophotometar | Eppendorf | 550507804 | |
| Trito X-100 | Life Technologies | 85111 | |
| NiSO4 | Sigma-Aldrich | 656895 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Tris-HCl | Sigma-Aldrich | RES3098T | |
| Protease Inhibitor Cocktail Tablets | Roche | 4693116001 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Imidazol | Sigma-Aldrich | I5513 | |
| Gdn-HCl | Sigma-Aldrich | G4505 | |
| protein size marker | Thermo Fisher Scientific | 26620 |
参考文献
- Biasini, E., Turnbaugh, J. A., Unterberger, U., Harris, D. A. Prion protein at the crossroads of physiology and disease. Trends in Neurosciences. 35, 92-103 (2012).
- Colby, D. W., Prusiner, S. B. De novo generation of prion strains. Nature Reviews. Microbiology. 9, 771-777 (2011).
- Chiti, F., Dobson, C. M. Protein misfolding, functional amyloid, and human disease. Annual Review of Biochemistry. 75, 333-366 (2006).
- Nelson, R., et al. Structure of the cross-beta spine of amyloid-like fibrils. Nature. 435, 773-778 (2005).
- Murphy, R. M. Kinetics of amyloid formation and membrane interaction with amyloidogenic proteins. Biochimica et Biophysica Acta. 1768, 1923-1934 (2007).
- Steunou, S., Chich, J. F., Rezaei, H., Vidic, J. Biosensing of lipid-prion interactions: insights on charge effect, Cu(II)-ions binding and prion oligomerization. Biosensors & Bioelectronics. 26, 1399-1406 (2010).
- Watts, J. C., Westaway, D. The prion protein family: diversity, rivalry, and dysfunction. Biochimica et Biophysica Acta. 1772, 654-672 (2007).
- Westaway, D., Daude, N., Wohlgemuth, S., Harrison, P. The PrP-like proteins Shadoo and Doppel. Topics in Current Chemistry. 305, 225-256 (2011).
- Baillod, P., Garrec, J., Tavernelli, I., Rothlisberger, U. Prion versus doppel protein misfolding: new insights from replica-exchange molecular dynamics simulations. Biochemistry. 52, 8518-8526 (2013).
- Daude, N., et al. Wild-type Shadoo proteins convert to amyloid-like forms under native conditions. Journal of Neurochemistry. 113, 92-104 (2010).
- Li, Q., et al. Shadoo binds lipid membranes and undergoes aggregation and fibrillization. Biochemical and Biophysical Research Communications. 438, 519-525 (2013).
- Watts, J. C., et al. The CNS glycoprotein Shadoo has PrP(C)-like protective properties and displays reduced levels in prion infections. The EMBO Journal. 26, 4038-4050 (2007).
- Watts, J. C., et al. Protease-resistant prions selectively decrease Shadoo protein. PLoS Pathogens. 7, e1002382 (2011).
- Westaway, D., et al. Down-regulation of Shadoo in prion infections traces a pre-clinical event inversely related to PrP(Sc) accumulation. PLoS Pathogens. 7, e1002391 (2011).
- Chevalier, C., et al. PB1-F2 influenza A virus protein adopts a beta-sheet conformation and forms amyloid fibers in membrane environments. The Journal of Biological Chemistry. 285, 13233-13243 (2010).
- Tarus, B., et al. Oligomerization paths of the nucleoprotein of influenza A virus. Biochimie. 94, 776-785 (2012).
- Biancalana, M., Koide, S. Molecular mechanism of Thioflavin-T binding to amyloid fibrils. Biochimica et Biophysica Acta. 1804, 1405-1412 (2010).
- Minic, J., Sautel, M., Salesse, R., Pajot-Augy, E. Yeast system as a screening tool for pharmacological assessment of g protein coupled receptors. Current Medicinal Chemistry. 12, 961-969 (2005).
- Schein, C. H. A cool way to make proteins. Nature Biotechnology. 22, 826-827 (2004).
- Sorensen, H. P., Mortensen, K. K. Advanced genetic strategies for recombinant protein expression in Escherichia coli. Journal of Biotechnology. 115, 113-128 (2005).
- Zhang, J., et al. Disruption of glycosylation enhances ubiquitin-mediated proteasomal degradation of Shadoo in Scrapie-infected rodents and cultured cells. Molecular Neurobiology. 49, 1373-1384 (2014).
- Englund, P. T. The structure and biosynthesis of glycosyl phosphatidylinositol protein anchors. Annual Review of Biochemistry. 62, 121-138 (1993).
- Puig, B., Altmeppen, H., Glatzel, M. The GPI-anchoring of PrP: implications in sorting and pathogenesis. Prion. 8, 11-18 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved