Method Article
マルチエクソンイヌX連鎖筋ジストロフィーでカクテルアンチセンスオリゴヌクレオチドを使用してスキップ
* これらの著者は同等に貢献しました
要約
エクソンスキッピングは、現在、デュシェンヌ型筋ジストロフィー(DMD)のための最も有望な治療選択肢です。 DMD患者のための適用性を拡大し、切り捨てられジストロフィン蛋白質の安定性/機能を最適化するために、カクテルアンチセンスオリゴヌクレオチドを用いたマルチエクソンスキッピングアプローチが開発された、我々は犬のモデルで全身ジストロフィンの救助を実証しました。
要約
デュシェンヌ型筋ジストロフィー(DMD)はジストロフィン (DMD)遺伝子の突然変異によって引き起こされる、世界的に最も一般的な致死性の遺伝性疾患の一つです。エクソンスキッピングはリーディングフレームを復元し、短いが、機能性タンパク質を産生するアンチセンスオリゴヌクレオチド(AONは)と呼ばれる短いDNA / RNA様分子を採用しています。 (単一AON薬で治療することができる患者のわずか13%まで)限定された適用性、および短縮型タンパク質の不確かな機能:しかし、エクソンスキッピング治療は、2つの主要なハードルに直面しています。これらの問題は、カクテルAONのアプローチで対処されました。 DMD患者の約70%が単一エクソンスキッピングにより(結合されたすべてのエキソン)で処理することができるがカクテルアンチセンス薬剤を使用してスキップ複数のエクソンを実現することができる場合、一方は、潜在的にDMD患者の90%以上を治療することができました。イヌX連鎖筋ジストロフィー(CXMD)犬のモデル、その表現型人間のDMD患者に、より似ているが、全身efficを試験するために使用しましたエクソン6と8のマルチエクソンスキッピングのACYと安全性がCXMD犬のモデルは、 ジストロフィン mRNAにおけるエクソン7の欠如につながる、イントロン6のスプライス部位突然変異を保有します。 CXMDに読み枠を復元するには、エクソン6と8のマルチエクソンスキッピングが必要です。したがって、CXMDは、マルチエクソンスキッピングの有効性と安全性をテストするための良い中型動物モデルです。現在の研究では、エクソン6及びエクソン8を標的とするアンチセンスモルホリノのカクテルを設計した、それは身体全体の骨格筋でジストロフィン式を復元しました。 CXMD犬モデルでカクテルオリゴとマルチエクソンスキッピングの有効性と安全性の評価のトランスフェクション/注入するための方法が提示されています。
概要
デュシェンヌ型筋ジストロフィー(DMD)は、最初の博士ギヨーム・ベンジャミン・アマンデュシェンヌ型(デブローニュ)1によって説明、進行性の筋力低下によって特徴付けられるX連鎖劣性筋疾患です。 DMDは、毎年2,3生まれた約2万影響を受けた子供たちと、全世界で約1 3500で男の子に影響を与える一般的な遺伝性疾患です。運動発達が遅れ、歩行障害を早期に十代の若者付近で車椅子の依存が続く、幼児4に見られます。死は、一般的に起因する呼吸や心不全5-8に20と30歳の間に起こります。 DMDの治療法は現在ありません。グルココルチコイドを用いた治療は、ある程度筋変性の進行を遅らせることができるが、肥満および糖尿病2,7,8を含む重大な副作用と関連します。 DMDは、機能的なジストロフィンproteiの損失につながる、 ジストロフィン (DMD)遺伝子の突然変異に起因しますn個。DMDは、200万以上の塩基対と79個のエクソン9,10に非常に大きな遺伝子です。フレーム外の突然変異につながる欠失、ナンセンス、及び重複変異は、DMD表現型の最も一般的な原因です。 9及びエクソン45 - -エクソン3領域ほとんどの患者は、DMD患者3,9,11-16に非機能的ジストロフィンをもたらす、遺伝子のこれらの部 分内に欠失変異を持つように55を「突然変異ホットスポット」と呼ばれます。筋膜安定化に大きな役割を持っているジストロフィン - 糖タンパク質複合体(DGC)、内ジストロフィン機能。中央ロッドドメインはそれほど重要な役割3,9,17を果たしながら、N末端 およびC末端は、機能のための最も重要なドメインです。主にDMD遺伝子内のインフレーム変異から生じるベッカー型筋ジストロフィー(BMD)、関連付けられている軽度の表現型の遵守は、DMDを治療するためのエクソンスキッピングのアプリケーションに影響を与えました。 BMD患者は短く、しかし、関数Aています末端3,6,18の両方を維持リットル、ジストロフィンタンパク質。エクソンスキッピングは、理論的には、BMD 3,19に見られるものと同様の機能短縮-しかし、ジストロフィン蛋白質で、その結果、リーディングフレームを復元することができます。
アンチセンスオリゴヌクレオチド(AONは)複数の種類が2'-O-メチルホスホロチオエート(2'OMePS)およびホスホロジアミデートモルホリノオリゴマー(PMOS)を含む臨床試験において試験されてきました。これらのAONを用いてスキップエクソン51と53が検査され、結果は有望であるが、それは、変異特異3、19、20,21、22〜26であるように、単一エクソンスキッピングは、適用性を制限しています。質問はまた、単一エクソン22,23をスキップから生産結果の短縮ジストロフィン蛋白質の安定性について残ります。さらに、一部の患者は、読み枠3を回復するためにスキップする単一エクソン以上が必要です。技術的にはより困難にしながら、マルチエクソンスキッピングは、1つの方法であることこれらの問題3,19に対処することができます。マルチエクソンスキッピングは、以前ジストロフィー犬及びインビトロでのヒト細胞系において実証されています。さらに、mdx52マウスおよびイヌX連鎖筋ジストロフィー(CXMD)犬のモデルは、生体内に使用されてきた22、24-27を研究しています。犬X連鎖筋ジストロフィー日本(CXMD J)CXMD Jのリーディングフレームがエクソン6,8、または追加のエクソン( 例えば 、エクソンは、3から9)のマルチエクソンスキッピングによって復元することができるようビーグル犬は、ここで使用された( 図1)。ビーグルベースCXMDはゴールデンレトリバー筋ジストロフィー(GRMD)モデルと同じ変異パターンを共有するが、ビーグル犬は、このようにDMD 28,29のための有用なモデルを提供し、それらの体の大きさに維持するために小型で安価です。 CXMD犬は、より密接に齧歯類のように、小さい動物モデルよりも人間のDMD表現型を模倣する、と毒物学的評価3,22,30,31のために、より信頼性が高いです図2)>アップ。 CXMD犬は、DMDに見られるものと類似の漸進的筋崩壊、歩行障害、心臓や呼吸器系の問題を表示します。単一エクソンスキッピングと比較して、マルチエクソンスキッピングは、患者のはるかに大きな割合にも適用可能です。最も一般的な3つの変異型(欠失、ナンセンス、および重複)のうち、80 -すべてのDMD患者の45%は特にエクソン45をスキップしてから利益を得ることができる一方で、患者の98%は、14,32,33をスキップするマルチエクソンを通じて治療することができます- 55 3,19,22,34。
修正されたモルフォリノの発展に伴い、エクソンスキッピングを容易にAONカクテルの効率が向上しました。アルギニンリッチ細胞透過性ペプチドコンジュゲートのPMO(PPMOs)、およびin vivo-モルフォリノ(VPMOS)が有意に細胞透過性と安定性3,35-38が改善されたAONの化学的性質です。懸念は、長期的AON毒性について残ります。しかし、重要な進展なされています。モルフォリノに作られた化学修飾を大幅にオフターゲット効果を減少させ、前臨床研究では、有意な毒性作用3,22,39,40を報告しませんでした。マルチエクソンスキッピングのための残りの課題は、各単一AONの現在の要件はカクテル3,19,22,41,42としての代わりに、一緒に、単一の薬剤として、単独の毒性について試験されます。シングルと心をターゲットに飛びマルチエクソンの両方を含むDMDの研究では、ジストロフィー心臓組織でほとんど改善がありました。心臓内のモルフォリノの有効性は乏しいため、細胞透過性能力の低いものと考えられています。ペプチド結合PPMOs心臓3,19,38にレスキュー機能性ジストロフィンタンパク質の量を増加させる、心臓細胞に浸透するAONの能力を改善しています。
ここでは、私たちのAONカクテルアプローチはESEfinderソフトウェア43を使用してAON配列の設計を含め、長さで議論されています。 Protocマルチエクソンスキッピングと犬の実験のためのオールも記載されています。 CXMD Jのビーグル犬は、エキソン6,8スキップ実験に使用しました。 CXMD犬モデルでスキッピングマルチエクソンは、有望な結果を示しているが、課題は、彼らが臨床的に適用される前に、その必要性が克服されずに残っています。
プロトコル
以下に記載されているすべてのプロトコルは、日本の精神・神経(NCNP)のナショナルセンターが定める動物保護ガイドラインに従っています。全ての実験は、NCNPの施設内動物管理使用委員会によって承認されました。
アンチセンスオリゴの1デザイン
- ESEサイト44、45-47を検出するために、救助ESEとESEfinderプログラムを使用してください。
- 設計25塩基対(bp)の標的とされるエキソンに対してアンチセンスである配列。ターゲットエクソン6と犬モデルにおける8( 図1)。
- pMOS用30bpの配列( 表1)または2'OMePSのための25bp - 25を使用してください。 25 bpの配列を設計するには、対象領域内にある配列を選択します。安定したシーケンス43を作成するために、二次構造、ヘテロの回避、エクソンスプライシングエンハンサーモチーフ、およびGC含量を考えてみましょう。上記SOFによって識別されるのAONはESE部位の少なくとも一つを標的とすべきですtware。
- 未満の連続4 G 'ので、65%未満であるGC含量とのAONを選択し、自己相補的な配列を含んでいません。オフターゲットアニーリング部位22,48,49を予測するためのNCBI BLASTソフトウェアを使用してください。
- 適切なAONの骨格化学を選択します。 in vitroの実験のために2'-O-メチルオリゴヌクレオチド(2'OMePS)またはモルホリノを使用しています。 in vivo実験のために、2'OMePS、モルフォリノまたはVPMOSを使用します。3,19,48,50
インビトロ実験2.(エキソン6,8 CXMDモデルにスキップ)
- 犬筋芽細胞の2'OMePSトランスフェクション
- 6ウェルプレート中で増殖培地の3ミリリットル文化CXMD筋芽細胞。シード1から5×10 3細胞/ cm 2 0.5とミリリットル/筋芽細胞用培地のcm 2でした。増殖培地は、10%ウシ胎児血清(FBS)および1%のダルベッコ改変イーグル培地(DMEM)を使用しペニシリン/ストレプトマイシン(P / S)40。
- 80%コンフルエント - 60まで37℃でインキュベートします。これは、約12〜24時間かかります。
- (:1の比のトランスフェクション剤:AONは、 例えば 、対リポフェクチン10μlの5μgののAON 2)低血清培地中の100μlの合計にカチオン性リポソームトランスフェクション剤を希釈します。 45分 - 混合物を30室温で放置します。
- 低血清培地中の100μlの最終容量までのAON(2'OMePSまたはモルホリノ)を希釈します。
- 希釈のAONで希釈したトランスフェクション剤を組み合わせて、10 RTでインキュベート - 15分。
- トランスフェクション剤/ AON混合物をRTで座っている間に、吸引を介して細胞から古いメディアを削除して、メディアで細胞を洗浄。
- トランスフェクション剤/ AON混合物に0.8ミリリットルのメディアを追加し、新たに洗浄した細胞にソリューション全体を追加します。 37℃で3時間インキュベートします。
- インキュベートした後、differentiatでメディアを交換イオン培地(DM)分化は、10日ほどかかる場合があります。分化は3日目のまわりで始まる発生したかどうかを確認してください分化培地を2%ウマ血清、200 U / mlペニシリン、200 mg / mlでストレプトマイシン、および10μg/ mlのインスリンを含むDMEMです。
- 犬筋芽細胞のモルフォリノトランスフェクション
- ステップ2.1で説明したように文化CXMDは、成長培地中で筋芽細胞。
- 分化培地(DM)に切り替え、最終濃度1μMを作るために各ウェルに0.1 mMストックのモルホリノを追加します。 AONの凝集を回避するために、トランスフェクションまたは注入前に10分間65℃で熱カクテルモルホリノ。ペプチド送達試薬39,51を追加し、3の最終濃度になるように調整- 6μM。
- 16後 - インキュベーションの48時間、RNA抽出のために細胞を収集します。プレートから細胞を剥離するために、細胞に1ミリリットル酸グアニジンチオシアネート - フェノール - クロロホルムを追加します。 RNA extracを実行しますこの工程の後る。
- あるいは、すべてのセルを覆うようにトリプシンを添加し、37℃で2分間インキュベートします。
免疫化学を実行しようとする場合には、培養室のためのスライドガラスを使用します。注意してください。分化後、細胞をパラホルムアルデヒド(PFA)(10分間、4%)を使用して固定することができます。
- あるいは、すべてのセルを覆うようにトリプシンを添加し、37℃で2分間インキュベートします。
- RNA抽出および逆転写ポリメラーゼ連鎖反応(RT-PCR)
- 細胞は筋管に分化された後、培地を除去し、1ミリリットルを酸グアニジンチオシアネート - フェノール - クロロホルムを追加します。 RTで10分間インキュベートします。
- 1.5ミリリットルチューブに移します。 200μlのクロロホルムを用いて結合し、3つの別々の層が見られるまで2分間室温でインキュベートします。上から下に3つの層がある:RNA層、DNA層、およびタンパク質層。
- 4℃で15分間、12,000×gで遠心分離します。 500&#でチューブ内の最上層の上澄みと場所を削除します181;リットルイソプロパノール(ここで止める場合は、-80℃上清を保存)。遠心し、4℃で10分間12,000×gで上清;遠心分離後、得られたRNAペレットを維持し、上清を捨てます。
- 4℃で5分間、8000×gでエタノールと遠心分離でペレットを洗浄。 15分間チューブを反転させ、残留エタノールを蒸発させ、次いで15追加 - RNaseフリー水30μlのを。 260 nmで米国/ VIS分光法を用いて、全RNA濃度を定量化します。
- 1.5μlの10μMリバースプライマー、1μlのdNTPを、5μlのワンステップPCRキットバッファー、0.7μlのRNase阻害剤、1μlの酵素混合物から一次元、1.5μlの10μMフォワードプライマー:RT-PCR反応に必要な試薬を結合PCRキットステップ、及びRNAの200ngの。これらを混合した後、25μlの最終容量まで水を加えます。
- サーモサイクラー中で、混合物を置きます。 50℃、15分で30分間のサイクルを実行します0; 95℃でのサイクルは、1分間94℃の35サイクル、1分間60°C、1分間72°C。最後に、72℃で10分間のサイクルを実行します。 4℃または-20℃の冷蔵庫に保管したPCR産物
- 相補的DNA(cDNA)をシークエンシング
- アガロースゲル電気泳動を使用して、9-スキップバンド - エクソン6を識別します。 1.5%アガロースゲルのウェルにロードし、各サンプルの5μLを、5分間ゲルを通して135 Vを実行し、そして20分間、その後120 V。次に、室温で30分間DNAゲル染色でゲルをインキュベートします。イメージングソフトウェアを使用してバンドを可視化。
- ゲル抽出キットを用いて目的のバンドを切り出します。
- DNAフラグメントを切除し、200μlのNTI / 100mgのゲルを用いたゲルスライスを可溶化します。これを50℃の水浴中で5〜10分間放置。その後、シリカ膜チューブに移します。
- 30秒間11,000×gで遠心分離します。 CEの前に700μlのNT3緩衝液で2回洗浄30秒間11,000×gで再びntrifuging。
- 1分間11,000×gで遠心分離することにより、シリカ膜を乾燥させます。
- 30μlのNEバッファと、それは1分間室温で静置する - 15を追加します。その後、1分間11,000×gで遠心します。シリカゲルを外し、チューブの内容を保持します。
- 製造業者のプロトコルに従って配列を決定するために配列決定キットを使用してください。
3.筋肉内注射またはOpen筋生検
- 生存手術中の無菌状態の維持のために、手術部位(後肢)の周囲にバリカンを使って髪を削除します。消毒剤としてヨードフォアまたはクロルヘキシジンを使用してください。全体動物と手術台の上にそれらを配置し、固定することによって、手術部位のために滅菌ドレープを使用してください。
- 手術室52,53のためにきれいなスクラブ、フェイスマスク、ヘッド覆い、滅菌手袋、特殊な靴を着用してください。
- それらを麻酔するためにチオペンタールナトリウムを20mg / kgのCXMD犬を注入します。乾燥から目を防ぐために、目に獣医軟膏を使用してください。
- 全身麻酔( 図3)を維持するために3%イソフルランの吸入- 2を使用してください。筋肉の反射神経をチェックして、麻酔の深さを評価するために、心臓や呼吸速度を監視します。次のように全身麻酔下での通常の呼吸速度(RR)、心拍数(HR)、およびたSpO 2がある:RR:10から20呼吸/分; SpO 2 95 - 100%のHR:80 -分(BPM)あたり120拍。
- メスを用いて、(若い成犬用)縦方向に約5cmも前脛骨筋(TA)として知られ、頭蓋脛骨(CT)の上に皮をカットし、シングルカットを行います。注射部位をマークするには、手術針および手術用糸を使用して、深い筋膜をステッチし、2cmの間隔で2ステッチマーカーを作ります。
- 27 G針で筋肉にAONの所望の濃度を注入します。希望concentrationは、処理条件との間で変化します。 CTについては、カクテルのPMO(0.4mgの各PMO)やカクテルVPMOS(0.13 mgの各vPMO)の0.4ミリグラムの1.2 mgの合計、1ミリリットルボリュームそれぞれの2回の注射を与えます。尺側手根伸筋(ECU)前肢の筋肉については、カクテルのPMO(0.4mgの各PMO)やカクテルVPMOS(0.13 mgの各vPMO)の0.4ミリグラムの1.2 mgの合計0.5ミリリットルずつの2つのボリュームを注入します。 1分間に針を残します。カクテルのための各AONの等しい量を使用してください。
- 手術用メスを用いてCT筋からの筋組織の一片の長さは約2cmを除去することにより、オープン筋生検を行います。
- 筋肉サンプル調製のために6.5に進みます。
- 針を使用して、全身麻酔から覚醒する前には0.02mg / kgのブプレノルフィン塩酸塩の筋肉内注射を投与します。背筋を超える筋膜と皮膚を置き、筋肉の筋膜と皮膚閉鎖のための3-0吸収糸と3-0ナイロン糸を使用して、これらのステッチ、respectivエリー。
- 口が開いたまま、咽頭反射が戻っているかどうかを判断します。咽頭反射が戻ってきたとき、犬を抜管。
- 感染を予防するために静脈内または筋肉内注射を介して15ミリグラム/ 3日間までキロセファゾリンまたはセファレキシン(抗生物質)30を管理します。
- 7日以内に縫合糸を取り外します。それは胸骨横臥位を維持し、完全に回復が行われるまでの犬は他の動物と対話することはできません十分な意識を取り戻したまで無人の犬を放置しないでください。できるだけ長く場所に気管内チューブを保持し、動物が噛むまたは飲み込むし始めたときにそれらを削除します。彼らは安定しており、正常範囲内であることを確認するために動物の心拍数、呼吸、及び水和を監視します。
- 術後のケアのために、静かな、暗い休憩所、適切な傷や包帯のメンテナンス、ソフトを含め3日間( 例えば 、ブプレノルフィンは0.01mg / kg)および看護支援のための鎮痛を提供休ん面、経口または非経口流体と再水和、および高美味食品やお菓子の使用により、通常の摂食への復帰。任意の動物が追加の薬剤が必要な場合は、痛みの症状に応じて、酒石酸ブトルファノールの0.3 10mg / kgの筋肉内注射を与えます。
注:痛み犬は、噛む傷、または痛みを伴う領域を守る、と取り扱えば、異常に不安または攻撃的でもよいです。また、1肢の痛みは、通常はそれを使用しようとする試みと患肢の跛行または保持アップにつながります。 8時間 - このような状況では、塩酸ブプレノルフィンの0.02ミリグラム/ kgのすべての6の筋肉内注射を与えます。
4.全身注射
注:この手順では、週の所望の数のために、毎週または隔週繰り返すことができます。
- 横に犬を取得することによって手動で、ゆっくりと犬を抑制し、その後トン全体の場所で犬を保持するために肩や腰の上に腕を羽織ります彼手順。
- AONを注入します。 120から240ミリグラム/キログラムカクテルのPMO - (橈側または伏在静脈として知られている)四肢の静脈への静脈留置針を用いて、(40〜80 mgの各AON)。注入されたAONの量は、実験条件に依存します。カクテルのための各AONの等しい量を使用してください。
- 製造業者の指示に従って、20分間/分2.5 mlと速度で50 mlの全を注入する注入ポンプまたはシリンジポンプを使用します。ジストロフィン式として隔週毎週または繰り返し注射(隔週)少なくとも5回は、繰り返し注射で蓄積されます。
- 毒性を調べるために、毎週血液検査を行います。
- 全血球数(CBC)のための0.5ミリリットル、他の詳細は2.5ミリリットル - - フォアまたは後肢の皮下静脈の1から針を使用して、血液の3ミリリットルを集めます。 CBC、ガンマグルタミルトランスフェラーゼ(GGT)、アスパラギン酸アミノトランスフェラーゼ(AST)、血中尿素窒素(BUN)、アラニンaminotraを含みますnsferase(ALT)、クレアチンキナーゼ(CK)、およびクレアチニンの評価血液検査キットの製造業者の説明書に従って、採取した血液を試験する。40,54
犬の5.臨床グレーディング
- ビデオカメラと記録犬の行動と歩行を設定します。犬を採点するとき、これは参照として機能するように犬と一緒に全体の出会いを記録。これは、各ビデオは、犬の能力や意欲に応じて異なる長さになることを意味します。デフォルトの記録パラメータを使用します。それは後日確認することができますので、撮影はグレーディングのレコードを作成します。
- グレード歩行や運動の妨害。
- 歩行や運動の妨害については、以下のグレードを使用します。
グレード1 =なし、後肢で座っグレード2 =拡張、グレード3 =後肢でバニーホップ、グレード4 =シャッフル散歩、そしてグレード5 =歩くことができません。 - GRグレード1 =なし、:モビリティの乱れについては、以下のグレードを使用しますADE 2 = =、通常よりもより多くの後肢、グレード4にジャンプすることはできませんグレード3 =横たわって動き回る困難、とグレード5 =立ち上がって動き回ることができないを増やします。
- 歩行や運動の妨害については、以下のグレードを使用します。
- それは15メートルを実行するために犬を取るどのくらいの時間。 、15メートルを測定するスタートラインで犬を配置し、15メートルマークまで実行することを奨励します。
- 以下の評価尺度を用いて、四肢の筋萎縮を決定します。
グレード1 =なし、グレード2 =容疑者硬さ、グレード3 =硬さを感じたり、薄い表示され、グレード3と5との間にグレード4 =、およびグレード5 =非常に薄いまたはハードすることができます。 - グレードは、以下のスケールを使用して、よだれを垂らしていない:グレード1 =なし、グレード2 =飲食、グレード5 =連続よだれとき、グレード3 =いくつか食べてよだれや飲酒、グレード4 =よだれの文字列に座ったときに時折唾液をドリブル。
- グレード1 =なし、グレード2 =やや拡大、グレード3 =拡張outsi:以下のスケールを用いて、舌のグレード肥大(巨大舌)デ・歯列、グレード4 =拡大、わずかに肥厚し、グレード5 =拡大および肥厚。
- グレード以下のスケールを使用して飲み込む犬の能力:グレード1 =支障なく、グレード2 =は、プレートから食べ物を取ることでグレード3 =難しさ、食べ物を取りに時間と労力を要する咀嚼におけるグレード4 =難しさ、嚥下、または飲酒食べること、及びグレード5 =ができません。
- 55(15メートル走行試験を除く)各カテゴリからスコアを追加することで、トータルグレードを計算します。
注意:バイアスを導入しないように研究が盲目にする必要があります。
前記磁気共鳴イメージング(MRI)
- 後肢のT2強調画像を得るために、3テスラ(3T)、MRI、18センチ直径18 /長さ1cm、人間の四肢コイルを使用してください。
- チオペンタールを20mg / kgのCXMD犬を注入することにより、動物を麻酔。乾燥から目を防ぐために、目に獣医軟膏を使用してください。全身麻酔を維持2-3%イソフルランの吸入を使用してください。
- 筋肉の反射神経をチェックして、麻酔の深さを評価するために、心臓や呼吸速度を監視します。次のように全身麻酔下での通常の呼吸速度(RR)、心拍数(HR)とのSpO 2は 、次のとおりです。RR:10から20呼吸/分、のSpO 2:95から100まで%、HR:80 -毎分120拍数(bpm )。
- T2強調画像取得するには、次の設定を使用した:TR / TEは= 4000/85ミリ秒、スライス厚= 6ミリメートル、スライスギャップ= 0ミリメートル、ビュー= 18センチフィールド×18センチ、行列サイズ= 256×256、および高速スピンエコー( 図4)の間に買収= 3の数。
7.筋肉サンプリングと準備(剖検)
注:筋肉は最後のAON注射後1〜2週間をサンプリングする必要があります。
- それらを麻酔するためにチオペンタールナトリウムを20mg / kgの犬を注入します。目の乾燥を防ぐために、麻酔中に目に獣医軟膏を使用してください。
- anesを維持するために、3%のイソフルラン吸入 - 2を使用しますthesia。筋肉の反射神経をチェックして、麻酔の深さを評価するために、心臓や呼吸速度を監視します。次のように全身麻酔下での通常の呼吸速度(RR)、心拍数(HR)とのSpO 2は 、次のとおりです。RR:10から20呼吸/分; SpO 2:95〜100パーセント、HR:80から120 BPM。
- (のみ検死のために)全身麻酔下で放血犬を安楽死させます。分子分析における血液由来因子( 例えば 、心臓の筋肉)による影響を回避するために、深い全身麻酔下で放血を使用してください。
- 解剖以下の筋肉( 図5):CT、長指伸筋(EDL)、腓腹筋、ヒラメ筋、大腿二頭筋、大腿直筋、上腕二頭筋、上腕三頭筋、三角筋、ECU、橈側手根伸筋(ECR)、尺側手根屈筋(FCU )、橈側手根屈筋(FCR)、薄筋、肋間、腹部の筋肉、横隔膜、横dorsi、食道、胸鎖乳突筋、および心臓。毒性を調べるために、腎臓およびLiを収集サンプル版。解剖技術56のための基準としてEvansとアレクサンダー・デ・Lahunta(2009)を使用します。
- カットCT、EDL、腓腹筋、ヒラメ筋、大腿二頭筋、大腿直筋、上腕二頭筋、上腕三頭筋、三角筋、ECU、ECR、FCU、FCR、薄、肋間、腹筋、横dorsi、食道、胸鎖乳突筋、心臓、腎臓、そして、小さなセクションに肝臓の約1 - 長さ1.5cm。振動板をロールアップしてから1にカット- 1.5センチメートルセクション56。
- コルクディスク上に厚さ1cm - それは約0.5であるようにトラガカントガムを置きます。トラガカントゴムの反対側に、動物の識別や筋肉の名前のラベルのディスク。
- トラガカントゴムでコルクに垂直なそれらの縦軸と筋肉を置きます。
- 液体窒素中で座っているイソペンタンの容器にコルクを置きます。 1分間または完全に凍結するまで、ピンセットで絶えずそれを周りに移動します。コルクにストア筋肉-80℃でバイアルインチ輸送の際は、ドライアイス上にバイアルを置きます。
- 動物の識別/筋肉の名前と日付で標識されたガラススライドを準備します。
- クライオスタットではスタンドにコルクをマウントし、-25℃に冷却しました。所望のレベルに切片厚を設定します。免疫組織化学のための8μmで、ヘマトキシリンおよびエオシン(HE)染色のために12ミクロンを使用してください。ウエスタンブロット試料について15ミクロンを使用してください。適切な筋肉のサンプリングのための平らな筋肉を得るために、筋肉の約四分の一をトリミング。
- 一度に筋肉の1部分を切断、免疫組織化学またはHE染色のためのサンプルを使用することを計画している場合、同じスライドガラス上にセクション番目ごとに6を配置します。 -80℃でチューブや店舗で40セクション - ウェスタンブロットのためのサンプルを使用している場合は、30を置きます。
- スライドの調製後、スライドを室温で1.5時間乾燥させて。ストアは、-80℃でスライドします。
8.免疫組織化学
- ストレージから準備されたスライドを削除し、それらを置きます湿度チャンバーを分離し、スライドを維持し、水分を維持します。底部がちょうど水(水の約1mm)で覆われているように、水分チャンバを満たします。
- 空気乾燥0.5時間のために。疎水性バリアペンを使用して、スライド上の筋肉のサンプルを囲む四角形を描画します。
- リン酸緩衝生理食塩水(PBS)中の15%ヤギ血清を追加し、ブロッキング試薬で室温で2時間インキュベートします。
- (:150希釈1)犬のジストロフィン染色のための抗ジストロフィンロッドドメイン(DYS-1)マウスモノクローナル一次抗体、またはC末端モノクローナル抗体(DYS-2)を追加します。 PBSの1.25ミリリットルでブロッキング剤を使用して希釈します。冷蔵庫で4℃でO / Nインキュベートします。
- 5分間、PBSで洗浄し、3回繰り返します。 (:2500 1)(DYS-1の場合)またはIgG2の(DYS-2用)マウスIgG1に対する二次抗体のAlexa 594ヤギ抗体を追加します。フェノールエトキシレートオクチル0.1%を含むPBSでブロッキング試薬で希釈します。 RTで0.5時間インキュベートします。
- 5分三tについてPBSで洗浄IME。スライドが乾燥することができます。 2滴4の(3 ngの/ ml)を '、6-ジアミジノ-2-フェニルインドール(DAPI)マウントソリューション - 1を追加します。ピンセットを使用して、泡を避け、セクションの上にガラススリップを配置。
- ビューdystrophin-(DYS-1 / DYS-2)20X倍率で594 nmでの蛍光顕微鏡下で陽性線維。
9.ウェスタンブロッティング
- 氷上でのサンプルバッファー150μlに凍結切片から収集した筋肉セクションを追加します。
- ハンドホモジナイザーを用いて、簡単にタンパク質サンプルをホモジナイズします。 5分 - 3 95℃で加熱ブロックインキュベーター中で1.5mlチューブにおける熱のサンプル。上清を15分間、16,500×gで遠心分離し、収集します。
- -70℃上清のストアアリコート。 100倍に希釈し、蒸留水を使用してください。
- 製造業者のプロトコルに従って市販のキットを用いてタンパク質濃度を決定します。 3分間のサンプルおよび熱に2×レムリSDSローディングバッファーを追加します  95℃で。
- 3にロードするサンプル- 150 Vで3時間のためにそれを実行する前に、8%トリス-酢酸ゲルは、定量化のためのいくつかの希釈した野生型(WT)のサンプル( 例えば 、1%、10%、および50%)を含めます。ジストロフィンの1%未満のWTレベルは、この方法を用いて検出されるべきです。
- 20分間陰極バッファーでゲルを置きます。この間、ろ紙9個を取り、転送バッファカソードバッファー中の(3論文[+]、陽極バッファー(に入れ[ - ]、濃縮陽極バッファー[ - ]はそれぞれ、)この感度( 図6)を増加させる半乾燥転送方法を説明します。
- 20秒間メタノールにPVDF膜を浸し、その後、陽極バッファに配置します。
セミドライトランスファーのための膜を用いてゲルを設定し、それはRTまたは低温室で400ミリアンペアで1.5時間を実行することを可能にします。 - PBSで膜を洗浄します。 2時間のTween 20(PBST)および5%粉乳を含むPBSの混合物中で膜をインキュベートします。
- 1:100希釈をPBST、5%粉乳混合物中DYS-1(一次抗体)を希釈します。膜にそれを追加し、それは少なくとも1時間インキュベートしましょう。 15分ごとに100ミリリットルPBSTで3回洗浄します。
- 1で65μL/ HRP結合二次抗体(DYS1ための抗マウスのIgG2a)のレーンを追加します:5000希釈の暗い領域におけるRTで1時間。その後、20分間、200mLのPBSTで3回洗浄します。指示通りに検出キットからソリューションを混ぜます。 1分間インキュベートします。
- バンドを検出し、ImageJソフトウェア48,57,58と分析するためにフィルムを開発。
結果
インビトロ実験で
筋芽細胞は、各AONの有効性を比較するために、様々な2'OMePS処理条件を用いてトランスフェクトしました。 600 nMのEx6A、Ex6B、Ex8A、またはEx8Bのそれぞれと単一AON処理は、600 nMのすべての4 AONの配列の各々でのカクテル治療と同様に、行われました。 RNAサンプルを、トランスフェクションの4日後に採取しました。 RT-PCR後、各治療のためのサンプルは、非処置(NT)のサンプルと一緒にゲルに流しました。ゲル上の高いバンドは、アウトオブフレームDMDの製品を表します。これらのバンドは、NT、Ex8Aで見られた、とEx8Bは筋芽細胞を処理しました。 Ex6A、Ex6B、Ex8A、そしてカクテルで処理した筋芽細胞は、インフレームの製品を示しました。 Ex8Aはインフレーム製品( 図7)のみ30%を示したカクテルとEx6A / Bは、インフレームの製品100%を示しました。エクソンスキッピングとの復元を確認するために、リーディングフレームは、cDNAの配列決定を行いました。 9実際に( 図7)はスキップされていた-結果は、エクソン6があることが示されました。免疫組織化学は、AON処理された犬はNTサンプル( 図8)と比較して、ジストロフィン陽性線維が増加したことを示しました。
in vivo 実験
様々なAON処理条件の効率を比較するために、CXMD犬(0.5から5歳)は1.2 mgのEx6Aまたは様々な用量でEx6A、Ex6B、およびEx8Aのカクテルで一回注射しました。二週間注射後、筋肉試料を集め、ジストロフィン陽性線維の数を比較するDYS-1で染色しました。全てのカクテルで処理したサンプルは、NTのサンプルと比較して増加したジストロフィン発現を示しました。ジストロフィン陽性繊維は、AONの投与量( 図9)と増加しました。次のシステムIC注射、野生型(WT)、NT、およびカクテル処置CXMD筋肉試料をDYS-1( 図10)を用いて染色しました。カクテルで処理したCXMD犬は、CTや心臓の筋肉サンプルの両方のNT CXMD犬、と比較して増加ジストロフィン発現を示しました。しかしながら、AON処理した骨格筋(CT)は、処理された心筋に比べジストロフィンの非常に高い発現を示しました。 WT、NT、および様々なモルホリノカクテルで処理した筋肉を比較するイムノブロットは、同じ結論に至りました。処理された骨格筋サンプルにおけるジストロフィン発現の大規模な範囲は、( 図10)もありました。ヘマトキシリンおよびエオシン(HE)染色は、CXMDをあしらったことを明らかにしました 犬はNT CXMD犬( 図11)と比較して中央に有核繊維(CNF)の有意な減少で、改善された組織病 理を示しました。これは、NTの犬で発生した複数の変性/再生、ジストロフィー筋病理の兆候があることを示します。さらに、処理された犬は速くていました臨床評価スケールで時間と改善されたスコアを実行しています。処理されたCXMD犬はすべてのカテゴリでNT CXMD犬( 図12)よりも良好なスコアを示しました。
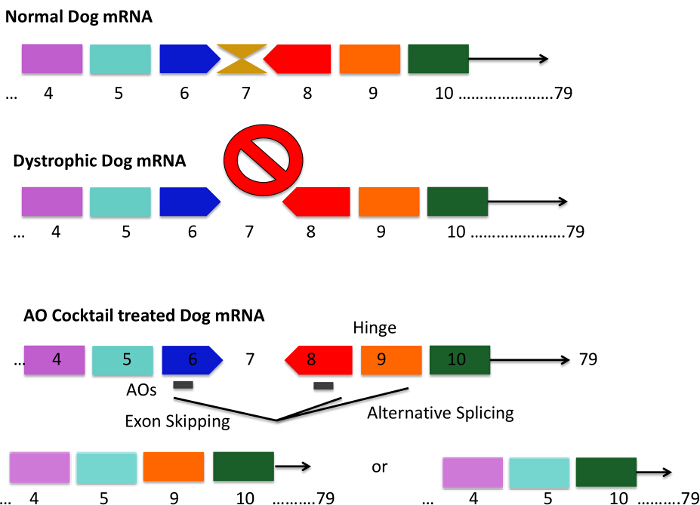
CXMD犬とエキソン6の図1.変異パターン- 。アンチセンスカクテルを使用した8スキップ戦略 CXMD犬は、ジストロフィー犬mRNAにおけるエクソン7の損失につながるエクソン6における点変異を持っています。これはmRNAがアウトオブフレームであるとジストロフィンタンパク質の産生が失われることになります。 AONカクテルで処理されたイヌの灰色のバーが短いAONシーケンスを表す8 - ショートAON配列が効果的に6個のエクソンをスキップmRNAスプライシングをもたらす6,8を、エクソンに結合するように設計されています。エクソン9は、ヒンジドメインをコードし、時には自然に短くなっているタンパク質が、機能ジストロフィンのためのエクソン6,8に対してのAONで得られたmRNAのコードをスプライシングされますal。は、この図の拡大版をご覧になるにはこちらをクリックしてください。
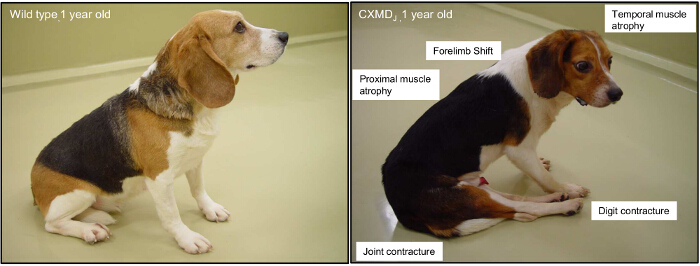
1歳のイヌX連鎖筋ジストロフィー(CXMD)動物の図2.主な臨床症状。1歳の野生型ビーグルとCXMD犬が示されています。近位、四肢、および一時的な筋肉の関与は通常、生後2ヶ月から観察されています。共同拘縮や骨盤のずれは、生後4ヶ月から顕性である。 この図の拡大版をご覧になるにはこちらをクリックしてください。
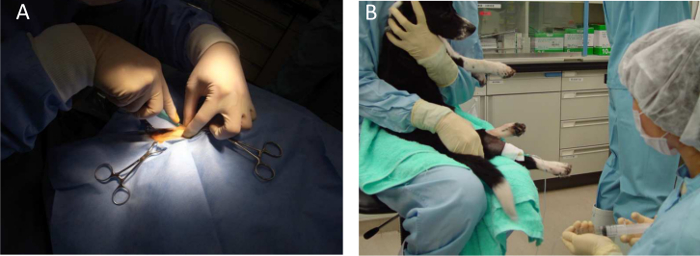
犬。A)Intramuscul図3.全身麻酔arの注射と筋肉生検をイソフルランで全身麻酔下で行われています。 B)全身注射のための動物の開催。 この図の拡大版をご覧になるにはこちらをクリックしてください。
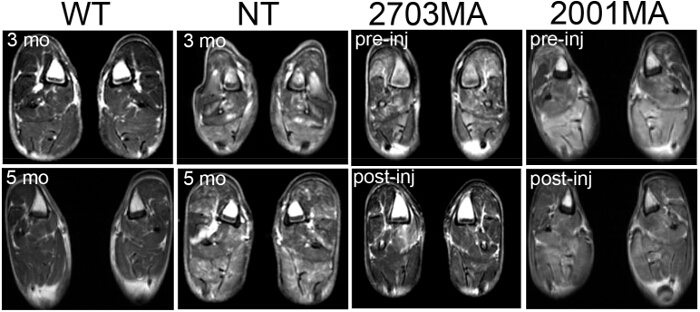
図4.磁気共鳴イメージング野生型の(MRI)、CXMD非処理、および WTおよびNT CXMD犬に3ヶ月と5ヶ月で後肢のCXMD。MRIスキャンを処理しました 。 AONのポスト噴射(最初の注射の前に1週間)で処理CXMD後肢MRIの前の2つのサンプル画像が表示されます。 2703MAは200ミリグラム/キログラムカクテルモルフォリノで7倍毎週処理しました。 2001MA 120ミリグラム/ kgのカクテルモルホリノの5X毎週のIV注射で処理しました。対照および処理の犬は、年齢をマッチさせました。処理された犬は減少T2信号を示しています。画像はADAPです横田らの許可を受けてテッド。(著作権2009年、ジョン・ワイリー・アンド・サンズ)40 この図の拡大版をご覧になるにはこちらをクリックしてください。
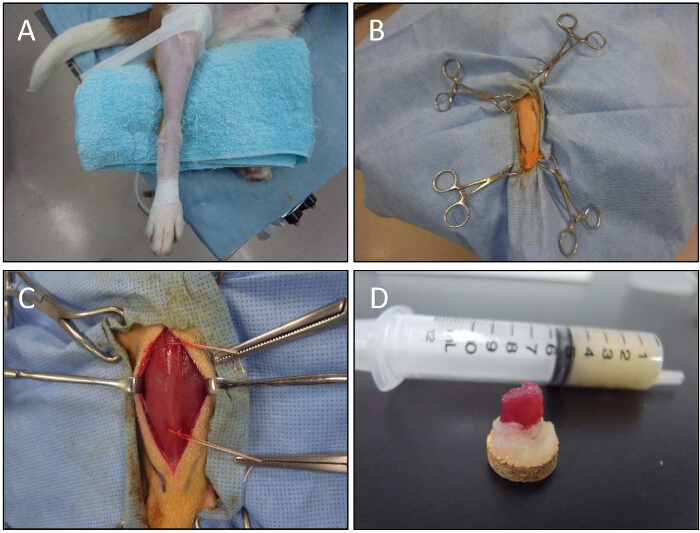
犬のための図5.筋肉生検手順。A)下肢が筋生検のために固定されています。 B)鉗子の助けを借りて、下肢が保持されています。 C)CTの筋肉を露出させます。開放生検技術は、注入部位の筋肉サンプルを得るために使用されます。スレッドは、生検試料を保持するために使用されています。解剖後トラガカントゴム上D)筋サンプル。 この図の拡大版をご覧になるにはこちらをクリックしてください。
/53776/53776fig6.jpg "/>
図6.セミドライ転送方式。ウェスタンブロッティング用のセミドライ転写法の表現が提示されています。濃縮された陽極バッファーに浸した3つの論文は、負端子に敷設されています。陽極緩衝液に浸漬した3論文は、この上に積層されています。 MbのPVDF紙6紙の上に置かれる前に、メタノール、次いで、陽極緩衝液に浸漬されています。カソードバッファー中に浸漬されたゲルを、PVDF紙の上に静かに置かれます。最後に、陰極バッファーに浸し3論文は、ゲルの上部に配置されています。正端子は上に設定されています。 1時間、400ミリアンペアは、システムを介して実行されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
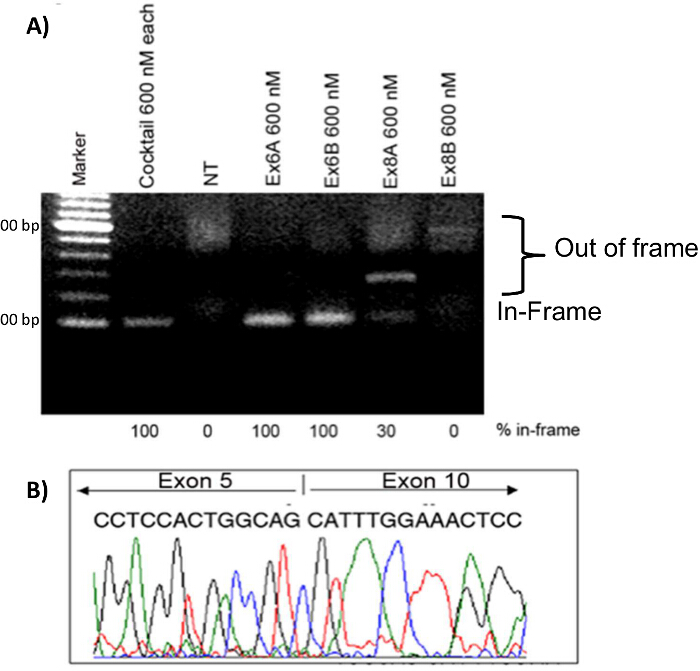
図7. CXMD筋芽細胞におけるエクソンスキッピング。 CXMDの筋芽細胞はEx6A、Ex6B、Ex8A、または単独でEx8B、またはすべての4のカクテルでトランスフェクトしました。 600 nMの合計は、個々の配列のために使用し、カクテル、各配列の600 nMで使用しました。 A)CXMD犬の筋芽細胞で治療を2'OMePS。 Ex6A、Ex6B、そしてカクテルで処理したサンプルは、インフレームエクソン・スキップ転写産物の予想される位置での強いバンドを示します。 Ex8AはEx8Bが弱いバンドを示し、中間バンドを示し、およびNTは、インフレームの位置にバンドが表示されません。単独Ex6Aから、4日間トランスフェクション後B)のcDNA配列決定。画像は横田らからの許可を得て適応されます。(著作権2009年、ジョン・ワイリー・アンド・サンズ)40。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図8.増加Dystrop2'-O-メチルホスホロチオエート(2'OMePS)トランスフェCXMD筋芽細胞に発現しホアヒン。CXMD筋芽細胞を単独でEx6Aまたはカクテル2'OMePSをトランスフェクトしました。 DYS-2(赤色)及びDAPI(青)染色を示します。処理された筋芽細胞は、野生型(WT)および非処理(NT)筋芽細胞と比較されます。画像は横田らからの許可を得て適応されます。(著作権2009年、ジョン・ワイリー・アンド・サンズ)40。バー=50μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
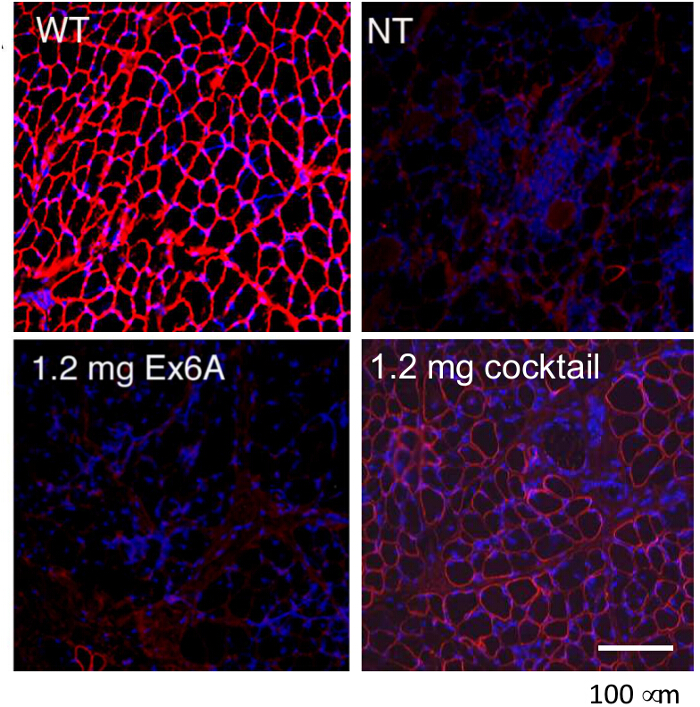
CXMD犬のモルフォリノの筋肉内注射でジストロフィン発現の図9.レスキュー。単独Ex6AまたはEx6A、Ex6B、およびEx8Aのカクテルは、CXMD犬のCTの筋肉に注射しました。野生型のジストロフィン(DSY-1)染色(WT)、無処理(NT)、およびCXMD犬が示されている処理されました。犬は単独で1.2ミリグラムのEx6Aまたは1.2 mgのカクテルで処理しました。画像は横田らからの許可を得て適応されます。(著作権2009年、ジョン・ワイリー・アンド・サンズ)40。バー=100μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。

CXMD犬。ジストロフィンにおける全身カクテルモルホリノ治療 (DYS-1)の後 、 図10の増加ジストロフィン発現は染色は、(NT)(陰性対照)、無処理、野生型(WT)(陽性対照)でジストロフィンの発現を比較するために使用されました120ミリグラム/ kgのモルホリノカクテル(各AONを40mg / kg)で処理し、CXMD犬。モルホリノカクテルはEx6A、Ex6B、およびEx8Aを含んでいました。犬は、静脈内に5回注射した私たちこのカクテルでekly。 A)ジストロフィンWT、NTの頭蓋脛骨(CT)の筋肉内での発現、および処理された犬との比較。 B)NTおよびモルホリノカクテルで処理された犬との間に心臓組織におけるジストロフィン発現の比較。ローディングコントロールとしてデスミンとジストロフィンのためのC)イムノブロットは、WT、NT、およびモルホリノカクテルで処理された犬のために示されています。以下の筋肉が処理された犬のために示されている:上腕三頭(TB)、上腕二頭筋(BB)、ダイヤフラム(DIA)、食道(ESO)、CT、内転筋(ADD)、長指伸筋(EDL)、咬筋(MAS)、そして、心。画像は横田らからの許可を得て適応されます。(著作権2009年、ジョン・ワイリー・アンド・サンズ)40。バー=200μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
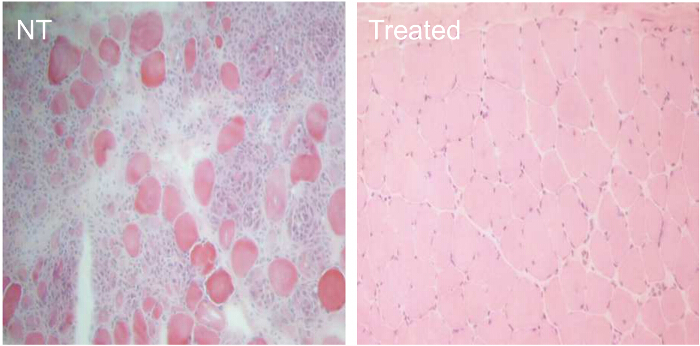
フィギュア11. CXMD犬における組織病 理240ミリグラム/キログラムモルホリノカクテルで7週間処理の改善。一度半年から5歳までのCXMD犬が240ミリグラム/キログラムモルホリノカクテル(Ex6A、Ex6B、およびEx8A)を静脈内注射しました7週間の週。 14日最後の注射後に、食道の筋肉を採取し、ヘマトキシリンおよびエオシン(HE)染色を行いました。 HEの非処理(NT)から食道の筋肉の染色およびモルホリノカクテルで処理した(処理された)CXMD犬(40X対物レンズ)。 この図の拡大版をご覧になるにはこちらをクリックしてください。
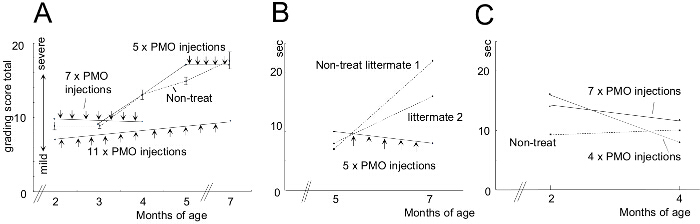
図12は、臨床成績評価のスコアを改善し、15メートルは、モルホリノ処理後の時間を実行している。モルホリノ処理された犬は、非処理(NT)同腹仔と比較しました秒。グラフ中のエラーバーはSEMを示します。 A)は、臨床グレーディング試験で合計スコアが治療前と後に計算し、処理した動物NT同腹子と比較しました。 B)で処理し、NT犬の15メートル走行時間の比較。 Bと同様にC);しかし、若い犬を使用しました。画像は横田らからの許可を得て適応されます。(著作権2009年、ジョン・ワイリー・アンド・サンズ)40。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| アンチセンスオリゴヌクレオチド | ヌクレオチド配列 |
| Ex6A | GTTGATTGTCGGACCCAGCTCAGG |
| Ex6B | ACCTATGACTGTGGATGAGAGCGTT |
| Ex8A | CTTCCTGGATGGCTTCAATGCTCAC |
表1アンチセンスオリゴヌクレオチドの設計。
ディスカッション
エクソンスキッピングは、DMDの治療のための有望な治療技術です。 in vitroおよびin vivo実験の両方で 、マルチエクソンスキッピングが可能であることを示しています。ここで、CXMD犬モデルの使用が議論されています。 8. 2'OMePS AON化学はCXMDの筋芽細胞トランスフェクションに使用し、モルフォリノAONの骨格化学は、in vivo実験のために選択した-まず、のAONは、 ジストロフィンのエクソン6を標的とするレスキュー-ESEとESEfinderプログラムを用いて設計しました。 VPMOSは変更されていないPMOをより効率的であるが、その高い毒性のために、彼らは、全身注射に適していません。 RNA抽出、RT-PCR、およびcDNA配列は、CXMD筋芽細胞で行いました。 PMOカクテルを注入したイヌは、臨床的に臨床症状の任意の改善を評価するために等級付けしました。イヌを人道的に安楽死させた後、筋肉試料を採取し、凍結切片用に調製しました。 Aによって誘導されたジストロフィンタンパク質の半減期2ヶ月 - ONを約1であると考えられています。これらの実験は新生児の犬や古い犬(> 5歳)で行うことができますが、若い成犬は、本研究で使用しました。調製された筋肉切片を組織病 理学を評価し、ウェスタンブロッティングおよび免疫組織48を通してジストロフィンタンパク質の救助を評価しました。
PMO溶液の体積は、注射の前に正しいことを保証することが重要です。そうしないと、結果に大きな影響を持つことになります。筋肉内注射時には、十分な圧力が筋線維を入力する必要があります。犬の健康と手術部位の検査の監視、トラブルシューティングのために重要です。動物の健康を監視するには、毎週の血液検査と計量を行うべきです。動物および筋肉サンプルの調製の安楽死の後、ジストロフィンタンパク質を検出する感度を確保するための重要なステップは、トリス - 酢酸ゲル、半乾燥ブロッティング法の両方を使用することですウェスタンブロッティング手順中。
代表的な結果に示されるように、Ex6A、Ex6B、Ex8A、そしてカクテルで処理した筋芽細胞(Ex6A、Ex6B、Ex8A、およびEx8Bを含む)がインフレームDMDの製品を生産しました。 Ex8Bはないエクソンスキップされた製品を生産していないので、in vivo実験で 、後続に使用されませんでした。 DYS-2染色で9スキップ発生し、免疫細胞化学処理された試料に復元されたジストロフィン発現を示した - のcDNA配列決定は、6つのエキソンがあることを示しました。 AON処理された犬はジストロフィン陽性線維の有意な増加を示しました。 8スキップされ、短縮タンパク質が産生された - これは、エクソン6があることを示します。ジストロフィン陽性繊維の量は、AONのカクテルを使用したときに増加し、AONの用量に比例しました。イムノブロットは、全身モルホリノ処置したイヌにおけるジストロフィン発現の増加を示しました。骨格筋はジストロフィン繊維の可変レベルを有していました。しかし、モルホリノ処理された心臓組織は少しを示しましたジストロフィン発現の改善。ジストロフィンは、高分子量(427 kDaの)を有しているため、ジストロフィンの少量の検出は困難であり得ます。最良の結果を得るには、トリス - 酢酸ゲル、半乾式転写法を用いました。 HE染色は、モルホリノ処理されたイヌにおいて、改善された組織病理を示しました。中心部有核繊維(CNFの)不健康な筋肉の兆候であり、筋変性と再生のサイクルを表します。モルホリノ処置CXMD犬は、非処理CXMD犬と比較して、CNFの割合の減少を示しました。臨床グレーディングは、モルホリノ処置動物におけるこのような増加ウォーキングや実行能力のような症状の改善を、明らかにしました。筋肉の硬さは、したがって、それは格付けスキーム59に含まれていた、筋萎縮を反映すると考えられます。腿(後肢)の筋肉の硬さを評価しました。彼らはCXMDに肥大よりもむしろ萎縮を示す傾向があるので、しかし、我々は頭蓋縫工筋を除外しました。処理された犬は表示します低い等級のスコアを編と15メートル走行試験に速い時間を持っていました。 15メートルテストに改善された時間が改善された筋肉機能40を示しています。全体的により高い等級のスコアは、貧しい人々の健康と増加した筋萎縮を示しています。
これらの結果は有望であるが、マルチエクソンスキッピングは、まだ技術が臨床応用性を持って前に克服する必要があります多くの課題を提示します。心臓組織は依然としてによる心筋および骨格組織との間の細胞輸送の違いによる可能性が高い、AONの取り込みの減少が表示されます。毒性効果は、現在の投薬レジメン下の動物において観察されませんでした。 AONのカクテルの使用は、臨床試験へ移動する前にしかし、より多くの仕事は、長期の毒性を評価するために行われる必要があります。規制当局は、一意薬として各AONの配列を定義するので、AONカクテル薬の承認を得ることは困難です。これは、カクテル中の各シーケンスは、個別safetについて試験する必要があることを意味しますyは、より多くの時間とより多くのお金を必要とします。臨床の現場でのマルチエクソンスキッピングの使用に対する別の障壁は、未知の機能で生成された中間タンパク質生成物の大規模な量です。これらのタンパク質は、潜在的に、個々の突然変異22に応じて、予測できない副作用につながることができます。さらに、現在のジストロフィー犬のモデル内で利用可能な変異パターンが限られています。そこにいくつかの天然に存在する変異があり、すべての変異は、マルチエクソンスキッピングを研究するために有用ではありません。ジストロフィーのブタモデルは、将来のDMDエクソンは研究33、34をスキップするための良い代替であることを約束します。
DMDの犬のモデルは、他のDMDモデルの上にいくつかの利点を持っています。大きな動物モデル、臨床グレーディングおよびMRIであることは、より詳細な分析を可能にする、ことが可能です。犬は大型動物であるため、彼らはまた、毒性試験のために、より適しており、より密接にマウスモデルと比較して、ヒトの疾患を表します。犬メートルodelsはまた、ヒト23、34、45に類似しているDMD遺伝子配列を有します。
技術的に困難が、マルチエクソンスキッピングのアプローチは、最終的にはDMD患者24の> 90%に利益を得ることができます。単一エクソンスキッピングは、患者の小さなサブセットにのみ適用されるように、これは、その単一エクソンスキッピングへのより良い代替手段になります。また、マルチエクソンスキッピングを短縮ジストロフィン蛋白質の機能を最適化し、削除パターンを選択することが可能となります。例えば、DMDのエクソンの欠失45から55は、非常に軽度の症状または無症候性の個人14,19,60-63に関連付けられています。エクソン45のマルチエクソンスキッピング- 55はすでにVPMOS 22,26の全身注射を用いて、エクソン52の欠失(mdx52)とDMDのマウスモデルで実証されています。カクテルVPMOSの使用は、例えば、筋ジストロフィーの他の形態で実証されています福山先天性筋ジストロフィー(FCMD)など。 FCMDは、異常なmRNAスプライシングは、レトロトランスポゾンの挿入によって引き起こされたエクソントラッピングによって引き起こされます。 VPMOS両方FCMDマウスモデルおよびヒト細胞系64にスプライシングパターンをレスキューすることが示されています。高い有効性と低い毒性を発揮する次世代AON化学は臨床応用へのマルチエクソンスキッピングアプローチの効果的な翻訳を容易にするであろう。さらに、マルチエクソンスキッピングは、潜在的にそのようなdysferlinopathies 24、65のような他の遺伝性疾患に適用することができます。
開示事項
Open access fees for this article were provided by, Gene Tools, LLC.
謝辞
This work was supported by The University of Alberta Faculty of Medicine and Dentistry, The Friends of Garrett Cumming Research Chair Fund, HM Toupin Neurological Science Research Chair Fund, Muscular Dystrophy Canada, Canada Foundation for Innovation (CFI), Alberta Advanced Education and Technology (AET), Canadian Institutes of Health Research (CIHR), Jesse's Journey - The Foundation for Gene and Cell Therapy, and the Women and Children's Health Research Institute (WCHRI).
資料
| Name | Company | Catalog Number | Comments |
| 2'OMePS Transfection of Dog Myoblasts | |||
| 3 ml 6-well plates | IWAKI | 5816-006 | |
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 11965-092 | |
| Fetal bovine serum (FBS) | HyClone | SH30071.01 | |
| Penicillin | Sigma-Aldrich | P4333 | 200 U/ml |
| Lipofectin | Invitrogen | 18292-011 | Total volume of 100 ml in opti-MEM media at a ratio of 2:1 for lipofectin. 10 ml lipofectin for 5 mg RNA. |
| 2’OMePS | Eurogentec | Ex6A (GUU GAUUGUCGGACCCAGCUCAGG), Ex6B (ACCUAUGA CUGUGGAUGAGAGCGUU), and Ex8A (CUUCCUGG AUGGCUUCAAUGCUCAC). | |
| Horse Serum | Gibco | 16050-114 | 2% |
| streptomycin | Sigma-Aldrich | P4333 | 200 μg/ml |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418 | |
| Insulin | |||
| Morpholino transfection of dog myoblasts All material from MePS Transfection of Dog Myoblasts for culturing | |||
| Antisense morpholinos | Gene-tools | Ex6A(GTTGATTGTCGGACCCAGC TCAGG), Ex6B(ACCTATGACTGTGGATGAG AGCGTT), Ex8A(CTTCCTGGATGGCTTCAAT GCTCAC) Dilute to a final volume of 100 L in opti-MEM media. 120–200 mg/kg of morpholinos at 32 mg/ml in saline | |
| Endo-Porter | Gene-tools | ||
| guanidinium thiocyanate-phenol-chloroform | Invitrogen | 15596-018 | 1 ml/plate |
| RNA Extraction and Reverse Transcription Polymerase Chain Reaction (RT-PCR) | |||
| guanidinium thiocyanate-phenol-chloroform | Invitrogen | 15596-018 | 1 ml/plate |
| Chloroform | Sigma-Aldrich | P3803 | 200 μl |
| 1.5 ml Tubes | Eppendorf | 22363204 | |
| Centrifuge | Beckman-Coulter | ||
| 75% Ethanol | Sigma-Aldrich | 34852 | |
| UV Spectrometer | |||
| Forward primer in exon 5 | Invitrogen | CTGACTCTTGGTTTGATTTGGA 1.5 μl 10 μM | |
| Reverse primer in exon 10 | Invitrogen | TGCTTCGGTCTCTGTCAATG 1.5 μl 10 μM | |
| dNTPs | Clontech | 3040 | |
| One-Step RT-PCR kit | Qiagen | 210210 | |
| Thermo-cycler | Scinco | ||
| Complementary DNA (cDNA) Sequencing | |||
| Gel extraction kit | Qiagen | 28704 | |
| Centrifuge | |||
| Terminator v3.1 Cycle Sequencing Kit | Applied Biosystems | 4337454 | |
| Intramuscular injections or open muscle biopsy | |||
| Surgical Tools | Scissors, scalpel, needle, surgical thread | ||
| Vet Ointment | |||
| Iodophors | webtextiles | 12190-71-5 | |
| chlorohexidine | Peridex | 12134 | |
| Surgical Drapes | |||
| Scrubs | |||
| Facial Mask | |||
| Surgical Gloves | |||
| Head Covering | |||
| Thiopental sodium | Mitsubishi Tanabe Pharma | 20 mg/kg | |
| Isoflurane | Abbott laboratories | 05260-05 | 2-3% |
| Antisense morpholinos | Gene-tools | Ex6A(GTTGATTGTCGGACCCAGC TCAGG), Ex6B(ACCTATGACTGTGGATGAG AGCGTT), Ex8A(CTTCCTGGATGGCTTCAAT GCTCAC) Dilute to a final volume of 100 L in opti-MEM media. 120–200 mg/kg of morpholinos at 32 mg/ml in saline | |
| 27 G Needles | TERUMO | SG3-2325 | |
| 50 ml syringe | TERUMO | SG2-03L2225 | |
| buprenorphine hydrochloride | |||
| Tongue Depressor | |||
| cephalexin | 15 to 30 mg/kg | ||
| cefazolin | 15 to 30 mg/kg | ||
| buprenorphine | 0.01 mg/kg | ||
| buprenorphine hydrochloride | 0.02 mg/kg | ||
| Systemic Injections | |||
| Syringe infusion pump | Muromachi | ||
| 22 G Indwelling needles | TERUMO | SG3-2225 | |
| 27 G Needles | TERUMO | SG3-2325 | |
| 50 ml syringe | TERUMO | SG2-03L2225 | |
| Saline | Ohtsuka-Pharmaceutical | 28372 | |
| Clinical Grading of Dogs | |||
| Video Camera | |||
| Stop watch | |||
| Magnetic resonance imaging (MRI) | |||
| 3 Tesla MRI l | |||
| 18 cm diameter/18 cm length human extremity coil | |||
| Muscle sampling and preparation (necropsy) | |||
| Thiopental sodium | Mitsubishi Tanabe Pharma | 20 mg/kg | |
| Isoflurane | Abbott laboratories | 05260-05 | 2-3% |
| Tragacanth gum | 10-20 ml | ||
| Liquid Nitrogen | |||
| Cork Discs | Iwai-kagaku | 101412-806 | |
| Dry Ice | |||
| Tweezers | |||
| Poly-L-lysine–coated slides | Fisher | 22-037-216 | |
| Cryostat Microsystem | Leica | cm1900 | |
| Immunohistochemistry | |||
| DYS1 | Novocastra | NCL-DYS1 | 1:150 dilutions |
| DYS2 | Novocastra | NCL-DYS2 | 1:150 dilutions |
| Alexa 594 goat antimouse IgG1 | Invitrogen | A-21125 | 1:2,500 dilutions |
| Alexa 594 goat antimouse IgG2 | Invitrogen | A-11005 | 1:2,500 dilutions |
| DAPI | Invitrogen | D1306 | Contains mounting agent |
| Goat Serum | Invitrogen | 10000C | 15% |
| PBS | |||
| Moisture chamber | Scientific Devise Laboratory | 197-BL | |
| Chamber slide | Lab-tek | 154453 | |
| Cover Glasses | Fisher | 12-540A | |
| Hydrophobic barrier pen | |||
| Fluorescent microscope | 594 nm at 20X magnification. | ||
| Western Blotting | |||
| Distillied Water | |||
| Hand Homogenizer | |||
| 2× Laemmli SDS-loading buffer | 0.1 M Tris–HCl (pH 6.6), 2% (w/v) SDS, 2% (0.28 M) beta-mercaptoethanol, 20% glycerol, 0.01% bromophenol blue | ||
| SDS gels | Bio-Rad | 161-1210 | 5% resolving |
| SDS gels | Invitrogen | Invitrogen, WG1601BOX | 3-8% |
| PVDF membrane | GE | 10600021 | |
| Methanol | |||
| Running buffer (10×) | 250 mM of Tris-Base, 1,920 mM of Glycine | ||
| Running buffer (1×) | 10% 10× buffer, 20% methanol | ||
| 0.05% PBS/Tween 20 (PBST) | 2,000 ml 3× 200 ml for washing | ||
| PBST/5% milk powder | 100 ml | ||
| Protein Assay Kit | BCA | T9650 | |
| Tween 20 | Sigma | P5927 | |
| Urea | Sigma | U5378 | |
| Beta Mercaptoethanol | Millipore | ES-007-E | |
| SDS | Sigma | L3771 | |
| Tris-Acetate | Sigma | ||
| Tris HCl | Sigma | T3253 | |
| Glycerol | Sigma | G8773 | |
| Loading/sample buffer for Western blotting | NuPage Invitrogen | NP007 | |
| NaCl | Sigma | S3014 | |
| PMSF | Sigma | P7626 | |
| Protease cocktail inhibitor | Roche | 11836153001 | |
| Cathode Buffer | 0.025 M Tris base + 40 mM 6-aminocaproic acid + 20% Methanol | ||
| Anode Buffer | 0.03 M Tris Base + 20% Methanol | ||
| Concentred Anode Buffer | 0.3 M Tris base + 20% Methanol | ||
| desmin antibody | Abcam | ab8592 | |
| DYS1 | Novocastra | NCL-DYS1 | 1:150 dilutions |
| ImageJ Software | |||
参考文献
- Duchenne, A. The Pathology of Paralysis with Muscular Degeneration (Paralysie Myosclerotique), or Paralysis with Apparent Hypertrophy. Br Med J. 14 (2), 541-542 (1867).
- Zellweger, H., Antonik, A. Newborn screening for Duchenne muscular dystrophy. Pediatrics. 55 (1), 30-34 (1975).
- Echigoya, Y., Yokota, T. Skipping multiple exons of dystrophin transcripts using cocktail antisense oligonucleotides. Nucleic Acid Ther. 24, 57-68 (2014).
- Bushby, R. F., Birnkrant, D. J., et al. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and pharmacological and psychosocial management. The Lancet Neurology. 9 (1), 77-93 (2010).
- Eagle, M., Baudouin, S. V., Chandler, C., Giddings, D. R., Bullock, R., Bushby, K. Survival in Duchenne muscular dystrophy: improvements in life expectancy since 1967 and the impact of home nocturnal ventilation. Neuromuscul. Disord. 12 (10), 926-929 (2002).
- Heald, A., Anderson, L. V., Bushby, K. M., Shaw, P. J. Becker muscular dystrophy with onset after 60 years. Neurology. 44 (12), 2388-2390 (1994).
- Stöllberger, C., Finsterer, J. Worsening of heart failure in Becker muscular dystrophy after non-steroidal anti-inflammatory drugs. Med. J. 98 (4), 478-480 (2005).
- Passamano, L., et al. Improvement of survival in Duchenne Muscular Dystrophy: retrospective analysis of 835 patients. Acta Myol. 31 (2), 121-125 (2012).
- Hoffman, E. P., Brown, R. H., Kunkel, L. M. Dystrophin: the protein product of the Duchenne muscular dystrophy locus. Cell. 51 (6), 919-928 (1987).
- Koenig, M., et al. Complete cloning of the Duchenne muscular dystrophy (DMD) cDNA and preliminary genomic organization of the DMD gene in normal and affected individuals. Cell. 50 (3), 509-517 (1987).
- Takeshima, Y., et al. Mutation spectrum of the dystrophin gene in 442 Duchenne/Becker muscular dystrophy cases from one Japanese referral. JHG. 55 (6), 379-388 (2010).
- White, S. J., et al. Duplications in the DMD gene. Hum. Mutat. 27, 938-945 (2006).
- Yokota, T., Duddy, W., Echigoya, Y., Kolski, H. Exon skipping for nonsense mutations in Duchenne muscular dystrophy: too many mutations, too few patients. Expert Opin. Biol. Ther. 12 (9), 1141-1152 (2012).
- Yokota, T., Duddy, W., Partridge, T. Optimizing exon skipping therapies for DMD. Acta Myol. 26 (3), 179-184 (2007).
- Magri, F., et al. Genotype and phenotype characterization in a large dystrophinopathic cohort with extended follow-up. J Neurol. 258 (9), 1610-1623 (2011).
- Yoshida, H. H., Ishikawa-Sakurai, M. Biochemical evidence for association of dystrobrevin with the sarcoglycan- sarcospan complex as a basis for understanding sarcogly- canopathy. Hum. Mol. Genet. 9 (7), 1033-1040 (2000).
- Bies, R. D., Caskey, C. T., Fenwick, R. An intact cysteine-rich domain is required for dystrophin function. J. Clin. Invest. 90 (2), 666-672 (1992).
- Monaco, A. P., Bertelson, C. J., Liechti-Gallati, S., Moser, H., Kunkel, L. M. An explanation for the phenotypic differences between patients bearing partial deletions of the DMD locus. Genomics. 2 (1), 90-95 (1988).
- Aoki, Y., Yokota, T., Wood, M. J. Development of multiexon skipping antisense oligonucleotide therapy for Duchenne muscular dystrophy. Biomed Res Int. 2013 (402369), (2013).
- Cirak, V. A. -. G., Guglieri, M., et al. Exon skipping and dystrophin restoration in patients with Duchenne muscular dystrophy after systemic phosphorodiamidate morpholino oligomer treatment: an open-label, phase 2, dose-escalation study. The Lancet. 378 (9791), 595-605 (2011).
- Goemans, N. M., et al. Systemic administration of PRO051 in Duchenne's muscular dystrophy. N Engl J Med. 364 (16), 1513-1522 (2011).
- Echigoya, Y., et al. Long-term efficacy of systemic multiexon skipping targeting dystrophin exons 45-55 with a cocktail of vivo-morpholinos in mdx52 mice. Mol Ther Nucleic Acids. 4, (2015).
- Hoffman, E. P., et al. Restoring dystrophin expression in Duchenne muscular dystrophy muscle progress in exon skipping and stop codon read through. Am J Pathol. 179 (1), 12-22 (2011).
- Aartsma-Rus, A., et al. Antisense-induced multiexon skipping for Duchenne muscular dystrophy makes more sense. Am J Hum Genet. 74 (1), 83-92 (2004).
- Aartsma-Rus, A., Kaman, W. E., Weij, R., Tden Dunnen, J., van Ommen, G. J., van Deutekom, J. C. Exploring the frontiers of therapeutic exon skipping for Duchenne muscular dystrophy by double targeting within one or multiple exons. Mol. Ther. 14 (3), 401-407 (2006).
- Aoki, Y., et al. Bodywide skipping of exons 45-55 in dystrophic mdx52 mice by systemic antisense delivery. Proc Natl Acad Sci U S A. 109 (34), 13763-13768 (2012).
- McClorey, G., Iversen, P. L., Moulton , H. M., Fletcher, S., Wilton, S. D. Antisense oligonucleotide-induced exon skipping restores dystrophin expression in vitro in a canine model of DMD. Gene Ther. 13 (19), 1373-1381 (2006).
- Sharp, N. J., et al. An error in dystrophin mRNA processing in golden retriever muscular dystrophy, an animal homologue of Duchenne muscular dystrophy. Genomics. 13 (1), 115-121 (1992).
- Shimatsu, Y., et al. Canine X-linked muscular dystrophy in Japan (CXMDJ). Exp Anim. 52 (2), 93-97 (2003).
- Nguyen, F., Cherel, Y., Guigand, L., Goubault Leroux, I., Wyers, M. Muscle lesions associated with dystrophin deficiency in neonatal golden retriever puppies. J Comp Pathol. 126 (2-3), 100-108 (2002).
- Nakamura, A., Takeda, S. Mammalian models of Duchenne Muscular Dystrophy: pathological characteristics and therapeutic applications. J Biomed Biotechnol. 2011 (184393), (2011).
- Yokota, T., et al. A renaissance for anti-sense oligonucleotide drugs in neurology: Exon-skipping breaks new ground. Arch. Neurol. 66, 32-38 (2009).
- Aartsma-Rus, A., et al. Theoretic applicability of antisense-mediated exon skipping for Duchenne muscular dystrophy mutations. Hum. Mutat. 30 (3), 293-299 (2009).
- Yu, X., Bao, B., Echigoya, Y., Yokota, T. Dystrophin-deficient large animal models: translational research and exon skipping. Am. J. Transl. Res. 7 (8), 1214-1231 (2015).
- Yin, H., Moulton, H., Betts, C., Wood, M. CPP-directed oligonucleotide exon skipping in animal models of Duchenne muscular dystrophy. Methods Mol Biol. 683, 321-338 (2011).
- Moulton, H. M., Moulton, J. D. Morpholinos and their peptide conjugates: therapeutic promise and challenge for Duchenne muscular dystrophy. Biochim. Biophys. Acta. 1798 (12), 2296-2303 (2010).
- Morcos, P. A., Li, Y., Jiang, S. Vivo-Morpholinos: a non-peptide transporter delivers Morpholinos into a wide array of mouse tissues. BioTechniques. 45 (6), 613-614 (2008).
- Betts, C., et al. A New Generation of Peptide-oligonucleotide Conjugates With Improved Cardiac Exon Skipping Activity for DMD Treatment. Mol Ther Nucleic Acids. 14 (1), e38 (2012).
- Saito, T., et al. Antisense PMO found in dystrophic dog model was effective in cells from exon 7-deleted DMD patient. PLoS One. 5 (8), e12239 (2010).
- Yokota, T., et al. Efficacy of systemic morpholino exon-skipping in Duchenne dystrophy dogs. Ann Neurol. 65 (6), 667-676 (2009).
- Melacini, P., et al. Cardiac and respiratory involvement in advanced stage Duchenne muscular dystrophy. Neuromuscul. Disord. 6 (5), 367-376 (1996).
- Guncay, A., Yokota, T. Antisense oligonucleotide drugs for Duchenne muscular dystrophy: how far have we come and what does the future hold. Future Med. Chem. 7 (13), 1631-1635 (2015).
- Fairbrother, W. G., Yeh, R. F., Sharp, P. A., Burge, C. B. Predictive identification of exonic splicing enhancers in human genes. Science. 297, 1007-1013 (2002).
- Cartegni, L., Wang, J., Zhu, Z., Zhang, M. Q., Krainer, A. R. ESEfinder: A web resource to identify exonic splicing enhancers. Nucleic Acids Res. 31, 3568-3571 (2003).
- Yokota, T., Hoffman, E., Takeda, S. Antisense oligo-mediated multiple exon skipping in a dog model of duchenne muscular dystrophy. Methods Mol Biol. 709, 299-312 (2011).
- Jenuth, J. P. The NCBI. Publicly available tools and resources on the Web. Methods Mol Biol. 132, 301-312 (2000).
- Yokota, T., et al. Extensive and Prolonged Restoration of Dystrophin Expression with Vivo-Morpholino-Mediated Multiple Exon Skipping in Dystrophic Dogs. Nucleic Acid Ther. , (2012).
- Summerton, J. E. Endo-Porter: a novel reagent for safe, effective delivery of substances into cells. Ann. N. Y. Acad. Sci. 1058, 62-75 (2005).
- Mangram, A. J., et al. Guideline for Prevention of Surgical Site Infection. Am J Infect Control. 27, 97-134 (1999).
- Reichman, D. E., Greenberg, J. A. Reducing Surgical Site Infections. A Review . Rev Obstet Gynecol. 2, 212-221 (2009).
- Mizuno, H., Nakamura, A., Aoki, Y., Ito, N., Kishi, S., Yamamoto, K., Sekiguchi, M., Takeda, S., Hashido, K. Identification of muscle-specific microRNAs in serum of muscular dystrophy animal models: promising novel blood-based markers for muscular dystrophy. PloS one. 6, (2011).
- Shimatsu, Y., et al. Major clinical and histopathological characteristics of canine X-linked muscular dystrophy inJapan, CXMDJ. Acta Myol. , 145-154 (2005).
- Evans, H., de Lahunta, A. Guide to the Dissection of the Dog. SAUNDERS. , (2009).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41 (47), (2004).
- Bearer, E. L., et al. Overview of image analysis, image importing, and image processing using freeware. Current protocols in molecular biology. 14, (2003).
- Shimatsu, Y., et al. Major clinical and histopathological characteristics of canine X-linked muscular dystrophy inJapan, CXMDJ. Acta Myol. 24, 145-1454 (2005).
- Beroud, C., et al. Multiexon skipping leading to an artificial DMD protein lacking amino acids from exons 45 through 55 could rescue up to 63% of patients with Duchenne muscular dystrophy. Hum Mutat. 28, 196-202 (2007).
- Ferreiro, V., et al. Asymptomatic Becker muscular dystrophy in a family with a multiexon deletion. Muscle Nerve. 39, 239-243 (2009).
- Nakamura, A., et al. Follow-up of three patients with a large in-frame deletion of exons 45-55 in the Duchenne muscular dystrophy (DMD) gene. J Clin Neurosci. 15, 757-763 (2008).
- Yokota, T., Pistilli, E., Duddy, W., Nagaraju, K. Potential of oligonucleotide-mediated exon-skipping therapy for Duchenne muscular dystrophy. Expert Opin Biol Ther. 7, 831-842 (2007).
- Taniguchi-Ikeda, M., et al. Pathogenic exon-trapping by SVA retrotransposon and rescue in Fukuyama muscular dystrophy. Nature. 478, 127-131 (2011).
- Lee, J. J., Yokota, T. Antisense therapy in neurology. J Pers Med. 3, 144-176 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved