Method Article
の嗅球にカルシウム変化をモニタリングを通じて温度によって誘発される神経活動を記録
* これらの著者は同等に貢献しました
要約
Here we describe a protocol for measuring and analyzing temperature responses in the olfactory bulb of Xenopus laevis. Olfactory receptor neurons and mitral cells are differentially stained, after which calcium changes are recorded, reflecting a sensitivity of some neural networks in the bulb to temperature drops induced at the nose.
要約
The olfactory system, specialized in the detection, integration and processing of chemical molecules is likely the most thoroughly studied sensory system. However, there is piling evidence that olfaction is not solely limited to chemical sensitivity, but also includes temperature sensitivity. Premetamorphic Xenopus laevis are translucent animals, with protruding nasal cavities deprived of the cribriform plate separating the nose and the olfactory bulb. These characteristics make them well suited for studying olfaction, and particularly thermosensitivity. The present article describes the complete procedure for measuring temperature responses in the olfactory bulb of X. laevis larvae. Firstly, the electroporation of olfactory receptor neurons (ORNs) is performed with spectrally distinct dyes loaded into the nasal cavities in order to stain their axon terminals in the bulbar neuropil. The differential staining between left and right receptor neurons serves to identify the γ-glomerulus as the only structure innervated by contralateral presynaptic afferents. Secondly, the electroporation is combined with focal bolus loading in the olfactory bulb in order to stain mitral cells and their dendrites. The 3D brain volume is then scanned under line-illumination microscopy for the acquisition of fast calcium imaging data while small temperature drops are induced at the olfactory epithelium. Lastly, the post-acquisition analysis allows the morphological reconstruction of the thermosensitive network comprising the γ-glomerulus and its innervating mitral cells, based on specific temperature-induced Ca2+ traces. Using chemical odorants as stimuli in addition to temperature jumps enables the comparison between thermosensitive and chemosensitive networks in the olfactory bulb.
概要
Over the last years, temperature sensitivity has no longer been described as a somesthetic sense only, but also as a physiological function relevant for the olfactory system. In rodents, the main olfactory bulb receives input from the Grueneberg ganglion (GG), an organ in the nasal cavity, consisting of thermosensitive neurons. GG neurons respond to cool temperatures1 as well as to chemical stimuli, and their chemosensitivity is modulated by temperature fluctuations2. These observations suggest that the olfactory bulb may integrate chemical and temperature information collected at the nose. In order to explore this hypothesis, we present here a set of experiments enabling the detection of temperature responses in the olfactory bulb of non-transgenic animals, using the Xenopus laevis larva as a model. The organization of the olfactory system in these animals closely resembles that of mammals. The olfactory receptor neurons of premetamorphic X. laevis terminate in tufts, and make synaptic contacts with the dendrites of second-order neurons, the mitral cells. Pre- and postsynaptic fibers intermingle and form skein-like neuropil structures called glomeruli3. The abundant synapses of the glomerular layer represent the first processing center of olfactory information. Mitral cells further integrate the sensory input and convey it to higher olfactory areas.
We have developed a protocol combining electroporation of olfactory receptor neurons (ORNs) with calcium-sensitive and non-sensitive dyes followed by bolus loading of the postsynaptic network of glomeruli and mitral cells. The staining by electroporation of two spectrally distinct dyes loaded in the nasal cavities serves to single out the γ-glomerulus3 through its bilateral innervation by ORNs from both olfactory epithelia. Thus, the location of the γ-glomerulus is identified prior to further measurements. Subsequently, bolus loading4 with Fluo-8 acetoxymethyl (Fluo-8 AM) is carried out in a volume comprising the γ-glomerulus. Imaging calcium changes with fast confocal microscopy allows the visualization of temperature responses in the 3D neuropil surrounding the γ-glomerulus, a unique temperature-sensitive glomerulus in this system5. Mitral cells innervating this specific structure can also be identified by their Ca2+ signals responsive to induced temperature drops. Next, activity correlation imaging6 uses the specific Ca2+ traces of these cells to reveal the dendritic morphology of thermosensitive mitral cells. Alternating repeated applications of cold Ringer solution and chemical odorants in one measurement can be used to visualize the mitral cell networks for odor and temperature processing surrounding the γ-glomerulus and identify potential overlaps. To unambiguously assign the responses to either the chemical or the temperature stimulus, we constantly monitor temperature at the olfactory epithelium.
プロトコル
アフリカツメガエルのオタマジャクシを持つすべての実験は、動物実験における倫理のゲッティンゲン大学委員会によって承認されたガイドラインに従って行いました。
1.エレクトロポ
- Nieuwkoopとフェーバー7に記載のステージ49-54の動物を選択してください。
- 記録のセットアップが大きな作動距離と、少なくとも2ヘルツの周波数で20ミリ秒のために20 Vの電圧パルスを印加することができるエレクトロポレーション装置を用いて実体顕微鏡で構成されていることを確認します。それらは損傷を引き起こすことなく、オタマジャクシ '鼻孔に挿入することができるように、200μmの粗い粒径を有する2つの白金電極を介して電圧パルスを印加します。
- デキストラン共役染料の結晶を準備します( 例えば、カルシウムグリーン10kDaのデキストラン、またはアレクサフルオロ647 10kDaのデキストラン)の小滴を蒸留水約100μl中の5mg通常、配信量を溶解し、せることによってパラフィルムのシート上の乾燥2μlの。
注:結晶が1日も経たないうちに乾燥し、年以上の期間、冷凍庫で-18℃、その後保存することができます。 - それが低下し、心拍数、すべての動きの損失および機械的刺激に対する応答の欠如によって特徴づけられる外科麻酔状態に達するまで、1~2分間、3%トリカインメタンスルホン酸を含有する水道水でそれらを配置することによって動物を麻酔。
- 純粋な水道水で10秒間麻酔動物を浸します。
- ゲルクッションの上に動物を置き、それを損なうことなく、その周りに針を置くことによってそれを修正。
注:その皮膚を通して針を突っついによって、動物を固定しないでください。 - 優しく組織と鼻の穴の周囲を乾燥させます。
- 実体顕微鏡下で動物を置き、鼻孔に焦点を当てます。
- wは、鼻孔の穴に一致する大きさの染料結晶を選ぶ鼻腔の1にそれを置き、それが完全に溶解するまで待つように鉗子を使用して、HICHは1分未満を取ります。結晶が小さい場合は、非半透明の高濃縮溶液を生成するまで、各キャビティ内に2または3を加えます。
- オタマジャクシの皮膚や鼻の穴の1つに陽極上に陰極を配置します。
注:この特定の設定は、ステップ1.3で引用された染料に適用されます。異なる極性の染料は、染色結果は、鼻孔にカソードを配置することによって改善することができます。染料の極性がわからない場合は、両方の電極は、鼻孔(鼻孔あたり1)で同時に配置することができ、かつ極性は、単一の電圧パルス間で交互に。 - 刺激間隔の約0.5秒で20 V、20ミリ秒の6個のパルスを適用します。
注:小さな気泡は、電極が皮膚と鼻孔内の溶液と接触していることを条件とするエレクトロポレーション中に鼻孔に電極の周囲に表示されます。気泡が表示されていない場合は接続ケーブルを確認し、必ず電気穿孔のdevicを作りますeは所望の電圧パルスを提供しています。 - 第二の鼻孔のための手順(1.9から1.11)を繰り返します。
- 室温で水道水で満たしたビーカー中にエレクトロオタマジャクシを転送します。動物が意識を取り戻し、その水泳を再開するまで5〜10分待ちます。それをフィードし、それは色素が嗅球に嗅神経に沿って搬送される間に、少なくとも1日で回復しましょう。
- 最良の撮像結果のためのエレクトロポレーション1-7日以内にエレクトロポレーションし、動物を使用してください。撮影前に、色素の輸送と回復のために少なくとも24時間の時間を与えます。
2.全体のマウントの準備
- すべての動きが停止していないと、それはもはや機械的刺激に応答するまで3%トリカインメタンスルホン酸を含む水道水で動物を麻酔。
- 実体顕微鏡下でゲルクッションにオタマジャクシを移し、FOの各側面に皮膚を通して針を突っついてそれをしっかりと固定しますrebrain。
- その脊髄を切断することによってオタマジャクシを生け贄に捧げます。
- 鼻腔、嗅神経および嗅球( 図1A)の両方を含む組織のブロックを分析するメスを使用してください。近い左の鼻孔-なしit-と終脳、間脳境界線まで左嗅神経と球根と一緒に切断前方刃を動かすに触れることへの最初の切開を行います。右側にも同様に行います。終脳に最終的なカット後部を行うことで、神経系の残りの部分から準備を分離します。
- オタマジャクシの体を処分し、脳の準備の腹側を上に向くように慎重に逆さまに組織ブロックを反転。
- 嗅神経の間に2本の針を挿入することにより、再び組織ブロックをピン。
- カエルリンゲル液の滴を入れて(98 mMのNaClを、2のKCl、1mMのCaCl 2を、2のMgCl 2、5 mMグルコース、5 mMのピルビン酸ナトリウム、10mMのpHを7.8に調整HEPES、osmola組織上の230オスモル/ Lのリティ)。
- 細かいハサミを使用して、3つの切開を行うことで、軸索のソートゾーンをカバーする髄膜および嗅球を削除します。電球への嗅覚神経の入口点(軸索仕分けゾーン)まで左嗅球に沿ってcaudorostrally密接にカットし、組織ブロックの後縁から出発。
- 右半球のための手順を繰り返し2.8。
- ピンセットで髄膜を上げ、軸索仕分けゾーンで以前のものに垂直に、第三のカットを行います。
注:嗅球の腹側は、イメージングおよびボーラスロード用アクセスできるようになりました。 - 透過光像の画質を向上させるために、背側の手順を繰り返します。これらの追加の手順は、ボーラスロード用のマイクロピペットのナビゲーションを容易にするが、厳密には必要ではないことができます。
- さらに処理およびイメージングのためにカエルリンガーで満たされた記録チャンバーにサンプルを転送します。 sのメイク腹側が上向きとナイロン繊維のネットでサンプルを確保していることUREは小さなプラチナフレームの上に張ら。
- 刺激のより容易なアプリケーションのためのナイロン繊維の1の上に鼻腔を置きます。
3.ボーラスのロード
- AM色素の原液を調製する(w / v)のプルロニックF-127の20%を含有するジメチルスルホキシド(DMSO)20μlにカルシウムAM色素( 例えば、フルオ8 AM)を50μgを溶解します。 1-2μlの容量の小さなアリコートで原液をフリーズします。ストック溶液は、少なくとも半年間安定であるが、凍結融解サイクルを避けます。
- マイクロピペットプラーを使用して、5-8MΩの抵抗及び1-2ミクロンの先端径でピペットを引き出します。
- 250〜500μMの濃度でカエルリンゲル液中の色素の準備原液を溶解させます。
- 多剤耐性トランスポーターをブロックするために、500μMの濃度に達するようにMK571を追加します。
- 細長いピペットチップを用いて、10μlの溶液でマイクロピペットを記入し、マイクロピペットをフリックして、すべての気泡を除去。
- ピペットホルダーにマイクロピペットをマウントし、圧力が注射器または空気圧薬剤吐出装置を手動で適用され、ゲージで適用される圧力を監視することができることを確認してください。
- 可能であればマイクロピペットチップからの流出を可視化し、調整することができるように、注入された色素を励起する能力を備えた顕微鏡のセットアップを使用しています。理想的には、共焦点イメージングのセットアップを使用しています。組織はマイクロピペットで到達することができるように浸対物レンズと正立顕微鏡を使用してください。
- 顕微鏡下で全体のマウントの準備を置き、電球まで嗅神経に従うと、嗅球への関心の領域に焦点を当てます。
- 準備の生存率を増加させ、色素の漏れを洗い流すために記録チャンバーを介して新鮮なリンゲル液を灌流マイクロピペットチップから。
- 先端は準備の吻側方向に向くよう、嗅球の表面上にピペットを下げます。
- ピペットの目詰まりを防止し、静かに組織に挿入するためにマイクロピペットに小さく、一定の正圧(〜25ヘクトパスカル)を適用します。
- ピペットは外側の組織層を突破した後、僧帽細胞層に吻側-背側方向に動かします。 (エレクトロポレーションによる嗅覚受容ニューロンの対比染色は、マイクロピペットの位置を調整することが有用であることに注意してください。)理想的には、所望の記録サイト50から100ミクロンの距離でピペットチップを配置します。
- 温度感受性γ-糸球体を染色するために、γ-糸球体のシナプス前神経網の位置から約50μm吻方エリアをターゲットにしています。
- 100-200ヘクトパスカルの範囲内で正圧を適用します。の大きさに応じた圧力の強さを調整しますマイクロピペットチップ。圧力が初めて適用されbrightlight照明下で目に見えるわずかな組織の動きを監視することによりピペットからの流出を確認してください。
- マイクロピペットは、組織のまま約10分間一定の圧力を維持します。可能であれば成功した負荷が時間の経過とともに強度の増加に伴って目に見える細胞細胞体の染色になりますように、蛍光灯照明下でセルの負荷のため、その間に神経網を確認してください。
注:多くの場合、失敗したロードのための理由は、先端または凝集色素クラスタに入る組織にピペットの目詰まりです。静かに記録チャンバーの下面に対してその先端を破壊することにより、ピペットを救出することが可能な場合があります。しかし、ピペットチップは、数マイクロメートルを超えてはなりません。ボーラスロード中に低い圧力を加えることによって、より大きなピペット開口部を補います。 - 荷重の10分後、ゼロにかかる圧力を低減し、染色を確認してください。
注意:染色された領域のサイズが大幅に変動し、注入した色素、吐出部位の位置の量のようないくつかのパラメータに依存します。良い染色は、約100μm×100μmでの領域をカバーしています。 - 染色された面積が小さすぎる、または所望の記録部位をカバーしていない場合は、繰り返しは3.10から3.13までを繰り返します。それがまだ詰まっていない場合、次の注射のために同じマイクロピペットを使用してください。
- 色素取り込みおよび脱エステル化を可能にするために、任意の実験を開始する前に、最後の注射後少なくとも30分待ちます。常に新鮮なリンゲル液で記録チャンバーを灌流し続けます。
4.計測設定
- 測定のセットアップは、3次元ボリュームを記録するために十分な速度を持つ共焦点顕微鏡で構成されていることを確認します。スタックごとに少なくとも1ヘルツの取得レートを選択します。
注:適当なセットアップがpでサンプルラインワイズの代わりにポイントをスキャンする例のライン照明顕微鏡が挙げられますOINT。このようなセットアップの簡単な実現は、以前に6に記載されています。その他のオプションは、ディスク顕微鏡を回転しています。そのような設定が利用可能でない場合は、通常のポイントスキャンセットアップをより小さい面積を測定することは可能です。 - 糸球体のサイズに合わせて十分に大きい容量をカバーすることができるように測定パラメータを設定します。
注:記録容量の典型的な厚さは、少なくとも5層によって覆われるべきである20μmの範囲です。 - 漂白のためにすべてのシナプス前の測定値を確認してください。記録された画像の平均蛍光強度は、記録の時間経過にわたって低下しないまで、レーザーパワーを調整します。
- 20〜30秒の漂白を超える測定のために発生する可能性が高いですが、できるだけ多くの漂白を避けるために、シナプス後側の記録のための測定時間と面積を制限します。
5.臭気アプリケーションおよび温度実験
- 25を注ぎます50mlチューブ中の新鮮なリンゲル液のミリリットル(以前は4℃で保存)。アイスバケットにチューブを置きます。
- チューブ内に温度計のきれいなプローブを挿入することにより、冷却されたリンガーの温度を監視します。温度は、実験を開始する前に、1°Cを下回るまで待ちます。
- 10μMの濃度でリンゲル液に溶解したL-ヒスチジンの50ミリリットルを準備します。
- チャンバー内の水の流れが刺激ソリューションのリリース時に一定かつ中断されないままであるように同時に灌流リンガーに漏斗アプリケーター8または刺激の配信を可能にする同様のアプリケーション・システムを使用してください。遠位出口が離れて嗅上皮から1mm未満になるように漏斗を配置します。
- 上皮とファンネルアプリケータの出口に近いデジタル温度計に接続されているのNiCr-Ni系の温度センサを配置します。記録し、視覚的に投するコンピュータへのワイヤ温度計の出力ポート小さな温度変動を反映した電圧変化を演じます。
- 実験を開始する前に、電圧 - 温度スケールファクタを確立するために、標準温度計に別のサーモセンサーを接続します。
- 記録チャンバー内浴温度を調査し、それが22℃を超えないようにしてください。
- 画像の取得を開始し、順次、20〜30秒の刺激間隔で電子ピペットを用いて冷たいリンゲル、L-ヒスチジンおよび室温リンガー(20-22℃)での200から400μLを適用します。刺激アプリケーションのより良い制御のために、可能な場合は、ピペットに選ばれたイメージングセットアップによって送信されたトリガ信号に刺激をリリース。再現性のある結果のためのアプリケーションプロトコルを繰り返します。
- 彼らは活動の相関イメージングとイメージング後の分析のために好適であるので、刺激のいくつかのラウンドで長い録音のセットを取ります。
注意:録画時間とスライスの生存率との間の妥協が持っています発見されます。 6刺激アプリケーションをカバーする約 2分の測定は、ネットワークの良い復興のための十分な活性を提供します。
6.画像処理を使用して、アクティビティに相関イメージング(ACI)
- プレシナプスレコーディングの画像処理
- 冷たいリンゲル液およびヒスチジンによる刺激とのレコーディングでは、それらの異なる応答プロファイル(Kludt ら 5を参照)によって、隣接するヒスチジンに敏感な糸球体からの温度感受性γ-神経網を区別する。
- ORN類は、γ-糸球体の二国間の神経支配を視覚化するために、2つの異なる色素でエレクトロポレーションされた脳の準備の記録から軸方向に最大値投影を作成します。
- 活動の相関イメージングを使用したポストシナプスレコーディングの画像処理(ACI)
- 十分な時間点での録音を選択します(10以上0フレーム)と活動のまともな量(少なくとも二つの事象)。
注:活動は、単一の僧帽細胞の過程を明らかに自発的または嗅覚刺激により活性化細胞ネットワークを明らかにするために、同じ記録中に刺激のいくつかのアプリケーションによって誘導されるいずれかであることができます。 - 測定された構造は、記録の時間経過にわたってこれ以上2-3よりもピクセルずつ移動どこの録音を選択してください。
注:あまりにも多くの動きとのレコーディングはKludt らシフト補正手順を適用することによって救出することができます5。 - 録音は漂白に苦しむかどうかを確認してください。画像全体の平均強度は、記録の時間経過にわたって低下した場合、漂白補正が必要であり、そうでない場合は次の2つのステップをスキップします。
- 線形回帰を実行することにより、各画素の時間トレースのための線形トレンドを計算します。
- リニアcomponenを排除するために、個別に各画素からの結果を減算漂白のトン。
注:BaOおよびシルド9で説明したように代替ルジャンドルフィッティングを用いることができます。 - Junek らによって記載されているように活動相関イメージングのためのステップバイステップガイド(ACI)と一緒にすぐに使用できるMATLABスクリプトをダウンロードしてください。6
注:提供MATLABスクリプトを使用する代わりに、Junek ら 6に記載されている手順に従ってください。 - データ評価のために使用されるシステムのMATLABパスにダウンロードしたコンテナからファイル「aci.m '、' matVis.m 'と' aci_roiSelector.m 'を移動します。
- xとyは横方向の寸法は、Z軸方向とt、時間経過を参照すると、[X、Y、Z、T] -マトリックスとして編成MATLABのユーザーのワークスペースに変数としてステップ5.8で取得した生データを読み込み。
- MATLABコマンドラインから「ACI」を呼び出します。
- ユーザインタフェース(UI)でその後、これが表示され、「データの準備」を選択し、結果を保存するには、データとディレクトリを含む変数を選択します。
注:UIの詳細については、マニュアルに伴うACIスクリプトを参照してください。 - 表示された分散マップの概要を取得するためにUIに対応するスライダーを動かすことによって測定したZ-層をスクロールします。
- UIに関心領域(ROI)のサイズを入力します。僧帽細胞体のために横方向及び軸方向に5μmので10μm程度にまたがるROIを調整します。糸球体の場合は、横方向に20μmから10μmのわずかに高い値が軸方向に適切です。
注:ROIのサイズは、記録のために選択された画素のスケーリングに依存する画素数として入力されなければなりません。 - CENTE上にマウスの中ボタンでクリックすることにより、周囲の僧帽細胞の各可視ソーマのためのγ-糸球体および追加の領域を含むROIを選択セル/糸球体のR。
- すべての参照トレースの相関マップの計算をトリガーメインUIを閉じます。結果は自動的に保存されて表示されます。
- 十分な時間点での録音を選択します(10以上0フレーム)と活動のまともな量(少なくとも二つの事象)。
結果
嗅覚受容ニューロン(ORN類)のエレクトロポレーションは、アクティブな軸索輸送を介して、順行性標識のためのデキストランの分子と結合したアレクサフルオロ色素やカルシウム指標で達成されました。前者染料は電球の糸球体層で分岐感覚ニューロンおよびその軸索末端の明るい染色を提供するが、後者は、これらの細胞における神経活動の測定を可能にする( 図1及び2)。まず、感熱γ-糸球体とその神経支配パターンの位置が左右の嗅覚上皮、( 図1A)にアレクサフルオロ647デキストランおよびアレクサフルオロ546デキストランをエレクトロポレーションにより可視化しました。手続き後の二十四時間、鼻孔内のORN類は、2嗅神経と両半球における糸球体は、蛍光顕微鏡下で見ることができました。異なる糸球体クラスタはidentifiaましたそれぞれの立場によってBLE、γ-糸球体( 図1B)を含む、特に小規模なクラスタ。反対側の嗅覚繊維の小さな数は前交連を渡り、同側γ-糸球体( 図2A)に終了し、反対側の嗅球を駆け抜けました。
γ-糸球体のシナプス前繊維のカルシウム応答を記録するために、カルシウムグリーンデキストランは同じ手順に従って、ORN類に電気穿孔しました。負の温度ジャンプを氷冷リンゲル液の制御放出を介して鼻孔に誘導された(0-1°C)。 γ-糸球体を含む3Dボリュームは、高速のライン照明の共焦点顕微鏡で画像化しました。 -1°CΔTsがはΔF/ FのCa 2+トレースで可逆的なピークとして、γ-糸球体とその求心性神経で冷たい応答を誘発するのに十分に認識した( 図2B </ strong>の、C)。
さらに、実験の手順は、そのramifying樹状終末を経由してγ-糸球体に接続僧帽細胞に低温で誘導される活性を測定するために行きました。これらのシナプス後の繊維とその周辺の神経網を効果的に、カルシウム感受性色素のFluo-8 AMのボーラス負荷によって染色されたアレクサ647デキストランは、ORN類( 図3A、B)にエレクトロポレーションされていた数日後に行われました。二回以下のパラダイムに従って僧帽細胞は、フルオ8 AMを充填した、と嗅上皮を刺激した:冷たいリンガー、ヒスチジン(10μM)と室温リンガーは、続いて適用されます。二つの基準トレースは、記録されたボリューム内の関心領域からの1つだけヒスチジン温度低下、他の1つに排他的に応答を採取しました。アクティビティ相関イメージング(ACI)6は、選択した基準に基づいて計算しました。高コントラストで温度やヒスチジン応答性のCa 2+シグナル( 図3C、D)のいずれかに対応するシナプス後のネットワークの樹状形態を可視化するためのトレース。最後に、感熱性及び化学感受性マップを色分けし、温度および化学的情報は嗅覚二次ニューロン( 図3E)に個々の糸球体から搬送される様子を示し、互いの上に重ね。共有嗅覚ネットワークの情報の両方のタイプの統合及び処理の説明については、Kludt ら5参照
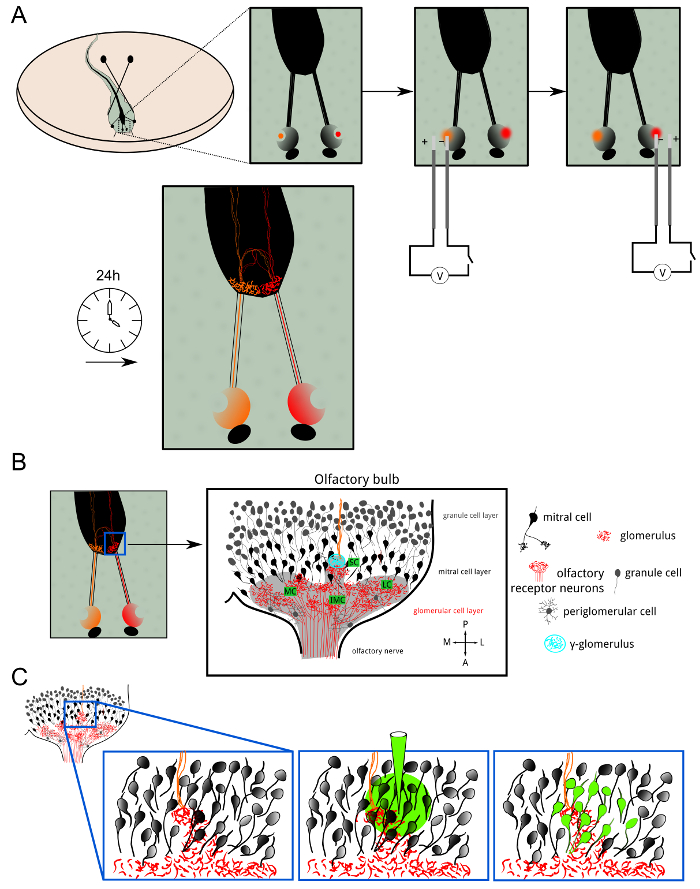
図1:ORNのエレクトロポレーションおよびボーラスロードの概要 (A)は、Xの両方の鼻腔内の嗅覚受容ニューロン。 ツメガエル幼生は、Alexa色素またはcalciuでエレクトロポレーションしましたデキストラン分子に結合されたメートル感受性色素。蛍光指示薬は、端末軸索樹枝状分岐まで順行性輸送されました。 24時間エレクトロポレーション後、両半球における糸球体層は、蛍光染色を示しました。 (B)1半球における嗅球の細胞組織の模式図。 、内側の小、中、横クラスター:糸球体層は、クラスタ内の電球にまたがります。嗅覚情報は、糸球体における興奮性シナプスを介して、僧帽細胞に受容ニューロンから転送されます。糸球体周辺細胞と顆粒細胞は、嗅覚処理と符号化を調節する抑制性ニューロンです。 γ-糸球体(シアン)を容易に同側(赤)と反対側(オレンジ)嗅覚繊維が合併小さな神経網として同定されました。 (C)ボーラスの負荷は、主に僧帽細胞とそのdendriからなるシナプス後神経網を染色するためにγ-糸球体付近で達成されました糸球体層にかなりの分岐チック木。 この図の拡大版をご覧になるにはこちらをクリックしてください。
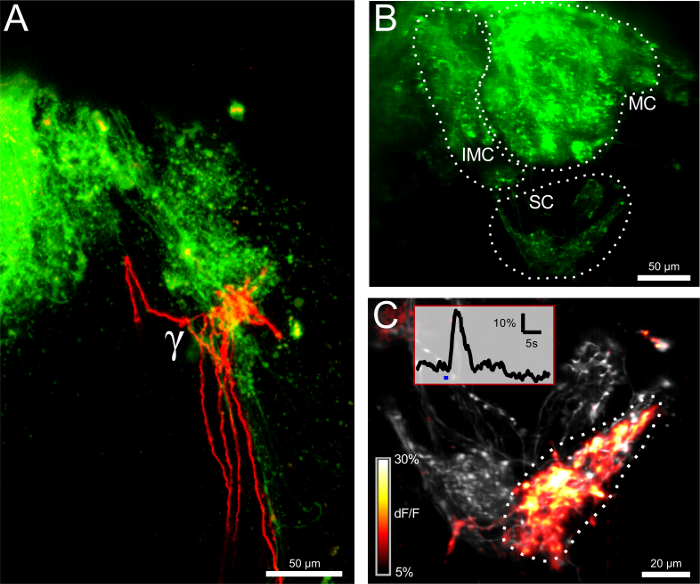
図2:ORN類のエレクトロポレーションは、構造的および機能的接続性を明らかにし 、同側(緑)によるγ-糸球体の(A)二国間の神経支配と反対側(赤)嗅覚受容ニューロン(ORN類)。 =50μmのスケールバー。 (B)カルシウム感受性色素カルシウムグリーンデキストランとのエレクトロポレーション後の嗅球。 intermedial(IMC)、内側(MC)と小さなクラスタ(SC)が表示されます。画像は、厚さ100μmの測定体積の最大投影です。 =50μmのスケールバー。 (C)小さなクラスタのクローズアップビュー。記録容量(12μm)があります最大投影で表現。画像は、オーバーレイとしてグレーと色分けされたΔF/ Fマップ内の基底蛍光レベルを示しています。冷リンゲル液での刺激に対する最大応答がプロットされています。隣接する二つの糸球体は黙秘しながら、γ-糸球体は強く反応しました。挿入図は、関心の示された領域に対応するγ-糸球体のためのΔF/ Fトレースを示しています。青いバーは、刺激のアプリケーションを表します。スケールバー=20μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
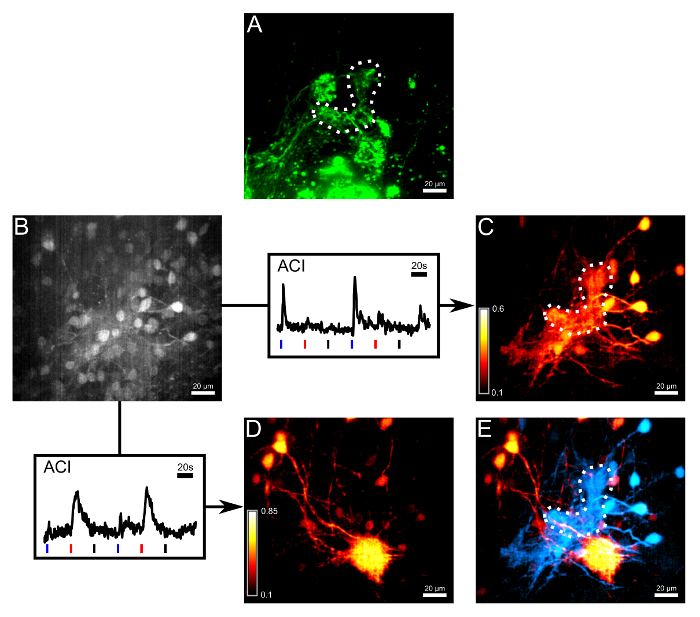
図3:小規模なクラスタで終端ORN類のボーラスロードとACIは、感熱および化学感受性のネットワークを解離 (A)軸索は、非カルチでエレクトロポレーションにより染色しましたええと感受性色素アレクサ647デキストラン。点線は、γ-糸球体の概要を説明します。カルシウム感受性色素のFluo-8 AMとボーラスロード後の第2の測定チャネルにおける(B)(A)と同じ領域の画像。一部の僧帽細胞の細胞体が見られたが、これに対しては限定的でした。矢印以下、2つの応答トレースが活性相関画像(ACI)のために使用された、プロットしました。ブルー、トレース以下の赤と黒のバーは、それぞれの冷リンガー、ヒスチジン(10μM)と室温リンガーなどのネガティブコントロールのアプリケーションの開始を示しています。 2のCa 2+トレースが測定した体積の関心の異なる領域から採取しました。 (C)(B)中の微量のACI結果冷たいリンガーに主に応答する領域を強調表示します。 (D)ヒスチジンに主に応答する(B)ハイライト領域における微量のACI結果。 2 ACIマップの(E)オーバーレイ。 hに応答する僧帽細胞istidineと神経支配糸球体(赤)は感熱僧帽細胞およびγ-糸球体(シアン)から容易に識別可能でした。この図のすべての画像は28ミクロン厚のボリュームの最大強度の投影です。スケールバー=20μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
本明細書に提示される方法は、 アフリカツメガエルの嗅球に記録温度処理を目指すオタマジャクシをアフリカツメガエル 。第一プロトコル汚れや嗅球における二次ニューロンとは、嗅覚系は、主に無傷のままであるサンプル調製物を提供します。従って、温度感受性γ-糸球体の活性化をモニターし、その化学感受性隣接糸球体と比較することができます。この糸球体のユニークな二国間の神経支配は、スペクトルの異なる色素で細胞エレクトロポレーションにより可視化されます。また、ボーラスローディングは嗅球内の大ボリュームにまたがる僧帽細胞の染色を可能にします。神経回路網の処理温度によって誘起される信号は、反復刺激アプリケーションでカルシウム測定を行うと、その後の活性相関イメージングを使用してデータを分析することによって明らかにされます。
プロトコルは、2つの洗練された染色proceを強調します満足と再現性のある結果を達成するために慎重な操作と実践を必要とどちらもデュレス、。エレクトロポレーションの間に、動物の任意の損傷は、鼻孔に電極を配置する場合は特に、避けなければなりません。最適には、嗅上皮との接触は発生しません。動物は依然としてエレクトロポレーション手順の後に住んでいると、その回復時間が考慮されなければならないことに注意してください。染色は、使用される染料の種類に応じて発生することができるエレクトロポレーションの一巡後弱すぎるままである場合、その強度は、鼻孔内の色素濃度を増加させることによって高めることができます。デキストラン結合分子は(1-2 MM / 10日目の速度で)遅い軸索輸送と受動拡散を含むいくつかのメカニズムを介して輸送されているので、別の代替は、動物を犠牲にする前に、エレクトロポレーション後48時間を待つことです。あるいは、エレクトロポレーションは、回復の1日後に繰り返してもよいです。
jove_content ">ボーラスローディング色素の量は、僧帽細胞に入るので、重要なステップは、制御が困難であり、ピペットチップのサイズとアプリケーションの位置など様々なパラメータに依存する。共焦点蛍光顕微鏡下で手順の監視をするために有用であることがわかります染料適用の持続時間を調整するので、製剤にわたって同様の染色結果を生成する。また、以前にエレクトロオタマジャクシは、(γ-糸球体を含む)小クラスターの位置を特定することにより、色素のアプリケーションに最適な位置を決定するために使用されるべきである。最も測定中の重要なステップは、サンプルのシフト及び退色の両方を回避することである。シフト注意深く顕微鏡下リンガーフローを配置することによって回避することができる。関心領域の漂白を制限するように、測定時間が重要に低減されるべきです。カルシウム感受性色素を持つボーラスローディング染色は非常に提供します健康な細胞は一般的に低カルシウムレベルを有し、したがって、弱い基底蛍光を示すので、限られたコントラスト。活動の相関イメージングを適用すると、同様のカルシウムシグナルとの活動やハイライトの構造に基づいて、コントラストを生成することにより、この制限を回避します。このポスト取込み分析法は、3Dボリューム内で選択された関心領域(基準トレース)、各個々のピクセルのカルシウム信号との間の相関係数を算出します。したがって、強く得られた結果は、基準トレースとして選択された活動パターンに依存しています。主な焦点は、僧帽細胞の神経支配のパターンを可視化する場合、自発的神経活動に由来する基準信号が好ましく、最も活発な僧帽細胞を選択することが最良の結果を生成します。僧帽細胞の化学療法または感熱ネットワークを明らかにするために、唯一のヒスチジンまたは冷たいリンゲルのいずれかへの応答を含む参照トレースを選択する必要があります。全体糸球体oの選択rを関心領域として僧帽細胞体は、常に2つの異なる刺激に応答する構造が互いの上に横たわっている場合は特に、明確な基準トレースを提供することはできません。このような場合には、関心領域として糸球体または細胞体のより小さな領域を選択することがしばしば有用です。
過去数十年間では、エレクトロポレーションは、単一または複数のセル11,12を染色するための効率的な方法として記載されています。ここでは、特に嗅覚受容体ニューロンを標識するために使用されます。デキストランコンジュゲート分子は、最高の効率を与え、非カルシウム感受性色素のために、選択の範囲が広く、一般的に蛍光顕微鏡13で使用される完全なスペクトルをカバーしています。まだ市販されている場合は、成功した嗅覚受容ニューロンにエレクトロポレーションされているカルシウム感受性色素は、カルシウムグリーンデキストランに限定された瞬間にある、とのFluo-4デキストラン。また、録音は主にsuperficiaをターゲット唯一の嗅球の腹面にL層、高速測定技術の侵入深さが限られているからです。二光子イメージングは、部分的にこの制限を克服するが、多くの場合、速度を欠き、さらに選択可能なカルシウム感受性色素の量を制限することができます。
ここで嗅球における温度誘導活性を測定するためのプロトコルを記載しています。脳の神経網は、温度の嗅覚処理に関与する複雑な細胞ネットワークを可視化するために、3次元ボリュームとしてスキャンされます。嗅球で温度誘導活性を測定することは非常に最近5を報告し、異なる技術を組み合わせ、特にカスタマイズされた手順を必要とされています。上記の技術の主要な資産は、細胞の数百人が嗅覚系のほとんどが無傷のまま準備に3次元で画像化されていることです。これらの利点は、高い染色技術への要求だけでなく、脳pを置きます償いとイメージング。例えば、セルのエレクトロポレーションおよびボーラスロードは、嗅上皮および球で細胞を大量にヒットし、したがって完全な携帯電話ネットワークの可視化を可能にします。また、代わりに遺伝的にコード化された蛍光体のボーラスロードを介した化学指標の配信は、種の潜在的に大規模なセットでの測定を可能にします。 AM色素とバスのインキュベーションのような他の選択肢は、主に無傷組織のわずか数百マイクロメートルを残し、深刻な嗅球を損傷スライスで働いています。 γ-糸球体の二国間の神経支配は無傷のままと録音は、このように、まだ手術システムに取り込まれることを比較して、我々のプロトコルで使用されるホールマウントの準備は、例えば、保証されます。最後に、撮影自体は、3Dボリュームの取得を可能とするライン照明顕微鏡によって行われます。ライン照明顕微鏡は、可能な限り最高の取得率6を提供する共焦点技術の一つです</ SUP>嗅球の大部分をカバーするために必要です。遅い取得システムが使用されるが、記録されたボリュームのサイズを小さくしなければならないという欠点を有していてもよいです。近年、高速な画像取得のための他の方法が開発されており、代替14,15として使用することができます。それにもかかわらず、ライン照明顕微鏡は、十分な速度と分解能の両方を獲得するための最も簡単な方法の一つです。ここでは、適切な画像のセットアップを選択するためのガイドラインとして、いくつかの情報を、次の。カルシウムイメージングが厚い脳の調製物からの内で行われているので、セットアップはまともな共焦点を提供すべきであると目的は、1.0以上の開口数を持つ必要があります。基準点のために、ライン照明顕微鏡で撮影した記録は0.5-1軽やかユニットのピンホールサイズの標準的なレーザ走査型顕微鏡で撮影した画像に相当します。高速取得速度が望ましいです。厚さ20μmの体積は、少なくとも5リットルで覆われてエアーズ、100ミクロン×100ミクロンの側方視野と0.5μm以下のピクセルサイズは、スタックあたり1ヘルツの最低速度でスキャンする必要があります。共焦点性を低減することが数えた光子の量を増加させ、必要に応じてこのように高速取得を可能にするが、より焦点外の光を記録するという欠点を有することができます。このようなアプローチは、光学切片の厚さを増加させるので、それは実際にACI 6の適用後に別のz平面を介して樹状突起の追跡を容易にすることができます。
広く嗅球ネットワークに温度処理を研究するために必要なツールは、本明細書で提示されています。温度誘発性の活性は、カルシウム感受性色素との信号到着およびγ-糸球体から逸脱することの両方を介して第1および第2次ニューロンに記録されています。さらに、個々の僧帽細胞は、化学的および温度情報の両方を評価することができるプロセスれる程度。準備LEAので、無傷の嗅球VES、嗅覚処理における二国間の神経支配の役割をさらに研究することができます。手順は、嗅覚ネットワーク5を重ねて符号化されているかどうか、およびどのように熱電とchemoinformation明らかにするのに便利です。最後に、上記の技術は、嗅球における温度応答の研究に限定されないが、大きな三次元ボリュームにおける嗅覚系、特に細胞処理ネットワークのより一般的な評価のために適用することができます。ボーラスロードと活動の相関イメージングは、異なる脳のネットワーク16にそれらを適用すること、ニューロンの数十の活動を観察し、比較するための強力なツールです。
開示事項
The authors have nothing to disclose.
謝辞
This project was funded by the DFG Excellence Cluster 171, the Center for Nanoscale Microscopy and Molecular Physiology of the Brain, the Bernstein Center for Computational Neuroscience and the ENC-Network, an Erasmus Mundus Joint Doctoral Program. The authors thank Stephan Junek, Mihai Alevra and Guobin Bao for providing MATLAB codes and custom-written programs for image evaluation and data analysis.
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Sodium chloride | Merck Millipore | 1064040500 | |
| Potassium chloride | Merck Millipore | 1049360250 | |
| Calcium chloride dihydrate | Merck Millipore | 1023820250 | |
| Magnesium chloride hexahydrate | Merck Millipore | 1058330250 | |
| D(+)-Glucose | Merck Millipore | 1083371000 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| HEPES | Merck Millipore | 1101100250 | |
| Calcium Green 10 kDa Dextran | Thermo Fisher Scientific | C-3713 | |
| Dextran, Alexa Fluor 647 | Thermo Fisher Scientific | D-22914 | |
| Dextran, Alexa Fluor 546 | Thermo Fisher Scientific | D-22911 | |
| Fluo-8 AM | TEFlabs | 203 | |
| MK571 | Alexis Biochemicals | 340-021-M005 | |
| MS-222 | Sigma-Aldrich | E10521 | |
| Pluronic acid F-127 | Sigma-Aldrich | P2443 | powder |
| L-Histidine monohydrochloride monohydrate | Sigma-Aldrich | 53370 | |
| DMSO | Merck Millipore | 1029522500 | |
| Equipment | |||
| Electronic pipette | BrandTech | HandyStep Electronic Repeating Pipette | |
| NiCr-Ni thermocouple | Greisinger Elektronik | GTF 300 | |
| Micropipette puller | Narishige | Model PC-10 | two-step puller |
| Funnel applicator | (Custom-made) | ||
| Line-illumination microscope | (Custom-made) | otherwise, a commercially available spinning disk microscope | |
| Objective W Plan-Apochromat 63X/1.0 | Zeiss | 441470-9900-000 | |
| Objective W Plan-Apochromat 40X/1.0 DIC | Zeiss | 441452-9900-000 | |
| Software | |||
| MATLAB | The MathWorks | from R2010b upwards |
参考文献
- Mamasuew, K., Breer, H., Fleischer, J. Grueneberg ganglion neurons respond to cool ambient temperatures. Eur J Neurosci. 28 (9), 1775-1785 (2008).
- Brechbühl, J., Moine, F., Broillet, M. -C. Mouse Grueneberg ganglion neurons share molecular and functional features with C. elegans amphid neurons. Front. Behav. Neurosci. 7 (193), (2013).
- Gaudin, A., Gascuel, J. 3D atlas describing the ontogenic evolution of the primary olfactory projections in the olfactory bulb of Xenopus laevis. J Comp Neurol. 489 (4), 403-424 (2005).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc Natl Acad Sci U S A. 100 (12), 7319-7324 (2003).
- Kludt, E., Okom, C., Brinkmann, A., Schild, D. Integrating temperature with odor processing in the olfactory bulb. J Neurosci. 35 (20), 7892-7902 (2015).
- Junek, S., Chen, T. W., Alevra, M., Schild, D. Activity correlation imaging: visualizing function and structure of neuronal populations. Biophys J. 96 (9), 3801-3809 (2009).
- Nieuwkoop, P. D., Faber, J. Normal Table of Xenopus laevis. , Garland Publishing Inc. New York. (1994).
- Schild, D. A computer-controlled device for the application of odors to aquatic animals. J Electrophysiol Tec. 12 (2), 71-79 (1985).
- Bao, G., Schild, D. Fast and Accurate Fitting and Filtering of Noisy Exponentials in Legendre Space. PLoSONE. 9 (3), (2014).
- Terasaki, M., Schmidek, A., Galbraith, J. A., Gallant, P. E., Reese, T. S. Transport of cytoskeletal elements in the squid giant axon. Proc Natl Acad Sci U S A. 92 (25), 11500-11503 (1995).
- Haas, K., Sin, W. C., Javaherian, A., Li, Z., Cline, H. T. Single-Cell Electroporationfor Gene Transfer In Vivo. Neuron. 29 (3), 583-591 (2001).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo-from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Lechleiter, J. D. Chemical Calcium Indicators. Methods. 46 (3), 143-151 (2008).
- Salome, R., et al. Ultrafast random-access scanning in two-photon microscopy using acousto-optic deflectors. J Neurosci Methods. 154 (1), 161-174 (2006).
- Keller, P. J., Ahrens, M. B., Freeman, J. Light-sheet imaging for systems neuroscience. Nature Methods. 12 (1), 27-29 (2015).
- Hjorth, J. J., et al. Detection of silent cells, synchronization and modulatory activity in developing cellular networks. Dev Neurobiol. , (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved