Method Article
マウスC1498細胞株およびその関連白血病マウスモデルを特徴付けるための詳細なプロトコル
要約
この原稿は、in vitroおよびその注射後にマウスにおいて誘導される急性白血病に C1498細胞培養物を特徴付けるために使用することができる技術的手順を提供します。表現型および機能的分析は、フローサイトメトリー、免疫蛍光顕微鏡法、細胞化学およびメイグリュンワルドギムザ染色を使用して実行されます。
要約
1941これらの注射は、急性白血病の発症をもたらすので、同系またはジェニックマウスへのC1498細胞の静脈内注射が行われています。しかし、この病気の性質は、文献に十分に文書化されていません。ここでは、 インビトロでの C1498細胞を特徴付けるためのin vivoで誘導される白血病の性質を決定するための技術的なプロトコルを提供します。この手順の最初の部分は、造血系および培養C1498細胞の分化段階を決定することに焦点を当てています。これを達成するために、マルチパラメトリックフローサイトメトリー染色は、造血細胞マーカーを検出するために使用されます。免疫蛍光顕微鏡法、細胞化学およびメイグリュンワルドギムザ染色は、その後、それぞれ、ミエロペルオキシダーゼの発現、エステラーゼおよび細胞形態の活性を評価するために行われます。このプロトコルの第2の部分は、 内に誘導される白血病疾患を記述するに専用されています生体内。後者は、血液中の白血病および内在細胞の頻度を決定することによって達成造血器官( 例えば 、骨髄および脾臓)および非リンパ組織( 例えば 、肝臓および肺)特異的染色を使用してフローサイトメトリー分析を流すことができます。白血病の性質は、その後、骨髄中の特定のエステラーゼのためのメイ・グリュンワルドギムザ染色および染色を用いて確認されます。ここでは、年齢をマッチさせたC1498-とPBSを注射したマウスでは、このプロトコルを用いて得られた結果を示します。
概要
急性骨髄性白血病(AML)は、成熟の異なる段階でブロックされた造血骨髄細胞の制御されない増殖を特徴とします。この調節不全は、顆粒球、単球、赤血球またはmegaryocytic分化経路1に影響を与えることができます。 AML細胞は、血小板減少、リンパ球減少症および貧血になる造血障害につながる、骨髄に蓄積します。白血病細胞は、血液および非リンパ系器官に侵入します。
C1498マウスモデルは、文献には、血液中に侵入を記述するがん細胞が1941年に白血病10ヶ月齢のC57BL / 6(H-2 b)の雌性マウスから単離されたので、急性白血病のためのモデルとして何十年も使用されてきました増殖性の高いC1498細胞による、造血器官( 例えば 、脾臓およびリンパ節)および非造血器官( 例えば 、肝臓、肺、卵巣、及び腎臓)それらが中を経由して注入した後に感受性マウス2-4にtravenous、皮下または腹腔内経路。しかし、このマウスモデルは、2,5顆粒球または骨髄のいずれか6白血病を誘発することが報告されました。より最近では、2002年に発表された研究は、マウスNKT細胞白血病7などの癌のこのタイプを記載しました。このように、文献はこのC1498細胞株の性質と、それは、マウスにおいて誘導関連白血病に関する異なります。 70年代 - これらの矛盾は、詳細の欠如および細胞に関する更新公開されている情報と多くの研究は、1950年に行われたため、一般的には白血病疾患が主な原因です。
ここでは、C1498細胞を特徴付けるし、マウスにそれらの静脈内注射によって誘発される白血病疾患の性質を分析する方法を説明するための詳細なプロトコルを提供します。このプロトコルの最初のセクションは、 インビトロで培養されたC1498細胞の説明に捧げられています。蛍光抗表面および細胞内の造血マーカーに対して指向体は、フローサイトメトリーを用いてそれらの表現型を決定するために使用しました。ミエロペルオキシダーゼの存在は、免疫蛍光顕微鏡を用いて評価し、その造血系及び分化段階はエステラーゼの活性を評価するために細胞化学を用いて評価し、メイグリュンワルドギムザ染色を行いました。 C1498細胞は、その後マウスに注射し、そして誘導された急性白血病の疾患は、この原稿の第二の部分に記載されています。同様の技術は、周波数および骨髄中の白血病および固有細胞、末梢血、脾臓および非造血器官(肝臓、肺)の表現型を決定するために使用しました。
このプロトコルは、非常に再現性があり、ここで提示されたデータは、研究者が新たな治療戦略の効果を評価するのに役立ちます。この白血病のマウスモデルは、すでに免疫療法に近づく試験するために使用されていますND異なる癌化学療法薬8,9。それらの有効性は、腫瘍負荷と生存率の変化を決定することによって評価しました。このプロトコルは、治療中の白血病および他の造血細胞集団の分布と生存についての追加情報を提供するために使用することができます。
プロトコル
動物のハウジングと、すべての実験手順は、地元の動物保護倫理委員会、CEEA.NPDC(契約no.512012)によって承認された、そしてすべての実験は、実験動物の管理と使用に関するフランスおよび欧州のガイドラインに従って行われました。
C1498細胞株のインビトロ特徴1.
- C1498細胞の体外培養において、
- 準備完全RPMI(ロズウェルパーク記念研究所()を100μg/ mlで)-streptomycinウシ胎児血清(FBS)を50 mlのペニシリン5mlの(100 U / ml)を添加することにより1640培地、50mMの500μlのβメルカプトエタノールRPMI培地500mlに、5 N-2-ヒドロキシエチルピペラジン-N-2-エタンスルホン酸(HEPES)mlの非必須アミノ酸の5 mlのピルビン酸ナトリウムを5mL。
- 完全RPMIでC1498細胞株を成長させます。ピペッティングにより懸濁液中の細胞を採取し、50mlチューブに細胞を移します。 10分間、350×gで遠心分離し、そしてsupernaを削除タント。
- 、リン酸緩衝生理食塩水(PBS)20mlの(1×)溶液を添加し、10分間350×gで遠心分離し、上清を除去します。
- 10蛍光活性化細胞選別装置(FACS)緩衝液のミリリットル(ウシ血清アルブミン(BSA)粉末2.5gおよび2 PBS溶液500ml中の0.5Mエチレンジアミン四酢酸(EDTA)溶液のml)に細胞を再懸濁。トリパンブルーで細胞を染色した後、トーマ細胞計数チャンバーを用いて細胞を数えます。
- 免疫染色を用いて、C1498細胞株の表現型の特徴とフローサイトメトリー分析
- 細胞表面染色
- FACS緩衝液を準備します。
- 10 7細胞/ mlにFACS緩衝液中に回収した細胞を調整し、チューブ、フローサイトメトリーに各染色実験について(100μl中)10 6個の細胞を分注します。
- FACS緩衝液中に希釈し、以下の抗体またはそれらに関連するアイソタイプ対照、100μlの細胞を標識:
- 形前駆体および分化した細胞のarkers、抗CD11b /抗CD18を有する細胞(1)、抗LY-6G(1)、抗CD19、抗B220(2)標識抗NK1.1、抗CD49b、抗CD4(1)、抗CD8(2)、抗CD3(3)、抗CD21 / 35、抗CD115および抗TCRVβ抗体。
- 造血幹/前駆細胞のマーカーのための、抗CD34 /抗CD117 /抗SCA-1、抗CD150 /抗CD117 /抗SCA-1、抗CD117 /抗CD127または抗の組み合わせを使用単独でCD16 / 32-ビオチン抗体。
- 細胞機能( 例えば 、接着、抗原の提示、共刺激分子および受容体)のマーカーについて、抗CD18(2)/抗のCD11a、抗MHCクラスI、抗MHCクラスIIで細胞を染色し、抗CD31、抗CD44、抗CD80ビオチン、抗CD86および抗CD274抗体。
- 4℃で30分間、フローサイトメトリー管の全てをインキュベートします。
- 各チューブに5分間、350×gで遠心分離をFACS緩衝液の2ミリリットルを追加することによって、細胞を2回洗浄し、上清を除去します。
- 各チューブにFACS緩衝液100μlのを追加し、ビオチン化標識抗体に(1/200の最終希釈のためにFACS緩衝液中1/100)蛍光ストレプトアビジン100μlを加えることにより、二次染色に進みます。 4℃で30分間チューブをインキュベートします。
- 次のように細胞を2回洗浄:5分間350×gで、各チューブに遠心管をFACS緩衝液の2ミリリットルを追加し、ピペッティングにより上清を除去します。
- 冷PBSの500μlの細胞を再懸濁し、氷上で細胞を配置し、チューブを覆うようにアルミホイルを用いて暗所でそれらを維持します。サイトメーター10を使用して結果を分析します。
- 細胞内染色
- PBS溶液375 mlの4%パラホルムアルデヒド(PFA)溶液125mlのを追加することによって、固定バッファを準備します。
注:換気フード内で撹拌プレート上で約60℃に4%PFAの500ミリリットル、熱PBS溶液400ミリリットルを準備します。 PFA粉末20グラムを追加し、pHを上げますPFAを溶解するまで。ソリューションは、冷却、pHを6.9にし、PBSで500ミリリットルにボリュームを構成することを許可します。 - PBS溶液500mlにサポニンを0.5g及びBSAを0.5gを添加することによって浸透化緩衝液を調製します。
- 10 7細胞/ mlにFACS緩衝液中に回収した細胞を調整し、フローサイトメトリーチューブに各染色実験のために細胞(100μl)を、10 6を配布します。 5分間、350×gで細胞を遠心分離し、上清を除去します。
- 1%PFA溶液200μlで細胞を固定し、4℃で10分間インキュベートします。
- 5分間、350×gで、各チューブに遠心管を透過性の緩衝液2ミリリットルを加え、ピペッティングにより上清を除去します。各チューブにバッファーを透過性の100μLを加えます。
- 抗CD3(2)/抗CD8(1)、抗CD3(3)/ A:バッファを透過性にそれらを希釈した後、以下の抗体またはそれらの対応するアイソタイプ対照、100μlの細胞を標識NTI-CD4(2)、抗CD107bおよび抗CD3(3)/抗TCRVβ。
- 4℃で30分間細胞をインキュベートします。
- 各チューブにバッファーを透過性の2ミリリットルを追加することによって、細胞を2回洗浄します。 5分間、350×gでチューブを遠心分離し、上清を除去します。
- 細胞にバッファを透過性の100μLを加えます。ビオチン化標識抗体にバッファを透過性に希釈した蛍光ストレプトアビジン100μlを加えることにより、二次染色に進みます。 4℃で30分間チューブをインキュベートします。
- 、各チューブにバッファーを透過性の2ミリリットルを加え、5分間350×gでチューブを遠心し、上清を除去します。この手順をもう一度繰り返します。
- 冷PBS500μlの細胞を再懸濁し、その後、暗所で細胞を氷上に置きます。 10フローサイトメーターを使用して結果を分析します。
- PBS溶液375 mlの4%パラホルムアルデヒド(PFA)溶液125mlのを追加することによって、固定バッファを準備します。
- 細胞表面染色
- 顕微鏡用スライド上の細胞懸濁液の調製
- ヘクタールのウォッシュ10 6冷のFACS 5mlで(ステップ1.1.4)で得られたrvested C1498細胞を緩衝液で2回、及び冷FACS緩衝液1ml中に細胞を希釈します。氷の上にチューブを入れます。
- 場所は、事前に取り付けられたフィルターカードと使い捨て室に挿入し、細胞遠心にこれらを配置します。
- 各チャンバやフィルタカードにFACS緩衝液100μlのを追加し、4.52×gで2分間、それらをスピン。
- 各チャンバやフィルタカードに細胞100μlを追加し、2分間、4.52×gで細胞をスピン。
- 注意深くミエロペルオキシダーゼ(ステップ1.4)、エステラーゼ(ステップ1.5)またはメイグリュンワルドギムザ(ステップ1.6)でそれらを染色する前に、チャンバ及び空気乾燥スライドからスライドを削除します。
- 免疫蛍光のためのミエロペルオキシダーゼ染色
- 冷メタノール中でスライドを浸漬することにより、スライド上の細胞を修正:アセトン(1:1)で2分間解決してから、スライドを空気乾燥させます。
- CIを描き、細胞を含有するスライドの領域に液体を閉じ込めるために、撥水性ペンを用いて細胞の周りrcle。
- 10分間冷PBS溶液200μlで細胞を洗浄します。
- 正常ロバ血清を10μlおよび精製された抗CD16 / 32抗体を10μg/ mlを含む3%BSA / PBS緩衝液200μlで細胞をブロックします。
- (3%BSA / PBS緩衝液中に20μg/ mlに希釈した)抗マウスミエロペルオキシダーゼの200μLを適用します。湿度チャンバー内で4℃で細胞O / Nインキュベートします。
- 冷たい0.1%BSA / PBS200μlで細胞を洗浄。
- 3%BSA / PBS緩衝液中で1/250に希釈した抗ヤギIgG抗体200μLを適用します。湿度室で室温で2時間、細胞をインキュベートします。
- 冷たいPBSで2回、0.1%BSA / PBS緩衝液200μlで細胞を3回洗浄し、。
- RTで2分間(を1μg/ mLの最終濃度まで)PBS中で1 / 1,000希釈ヘキスト200μlで細胞核を染色します。
- 水でスライドを洗浄しmountin前に空気乾燥にそれらを許可しますグラム。細胞に培地1を取り付けるの1滴を適用し、スライド上にカバーガラスの一方の端を置き、慎重にピンセットを用いて細胞にそれを下げます。任意の気泡を除去するためのカバーガラス上にそっと押します。
- エステラーゼ細胞化学
注:RTに事前に暖かいすべての試薬。- 固定液の準備
- クエン酸 - アセトン - ホルムアルデヒド(CAF)溶液を調製し、ガラスボトルにクエン酸塩溶液の2.5ミリリットル、6.5アセトンミリリットル、37%ホルムアルデヒドの0.8ミリリットルを追加します。穏やかに混合し、4℃で保存します。
- ナフトールAS-Dクロロ酢酸エステラーゼ(CAE)活性アッセイ
- 37°Cに温かい脱イオン水。
- 50mlのチューブにおいて、色素溶液1mlに亜硝酸ナトリウム溶液1mlを加えます。穏やかに混合し、2分間放置しました。追加予熱した脱イオン水40ml、5のpH 6.3緩衝液濃縮物mlのナフトールAS-Dクロロ酢酸溶液1ml。混合し、コプリンジャーに移します。
- 上に細胞を固定スライド(ステップ1.5.1.1を参照)CAF溶液で30秒間(1.3節を参照)、および脱イオン水で45秒間スライドを洗います。
- ステップ1.5.2.2で調製した溶液中にスライドを転送し、そして光から保護し、湿度チャンバ内で37℃で30分間スライドをインキュベートします。
- スライドを乾燥させた後、2分間脱イオン水に浸漬を介してそれらをすすぎます。
- ヘマトキシリン溶液の数滴を添加し、1分間それをインキュベートすることによって細胞を対比染色。
- 中性の水(pHが7)でスライドを洗浄し、空気乾燥にそれらを可能にします。細胞に媒体2を搭載するの一滴を適用し、スライド上にカバーガラスの一方の端を置き、慎重にピンセットを用いて細胞にそれを下げます。任意の気泡を除去するためのカバーガラス上にそっと押します。
- アルファナフチル酪酸エステラーゼ(NBE)活性アッセイ
- 使用前に37℃にウォームαナフチル酪酸ソリューション。
- ナトリウムNITの1錠を希釈イオン交換水6.25ミリリットルで儀式。
- 50mlのチューブに、亜硝酸ナトリウム錠剤溶液1.5mlおよびパラローザニリン溶液1.5mlを加えます。穏やかに混合し、溶液を5分間放置します。リン酸緩衝液40mLで溶液を補います。慎重に10NのNaOHを滴下してpHを6にもたらします。 、αナフチルブチレート溶液5mlを加え、全溶液を混合し、コプリンジャーにそれを転送します。
- RTでCAF液を用いて10秒間スライド上に細胞を固定し、脱イオン水で45秒間すすぎます。
- 転送は、ステップ1.5.3.2で調製し、光から保護しながら、加湿チャンバー内で37℃で1時間一緒にインキュベートされた溶液を含むコプリンジャーにスライドします。
- 中性の水(pHは7)と空気乾燥で2分間スライドを洗浄します。
- スライド上に数滴を添加することにより、メチレンブルー溶液で細胞を対比染色し、4分間インキュベートします。
- deioにスライドを浸し2分間水をデバイスと空気乾燥にそれらを可能にします。 、スライドをマウントする細胞に媒体2を搭載するの一滴を適用するには、スライド上にカバーガラスの一方の端を置き、慎重にピンセットを用いて細胞にそれを下げます。任意の気泡を除去するためのカバーガラス上にそっと押します。
- 固定液の準備
- メイグリュンワルドギムザ(MGG)染色
- 3分間のメイグリュンワルド液の入ったコプリンジャーにスライドを浸漬することにより、(セクション1.3で調製した)細胞を染色。
- 1分間のpH 6.8の緩衝液を含むコプリンジャーにスライドを転送します。
- 10分間(pH6.8の緩衝液中で1/20に希釈した)ギムザR溶液を含むコプリンジャーにそれらを配置することによりスライドを染色します。 10秒間の中性水(pHが7)でスライドを洗浄します。
- 排出し、スライドを空気乾燥させます。細胞への実装媒体2の1滴を適用することによって、スライドをマウントします。スライド上にカバーガラスの一方の端を置き、慎重にそれを下げますピンセットを用いて細胞へ。任意の気泡を除去するためのカバーガラス上にそっと押します。
急性白血病のインビボでの開発と特性2.
注:4週齢の雌コンジェニックC57BL / 6J-Ly5.1マウスは(無菌環境で、すなわち )は、特定の病原体を含まない条件下で維持しました。彼らは5〜6週齢であったときのマウスを注入しました。
- C1498細胞と静脈内注射
- ピペッティングにより懸濁液中で培養したC1498細胞を収穫。 10分間、350×gで50 mLのチューブと遠心分離機に細胞を移します。二回冷PBS 10mlに細胞を洗浄し、PBS中で10 7細胞/ mlの細胞懸濁液を調製します。注射を行う前に、氷上で細胞懸濁液を置きます。
- 制止にマウスを置き、層流フード内で無菌条件下で注入を行います。
- 細胞を注入するために注射器で29G針を使用します尾静脈。遠位端に尾を持ち、70%エタノールに浸したガーゼスポンジでそれを消毒します。シリンジ内に気泡がないことを確認するために確認してから、ゆっくりと尾静脈にC1498細胞懸濁液100μl(10 6細胞)を注入します。
- 注入後、尾から針を取り外し、注射部位での滅菌ガーゼスポンジで圧力を加えることによって、任意の出血を制御します。そのケージに動物を返し、そして慎重に次の時間と日にわたってその状態をチェック。
- 眼窩採血
- 白血病疾患の徴候のために、PBSおよびC1498-注射したマウス( 例えば 、立毛、グループからの単離、および減少またはケージ内の無運動)の挙動を監視します。
注:細胞が注入された後、これは通常17〜19日の間に発生します。 - ただ安楽死の前に眼窩採血を行い、層流で滅菌条件下で(ステップ2.2.7を参照してください)フードと加熱ランプの下では、低体温を防止します。
- 麻酔のために、10mg / kgの150ミリグラム/ kgおよびキシラジンでケタミンを使用します。 PBS溶液の18ミリリットルにキシラジンのケタミンの1.5ミリリットルと0.5ミリリットルを希釈することにより、麻酔液を準備します。
- 制御および白血病マウスを麻酔。 26G針を用いてマウスの10グラムあたりの麻酔薬溶液200μlを腹腔内注射し、1 mlシリンジに進みます。麻酔を確認するために、ペダル反射の消失を確認してください。
- 目の内側眼角にキャピラリーチューブを挿入します。血液は、毛細管に眼窩洞から上昇します。静かに滅菌ガーゼスポンジで眼に圧力を加えることによって出血を制御します。
注:血液の100から200マイクロリットルの容積が、この技術を用いて収集することができます。 - EDTAチューブに血液を採取し、単核細胞を単離する前に、サンプルを氷上で保存します。
- 頸椎脱臼を使用して、マウスを安楽死させると、臓器(セクション2.3)を単離するために進んでください。
- 白血病疾患の徴候のために、PBSおよびC1498-注射したマウス( 例えば 、立毛、グループからの単離、および減少またはケージ内の無運動)の挙動を監視します。
- 臓器や細胞の単離
- 臓器の分離
- プラスチック基板上の背面に安楽死させたマウスを置き、臓器の分離を容易にするために、動物の足を固定するために針を使用しています。切開を行う前に70%エタノールを用いてマウスを消毒します。
- 無菌のはさみを使用して、首に腹部の皮膚から腹側切開を行います。肝臓へのアクセスに腹壁を通してカット。胸郭と肺にアクセスするためのダイアフラムを介してカット。側に腸を移動し、滅菌したハサミやピンセットを用いて脾臓を除去します。
- 骨髄を単離するために、滅菌したハサミを使用して、関節上記大腿骨の上部で足を切りました。軽く引っ張ることにより、大腿骨から脛骨を取り外し、ピンセットやハサミを使用して、骨から皮膚や筋肉を取り除きます。
- 冷PBSを含む50 mlチューブに各臓器や骨を置き、氷の上に置きます。
- 臓器からの細胞の単離
- 細胞を破壊する前に、脾臓を量ります。機械的に50ミリリットルチューブにシリンジプランジャーを用いて、70μmのストレーナを介してそれらを押すことにより、脾臓、肺と肝臓を乱し、冷PBSの30ミリリットルに細胞を集めます。
- 、骨髄細胞を収集し、氷上でペトリ皿に大腿骨と脛骨を入れて、無菌のはさみを使用して四肢を切断し、冷PBSの5ミリリットルを含む10 mlシリンジに取り付けた26G針を挿入することによって、骨髄を洗い流すこと。
- 針/注射器を介して細胞懸濁液を通過させることにより骨髄細胞を破壊し、そして50mlチューブ中の70μmのストレーナーを通して細胞懸濁液を濾過します。
- 遠心機で10分間350×gで臓器および骨髄細胞のそれぞれを含むチューブの全。上清を捨て、そして溶解バッファー(1×)の2ミリリットルで肺と骨髄から採取した細胞と細胞を再懸濁優しく上下混合物をピペッティングすることにより溶解バッファー(1×)5mlに肝臓および脾臓から単離されたのです。冷PBSで50 mLにチューブを埋めます。
- 10分間、350×gで細胞を遠心。フローサイトメトリー分析のためにFACS緩衝液中で細胞を再懸濁または顕微鏡検査のために細胞を調製します。トリパンブルーでそれらを染色した後、トーマ細胞計数チャンバーを用いて細胞を数えます。
- 臓器の分離
- フローサイトメトリー分析のための器官から単離された細胞の細胞表面染色
- フローサイトメトリーチューブでは、ラベルのFACS緩衝液100μl中に精製された抗CD16 / 32抗体を10μg/ mlの臓器から単離した10 6個の細胞。
- 10 6個の骨髄細胞を、FACS緩衝液中に希釈した抗体およびそれらの対応するアイソタイプ対照を以下の抗体またはそれらの組み合わせの100μlを添加する:抗CD11b /抗CD3(1)/抗Ly6C /抗Ly6G(2)、抗B220(1)/anti-CD45.2/anti-CD19、抗CD115 /抗CD3(1)/単独のTI-Ly6C /抗Ly6G(2)、抗CD45.2、抗Ly6G(2)、抗CD11b、抗CD115または抗CD19補正設定の。
- 抗CD11b /抗CD3の組み合わせ(1)/抗Ly6C /抗Ly6G(2)、抗B220(1:脾細胞を、FACS緩衝液中に希釈し、以下の抗体およびそれらの対応するアイソタイプ対照の100μlを添加します)/anti-CD45.2/anti-CD19、抗CD45.2、抗Ly6G(2)、抗CD11bまたは抗CD19補正設定の。
- 肺と肝臓の細胞に、FACS緩衝液中で1/100に希釈した抗CD45.2抗体とその対応するアイソタイプ対照の100μlを添加します。
- 4℃で30分間細胞溶液の全てをインキュベートします。
- 各チューブにFACS緩衝液を2mL加えて細胞を洗浄します。 350×gで5分間チューブを遠心し、ピペッティングにより上清を捨てます。この手順をもう一度繰り返します。
- 冷PBS500μlの標識細胞を再懸濁します。氷上で細胞を維持し、交流のためのフローサイトメトリーを実行する前に、光から保護quisitionと分析10。
- フローサイトメトリー分析のために血液単核細胞および免疫蛍光染色の単離
- プロトコルを開始する前に、RTに分離ソリューションを事前に温めます。
- マイクロ遠心チューブに、(ステップ2.2から得られた100〜200μl)を、溶液の体積は500μlのあるまで、PBS / 1mMのEDTA溶液を添加血液サンプルを転送します。慎重に30G針および1mlシリンジを用いて血液を含む溶液の下にソリューションを分離し、500μlのレイヤ。血と分離液を混ぜて使用しないでください。
- RTで20分間(ブレーキなし)800 xgでチューブを遠心。遠心分離した後、ピペットを用いて細胞性リング(不透明な白色層)を収集。マイクロ遠心チューブに細胞を移します。
注:不透明な白色層は、リンパ球と同様に単球が含まれていると下層の間に表示されます - 分離ソリューション - と上層。 - 1ミリリットルを追加します。PBS溶液を、遠心分離で10分間350×gでチューブ。 FACS緩衝液600μlの中で細胞を再懸濁します。
- (各100μl)を精製した抗CD16 / 32抗体10μg/ mlを追加し、6つの別々のチューブに100μlの細胞懸濁液を配布します。
- FACS緩衝液中に希釈し、以下の抗体またはそれらに関連するアイソタイプ対照、100μlの細胞を標識:抗CD3(1)/抗B220(1)/anti-CD45.2および抗Ly6C /抗CD115の組み合わせ補償設定の/anti-CD45.2または抗CD45.2および単独の抗CD115。
- 4℃で30分間チューブの全てをインキュベートします。
- 各チューブにFACS緩衝液を2mlを加えることにより細胞を洗浄し、次いで、350×gで10分間、管を遠心分離し、ピペットを用いて上清を捨てます。
- 500μlの冷PBSで標識された細胞を再懸濁します。氷上で細胞を維持し、フローサイトメトリーの取得と解析10を実行する前に、光から保護。
- 顕微鏡用スライド上の骨髄細胞懸濁液の調製
- 1.3節で説明した手順に従いますが、今回はステップ1.3.1で、10 5骨髄細胞を使用し、ステップ1.3.4で、10分間、72.26×gで各チャンバに細胞をスピン。
- 骨髄細胞を用いたエステラーゼ活性アッセイ
- 骨髄エステラーゼ細胞化学アッセイを実行するには、1.5.3.7にステップ1.5から進んでください。
- 骨髄細胞のメイ・グリュンワルドギムザ染色
- 骨髄細胞を染色するには、セクション1.6に記載されているプロトコルに従いますが、ステップ1.6.1で、5分間のメイグリュンワルド液中でスライドをインキュベートします。
結果
C1498マウスモデルを特徴づけるために、我々は、2つの主要な手順で進めました。まず、C1498細胞は、 インビトロでの造血系および成熟段階( 図1)を決定するために特徴づけました。これらの細胞は、その後、コンジェニックマウスに注射し、および誘導白血病疾患の性質は、異なる特徴を決定するために評価した。白血病細胞浸潤、それらの表現型は、骨髄中の造血細胞(成熟及び前駆細胞/前駆体)の定量化、周波数C1498細胞や血液や臓器の腫脹(脾臓、肝臓、および肺)と細胞組成の評価で成熟造血細胞の。
インビトロでの C1498細胞の表現型を特徴づけるために、細胞は、造血前駆体および成熟細胞( 表1)で表される分子に対する抗体で標識し、その結果を流れcytometを用いて分析しました。RY。 C1498細胞は、Mac-1(CD11bの/ CD18)(約7%)、B220(> 25%)の細胞表面発現について陽性であり、それらはCD3ε、T細胞受容体(TCR)のVβ鎖およびMacの細胞内発現を示し-3( 図2AおよびB)。細胞は、細胞表面マーカーLy6G、Ly6C、CD115、CD21 / CD35、CD19、CD3、CD4、CD8、NK1.1、および汎NK分子についてとCD4とCD8の細胞内発現について陰性であった(データは示していません) 。次いで、それらを、造血幹細胞および前駆細胞( 表1)のマーカーを調べました。彼らはまた、CD117、CD34、SCA-1、CD150およびCD16 / 32の細胞表面発現について陰性であった(データは示さず)。これらの白血病細胞は、その後、接着、抗原の提示および共刺激分子の発現を決定するために試験しました。細胞は、表面マーカーLFA-1(のCD11a / CD18)、CD44、CD31(PECAM-1)、及びH-2D bは発現され、CD80、CD86およびCD274(データは示していない)、MHCクラスII陰性でした。 C1498細胞トンherefore骨髄(マック-1、Macの-3)およびリンパ系マーカー(B220、CD3、TCR)の両方を発現していました。
より自分の造血系統を特徴づけるために、ミエロペルオキシダーゼの発現は、免疫蛍光顕微鏡を用いて評価しました。細胞のすべてが彼らの骨髄起源( 図3A)を検証ミエロペルオキシダーゼ、陽性でした。細胞の大部分はまた、αナフチル酪酸エステラーゼ( 図3B、左パネル )について陽性染色され、そのうちのいくつかは、ナフトールAS-Dクロロ酢酸エステラーゼ(黒矢印)( 図3B、右パネル )について染色しました。結果は、細胞が単球および顆粒細胞の混合物を含有していることを示しています。メイグリュンワルドギムザ染色を行った後、C1498細胞は、核内で3〜5核小体、核周囲ハロ、多数の空胞及び好塩基性細胞質( 図3C、高い核-細胞質比でブラスト様形態を表示することが観察されました)。目私たちは、C1498細胞株は、単芽球と骨髄芽球で構成されています。
C1498細胞(CD45.2 +)を、静脈内でCD45.1 +マウスに注射しました。マウスは、細胞を注入した17〜19日後に死亡しました。彼らは病気で死亡前に白血病のタイプを分析することができるように、これらのマウスを屠殺しました。 PBSを注射した対照マウスは、比較のために同一の時点で分析しました。 C1498細胞を注射したマウスは、メイグリュンワルドギムザ染色が( 図4A)を実施した後の細胞の爆発のような外観によって示されるように、彼らの骨髄にC1498細胞の大量の浸潤を示しました。彼らはまた、急性骨髄性白血病の特徴である単芽球と骨髄芽細胞の蓄積を実証し、その単球及び顆粒球の表現型( 図4BおよびC)を保存しました。
Dに骨髄造血細胞の数は、白血病細胞の浸潤、CD45.2 + C1498細胞、Bリンパ球、単球及び(前駆細胞、前駆体および成熟した細胞を含む)、顆粒球集団以下低かった免疫蛍光染色およびサイトメトリー分析マルチパラメトリックフローを用いて定量したかどうかをetermine。白血病細胞は、造血細胞(データは示していない)の16〜36%を占めました。他の細胞型は、全ての平均で顆粒球細胞および3倍の平均の4倍、B細胞サブセットの平均で5倍(PBSを注射したマウスよりもC1498を注射したマウスにおいて有意に低い数字に存在しましたCへの単球サブセットのために)( 図5A)。
白血病と対照マウスの血液試料中の単核細胞の頻度の調査は、それらがリンパ球( 図6A)の匹敵する割合が、単球の高い周波数を含むことを示しましたそして白血病細胞。これらの特性は、急性骨髄性白血病11( 図6B)の代表です。
急性骨髄単球性白血病12の他の機能の中に、C1498-注射したマウスは、腫れ肝臓(肝腫)、肺および脾臓(脾腫)( 図7A)を提示します。 CD45.2 + C1498細胞の様々な周波数は、免疫蛍光染色を使用して、これらの器官において検出され、解析( 図7B)フローサイトメトリーました。脾腫浸潤した単球の高い数に起因することができ、我々はまた、脾臓集団の割合を推定しました。 Bリンパ球、単球内の細胞および顆粒細胞画分の数は2倍の平均値で、有意に大きかった、2.5倍と3倍、それぞれ、制御脾臓( 図7C)に比べて白血病脾臓インチ
薄ページ= "1"> 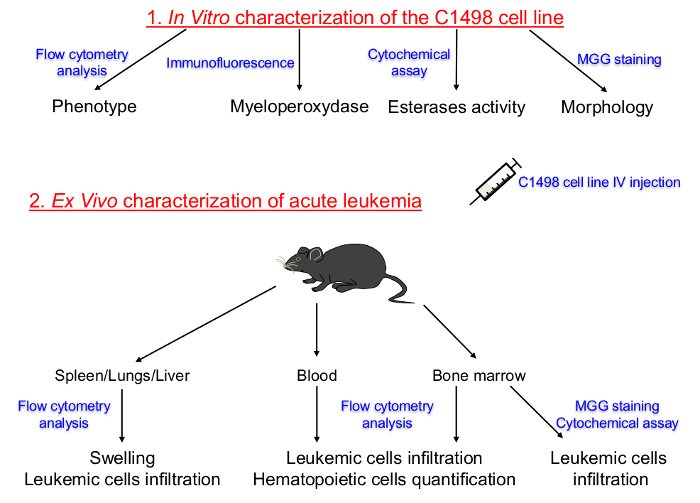
図1. 体外培養C1498細胞株および急性白血病のin vivoでの説明に特徴付けるためのプロトコルのセットアップの概略図。造血系および組織培養C1498細胞の分化段階を最初に決定しました。 C1498細胞は、その後、急性白血病の発達を誘導するためにコンジェニックマウスに注射しました。骨髄、末梢血、脾臓、肝臓および肺組織の単離は、C1498細胞浸潤後の周波数、表現型および形態学的変化を決定しました。 IV:静脈内MGG:メイグリュンワルドギムザこの図の拡大版をご覧になるにはこちらをクリックしてください。
広告/ 54270 / 54270fig2.jpg "/>
in vitroで培養。ドットプロットおよび細胞表面(A)および細胞内(B)のヒストグラム代表的なフローサイトメトリー後のC1498細胞の図2.表現型分析は、造血成熟細胞分化に関連した分子が示されているC1498-表明しました。 C1498細胞は、細胞表面のCD11b、CD18およびB220マーカーまたはそのアイソタイプコントロールに特異的であった蛍光抗体を用いて、培養物から回収し、洗浄し、標識しました。細胞内染色のために、細胞を固定し、透過およびMac-3に対する抗体、CD3ε、およびTCR(T細胞受容体)のVβ鎖またはそのアイソタイプコントロールの共通のエピトープを用いて標識しました。分析は、生きた細胞でゲーティングを使用して実施した。 この図の拡大版をご覧になるにはこちらをクリックしてください。
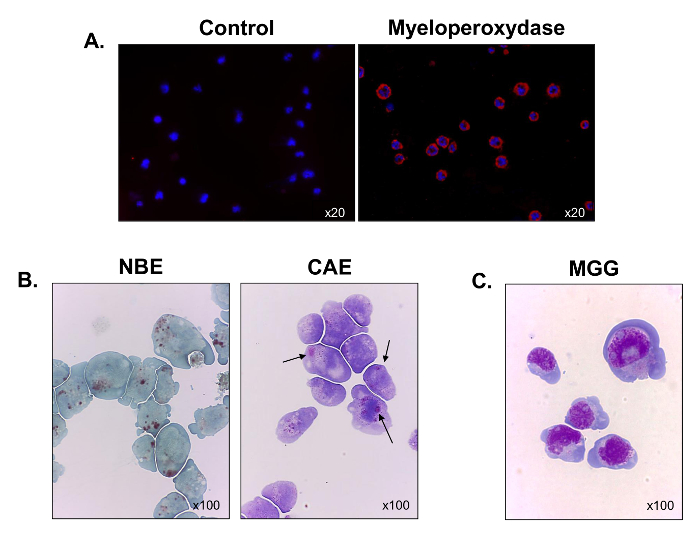
図3.機能および培養C1498細胞の形態学的特徴付け 。 C1498細胞を培養物から採取し、顕微鏡用スライド上に遠心分離した。(A)ミエロペルオキシダーゼの発現のために染色が免疫蛍光を用いて行った。(B)細胞化学反応は、αナフチル酪酸エステラーゼ(NBE)およびナフトールAS-Dクロロアセテートエステラーゼを分析するために使用しました。 (CAE)C1498細胞における活性。細胞は茶色と赤紫色、大型の細胞質顆粒は、それぞれ、観察された各ラベルについて陽性であると考えられた。C1498細胞の(C)、メイグリュンワルドギムザ(MGG)染色。各染色実験では、顕微鏡対物倍率が示されています。各画像は、3つの別々の実験の代表です。large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
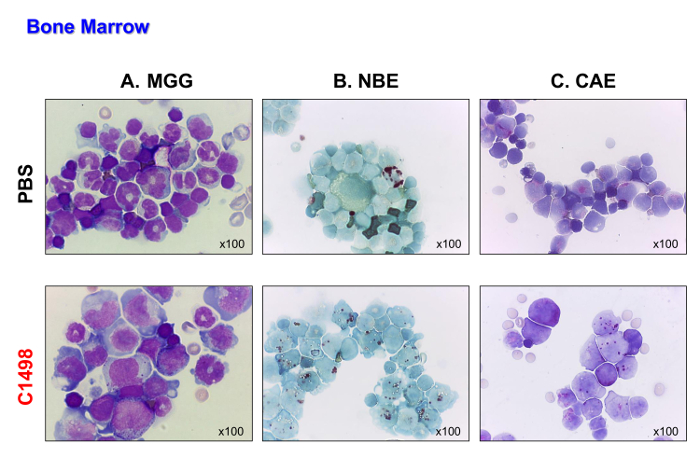
図4.骨髄、PBS中のモルフォロジーおよびC1498-注射したマウス。骨髄細胞を、PBSおよびC1498細胞を注射したマウスから単離し、顕微鏡用スライド上に遠心分離した。(A)メイグリュンワルドギムザ(MGG)染色。(B )α-ナフチル酪酸エステラーゼ(NBE)および(C)ナフトールAS-Dクロロエステラーゼ(CAE)関数は、細胞化学を用いて評価しました。パネルAでは、バンド(未成熟)またはセグメント(成熟した)好中球は、PBSを注射したマウスよりもC1498-注射したマウスの骨髄中の見えにくいです。パネルBおよびCは、制御骨髄において観察された数字と比較すると、白血病、骨髄中の単球や顆粒球細胞の蓄積があったことを示しています。すべて顕微鏡分析は、100X倍率の対物レンズを用いて行った。 この図の拡大版をご覧になるにはこちらをクリックしてください。
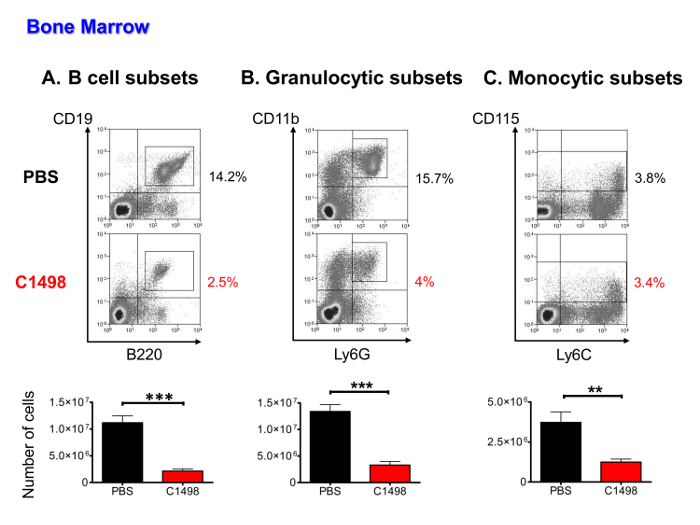
髄様、PBS中の集団とC1498-注射したマウスの図5.定量分析。骨髄細胞を、PBSおよびC1498細胞を注射したマウスから単離し、細胞計数を行った後に推定しました。異なる細胞集団の頻度は、免疫染色及びサイトメトリー分析生細胞ゲーティング流れ後に測定した。(A)B細胞サブセットは、中のBリンパ球(B)、顆粒球細胞を成熟プロB細胞の段階でCD19 + B220 +細胞を含まCD3 -前駆体Aを含めてのCD11b + Ly6G +系統、ND未熟および成熟顆粒(C)単球サブセットはCD3のように定義された- 。CD115 +および単球ステージを成熟させる前駆内のセルが含まれていました。 n = 7匹のマウス/群、およびデータは、平均±SEMを示すヒストグラムとして提示されています。 ***はp <0.0001 **、P <0.01、PBS処置およびC1498-注射したマウスを比較した対応のないスチューデントt検定。 この図の拡大版をご覧になるにはこちらをクリックしてください。
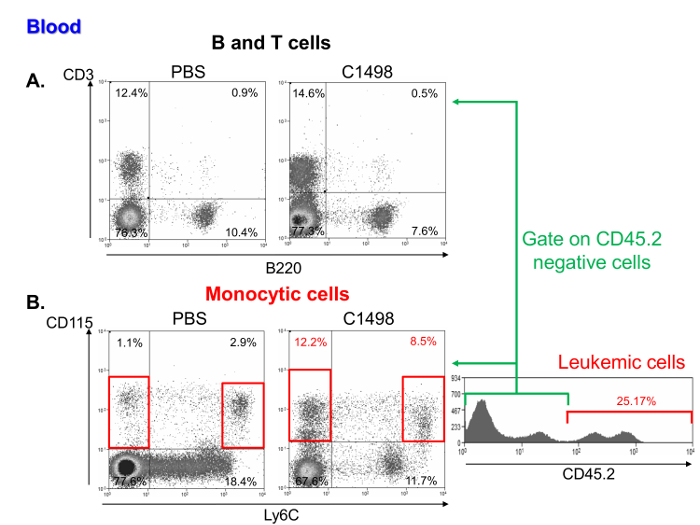
PBS処置およびC1498-注射したマウスにおける単核細胞サブセットの図6.血液分析 。それぞれ、PBSおよびC1498の中でCD3 +およびB220 +細胞と定義した(A)TおよびBリンパ球の割合、のドットプロット代表的なフローサイトメトリー細胞を注射しました。及びCD115 + Ly6C high細胞-マウス(B)C1498の白血病とコントロールにおける単球細胞の頻度は、(PBS)マウスは、CD115 + Ly6Cを分析することによって決定しました。分析は、生細胞をゲーティングすることによって行いました。白血病マウスおよび対照マウスを比較するために、CD45.2 + C1498細胞が除外された。 この図の拡大版をご覧になるにはこちらをクリックしてください。
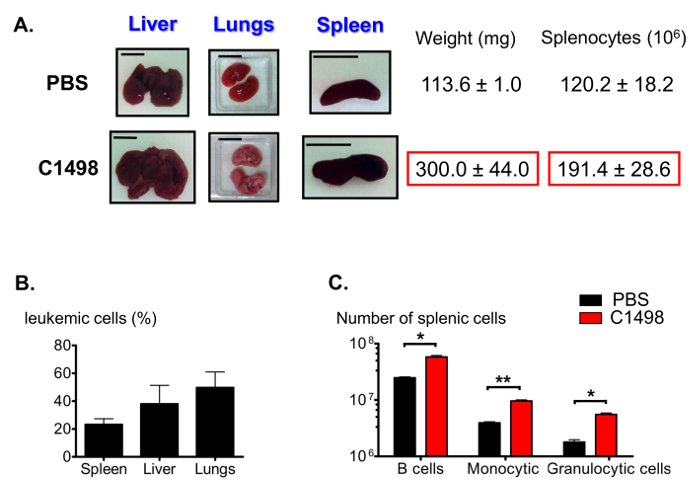
白血病およびコントロールマウスにおける脾臓集団の図7.推定。 (A)は、肝臓、肺および脾臓の代表的な写真は、対照マウスと比較して、白血病マウスの腫脹。脾臓を採取し、秤量し、脾細胞を組織破壊、次のカウントしたした。デフにおける白血病細胞の頻度を表す(B)ヒストグラムを免疫染色は、CD45.2 +細胞について実施し、結果は、フローサイトメトリーを用いて分析した。(C)脾臓Bの試算、顆粒球及び単球細胞数免疫染色した後、分析ゲートフローサイトメトリー後erent器官、生CD19 + B220 +を同定しました、CD3 -のCD11b + Ly6G +、CD3 -のCD11b + Ly6C -およびCD3 -のCD11b + Ly6C high細胞。肺、脾臓および肝臓のために示されたスケールバーは1cmに示しています。 n = 5から8マウス/群、およびデータは、平均±SEMとしてヒストグラムで表現されている*はp <0.05; PBS処置およびC1498-注射したマウスを比較**は p = 0.0033、対応のないスチューデントのt検定。。 してくださいこの図の拡大版をご覧になるにはこちらをクリックしてください。
| 細胞型 | 膜または細胞内分子 |
| 前駆体および成熟した細胞 | |
| NK細胞 | NK1.1 +、パンのNK + |
| NKT細胞 | NK1.1 +、汎NK +、TCR Vbeta +(8.2)、CD3 + |
| Tリンパ球 | TCR Vbeta +、CD3 +、CD4 +、CD8 + |
| B細胞前駆体およびBリンパ球 | B220 +、CD19 +、CD21 / 35 + |
| 顆粒球前駆体および顆粒球 | Ly6G +、Macの-1 +、CD11bの+ |
| 単球前駆体及び単球/マクロファージ | CD11b +、Macの-1 +、Macの-3 +、CD21 / 35 +、CD115 +、Ly6Chi |
| 前駆細胞 | |
| 多能性前駆細胞 | CD117 +のSca-1+ CD34 +(LIN-CD150-) |
| リンパプライミング多能前駆細胞 | CD117hi SCA-1hi CD127 +(LIN-) |
| リンパ球系共通前駆細胞 | CD117lo SCA-1LO CD127 +(LIN-) |
| 骨髄系共通前駆細胞 | CD16 / 32lo CD117 + CD34int(LIN-SCA-1-) |
| 顆粒球 - マクロファージ前駆細胞 | CD16 / 32hi CD117 + CD34hi(LIN-SCA-1-) |
| 巨核球、赤血球前駆細胞 | CD16 / 32lo CD117 + CD34lo(LIN-SCA-1-) |
| 造血幹細胞 | CD117 + SCA-1 + CD150 +(LIN-CD34-) |
表造血細胞系統および分化の1マーカー。
CD:CD分類。林:成熟細胞のマーカー; LO:低発現;こんにちは:高発現; int型:中間式。 NK:ナチュラルキラー細胞; TCR:T細胞受容体。
ディスカッション
以前の研究では、C1498細胞株は、急性顆粒球5、骨髄6またはNKT 7細胞白血病のインデューサーとして記載されました。しかし、文献で実証データが存在しないか、または不完全のいずれかでした。ここに提示プロトコルは、培養されたC1498細胞を特徴付けるために、それらが注入された後にマウスにおいて誘導される白血病の性質を決定するために、フローサイトメトリー、免疫蛍光、MGG染色および細胞化学的アッセイなどの様々な技術を使用します。
我々は免疫染色した後にインビトロで培養C1498細胞の表現型およびフローサイトメトリー分析時に行われたこれらの細胞は、以前に文献6,7に記載されているいくつかの細胞表面造血マーカーを発現しているため、我々はいくつかの制限を観察しました。我々の結果と一致して、ラブレらは 、フローcytometを使用C1498細胞に成熟したTCRの細胞表面発現を観察しませんでしたRY染色。それらはCD3εとTCRVβ8.2のmRNA 7を検出した後、しかし、それらは、NKT細胞株であるためにそれらを検討しました。我々はまた、細胞(> 70%)のほとんどでTCRVβ鎖およびCD3ε分子の細胞内発現を観察したが、Macの-3分子の同時細胞内発現もあったので、それらの造血系統を決定することができませんでした。
ミエロペルオキシダーゼ、MGG染色および細胞化学を用いた機能性エステラーゼを分析するためのアセスメントは、C1498細胞株は骨髄起源を持っていたし、芽球と骨髄芽球から構成されていたことを実証しました。これらの結果は、フローサイトメトリー染色分析で得られたのMac-3 +細胞の割合と一致しました。定量的ではないものの、これらの手順を実行するためのキーの実験を表します。確かに、彼らは、これまでのところ、ないまたはfを表現する造血細胞の系譜と分化ステージを特徴付けるための最良の既存の方法のままEW特定の表現型マーカー。
染色フローサイトメトリーは、C1498細胞を静脈内注射した後にコンジェニックマウスにおける急性白血病の開発を実証するために役に立ちました。末梢血および様々な臓器に浸潤CD45.2 + C1498細胞を単離し、それらの周波数が決定されました。定量化はまた、免疫表現後固有髄質および脾細胞を分析するために行きました。彼らはいくつかの造血マーカーを発現したとして、C1498細胞の表現型は臓器で調べたときの制限事項が発生した(そのうちのほんの数は、B220 +でした)。観察された急性白血病の性質を定義するには、メイグリュンワルドギムザ染色し、単球及び顆粒球エステラーゼの活性の分析は、骨髄を用いて行きました。結果は、C1498細胞は骨髄単球性白血病の発症を明らかにし、彼らの骨髄芽球と単芽の形態および機能を維持したことを示しました。
細胞化学反応およびMGG染色を行う際のpHのエラーは結果の誤った解釈につながることができますので、このプロトコルに記載の重要なステップのための配慮では、特に注意がpHに与えられるべきです。顆粒球およびリンパ球はまた、より高いpH値で、このテストのために陽性に染色することができますので、例えば、α-ナフチル酪酸エステラーゼ活性は6.0のpHで単球細胞に特異的です。細胞を固定すると、MGG染色を行う前に、推奨、我々はC1498細胞を用いたエステラーゼ細胞化学反応を行う場合にのみCAFの固定は満足な結果を提供したことを示したされていません。フローサイトメトリーによりCD115分子とその検出の発現を維持するために、試料( 例えば 、血液、骨髄、脾臓細胞)の全ては、手順の間、氷上に維持されるべきです。染色は、フローサイトメトリーおよび/または免疫蛍光実験を、抗体の参照、それらの記憶再において観察されていない場合表彰及びその希釈物をチェックする必要があります。材料/機器テーブルで指定された参考文献は、フローサイトメトリーまたは免疫蛍光アプリケーションに設定されています。一次/二次抗体またはその共役フルオロフォアは不適当なストレージにそれらの活性を失っている可能性がある( 例えば 、光または熱への曝露)、不適切な希釈、広範な凍結/解凍または汚染されたバッファを使用。それらが正常に機能していることを確認するために、ポジティブコントロールを実行します。目的のタンパク質を発現することが知られているマウスの骨髄または脾臓由来の細胞を使用します。高いバックグラウンドや非特異的な染色を避けるために、細胞が適切に洗浄し、(免疫蛍光のための)高湿度に保ち、指示通り抗体が希釈されていることをされていることを確認してください。正確に試料中のバックグラウンドレベルを決定するために、アイソタイプコントロール抗体と一次抗体のための同じ濃度および希釈を使用してください。エステラーゼ細胞化学実験のために、試薬は、精製マウス脾臓顆粒球(Ly6G +)および単球(CD115 +)細胞を含む陽性および陰性対照スライドを使用して試験することができます。
この研究で記載された手順は、C1498細胞の注射後のマウスにおいて観察された白血病の特徴の多くは、ヒト急性骨髄単球性白血病11,12と共通の特徴を共有していることを示しました。侵入した白血病細胞(前駆細胞および前駆体)は、成熟および未成熟骨髄造血細胞の減少をもたらしました。単球細胞であるとしてC1498細胞は、末梢血中の高頻度(> 20%)で存在します。肝腫および脾腫は、白血病細胞の浸潤から生じることが観察された、およびBリンパ球および骨髄細胞の大幅な増加も脾腫を伴うことが観察されました。血小板数は、血液分析器を用いて推定したときに血小板減少も観察されました。
それはショーでしたnは、 試験管内実験で使用して、C1498細胞は、可溶性因子13を分泌することにより、通常のマウスの造血を阻害すること。いくつかの腫瘍のマウスモデルにおいて、(単球および顆粒球細胞を含む)、未熟骨髄細胞はまた、抗腫瘍特異的T細胞活性化および増殖14を阻害する脾臓を骨髄から移行することが示されています。このように、骨髄中で観察された造血細胞の減少は、造血および/またはそれらの移民からの欠乏のいずれかから生じた可能性があります。この後者のメカニズムは、末梢血中の単球の存在または脾臓の拡大骨髄性画分の観察を説明することができます。これらの細胞は、改善された脾臓造血由来していることができることも考えられます。実際に、定常状態の条件下で、脾臓B細胞のいくつかのサブセットは、成熟Bリンパ球15の前駆体として同定されました。また、炎症性の条件の下で、のmedullary幹および前駆細胞は、成熟単球16の産生を誘導するために脾臓に移転することが示されています。このプロトコルは、私たちは、白血病の発症に関与しているメカニズムに関する結論を引き出すことはできません。また、付加的な機能だけでなく、分子アッセイは、そうするために採用されるべきです。しかし、これらのデータは、急性骨髄性白血病の臨床的特徴についての詳細な情報が含まれており、研究者が新たな治療薬の効果を評価し、理解するのに役立ちます。
開示事項
The authors declare that they have no competing financial interests.
謝辞
The authors would like to acknowledge the "Ligue Nationale contre le Cancer" (Comité du Septentrion), the SIRIC ONCOLille (Grant INCa-DGOS-INSERM 6041) and the Institut pour la Recherche sur le Cancer de Lille (IRCL) for supporting this work. They would like to thank Delphine Taillieu and the animal facility staff for housing the mice and maintaining their welfare. We also thank Raphaëlle Caillerez and Nathalie Jouy for their respective help in microscopy and flow cytometry.
資料
| Name | Company | Catalog Number | Comments |
| C1498 cell line | ATCC | TIB 49 | |
| C57BL/6J-Ly5.1 | Charles River | B6.SJL-Ptprc a Pep3 b/BoyCrl | |
| Cells culture reagents | |||
| 2-Mercaptoethanol, Gibco | ThermoFisher Scientific | 21985 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | 10270 | |
| HEPES, Gibco (1 M) | ThermoFisher Scientific | 15630 | |
| Non-Essential Amino Acids Solution, Gibco | ThermoFisher Scientific | 11140 | |
| Penicillin-Streptomycin, Gibco | ThermoFisher Scientific | 15140 | |
| RPMI 1640 Medium (Gibco, GlutaMAX Supplement) | ThermoFisher Scientific | 61870 | |
| Sodium Pyruvate, Gibco (100 mM) | ThermoFisher Scientific | 11360 | |
| Flow cytometry staining reagents | |||
| anti-mouse B220 APC (1) | ebiosciences | 17-0452 | clone RA3-6B2, final dilution 1/100 |
| anti-mouse B220 biotin (2) | ebiosciences | 13-0452 | clone RA3-6B2, 1/400 |
| anti-mouse CD3 eFluor450 (1) | ebiosciences | 48-0032 | clone 17A2, 1/100 |
| anti-mouse CD3 PE (2) | BD biosciences | 555275 | clone 17A2, 1/100 |
| anti-mouse CD3 PE-Cy5 (3) | ebiosciences | 15-0031 | clone 145-2C11, 1/100 |
| anti-mouse CD4 APC (1) | ebiosciences | 17-0041 | clone GK1.5, 1/500 |
| anti-mouse CD4 PE (2) | ebiosciences | 12-0041 | clone GK1.5, 1/200 |
| anti-mouse CD8 biotin (1) | ebiosciences | 13-0081 | clone 53-6.7, 1/100 |
| anti-mouse CD8 eFluor450 (2) | ebiosciences | 48-0081 | clone 53-6.7, 1/500 |
| anti-mouse CD11a biotin | ebiosciences | 13-0111 | clone M17/4, 1/100 |
| anti-mouse CD11b PE | ebiosciences | 12-0112 | clone M1/70, 1/200 |
| anti-mouse CD16/32 biotin | ebiosciences | 13-0161 | clone 93, 1/400 |
| purified anti-mouse CD16/32 (FcR blocking) | BD biosciences | 553141 | clone 2.4G2 |
| anti-mouse CD18 biotin (1) | ebiosciences | 13-0181 | clone M18/2, 1/100 |
| anti-mouse CD18 FITC (2) | ebiosciences | 11-0181 | clone M18/2, 1/50 |
| anti-mouse CD19 PE | ebiosciences | 12-0193 | clone 1D3, 1/200 |
| anti-mouse CD21/35 PE | ebiosciences | 12-0211 | clone 8D9, 1/50 |
| anti-mouse CD31 PE | ebiosciences | 12-0311 | clone 390, 1/100 |
| anti-mouse CD34 eFluor660 | ebiosciences | 50-0341 | clone RAM34, 1/20 |
| anti-mouse CD44 PE | BD biosciences | 553134 | clone IM7, 1/50 |
| anti-mouse CD45.2 FITC | ebiosciences | 11-0454 | clone 104, 1/100 |
| anti-mouse CD49b/Pan NK PE | BD biosciences | 553858 | clone DX5, 1/50 |
| anti-mouse CD80 biotin | ebiosciences | 13-0801 | clone 16-10A1, 1/200 |
| anti-mouse CD86 biotin | ebiosciences | 13-0862 | clone GL1, 1/200 |
| anti-mouse CD107b (Mac-3) PE | ebiosciences | 12-5989 | clone M3/84, 1/40 |
| anti-mouse CD115 PE | ebiosciences | 12-1152 | clone AFS98, 1/100 |
| anti-mouse CD117 eFluor450 | ebiosciences | 48-1171 | clone 2B8, 1/100 |
| anti-mouse CD127 PE | ebiosciences | 12-1271 | clone A7R34, 1/100 |
| anti-mouse CD150 APC | ebiosciences | 17-1501 | clone 9D1, 1/20 |
| anti-mouse CD274 (PD-L1) biotin | ebiosciences | 13-5982 | clone MIH5, 1/200 |
| anti-mouse Ly-6A/E (Sca-1) PE | ebiosciences | 12-5981 | clone D7, 1/100 |
| anti-mouse Ly-6C APC | ebiosciences | 17-5932 | clone HK1.4, 1/200 |
| anti-mouse Ly-6G (Gr-1) biotin (1) | ebiosciences | 13-5931 | clone RB6-8C5, 1/400 |
| anti-mouse Ly-6G FITC (2) | ebiosciences | 11-9668 | clone 1A8, 1/50 |
| anti-mouse MHC class I (H-2Db) biotin | ebiosciences | 13-5999 | clone 28-14-8, 1/50 |
| anti-mouse MHC class II (I-A/I-E) PE-Cy5 | ebiosciences | 15-5321 | clone M5/114.15.2, 1/1000 |
| anti-mouse NK1.1 PE | BD biosciences | 557391 | clone PK136, 1/50 |
| anti-mouse TCRVb FITC | BD biosciences | 553170 | clone H57-597, 1/50 |
| streptavidin PE-Cy5 | ebiosciences | 15-4317 | 1/200 |
| Immunofluorescence staining reagents | |||
| Anti-mouse myeloperoxidase (heavy chain antibody) | Santa Cruz Biotechnology | sc-16129 | 1/10 (20 µg/ml) |
| anti-goat IgG (Texas Red coupled antibody) | Jackson Immunoresearch | 705-076-147 | 1/250 |
| Normal donkey serum | Jackson Immunoresearch | 017-000-001 | |
| Hoechst solution | BD Biosciences | 561908 | 1/1000 |
| Mounting medium 1 (Fluoromount) | Sigma-Aldrich | F4680 | |
| Acetone | VWR | 20066 | |
| Methanol | Merck Millipore | 106009 | |
| Esterase cytochemical staining reagents | |||
| Naphtol AS-D chloroacetate solution | Sigma-Aldrich | 911 | |
| Dye solution (Fast Red Violet LB Base solution) | Sigma-Aldrich | 912 | |
| pH6.3 buffer concentrate (TRIZMAL) | Sigma-Aldrich | 913 | |
| Sodium nitrite solution | Sigma-Aldrich | 914 | |
| Citrate solution | Sigma-Aldrich | 915 | |
| Hematoxylin solution | Sigma-Aldrich | GHS3 | |
| Acetone | VWR | 20066 | |
| Formaldehyde solution, 37% | Sigma-Aldrich | F1635 | |
| α-naphthyl butyrate solution | Sigma-Aldrich | 1801 | |
| Phosphate buffer solution | Sigma-Aldrich | 1805 | |
| Sodium nitrite Tablet | Sigma-Aldrich | 1809 | |
| Pararosaniline solution | Sigma-Aldrich | 1804 | |
| Methylene blue solution | Sigma-Aldrich | 1808 | 1/10 |
| mounting medium 2 (Clearmount) | Invitrogen | 00-8010 | |
| May-Grünwald Giemsa staining reagents | |||
| May-Grünwald solution | RAL Diagnostics | 320070 | |
| Giemsa R solution | RAL Diagnostics | 320310 | 1/20 |
| pH 6.8 buffer solution | RAL Diagnostics | 330368 | |
| Others materials, reagents and equipment | |||
| Ketamine 1000 (100 mg/ml) | VIRBAC | 3597132111010 | |
| Xylazine SEDAXYLAN (20 mg/ml) | CEVA | ||
| Bovin albumin serum (BSA) powder | ThermoFisher Scientific | BP671 | |
| PBS solution (1x concentrate) | ThermoFisher Scientific | 14190 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | 158127 | |
| Saponin | Sigma-Aldrich | 47036 | |
| Ultra Pure 0.5 M EDTA solution, pH 8.0 | ThermoFisher Scientific | 15575 | |
| Separating solution (Pancoll Mouse) | PANBIOTECH | P04-64100 | |
| Lysis buffer (Red Blood Cells Lysing Buffer) (10x) | BD Biosciences | 555899 | 1/10 |
| NaOH 10 N | ThermoFisher Scientific | SS267 | |
| Trypan blue solution (0.4 %) | ThermoFisher Scientific | 15250-061 | 1/2 |
| 50 ml tube (Falcon) | Fisher Scientific | 14-432-22 | |
| 70 µm Cell Strainer (Falcon) | Corning Life Sciences | 352350 | |
| Chamber & filter card (EZ Cytofunnel Shandon) | Thermo Scientific | A78710003 | |
| Microscope Cover Glasses, 24 x 24mm | Knittel Glass | VD1 2424 Y100 | |
| Slides (Starfrost - ground edges 90) | Knittel Glass | VS1137# 077FKB | |
| EDTA Tube | Greiner Bio-One | 454034 | |
| Pasteur Pipette 150 mm (capillary tube) | Fisherbrand | 1154-6963 | |
| 26 G needle | Terumo | NN-2613R | |
| insulin syringe and needle 29 G | Terumo | BS05M2913 | |
| 30 G needle | Becton & Dickinson | 304000 | |
| Flow cytometry tubes (blue) | Beckman Coulter | 2523749 | |
| Water-repellent pen (Dakopen) | Dako | S200230 | |
| Sharp sterile scissors | Nessi-care | SCI-01 | |
| Sterile forceps | Dominique Dutscher | 956506 | |
| Thoma cell counting chamber | VWR | 631-0397 | |
| Petri Dishes (Fisherbrand Plastic) | ThermoFisher Scientific | S33580A | |
| Microcentrifuge tube (1.5 ml) | ThermoFisher Scientific | 05-408-129 | |
| Cylindrical Restrainer 15 - 30 gm | Stoelting | 51338 | |
| Shandon Cytospin 3 Cytocentrifuge | ThermoFisher Scientific | ||
| 10 ml syringe | Terumo | SS-10L | |
| 1 ml syringe | Terumo | SS-01T | |
| Ethanol | Merck | 1.08543 | |
| Sterile gauze sponges | URGO | 501580 |
参考文献
- Forthun, R. B., Hinrichs, C., Dowling, T. H., Bruserud, Ø, Selheim, F. The past, present and future subclassification of patients with acute myeloid leukemia. Curr. Pharm. Biotechnol. 17 (1), 6-19 (2016).
- Goldie, H., Butler, C. H., Anderson, M. M., Maxwell, M. C., Hahn, P. F. Growth characteristics of free C1498 (granulocytic leukemia) tumor cells in the peritoneal fluid and the blood of C57 mice. Cancer Res. 13 (2), 125-129 (1953).
- Tanaka, K. K., Roberts, E. Biological studies of E.L.4 lymphoma and C Leukemia in susceptible (C57BL) and resistant (B10.D2) mice. Cancer Res. 24 (1498), 1785-1797 (1964).
- Law, L. W. Characterization of an influence affecting growth of transplantable leukemias in mice. Cancer Res. 4, 257-260 (1944).
- Graham, J. D., McMahon Welch, C., Patchen, M. L. Studies of an implanted murine myelogenous leukemia C1498. Ohio J. Sci. 75 (4), 202-208 (1975).
- Boyer, M. W., Orchard, P. J., Gorden, K. B., Anderson, P. M., Mclvor, R. S., Blazar, B. R. Dependency on intercellular adhesion molecule recognition and local interleukin-2 provision in generation of an in vivo CD8+ T-cell immune response to murine myeloid leukemia. Blood. 85 (9), 2498-2506 (1995).
- Labelle, J. L., Truitt, R. L. Characterization of a murine NKT cell tumor previously described as an acute myelogenous leukemia. Leuk. Lymphoma. 43 (8), 1637-1644 (2002).
- Bradner, W. T., Pindell, M. H. Myeloid leukemia as a screen for cancer chemotherapeutic agents. Cancer Res. 26 (4), Pt 2 375-390 (1966).
- Lin, J. M., Li, B., Rimmer, E., VanRoey, M., Jooss, K. Enhancement of the anti-tumor efficacy of a GM-CSF-secreting tumor cell immunotherapy in preclinical models by cytosine arabinoside. Exp. Hematol. 36 (3), 319-329 (2008).
- Robinson, J. P. Handbook of Flow Cytometry Methods. , Wiley-Liss, Inc. New York, NY. (1993).
- Xu, Y., McKenna, R. W., Wilson, K. S., Karandikar, N. J., Schultz, R. A., Kroft, S. H. Immunophenotypic identification of acute myeloid leukemia with monocytic differentiation. Leukemia. 20 (7), 1321-1324 (2006).
- Hassan, K., Qureshi, M., Shafi, S., Ikram, N., Akhtar, M. J. Acute myeloid leukemia-FAB classification and its correlation with clinico-haematological features. J. Pak. Med. Assoc. 43 (10), 200-203 (1993).
- Quesenberry, P. J., Rappeport, J. M., Fountebouni, A., Sullivan, R., Zuckerman, K., Ryan, M. Inhibition of normal murine hematopoiesis by leukemic cells. N.Engl.J. Med. 299 (2), 71-75 (1978).
- Youn, J. I., Nagaraj, S., Collazo, M., Gabrilovich, D. I. Subsets of myeloid-derived suppressor cells in tumor-bearing mice. J. Immunol. 181 (8), 5791-5802 (2008).
- Loder, F., et al. B cell development in the spleen takes place in discrete steps and is determined by the quality of B cell receptor-derived signals. J. Exp. Med. 190 (1), 75-89 (1999).
- Robbins, C. S., et al. Extramedullary hematopoiesis generates Ly-6C(high) monocytes that infiltrate atherosclerotic lesions. Circulation. 125 (2), 364-374 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved