このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
癌細胞の浸潤や衛星腫瘍形成を探検するための三次元培養アッセイ
要約
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
要約
単層での哺乳動物細胞の培養は、広く様々な生理学的および分子プロセスを研究するために使用されます。しかし、成長細胞を研究するために、このアプローチは、多くの場合、不要なアーティファクトを生成します。したがって、多くの場合、細胞外マトリックス成 分を用いた3次元(3D)環境内での細胞培養は、によりインビボ組織または臓器において天然にその近い類似に興味深い代替として登場しました。我々は、フィブリンゲルからなる疑似一次macrospherical腫瘍および(ii)の周辺の無細胞区画としてコラーゲンゲル作用に埋め込 まれた癌細胞を含む中心コンパートメント、二つの区画、すなわち(i)を用いて、三次元細胞培養システムを開発しましたすなわち、中心部に使用されるものとは異なる細胞外マトリックス成 分は、ここで癌細胞が遊走する(浸潤フロント)および/ または第二またはサテライト腫瘍を表す微小球腫瘍を形成することができます。末梢コンパートメント内の衛星腫瘍の形成であります著しく、この3D培養系は、ユニークなネイティブの腫瘍細胞の既知の攻撃性または転移性の起源、と相関。この細胞培養アプローチは、癌細胞の浸潤性および運動性、細胞 - 細胞外マトリックス相互作用と抗がん剤の特性を評価する方法としてを評価するために考慮されるかもしれません。
概要
癌細胞の浸潤/遊走およびその後の転移の確立の基本的および生物医学的特性を調査することは熱心な研究1,2の主題です。転移は、がんの究極の段階であり、その臨床管理はとらえどころのないままになります。細胞および分子レベルでの転移のより良い理解は、より効率的な治療法3の開発を可能にします。
転移性細胞のいくつかの特性は、それらの幹細胞性と移行し、内と原発腫瘍5から侵入する遷移状態( 例えば 、類上皮間葉移行)を取得する可能性を含む試験管 4 で検討することができます。それは事実上の血液/リンパ循環の寄与を除外しかし、浸潤/転移過程のin vitro評価は、課題でした。コラーゲンゲルに腫瘍断片を埋め込む器官培養物previou有しますずる癌の攻撃性をモニターするために使用されて。腫瘍の複雑さ( 例えば 、非癌性細胞の存在)を保持しているが、腫瘍断片を、制限された培地の拡散にさらされている、サンプリング変化、および間質細胞6の異常増殖です。別の方法は、三次元(3D)細胞環境を模倣する細胞外マトリックス(ECM)の構成要素内の癌細胞を成長させることにあります。コラーゲンゲルおよび/または基底膜由来のマトリックス中の乳癌細胞株の増殖は、3次元細胞培養物の最もよく特徴づけ実施例の中です。特定の三次元細胞培養環境を使用して、標準的な条件下で増殖させた乳癌細胞について観察された無秩序なアセンブリは、乳腺腺房と管状構造7-10の自発的形成を逆転させることができます。また、腺癌細胞由来の多腫瘍スフェロイドの形成は、(別の技術を使用して集まっ例えば、滴、浮遊スフェロイド、寒天埋め込 み)を吊りは現在最も一般的に使用される三次元細胞培養アッセイ11-13を構成しています。しかし、このアッセイは、スフェロイドを形成することができる癌細胞株の制限されたセットによってこれらの条件で細胞を研究するために利用可能な短い期間によって制限されます。
この視覚化技術では、我々は、本明細書中に関心の癌細胞は、代わりに基底膜由来のマトリックスで被覆することができる擬似原発腫瘍のインビトロ形成を可能にするために、コラーゲンゲル中に包埋された洗練された三次元細胞培養アッセイ法を導入します。一旦形成されると、擬似原発腫瘍はその後、癌細胞は、2つの行列の区画との間の界面を横断することを可能にする無細胞マトリックス(ここでフィブリンゲル)に挟まれている( 図1参照)。興味深いことに、攻撃的な癌細胞と共に擬似原発腫瘍に由来する二次性腫瘍のような構造は、で表示されフィブリンゲル。このような三次元培養系は、例えば、抗癌剤、遺伝子発現および細胞-細胞および/ または細胞-ECM相互作用14-16、調査に必要な柔軟性を提供します。
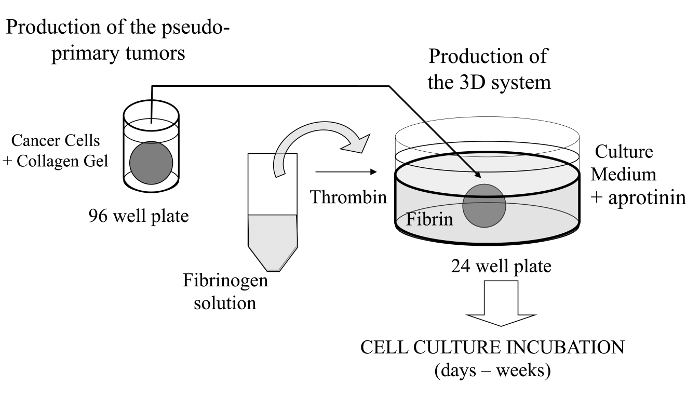
図1: メソッドの概要癌研究のためのモデルとして、3D細胞培養系を生成するための方法の概略要約この図の拡大版をご覧になるにはこちらをクリックしてください。
プロトコル
注:いいえ倫理考慮動物およびヒトの癌細胞が購入または親切に私たちに提供されたので。
1.コラーゲンプラグ(擬似原発腫瘍)の作成
- コラーゲン分散液を準備します。以前に17を報告した 、または購入として私は、ラットの尾の腱(RTT)から型コラーゲンを抽出し、滅菌することができるのいずれか。 (; 5 2分の実行高速設定)均一な混合のために凍結乾燥したRTTコラーゲン(0.02 N酢酸で3.25から3.50 mg / mlで)ブレンダーを使用して分散させます。
- ハーベスト(トリプシン-EDTA、通常)とは、血球計数器を使用して生細胞をカウントするためのトリパンブルー排除を使用します。所望の細胞密度(プラグあたり5×10 4細胞)に調整します。
- 無菌条件下で別々に全ての溶液(NaOHを、ウシ胎児血清、DMEM 5倍、 炭酸水素ナトリウム)( 表1)を準備し、氷上で冷やしておきます。注:種々の溶液の添加の順序は、細胞内の浸透圧または酸性ショックを防止することが重要です。
- 可能な限り迅速に最終コラーゲン溶液(5ミリリットル)に細胞分散(1.25×10 6細胞)を実行します。気泡を避けながら(上下にピペッティングすることによって)十分に混合し、その後すぐに96ウェルプレートの各ウェルにすぐに使用できる溶液200μlを分配します。穏やかに気泡を除去するために、ウェルの内部に均一に溶液を広げるために、細胞培養フードの作業領域表面上のマルチウェルプレートに衝突します。
- (このステップは96ウェルプレート当たり約15〜20分かかります)すべてのウェルを充填した後、インキュベーターに格納します。
- 一晩に2時間から37℃でプレートをインキュベートします。コラーゲンゲル化( すなわち 、原線維)は30分以内に起こります。一晩のインキュベーションを行うために培養し(100μl/ウェル)、培地を追加します。
フィブリンゲルの2第一層
- フィブリノーゲン溶液の調製。
注:フィブリンゲルの同じバッチは、理想的には、より再現resulのために使用されるべきですフィブリンゲル形成などのTSは、商業的な凍結乾燥フィブリノーゲンの異なるバッチ間で変化してもよいです。- 常に新たに調製したフィブリノゲン溶液を使用します。水和物結晶の形成を回避するために、バイアルを開く前に室温に凍結乾燥したフィブリノーゲンを持参してください。
- 徐々に(最低限必要な最終容量の15%超過を調製考える3 mg / mlでの作業濃度での Ca 2+ / Mgの2+ハンクス平衡塩溶液(HBSSに)予め温めた(37℃)でフィブリノゲンを溶解: 例えば 、5ミリリットルソリューションの5.75ミリリットルで17.25 mg)を。
- フィブリノゲン断片を可溶化するために最初に予め温めたHBSSの滴下を追加します。ビーカー内のへらでより大きなフラグメントを打破します。混合を容易にするために、随時ビーカーを攪拌します。手順中の攪拌プレートを使用しないでください。サスペンションの上下にピペッティングすることによって、残りの粉末を溶かします。
- steriながら生ぬるいフィブリノゲン溶液を保ちます0.22μmのフィルターを通すことにより、溶液をlizing。注:HBSSが十分に暖かいではないか、フィブリノゲンが完全に溶解していない場合は、解決策は、フィルターを詰まらせることがあります。該当する場合は、フィブリノーゲン濃度を低下させ、ひいてはフィブリン血餅剛性もよく、一度か二度フィルターを交換してください。
- 別の方法として、その最終的な音量を調整しながら、すぐに使用できるフィブリノーゲン溶液に、目的とする細胞( 例えば 、内皮細胞)をサスペンド。
- トロンビン溶液を準備します。
- ddH 2 O(50 NIH単位/ ml)の原液を調製し、その後、0.22μmのフィルターを使用して滅菌します。
- フィブリンゲルを生成するために0.0075(V / V):フィブリノーゲン/トロンビン比≥1使用。
- フィブリンゲルを生成します。
- 無菌フィブリノゲンを維持し、すべての次のステップの間、氷上でストック溶液をトロンビン。フィブリンゲルは、24ウェルプレート中に形成させました。
- 速やかにオーバーレイ番目フィブリノゲン溶液(200μL/ウェル)で各ウェルのE面の気泡の形成を回避しつつ。一度に6ウエルを処理します。
- フィブリノゲン溶液は、完全に、ウェルの表面を覆って、45°の角度でプレートを傾け、ウェルの中心にトロンビンをドロップすることにより、第1のウェルにトロンビン溶液の1.5μlを添加し、その後緩やかにするために、水平プレートを旋回したら1-2秒。
- 層流フード(5〜10分)、ゲル化/凝固プロセスが完了するまで下に安定した位置にプレートを残す(NB:重合プロセスは、インキュベーターにプレートを輸送することにより、 例えば 、邪魔してはいけません)。
- 最初の6ウェルを重合した後、全てのウェルが処理されるまで、次の6ウェルについて同じ配列( すなわち 3前の手順)を繰り返します。
フィブリンゲルとに挟まれたコラーゲンプラグの3第2層
- オプションA:(すぐにコラーゲンプラグを使用)。
- フィブリンゲルの第1層は微妙にプレートを傾けることによって、すべてのウェル中で重合していることを確認します。コラーゲンプラグの移動を容易にする(フィブリンゲルを含む)を24ウェルプレートで並んでコラーゲンゲルプラグの側面を含む96ウェルプレートを置き。
- コラーゲンプラグを含むプレートの各ウェルにHBSSの1滴を追加します。
- 薄い(ハンドルとして使用)、注射器に取り付けられた針または(ビデオを見る)マイクロスプーンを使用してウェルから各コラーゲンプラグを取り外します。コラーゲンプラグがウェルにセンタリングされ、その無菌性が良好に維持されていることを確認しながら、1または2つのマイクロスプーンを使用して第1のフィブリンゲル層の上に、各コラーゲンプラグを転送します。
- フィブリノゲン溶液の第二の層と、以前に形成されたフィブリンゲルをオーバーレイ(300μL/ウェル)、2.3で説明したようにトロンビンを導入し、最小限の1を維持:一度に0.0075比と6ウェルのシーケンスを
- オプションB(成長因子低減基底膜(GFRBM)の薄層でコラーゲンプラグをコーティング)。
- 事前にすべての準備ソリューションや楽器を冷却し、GFRBMの凍結アリコートを解凍中に過度の加熱速度に非常に敏感であるため、取り扱い時に( 例えば 、ピペット、チップ、試験管)4℃または氷上で保管してください(メーカーの指示に従ってください) 。
- プレートのウェルから除去した後、純粋なGRFBM溶液100μlを含む氷上で1.5 mlの遠心管中で2分間、各コラーゲンプラグを浸します。
- 前述したように、それは、よく中心で確保しつつ、第1のフィブリン層の上にそれぞれコーティングされたプラグを転送します。 GRFBMがゲルを形成することができるように5分間37℃で、プラグを含むプレートをインキュベート。ステップ3.1.4でのように、第2のフィブリン層を追加します。
4.細胞培養培地条件
- 4(培養液で各ウェルを充填00μl)を。培地および補充物は、細胞株および実験条件に基づいて選択されます。
- 100カリクレイン阻害剤単位(KIU)/ mlの最終濃度で培養培地へのアプロチニン、抗線維素溶解剤を追加します。
注:試験した細胞株に使用される条件の下で細胞培養インキュベーターでプレートを保管してください。 - 一日おきに新鮮な培地で培養液を補充するか、実験的なスケジュールに従って、およびアプロチニンを追加します。新鮮な培地を追加する前に、わずかに(30-35°の角度で)プレートを傾け、慎重に一定の観察下に馴化培地を吸引しながら、ウェルの側面にピペットを傾け。
結果
前述したように、この三次元細胞培養アッセイの興味深い特徴は、癌細胞は、隣接するフィブリンゲルにコラーゲンプラグからの移行だけでなく、二次性腫瘍( 例えば 、衛星腫瘍様構造)を確立することができないだけです。これは、直接、特に長い作動距離コンデンサ( 図2)を用いて、ゲルの厚さを通って低及び高倍率で倒立位相差顕微鏡を?...
ディスカッション
重要な技術脚注として、ギャップは、中枢および末梢ゲルとの間の界面に存在しないことが必須です。それ以外の場合は、フィブリンゲルに侵入/移行する細胞の能力を低下させる可能性があります。トロンビンは、適切に希釈されていない場合、コラーゲンとフィブリンゲルとの間の空間は、培養の最初の24時間の間に形成してもよいです。試験した細胞株は、それによって両方のゲルの間?...
開示事項
The authors have no disclosure.
謝辞
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
資料
| Name | Company | Catalog Number | Comments |
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65 - 85% protein with ≥ 75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5 - 10T IU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
参考文献
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved