このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
改善されたラットのトレーニングパフォーマンスのための革新的なランニングホイールベースのメカニズム
要約
本研究では、ラットで効果的な運動活動を定量化するための革新的なランニングホイールベースの動物モビリティシステムを提供します。ラットに優しいテストベッドは、事前定義された適応加速曲線を使用して、構築され、かつ効果的な運動率と梗塞体積との間に高い相関が脳卒中予防実験のためのプロトコルの可能性を示唆しています。
要約
この研究は、ラットにおける脳卒中の影響の重症度を低減するための運動活性の有効性を定量化する方法として、位置決め走行輪(PRW)を装備した動物の移動システムを示します。このシステムは、このようなトレッドミルと電動式の走行車輪(MRWs)として商業的に入手可能なシステムよりも効果的な動物の運動トレーニングを提供します。唯一の20メートル/分未満の速度を達成することができますMRWとは対照的に、ラットをた15センチ幅のアクリルホイールによってサポートされ、より広々とした高密度ゴムランニングトラックに30メートル/分の安定した速度で実行することが許可されていますこの作品55 cmの直径の。事前定義された適応加速曲線を使用して、システムだけでなく、オペレータのエラーを減少させるだけでなく、指定された強度に達するまで持続的に実行するために、ラットを訓練します。運動の効果を評価する方法として、ラットのリアルタイムの位置が走行輪にデプロイ赤外線センサ4対によって検出されます。かつて適応加速度曲線は、マイクロコントローラを使用して開始され、赤外線センサによって得られたデータは、自動的にコンピュータに記録され、分析されます。比較目的のために、3週間のトレーニングは、トレッドミル、MRWとPRWを用いてラットに対して行われます。外科的に中大脳動脈閉塞(MCAO)を誘導した後、変更された神経学的重症度スコア(mNSS)と傾斜面試験をラットに神経損傷を評価するために行きました。 PRWは、実験的に、このような動物のモビリティ・システムの中で最も有効であると検証されます。さらに、ラット位置解析に基づいて、運動効果の尺度は、そこに効果的な運動および梗塞体積の間に高い負の相関であり、脳損傷の減少実験の任意のタイプのラットの訓練を定量化するために使用することができることを示しました。
概要
ストロークは肉体的にも精神的に無効になって1、2数え切れないほどの患者を残して、世界的に国への財政負担として継続的に存在します。そこに定期的な運動は、神経再生を改善し、神経接続3を強化することができることを示唆する臨床的証拠、4であり、そしてまた、運動は、虚血性脳卒中5に罹患するリスクを減少させることができることが示されています。 8 -運動トレーニングシステムとしてトレッドミルや走行輪のいずれかで、例えば、ラットなどのげっ歯類は、臨床実験6の大多数の演習の有効性を試験するための人間のためのプロキシとして機能します。トレーニングシステムは、通常、ラットが一定の速度で実行される時に、一定期間、ラットを訓練することを含みます。 8 -したがって、トレーニング強度は、一般的に、運動速度および持続時間6に従って計算されます。同じアプローチがに適用されます神経生理学的保護のために必要な運動量を推定します。 11 -しかし、実験演習は時々 、このようなラットつまずくが、落下、またはそれらが走行車輪速度9に追いつくことができません一度レールをつかむときのように、効果がないことが判明しています。言うまでもなく、効果のない運動の事件が大幅に運動効果を減少させます。何の任意の普遍的に受け入れアプローチが存在しないにもかかわらず、現在、脳の損傷を低減するための効果的なエクササイズを定量化するために、効果的なエクササイズのレベルはまだ臨床研究者が神経生理学の規律に運動の利点を説明するための客観的な評価として立っています。
今日の脳のダメージ減少実験12で使用される市販の動物モビリティ・システム上の多くの制限が存在します。トレッドミルのケースでは、ラットは、心理的な驚異的な誘導、電気ショックによって実行することを余儀なくされています動物や最終的な神経生理学的検査結果8における干渉のストレス、13、14。走行車輪、すなわち自発的かつ強制的に2種類、に分類することができます。電動走行車輪(MRWs)を実行するために、ラットを強制的に、ホイールを回すためにモーターを採用しながら、自主ランニングホイールは、原因ラットの物理的特性と能力15の違いの過度の変動を作成し、ラットは自然に実行できるようにします。また、強制的な訓練の形であるにもかかわらず、MRWsはトレッドミル13、16、17よりもラットにあまり心理的ストレスを課します。しかし、MRWsを用いた実験では、ラットは時々輪トラックにレールをつかみ、20メートル/分の9を超える速度で動作するように拒否することによって、運動を中断することを報告しています。これらの例は、現在利用可能な動物の移動システムは、運動効果的な阻害固有の欠点を有していることを示しています。ために客観的なラットの訓練の目的は、非常に効果的なトレーニングシステムの開発が、低干渉では、したがって、神経生理学、運動実験のための喫緊の課題と見られています。
本研究では、脳卒中11の効果の重症度を低下させる上での実験のために非常に効果的なランニングホイールシステムを提供します。トレーニングプロセスの間の干渉要因の数の減少に加えて、このシステムは、それによって効果的な運動活動のより信頼できる推定値を得る、ホイールに埋め込まれた赤外線センサを用いたラットの走行位置を検出します。伝統的なトレッドミルとMRWsの両方で頻繁に運動の中断によって課される心理的ストレスは、得られた運動推定の客観性をゆがめます。この研究で提示された位置決め走行輪(PRW)システムが有効なexeファイルを定量するための信頼性の高いトレーニングモデルを提供しながら、不要な干渉を最小にする試みで開発されていますrcise。
Access restricted. Please log in or start a trial to view this content.
プロトコル
倫理の声明:実験手順は、科学技術研究所動物センターの南台湾大学、国家科学委員会、中華民国(台湾台南市)の動物倫理委員会によって承認されました。
1.実行中のホイール構造を構築
注:すべてのアクリルは透明であるべきです。各使用後のゴムクローラとアクリルシートを拭くためにアルコールを使用し、その後、水で分解し、ホイールを洗ってください。
- 直径55センチ、幅15 cmでアクリル走行輪を取得します。
注:このホイールは、従来の走行輪よりも大きい(直径= 35センチメートル;幅= 12 cm)の(Fのigureの1A)。 - カッターを使用して、ラット( 図1B)のために、ならびに入口および出口として作用する走行輪の一方の側に四半円形開口を切ります。 ACRの内側に高摩擦のゴムクローラの層を配置ylicホイール( 図1B)。
- ランニングホイール( 図1B)を接続するためのベアリングを鉄の棒を置きます。支持フレーム( 図1B)として機能するように走行輪の一方の側にある2つのアクリル三角形の列を配置します。
- ネジを使用して2つの三角形の列の外部側面に厚さ1mmの半円、透明なアクリル板を取り付けます。赤外線センサを展開するために、このシートを使用してください。アクリルシートは約3cm離れて走行輪のそれぞれの側からであることを確認してください。
2.赤外線センサを配備し、効果的なエクササイズエリアの定義
注:アカウントに走行輪のサイズと赤外線システムの設計におけるラットの長さを取ります。ラットは、一度に単一のセンサをトリガします。この実験では、ラットは20〜23センチです。
- 距離で、45°毎(アーク間隔= 21 cm)のアクリルシートに穴を開けます二つの穴の間の試験ラットの長さとほぼ同等です。穴赤外線センサ( 図2A)と同じサイズにしてください。
注:伝統的なMRWsについては、穴を開けごとに70°(アーク間隔= 21センチ、 図2B)。 - PRW実験中、0°〜135°の間で実行されているの定常状態でラットを維持します。
注:効果のない運動領域として他のすべてのセクションを表示しつつ、効果的な運動領域としてこの領域を定義します。伝統的なMRWsについては、140°( 図2B)に0°との間の部分のような効果的な運動領域を定義します。
3.ランニングホイールを駆動
- 走行輪を駆動するブラシレスDCモータとモータドライバを使用してください。
- モーターの中心軸( 図1B)に直径10cmのゴム製のディスクをマウントします。
- モータを支持する鉄骨とスプリングを使用すると、ゴム製のディスクから接続します走行車輪の外側に、モータの中心軸。
注:スプリングはダイナミックモータの高さ調整を可能にし、理由緩いバネの走行輪トラックに切断されるからゴム製ディスクを防ぐために、ネジで協力しなければなりません。 - マイクロコントローラを使用して、直径10cmのゴム製のディスクを駆動するためのモータを操作して、ホイールを観察し、電動走行輪のプラットフォームを作成し、ゴム製のディスクと車輪の滑走路との摩擦による回転します。
- 135°〜0°の間のマウント4赤外線センサを順次( 図2A)。
注:伝統的なMRWsについては、0〜140°( 図2B)との間にセンサーを取り付けます。 - 赤外線センサ4対はそれによって位置決め走行ホイールシステムを形成する、単芯ケーブルを使用して、マイクロコントローラの一般的なピンの両方アクリルシートに取り付けられた接続。
4.適応Acceleratiを構築曲線上
- 三日公式の3週間の運動トレーニングの開始前に、手動で実行しているホイールを操作することにより、ラットを訓練します。
注:目標は、ラットが走行環境に慣れることができるようになり、各ラットは、20メートル/分の速度で動作して耐えることができるかどうかをテストすることです。- ラットがペースを維持することができないまで手動で操作トレーニング中、徐々に走行速度を加速します。これが発生すると、ラットは、定常走行ペースを取り戻すまで、速度を減少させ、ラットが20メートル/分( 図3の破線)に達するまで、その後再び徐々に速度を上げます。手動のトレーニングは、トレーニング曲線を構築するために7匹のラットを伴います。
- 手動テストの3日目に測定したデータに合うように数式を使用して、手動トレーニング(円と曲線、 図3)に最も近い加速曲線を計算します。生データへのフィット式1、C INI = 8、C フィン = 20、τ= 30)は、それぞれ初期速度、最終速度と時定数を表します。
注:この式は、ラットの体の状態に適応します。したがって、適応加速度トレーニングモデルとして計算曲線を参照してください。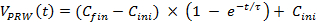 (1)
(1) - 正式な訓練の週1のための式(1)を使用してください。
- 週2とトレーニングの3、式1のパラメータを調整するために、それは速度は30m /分に到達できるようにするには、22から12からの変更は、A、と言うことです。
5.ソフトウェアプログラムの制御
注:排他的マイクロコントローラベースのモータ動作およびその後のデータ分析のためにコンピュータに赤外線センサからの信号の送信のためのコードを開発します。
- 一つのメインプログラムとタイマーの2つの割込みサービス・ルーチン内を含むソフトウェア制御プログラムを書き込むためのCプログラミング言語を使用してマイクロコントローラ18。
- メインプログラムは、マイクロコントローラのレジスタを初期化し、マイクロコントローラのメモリに適応加速度曲線モデルを構築することを確認してください。
- 適応加速曲線を活性化し、全体の訓練期間を計算するためにタイマ0の割り込みサービス・ルーチンを使用してください。
- 赤外線センサから信号データを抽出するために、タイマ1の割り込みサービスルーチンを使用して、コンピュータにデータを転送します。
- 走行輪の速度を調整するために0 Oの位置を記録するために、メインプログラムを使用してください。
- 0℃で受信IRセンサがトリガーされると、メインプログラムによって蓄積された落下の発生、と解釈。秋の発生率の発生時刻モーメントがラットの位置検出数の10%のしきい値をヒットし、訓練を受けたラットのための安全対策として、自動的に走行輪を減速します。注:スピードOラットがセーフゾーン(0 O 135○)に戻り、安全対策のために安定した走行状態を維持できるようになるまでホイールを実行してfを減少させます。
6.ポジショニングランニングホイールシステムを動作させます
- マイクロコントローラをオンにして、オペレータは、毎週のトレーニングモデルを開始するためにボタンを押すのを待ちます。
- 週1のための訓練モデルを開始するには、「スタート」ボタンを押してください。
注:20m /分に達し、自動的に30分後に停止するまで、モータが自動的に適応加速度曲線に基づいて加速します。 - 第2週のための訓練モデルを開始するには、「スタート」ボタンを押してください。
注:30m /分に達し、自動的に30分後に停止するまで、モータが自動的に適応加速度曲線に基づいて加速します。 - 週3のための訓練モデルを開始するには、「スタート」ボタンを押してください。
注:モーター自動的accelera適応加速度曲線に基づいて、TESが30m /分に達し、自動的に60分後に停止するまで。
注記:全訓練プロセスを通して、データを無線でコンピュータに赤外線センサから受信した信号を送信します。
- 週1のための訓練モデルを開始するには、「スタート」ボタンを押してください。
- コンピュータを使用して、(全体の運動処理に効果的な運動の測定値を取得するための位置データを分析
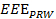 )。式2を参照してください。
)。式2を参照してください。 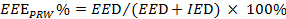 (2)
(2)
注:EEE、EEDとIEDはそれぞれ、効果的な運動対策、効果的かつ非効果的な運動の持続時間を表します。
7.ラットトレーニング
- シャム、制御、トレッドミル、MRWとPRWグループ:ランダム(各群についてはn = 9)5つのグループに成体雄Sprague-Dawleyラットを分割。
- TR すなわち 、3運動グループのための3週間の運動トレーニングを実施eadmill、MRWとPRWグループ、偽および対照群のためにはそうではありません。
注:各運動群のための3週間の運動トレーニングは週1の間に30分間20メートル/分で、30メートル/分週3の間に60分間30週2中の分及び30メートル/分。
8.動物や脳卒中モデル
- 節で述べたように。 7.1は、無作為に5群に、250〜280グラムの間の体重、関連するすべての成体雄Sprague-Dawleyラットを分割します。
- 正確な薬物投与量の計算を確実にするために、全ての動物を秤量します。ペントバルビタールナトリウム(25 mgの/ kgで、腹腔内[IP])とケタミンを含有する混合物(4.4ミリグラム/キログラム、筋肉内[IM])、アトロピン(0.02633ミリグラム/キログラム、[IM])およびキシラジン(6.77ミリグラムでラットを麻酔/ kgで、[IM])。
- 呼吸速度(通常の70から115呼吸/分)、リズム、呼吸、粘膜の色や反射の定期的なテストの深さ、 例えばつま先のピンチ、テールピンチ、まぶた/まつげを監視することにより、麻酔深度を評価しますそして、眼瞼。
- 直腸内に温度プローブを挿入し、別々の加熱ランプを使用して37.5℃に37間の直腸温度を維持。
- 外頸動脈アプローチ19を介して中大脳動脈の開口部を閉塞するために内頸動脈内にフィラメントを挿入して局所虚血、一過性中大脳動脈閉塞(MCAO)を誘導します。
- 内頸動脈にフィラメントを挿入していない一方で、偽手術動物で同じ操作手順を実行します。 1時間局所脳虚血を維持し、フィラメントを取り外し、切開部を閉じ、再灌流を可能にするために引き出すことができたナイロン縫合糸突出、1cmのままにしておきます。
- 3日間1日2回鎮痛のための動物への皮下(SC)鎮痛剤(ブプレノルフィン(0.05ミリグラム/ kg、皮下))の注射を、管理します。
9.神経の損傷を評価します
- 評価それぞれuate神経および運動機能、神経学的重症度スコア(mNSS)20と傾斜面のテスト21による。
注:mNSSモータ(筋肉の状態、異常な動き)、感覚(視覚、触覚および固有受容)と反射試験の複合体です。タスクを実行する障害の1点を与えます。 0-18のスケールでレート神経機能(通常のスコア= 0;最大の赤字スコア= 18)。 - 手術後7日の時間スパン日以上前に、毎日の行動のパフォーマンスの面で全てのラットを評価します。
- 傾斜面を用いたラットの後肢握力を測定します。
- 日常的に傾斜クライミング装置にラットを置き、1週間試験前に装置にラット及び試験条件を順応。
- 装置上で各ラットを置き、順化期間中に装置の上面までのプラットフォームを登るために、ラットを奨励します。
- でラットを配置テスト中に下向きのヘッドを備えた装置の上部。ラットの体軸が25°の角度で始まる傾斜面上に20×20 cm 2のゴムリブ付き表面に沿って留まることを確認してください。
- 動物が平面に保持することができたで最大角度を決定するために、ステッピングモータに接続されたボールねじを使用して動的に角度を増やします。マウスが傾斜面に保持し、その後、滑落イベントを検出することができなかったまで徐々に傾斜面の角度を増やします。傾斜面のベースラインの程度は、初めに25°です。
- 左側と右側の最大角度の平均値、すなわち 、独立して、すべての行動試験を調べ、得点するために、二人の観察者(ラットが与えられていたものを、治療を知らない)を確認して下さい。
- サクリFiのCEのにMCAo後の7日目にすべての動物。生理食塩水22で(ペントバルビタールナトリウムを100mg / kg、腹腔内)深麻酔下の動物の心を潅流。削除して、その後、組織スライサー22を使用して、2.0ミリメートルの冠状切片にスライスされた5分間、冷生理食塩水で脳組織を浸します。
- 次に24時間4℃でのfi xation 5%ホルムアルデヒド溶液にスライスを転送する、30分間、37℃で2、3、5 - 塩化トリフェニルテトラゾリウム(TTC)中に新鮮な脳切片を水没。プレキシグラスホルダーに染色された脳スライスを配置します。
- 画像処理ソフトウェアがロードされ、パーソナルコンピュータに連結したCCDカメラを用いて較正スケールでTTC染色切片を撮影します。各TTC染色した脳切片23から梗塞面積( 平方ミリメートル)を推定するとともに半自動画像解析システムを使用してください。
- すべての脳切片の梗塞領域の合計によって各スライスの総梗塞容積を計算します。マーク非染色領域(虚血性脳)別々に2mm厚のスライスの各側には、梗塞体積および平均値を計算します。
- Calcu後半に補正梗塞体積(CIV)として
CIV = {LT-(RT-RI)}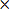 D(3)
D(3)
注:LT及びRTはmm 2での左右半球の領域を示し、それぞれ、RIは、 平方ミリメートルで梗塞面積であり、d = 2mmでスライス厚です。
Access restricted. Please log in or start a trial to view this content.
結果
このセクションでは、比較に専念手術後1週間行われ、mNSSスコアに、5つのグループのうち、平面試験結果と脳梗塞体積を傾ける。 図4Aおよび4Bは 、それぞれ平均mNSSスコアと傾斜面の試験結果の平均値を、提示します。 PRWグループはmNSS改善の面で最高のように表示されます。 PRWとMRWの間トレッドミルとPRW間に有意差は明らかにPRWをより効果?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
このプロトコルは、動物における脳卒中の影響の重症度を減少させるための非常に効果的な走行輪システムを記載しています。ラット向けテストベッドとして、このプラットフォームは、安定した走行速度が所定の適応加速度曲線を用いて、実行中のプロセス全体を通してラットによって維持することができるように同様に設計されています。典型的な訓練システムでは、予め設定されたト?...
Access restricted. Please log in or start a trial to view this content.
開示事項
The authors have nothing to disclose.
謝辞
The authors would like to thank Dr. Jhi-Joung Wang, who is the Vice Superintendent of Education at Chi-Mei Medical Center, and Dr. Chih-Chan Lin from the Laboratory Animal Center, Department of Medical Research, Chi-Mei Medical Center, 901 Zhonghua, Yongkang Dist., Tainan City 701, Taiwan, for providing the shooting venue. They would also like to thank Miss Ling-Yu Tang and Mr. Chung-Ham Wang from the Department of Medical Research, Chi-Mei Medical Center, Tainan, Taiwan, for their valuable assistance in demonstrating the prototype system in real experiments with rats. The author gratefully acknowledges the support provided for this study by the Ministry of Science and Technology (MOST 104- 2218-E-167-001-) of Taiwan.
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Brushless DC motor | Oriental Motor | BLEM512-GFS | |
| Motor driver | Oriental Motor | BLED12A | |
| Motor reducer | Oriental Motor | GFS5G20 | |
| Speedometer | Oriental Motor | OPX-2A | |
| Treadmill | Columbus Instruments | Exer-6M | |
| Infrared transmitter | Seeed Studio | TSAL6200 | |
| Infrared Receiver | Seeed Studio | TSOP382 | |
| Microcontroller | Silicon Labs | C8051F330 | |
| CCD camera | Canon Inc. | EOS 450D | |
| Image processing software | Adobe Systems Incorporated | ADOBE Photoshop CS5 12.0 | |
| Image analysis | Media Cybernetics | Pro Plus 4.50.29 | |
| Sodium pentobarbital | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA P-3761 | |
| Ketamine | Pfizer (Kent, UK) | 1867-66-9 | |
| Atropine | Taiwan Biotech Co., Ltd. (Taoyuan, Taiwan) | A03BA01 | |
| Xylazine | Sigma-Aldrich (Saint Louis, MO, USA) | SIGMA X1126 | |
| Buprenorphine | Sigma-Aldrich (Saint Louis, MO, USA) | B9275 |
参考文献
- Mayo, N. E., Wood-Dauphinee, S., Cote, R., Durcan, L., Carlton, J. Activity, participation, and quality of life 6 months poststroke. Arch Phys Med Rehabil. 83 (8), 1035-1042 (2002).
- Duncan, P. W., Goldstein, L. B., Horner, R. D., Landsman, P. B., Samsa, G. P., Matchar, D. B. Similar motor recovery of upper and lower-extremities after stroke. Stroke. 25 (6), 1181-1188 (1994).
- Raichlen, D. A., Gordon, A. D. Relationship between exercise capacity and brain size in mammals. PLoS One. 6 (6), (2011).
- Trejo, J. L., Carro, E., Torres-Aleman, I. Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus. J Neurosci. 21 (5), 1628-1634 (2001).
- Zhang, F., Wu, Y., Jia, J. Exercise preconditioning and brain ischemic tolerance. Neuroscience. 177, 170-176 (2011).
- Wang, R. Y., Yang, Y. R., Yu, S. M. Protective effects of treadmill training on infarction in rats. Brain Res. 922 (1), 140-143 (2001).
- Ding, Y., et al. Exercise pre-conditioning reduces brain damage in ischemic rats that may be associated with regional angiogenesis and cellular overexpression of neurotrophin. Neuroscience. 124 (3), 583-591 (2004).
- Li, J., Luan, X. D., Clark, J. C., Rafols, J. A., Ding, Y. C. Neuroprotection against transient cerebral ischemia by exercise pre-conditioning in rats. Brain Res. 26 (4), 404-408 (2004).
- Leasure, J. L., Jones, M. Forced and voluntary exercise differentially affect brain and behavior. Neuroscience. 156 (3), 456-465 (2008).
- Chen, C. C., et al. A Forced running wheel system with a microcontroller that provides high-intensity exercise training in an animal ischemic stroke model. Braz J Med Biol Res. 47 (10), 858-868 (2014).
- Chen, C. -C., et al. Improved infrared-sensing running wheel systems with an effective exercise activity indicator. PLoS One. 10 (4), (2015).
- Fantegrossi, W. E., Xiao, W. R., Zimmerman, S. M. Novel technology for modulating locomotor activity as an operant response in the mouse: Implications for neuroscience studies involving "exercise" in rodents. J Neurosci Methods. 212 (2), 338-343 (2013).
- Hayes, K., et al. Forced, not voluntary, exercise effectively induces neuroprotection in stroke. Acta Neuropathol. 115 (3), 289-296 (2008).
- Arida, R. M., Scorza, C. A., da Silva, A. V., Scorza, F. A., Cavalheiro, E. A. Differential effects of spontaneous versus forced exercise in rats on the staining of parvalbumin-positive neurons in the hippocampal formation. Neurosci Lett. 364 (3), 135-138 (2004).
- Waters, R. P., et al. Selection for aerobic capacity affects corticosterone, monoamines and wheel-running activity. Physiol Behav. (4-5), 1044-1054 (2008).
- Ke, Z., Yip, S. P., Li, L., Zheng, X. -X., Tong, K. -Y. The effects of voluntary, involuntary, and forced exercises on brain-derived neurotrophic factor and motor function recovery: A rat brain ischemia model. PLoS One. 6 (2), (2011).
- Caton, S. J., et al. Low-carbohydrate high-fat diets in combination with daily exercise in rats: Effects on body weight regulation, body composition and exercise capacity. Physiol Behav. 106 (2), 185-192 (2012).
- C8051F330/1/2/3/4/5 datasheet. , Silicon Laboratories Inc. Available from: https://www.silabs.com/Support%20Documents/TechnicalDocs/C8051F33x.pdf (2006).
- Longa, E. Z., Weinstein, P. R., Carlson, S., Cummins, R. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke. 20 (1), 84-91 (1989).
- Chen, J. L., et al. Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats. Stroke. 32 (4), 1005-1011 (2001).
- Chang, M. -W., Young, M. -S., Lin, M. -T. An inclined plane system with microcontroller to determine limb motor function of laboratory animals. J Neurosci Methods. 168 (1), 186-194 (2008).
- Gartshore, G., Patterson, J., Macrae, I. M. Influence of ischemia and reperfusion on the course of brain tissue swelling and blood-brain barrier permeability in a rodent model of transient focal cerebral ischemia. Exp Neurol. 147 (2), 353-360 (1997).
- Chen, F., et al. Rodent stroke induced by photochemical occlusion of proximal middle cerebral artery: Evolution monitored with MR imaging and histopathology. Eur J Radiol. 63 (1), 68-75 (2007).
- Almenning, I., Rieber-Mohn, A., Lundgren, K. M., Lovvik, T. S., Garnaes, K. K., Moholdt, T. Effects of high intensity interval training and strength training on metabolic, cardiovascular and hormonal outcomes in women with polycystic ovary syndrome: a pilot study. PLoS One. 10 (9), (2015).
- Costigan, S. A., Eather, N., Plotnikoff, R. C., Taaffe, D. R., Lubans, D. R. High-intensity interval training for improving health-related fitness in adolescents: a systematic review and meta-analysis. Br J Sports Med. 49 (19), (2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved