Method Article
ゼブラフィッシュで筋肉のパフォーマンスと機能を評価するためにタッチ誘発応答と歩行アッセイを使用して
要約
Zebrafish are an excellent model to study muscle function and disease. During early embryogenesis zebrafish begin regular muscle contractions producing rhythmic swimming behavior, which is altered when the muscle is disrupted. Here we describe a touch-evoked response and locomotion assay to examine swimming performance as a measure of muscle function.
要約
ゼブラフィッシュ筋肉の発達は非常にそれらの筋肉の機能と疾患を研究するための優れたモデル作り、哺乳動物系で保存されています。骨格筋の機能に影響を与える多くの筋障害を迅速かつ容易に胚発生の最初の数日にわたってゼブラフィッシュで評価することができます。 24時間後に受精(HPF)により、野生型ゼブラフィッシュは、自発的に自分の尾の筋肉を収縮させ、48 HPF、ゼブラフィッシュ展示制御水泳行動によって。頻度の減少、または他の改変において、これらの動きは、骨格筋の機能障害を示すことができます。遊泳行動を分析し、初期のゼブラフィッシュの開発中の筋肉の性能を評価するために、我々はタッチ誘発エスケープ応答と運動アッセイの両方を利用します。
タッチ誘発エスケープ応答アッセイは、高速単収縮筋線維の収縮に起因する短いバースト運動中の筋肉の性能を評価するために使用することができます。この場合にタップ外部刺激に応答してヘッド、2日後に受精(DPF)で野生型ゼブラフィッシュは、一般的にシャープなターンを伴う、強力なバースト水泳を示します。私たちの方法は、バースト水泳運動時の最大加速度を測定することにより、骨格筋の機能を定量化の加速は、筋肉の収縮によって生じる力に直接比例します。
対照的に、初期のゼブラフィッシュ幼虫の発育中の移動アッセイは筋活動の持続期間中の筋肉パフォーマンスを評価するために使用されます。遊泳行動を監視するために追跡システムを使用して、我々は彼らの骨格筋機能の反射6日齢のゼブラフィッシュの活動との距離の周波数の自動計算を得ます。水泳能力の測定は、疾患モデルと骨格筋の機能に影響を与える変異または化学処理のハイスループットスクリーニングの表現型の評価のために有用です。
概要
過去十年間のゼブラフィッシュの上にますます筋細胞生物学および疾患を研究するために使用されています。その光学的透明性と相まってゼブラフィッシュ胚の急速な外部開発は、筋肉形成、成長、および機能の直接的な可視化を可能にします。筋肉の発達の過程は非常にゼブラフィッシュにおいて保存され、これは筋ジストロフィーや先天性ミオパチー1-8を含む筋疾患の範囲の成功モデル化を可能にしました。ゼブラフィッシュモデルの詳細な検討は、これらの条件の病理生物学に新たな洞察を提供するだけでなく、適切な治療6,9-13のテストのためのプラットフォームを提供していません。
筋疾患のゼブラフィッシュモデルの分析は、筋肉の性能を測定するための信頼性の高い再現可能なアッセイに依存しています。以前の研究では、正常にすることにより、DPF 3と7の間の魚類のゼブラフィッシュ体幹筋の力発生能力を測定しました電気力伝達系14に取り付けられた固定化された魚の収縮を刺激します。これは、力の詳細な測定を提供することができますが、理想的には、より高いスループット実験に適していないと水泳時の筋肉のパフォーマンスを測定することには利点があります。ゼブラフィッシュ筋DPF 2で完全に機能していると魚が刺激に応答して、バースト水泳の動きを誘発することができます。タッチ誘発エスケープ応答アッセイは、収縮力の尺度として用いることができるバースト水泳運動中に加速度を測定するために使用されます。
ミオパチー患者における筋機能の中で最も利用方策の一つは、総距離は硬い平らな面15,16上を歩いた記録6分歩行試験、です。私たちは、私たちが泳いだ距離の合計を監視することにより、ゼブラフィッシュの幼虫、および10分間にわたって各幼虫によって行われた運動の総数DPF 6における筋機能を測定するための同等の試験を適用しています。これが実行されます筋肉性能の信頼性の高スループットの測定値を提供する自動化された追跡システムを使用して。両方の筋肉テストは、高い再現性であり、ゼブラフィッシュミオパシーモデル8における筋性能の差を定量化するために使用されています。
プロトコル
1.タッチ誘発応答アッセイ
- タッチ誘発応答アッセイのための胚DPF 2の調製
- 活動は一日17,18を通して劇的に変化させることができるので、テストが実施される時刻は、実験間で一貫していることを確認してください。
注:実験が行わ盲目にされるべきであり、試験の順序は実験的なアーティファクトを最小限にするために無作為化。 - 魚を割り当て実験を行う個人に不明な番号を、株。これに続いて、自由に利用できるオンラインツールを使用すると、テストの順序を指示するランダムなリストを生成します。
- 試験の前に少なくとも1時間、dechorionate胚絨毛膜に穴をリッピングし、静かに細かいピンセットを使って離れて絨毛膜を引っ張ることによって。 28℃のインキュベーターに戻る前にペトリ皿からごみを取り除きます。
- 活動は一日17,18を通して劇的に変化させることができるので、テストが実施される時刻は、実験間で一貫していることを確認してください。
- タッチ誘発応答アッセイを実施
- ヒート駅28℃で少なくとも15分のGE試験を開始する前に。
注:この段階では、温度制御され、28のままになります テストの期間中にCを°。温度が活性に影響し、一定の温度を維持することが重要です。加熱されたステージを使用できない場合には、水の温度が監視されるべきであり、すべての実験は、同じ温度で行うべきです。 - 胚培地(5のNaCl、0.17mMのKCl、0.33mMのCaCl 2を、水中の0.33 mMのMgSO 4)し照らされ、ステージ上で満たされたペトリ皿を置き、ペトリ皿の上に高速度カメラをマウントします。
- (例えば、ここで説明ストリームピックス5、のような)ビデオカメラの録画ソフトを起動し、「ワークスペース」タブの下に魚の高速遊泳のアクションが記録されていることを確認するためのキャプチャースピードとして毎秒千フレーム(千のfps)を選択します。
- 一度に一つの胚を使った作業、middに胚を置きます視野内のはっきりと見えるゼブラフィッシュとペトリ皿のル。
注:胚が離れて泳ぐ場合奪還と胚の位置付けは、それが刺激に鈍感にし、繰り返しバースト応答となって生じ得ることは、いくつかの疾患モデルにおける筋力低下を促進することができるように、実験前の開始に、別のと交換してください。 - 「記録」ボタンをクリックして録音を始め、頭の上に鈍い針で軽く触れることによって胚に機械刺激の刺激を提供します。
- 胚は視野の外に泳いや休息に戻った後に記録を停止します。
注:機械的刺激次のバーストのエスケープ応答の最初の0.2秒内の加速度ピーク。したがって、少なくとも魚を記録逃避反応の最初の0.2秒の間に視野内にあることを確認してください。ステップ1.2.3に記載されているソフトウェアを使用して、データが自動的に保存されます.AVIビデオファイルとして。このようなダウンロードのために自由に利用できますどちらも無料ビデオキャプチャやソフトニック、などの代替ビデオキャプチャソフトウェアを使用することもできます。 - 新しいペトリ皿に胚を戻し、テストのために別の胚を選択します。 15魚の最小値にテストを実行します。
- ヒート駅28℃で少なくとも15分のGE試験を開始する前に。
- 遊泳行動の定量化
- 遊泳行動を定量化するために、ソフトウェアを起動し、.aviファイル保存したビデオファイルを開くには、「バックグラウンド除去することなく、単一の幼虫ロコモーション」モジュールを選択します。
- 分析に使用される映画のメニューバーの選択領域から「フリーハンド」または「多角形」ツールを使用して。領域は魚の元の位置と魚が泳ぐになると面積の両方を包含することを確認してください。プローブは、分析されるべき領域から除外されていることを確認してください。ソフトウェアは自動的に所望の領域内の魚の軌跡を追跡します。
- トンを実行するには彼の分析、メニューバーから「実験」をクリックし、「実行」を選択します。所望の位置に生データ分析ファイル(.phr形式)を保存するメッセージが表示されたら。保存された後、分析を開始するには、「スタート」をクリックしてください。 「実験」ドロップダウンメニューの下に「停止」をクリックして分析を終了します。結果を含むウィンドウが表示されます。
- 「最大加速度」の値を取得するために右にスクロールします。必要であれば、結果ウィンドウを閉じると、「結果」ドロップダウンメニューの下の「輸出瞬間結果」ボタンをクリックすることで、このデータをエクスポートします。適切な生データ分析ファイルを選択し、[開く]をクリックします。スプレッドシートプログラムで開くことができるテキストファイルが保存先のフォルダに保存されます。
- 各個々の魚や、各株の平均最大加速度を得るために平均的にこの処理を繰り返します ( 図1を参照)。
注:usinの代替としてGここで説明するソフトウェアは、自由に利用可能なImageJソフトウェアと同様のパッケージは、関連する動きデータを抽出するために使用することができます。 3次元粒子追跡プラグインは、水泳軌跡を追跡するために使用することができます。
2.歩行アッセイ - 10分水泳試験
- 水泳分析のための胚DPF 6の調製
- 必要に応じて、ソート胚必要な遺伝子型のため、例えば蛍光タンパク質の発現を調べることによって、または表現型によってであれば、独立したペトリ皿(皿当たり25-30胚)に配置します。あるいは、遺伝子型は移動アッセイの完了後に決定することができます。
- 3 DPFでは、ペトリ皿を再検討し、任意の未孵化胚および破片を除去します。 6 DPFまで28℃のインキュベーターにペトリ皿を返します。
- ゼブラフィッシュの幼虫が最も活性である時刻である午前9時から午後12時、間のすべての株のテストを実行します。 Pにテストと位置の順番をランダム野生型および変異体サンプルの後半は、概日の違いや他の実験バイアスの影響を最小限に抑えることができます。
注:これは、アクティビティが終日劇的に変化することができるため、テスト時間が実験間で一貫していることが重要です。 - 試験前に少なくとも30分、ウェルあたり1幼虫で48ウェルプレートに場所の幼虫。水面がちょうどよくの最上部の下になるように転送した後、気泡がない確実に、井戸を埋めます。 28℃のインキュベーターにプレートを返します。
- インキュベーターからプレートを取り出し、試験前に5分間光に順応。
- 歩行アッセイを行います
- 幼虫は暗闇の中で検出することができるように、60フレーム/秒、最大取り込み、赤外線デジタルカメラが装備されている記録チャンバーへ48ウェルプレートを置きます。全てのウェルは、運動のソフトウェア上で円形グリッドの内側に配置されていることを確認し、すべての幼虫がCLEあることアルリー検出可能。
- ソフトウェアを起動し、「追跡」モジュールを選択します。 「ファイル」の「生成する新しいプロトコル」をクリックして、実験に使用したウェルの数を編集します。テスト期間と「パラメータ」をクリックして、10分の積分期間の両方を設定するドロップダウンメニューと「プロトコルパラメータ」、続いて「時間」タブを選択します。同じ「プロトコルパラメータ」ダイアログボックスの「オプション」タブをクリックし、「Numeriscope」チェックボックスは、「プロトコル・パラメータ」ダイアログボックスを閉じることができ、次のようにクリックされたことを確認します。
- 記録領域を設定するには、ウェルの1にグリッド全体をダブルクリックを強調表示します。 「地域を描く」ボタンをクリックし、左上、右上、左下、ウェルの周りに描き、ソフトウェアが自動的に各ウェルの位置を決定することを可能にする「ビルド」をクリックします。またスケールで描きますバー、「グループに適用」をクリックしてください。完了したら、「領域を描画」ボタンをクリックします。
- 視覚だけで魚の動きが背景なし信号で強調表示されるレベルに「検出閾値」バーをスライドさせることにより検出閾値を決定します。
注記:検出閾値は、株の間で変化し、従って、閾値は、新しい株が試験されたときに決定されなければなりません。代表的なデータは25mmで検出閾値を提示で/秒を使用しました。 - テストを開始する前に、非アクティブの検出、小規模および大規模な動きを移動しきい値を入力します。
注:代表的なデータでは6ミリメートル/秒の非アクティブのしきい値を発表し、30ミリメートル/秒の活動バーストしきい値を使用しました。しきい値は、最小動きがアクティブと見なされるべきかを決定し、必要なレベルは、バーストの活動を考慮し、(小さなアクティブにするがバーストactiviの下に活動の分類を可能にしますTYのしきい値)とバースト活動しきい値よりも大きい(大)の動き。閾値は、分析、特定の魚の株の活性に応じて変更することができます。
注:このアッセイは、光や暗い条件のいずれかで行うことができますが、ゼブラフィッシュの幼虫は暗い18でより積極的であることが示されています。 - ドロップダウンメニュー「パラメータ」の「光駆動設定」ボタンをクリックすることで、0%になるように室内に光強度を設定します。結果のダイアログボックスで、必要な光の設定を追加します。
注:室内の光強度は、幼虫の活性を刺激するために試験時間中にオン・オフするようにトリガすることができます - 記録室のドアを閉じて、ビデオ録画を開始します。
- 遊泳行動の定量化
- 実験が完了した後、「実験」ドロップダウンメニューの下に「停止」をクリックしてください。対話洪明甫すべての結果にxが表示されます。
- Excelでこれらの結果にアクセスするには、「フォルダを含む開く」とその結果]フォルダに表示されたExcelファイルを開く]をクリックします。重要なパラメータは、「smlct」(小さな動きカウント)、「larct」(大運動回数)、「smldist」(小さな動きで魚で覆われた総距離)と「lardist「大きな動きで魚によってカバーさ(総距離です)。
注:録音後、ソフトウェアはまた、中の歩行運動の視覚的な表現を含む((10分の記録のビデオを含む) の.aviファイルの形式と.pngの画像ファイル内に二つの追加の出力ファイルを返します。10-分実験; 図2)を参照してください。 - 歩行値が計算されると、正確に計算された運動値は魚の遊泳運動を描くかどうかを確認するためにaviファイルと.pngのファイルを再生( 図を参照してください3)。
注:ここで説明するソフトウェアを使用する代わりに、そのような自由に利用可能なImageJソフトウェアとしてパッケージは運動器官の行動を追跡するために使用することができます。
結果
タッチは、アッセイは、筋力の比例尺度である水泳の動きの速度と加速度を決定するために使用することができます応答を誘発しました。このような野生型ゼブラフィッシュDPFヘッド2上の小さなタップのような機械的刺激に応答して高速なスイミングアクションを発揮。ビデオは、二つの異なるゼブラフィッシュミオパシーモデルで捕捉し、分析したTgは(ACTA1 D286G -eGFP)、nemalineの有意な筋力低下を有することが示された筋障害、及び重度の筋欠陥が記載されたデュシェンヌ型筋ジストロフィーのモデルのモデル19,20 DPF 5時。典型的なタッチのビデオからの画像は 、 図1Aに示されているアッセイを誘発しました。ゼブラフィッシュの加速を調べ、バースト水泳逃避反応( 図1B)の最初の0.2秒以内にピークに発見されました。このピーク最大加速度は、力Gに比例した尺度を提供します骨格筋の容量をenerating。 Tgは(ACTA1のD286G -eGFP):平均276.0±28.8メートル/秒2、n = 3の独立した反復実験であっ=最大加速度値は、それぞれの株の平均最大加速度値(平均値の±標準誤差)を得るために平均化されました15個々の魚。野生型コントロール:平均= 500.8±50.28メートル/秒2、N = 15、個々の魚を備えた3つの独立した反復実験。 DMD PC2 - / -変異体:平均= 249.9±19.1メートル/秒2、N = 12-19個々の魚を備えた3つの独立した反復実験。 DMDのPC2 +/-ヘテロ接合体:平均= 235.9±8.7メートル/秒2、N = 16-27個々の魚を備えた3つの独立した反復実験。 DMD PC2 + / +野生型ホモ接合体:平均= 230.9±8.7メートル/秒2、N = 8月27日の個々の魚(図1C)を含む3つの独立した反復実験。予想されたように、Tgは(ACTA1のD286G -eGFP)魚は、マウスモデル及び患者データ8,21,22と一致して減少し、筋肉機能を示す最大加速度の有意な減少を有することが見出されました。 DMDのPC2 - / -変異魚はしかし、20( 図1D)、DPF 3から筋肉の欠陥の検出と一致し、2 DPFで、最大加速度に差は認められませんでした。
移動アッセイは、筋肉性能の指標としてゼブラフィッシュ株によって泳い活性及び距離を決定するために、6 DPFで行いました。試験の後、10分の試験期間にわたって水泳運動の概略図は、非アクティブ期間を表すそれぞれ低速および高速運動の期間を表す赤と緑の線と黒線( 図2)で、生成されました。 opposとして非アクティブの比較的無周期を有する個々の野生型ゼブラフィッシュショー高活性試験期間( 図2B)を介して活性が低いのTg(ACTA1 D286G -eGFP)魚にエド。
水泳行動は移動の数および各魚( 図3)で泳い距離の個々の値を平均することによって定量しました。両方のTg(ACTA1 D286G -eGFP)魚( 図3Aおよび図3B)およびDMD PC2 - / -突然変異体魚( 図3C及び3D)は 、それぞれに比べ泳い移動距離の平均数の有意な減少を有することが見出されましたコントロール:Tgは(ACTA1 D286G -eGFP)魚:運動の平均数= 94.3±13.6、平均距離泳いだ= 112.9±18.4ミリメートル、N = 45魚を備える3つの独立した反復実験。野生型コントロール:距離泳いだ= 300.2±22.8ミリメートル、n = 3の独立したRを意味し、177.4±14.0 =動きの数を意味します45魚を備えるeplicate実験。 DMD PC2 - / -変異体:、163.3±30.0 =動きの数を意味する距離泳いだことを意味:298.4±60.37ミリメートル、N = 12-20魚を備えた3つの独立した反復実験。 DMD PC2 +/-ヘテロ接合体:距離泳いだことを意味、運動= 362.3±38.8の平均数:660.3±86.1ミリメートルのn = 17-27魚を備えた3つの独立した反復実験。 PC2 + / +野生型ホモ接合体をDMD:距離泳いだ= 574.3±170.9ミリメートルのn = 8月25日、魚を備える3つの独立した反復実験を意味し、= 341.9±91.6の移動の回数を意味します。
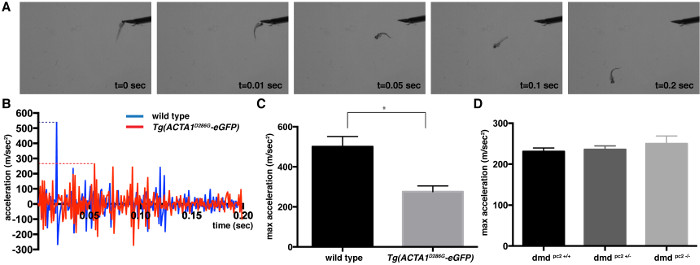
図1:ゼブラフィッシュ胚DPF 2用のタッチ呼び起こす応答アッセイの定量化制御ゼブラフィッシュの(A)スナップショットイメージの間に2 DPFでのアッセイをタッチ呼び起こします。 (B)の最初の0.2秒の加速プロフィールタッチ刺激の適用後に単一のTg(ACTA1 D286G -eGFP)(赤)と単一の制御(青)ゼブラフィッシュ。最大加速度は、点線で表されています。 (C、D)(C) のTg(ACTA1 D286G -eGFP)ゼブラフィッシュのタッチ誘発反応アッセイから記録された最大加速度(メートル/秒2)の定量化と (D)DMD PC2 - / -変異体魚は2 DPFでゼブラフィッシュを制御するために比較しました。エラーバーは、3回の反復実験のために±SEMを表す*はp <0.05。 この図の拡大版をご覧になるにはこちらをクリックしてください。
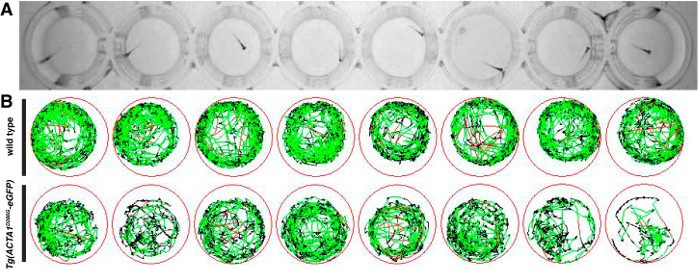
図2: ゼブラフィッシュ胚のための移動アッセイの表現(。A)ゼブラフィッシュ胚を48ウェルプレートに入れ、運動は、赤外線デジタルカメラを使用して上から記録されています。 (B)速い動き、遅い動きを描いた緑色の線と非アクティブを描いた黒い線を(ソフトウェアに入力された検出閾値によって決定される)を示す赤い線でのテスト期間中のゼブラフィッシュの動きの概略図。 の拡大版をご覧になるにはこちらをクリックしてください。この図。
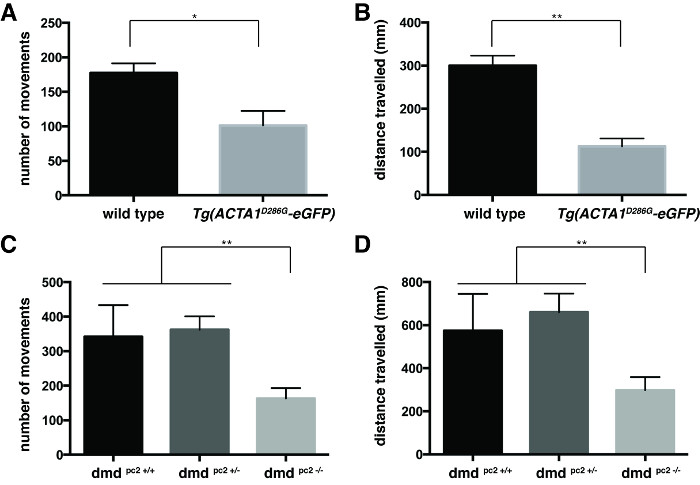
図3: ゼブラフィッシュの幼虫DPF 6のための移動アッセイの定量化 (A)の動きの数と(B) のTgが移動した距離(ACTA1 D286G -eGFP)ゼブラフィッシュは6 DPFでゼブラフィッシュを制御するために、比較の定量。- / - (C)移動の回数とDMDのPC2が移動(D)距離の定量変異魚が6 DPFでゼブラフィッシュを制御するために比較しました。エラーバーは、3回の反復実験のために±SEMを表す* P <0.05、** P <0.01。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
マウス、イヌ、ゼブラフィッシュ、ハエやワームなど、さまざまな動物モデルは、筋疾患の遺伝的および分子的基礎の理解に貢献し、それらに対抗する治療法の開発を支援してきました。ゼブラフィッシュは、筋肉疾患の研究のためのいくつかの利点を誇っています。ゼブラフィッシュは、in vitro培養系では不可能である、適切な生理的環境で複雑な筋肉のパターニングを評価するための遺伝的に操作可能なシステムを提供します。他の脊椎動物モデルとは異なり、製造魚の多くは、一緒になって、その光学的透明性と、 生体内の化学的および遺伝的スクリーニングにおいて迅速、ハイスループットを容易にします。
ここでは、ゼブラフィッシュの胚発生時の筋肉の性能を評価するためのハイスループットおよび自動化された方法を提供するために、ゼブラフィッシュの移動アッセイの開発について説明します。両方のアッセイのためには、その概日リズムを認めなければならず、外部環境刺激が大幅にゼブラフィッシュ遊泳行動17,18に影響を与えます。同じゼブラフィッシュの反復試験はまた、触覚23を刺激に応答して低下を引き起こす慣れにつながります。したがって、実験間の再現性のある結果を達成するために、各ゼブラフィッシュ胚は、日、照明条件の時に標準化する必要があり、一度テストする必要があり、水の温度が厳密に調節する必要があります。
タッチを使用すると、私たちは直接、筋力に比例するバーストスイミングアクションの最大加速度を計測することができる2 DPFで分析を誘発しました。ゼブラフィッシュの前の技術は、筋肉の収縮は、電場を用いて刺激され、筋肉14の力を発生する能力を測定する実験装置の次に胚の両端を結ぶことにより、筋力を検討しました。この方法は、Tの容量を生成する力を測定しながら彼幼虫の筋肉、それは水泳中の幼虫の筋肉によって生成された実際の力を測定するものではありません。したがって、我々は間接的に筋肉の健康の全体的な測定を提供するために、通常の幼虫の水泳運動時に発生する力を評価する方法を開発しました。千フレーム/秒のフレームレートで個々のゼブラフィッシュの動きを記録することが可能な高速ビデオシステムは、目で直接に区別できない筋機能における小さいが有意差を同定するために使用され得ます。これは、電気的に刺激力世代の変化水泳パフォーマンスの変化と相関を報告した方法を、以前に参照するために対象としています。
またタッチが反応アッセイはまた、運動器官の挙動の定量的測定を与えるために、そのような水泳運動24時の身体の波の形状や速度などの水泳運動を評価するために使用することができ誘発しました。
zebrafの自発的な運動のためにっぽい幼虫は3 DPFの後、我々は、筋機能を測定するためにタッチ呼び起こすアッセイを実行することができませんでした。逆に、我々は6 DPFでゼブラフィッシュの幼虫によって泳い距離を決定することにより、より長い期間にわたって、筋肉のパフォーマンスを測定しました。この試験は、筋機能の間接的な尺度であるが、障害筋肉性能8または神経変性25,26を表示する魚を同定することができます。このテストは、6分の歩行試験に類似した測定値を提供するだけでなく、 生体内における薬物または突然変異誘発画面で自動化ハイスループットに適しているだけではなく。
開示事項
The authors have nothing to disclose.
謝辞
We thank Viewpoint for their kind sponsorship of this manuscript. This work was funded by an Australian National Health and Medical Research Council (NHMRC) Project Grant (APP1010110).
資料
| Name | Company | Catalog Number | Comments |
| 21 G x 1' Blunt Needle | Terumo/Admiral Medical Supplies | TE2125 | |
| 48-well plates | Sigma | M8937 | |
| 90 mm Petri Dishes | Pacific Laboratory Products PT | S90001 | |
| High Speed Camera | Baumer | HXC20 | |
| http://www.randomization.com | N/A | Steps 1.1.2, 2.1.3 | |
| Incubator | Thermoline Scientific | TEI-43L | |
| Plastic Pipette | VWR | 16001-188 | |
| StreamPix5 | NorPix | Step 1.2.3 | |
| Temperature Control Unit | Viewpoint | ||
| Tweezers, style 8 | ProSciTech | T04-821 | |
| Zebrabox System | Viewpoint | ||
| Zebralab | Viewpoint | Steps 1.3.1, 2.2.1 |
参考文献
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Gupta, V. A., Kawahara, G., et al. A splice site mutation in laminin-α2 results in a severe muscular dystrophy and growth abnormalities in zebrafish. PLoS ONE. 7 (8), e43794 (2012).
- Gupta, V., Kawahara, G., et al. The zebrafish dag1 mutant: a novel genetic model for dystroglycanopathies. Hum Mol Genet. 20 (9), 1712-1725 (2011).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. Proc Natl Acad Sci. 108 (13), 5331-5336 (2011).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model & Mech. 5 (3), 389-396 (2012).
- Ruparelia, A. A., Oorschot, V., Vaz, R., Ramm, G., Bryson-Richardson, R. J. Zebrafish models of BAG3 myofibrillar myopathy suggest a toxic gain of function leading to BAG3 insufficiency. Acta Neuropathol. 128 (6), 821-833 (2014).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum Mol Genet. 21 (21), 4718-4731 (2012).
- Sztal, T. E., Zhao, M., et al. Zebrafish models for nemaline myopathy reveal a spectrum of nemaline bodies contributing to reduced muscle function. Acta Neuropathol. 130 (3), 389-406 (2015).
- Pichler, F. B., Laurenson, S., Williams, L. C., Dodd, A., Copp, B. R., Love, D. R. Chemical discovery and global gene expression analysis in zebrafish. Nat Biotechnol. 21 (8), 879-883 (2003).
- Peterson, R. T., Shaw, S. Y., et al. Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nat Biotechnol. 22 (5), 595-599 (2004).
- Kawahara, G., Serafini, P. R., Myers, J. A., Alexander, M. S., Kunkel, L. M. Characterization of zebrafish dysferlin by morpholino knockdown. Biochem Bioph Res Co. 413 (2), 358-363 (2011).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. , (2005).
- Smith, L. L., Beggs, A. H., Gupta, V. A. Analysis of skeletal muscle defects in larval zebrafish by birefringence and touch-evoke escape response assays. J Vis Exp. (82), e50925 (2013).
- Sloboda, D. D., Claflin, D. R., Dowling, J. J., Brooks, S. V. Force measurement during contraction to assess muscle function in zebrafish larvae. J Vis Exp. (77), (2013).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test as a new outcome measure in Duchenne muscular dystrophy. Muscle Nerve. 41 (4), 500-510 (2010).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test and other clinical endpoints in duchenne muscular dystrophy: reliability, concurrent validity, and minimal clinically important differences from a multicenter study. Muscle Nerve. 48 (3), 357-368 (2013).
- Hurd, M. W., Debruyne, J., Straume, M., Cahill, G. M. Circadian rhythms of locomotor activity in zebrafish. Physiol Behav. 65 (3), 465-472 (1998).
- MacPhail, R. C., Brooks, J., Hunter, D. L., Padnos, B., Irons, T. D., Padilla, S. Locomotion in larval zebrafish: Influence of time of day, lighting and ethanol. Neurotoxicology. 30 (1), 52-58 (2009).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J Cell Mol Med. 15 (12), 2643-2651 (2011).
- Berger, J., Sztal, T., Currie, P. D. Quantification of birefringence readily measures the level of muscle damage in zebrafish. Biochem Bioph Res Co. 423 (4), 785-788 (2012).
- Ravenscroft, G., Jackaman, C., et al. Mouse models of dominant ACTA1 disease recapitulate human disease and provide insight into therapies. Brain. 134 (4), 1101-1115 (2011).
- Ravenscroft, G., Wilmshurst, J. M., et al. A novel ACTA1 mutation resulting in a severe congenital myopathy with nemaline bodies, intranuclear rods and type I fibre predominance. Neuromuscular Disord. 21 (1), 31-36 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci. 108 (37), 15468-15473 (2011).
- Müller, U. K., van Leeuwen, J. L. Swimming of larval zebrafish: ontogeny of body waves and implications for locomotory development. J Exp Biol. 207 (Pt 5), 853-868 (2004).
- Cheng, W., Tian, J., Burgunder, J. M., Hunziker, W., Eng, H. L. Myotonia congenita-associated mutations in chloride channel-1 affect zebrafish body wave swimming kinematics. PLoS ONE. 9 (8), e103445 (2014).
- Moggio, M., Colombo, I., et al. Mitochondrial disease heterogeneity: a prognostic challenge. Acta Myol. 33 (2), 86-93 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved