このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
リアルタイムでのキトサンフィルム上にペプチドグラフトを監視するためのキャピラリー電気泳動
要約
Free solution capillary electrophoresis is a fast, cheap and robust analytical method that enables the quantitative monitoring of chemical reactions in real time. Its utility for rapid, convenient and precise analysis is demonstrated here through analysis of covalent peptide grafting onto chitosan films for improved cell adhesion.
要約
自由溶液キャピラリー電気泳動(CE)は、電界の印加を介して溶液中の分析物、一般的に荷電した化合物を分離します。クロマトグラフィーなどの他の分析分離技術と比較すると、CEは、堅牢、安価で効果的に(複雑な自然のマトリックスまたはポリマーサンプルの数のために)何の試料調製を必要としません。分離された化合物について観察されたシグナルは、溶液中のそれらの量に正比例するようにCEは、高速かつリアルタイムで混合物の進化を追跡するために使用され得る( 例えば 、化学反応速度論)です。
ここでは、CEの効率は、その後の生物医学的用途のためのキトサンフィルム上へのペプチドの共有結合グラフトを監視するために示されています。キトサンの抗菌性および生体適合性特性は、このような細胞増殖基質として生物医学的応用のための魅力的な材料にします。グリシン - 共有結合ペプチドRGDS(アルギニンをグラフト -アスパラギン酸 - セリン)キトサンフィルムの表面には、細胞の付着を改善することを目的とします。歴史的には、クロマトグラフィーおよびアミノ酸分析は、グラフト化されたペプチドの量の直接測定を提供するために使用されてきました。しかし、CEが提供する試料調製の高速分離と不在がまだペプチドグラフト化プロセスのリアルタイム監視を均等に正確なことができます。 (非グラフト化)ペプチドおよび化学的カップリング剤:CEは、反応混合物の異なる成分を分離し、定量することができます。このように、CEの使用は、下流の適用のための改良されたフィルムになります。
キトサンフィルムは、固体NMR(核磁気共鳴)分光法を介して特徴付けました。この技術は、より時間がかかり、リアルタイムで適用することはできないが、ペプチドの直接的な測定値が得られるので、CE技術を検証します。
概要
自由溶液キャピラリー電気泳動(CE)は、それらの電荷-摩擦比1.2をベースにしたソリューションにおける化合物を分離する技術です。電荷対サイズ比は、多くの場合、文献に記載されているが、この単純化は、この作品でポリペプチドを含む、高分子電解質には適用されません、また、小有機分子3に適切ではないことが示されました。 CEは、固定相のみのバックグラウンド電解質(通常は緩衝液)を有していないという点で他の分離技術とは異なります。これは、技術は合成ポリマー7の上に、このような植物繊維5、発酵ビール6グラフトなどの複雑なマトリックス4とサンプルの大規模な範囲を分析する能力に堅牢にすることができ、食品サンプル8、及び難溶性のペプチド9面倒な試料調製なしと精製。これは、溶解の問題が複雑な高分子電解質(複数の場合に特に重要ですuchがしたがって、キトサン10とジェランガム11)ととして集約された、または溶液中に沈殿が存在し、正常サンプルろ過せずに分析されています。また、朝食用シリアルのサンプルの粒子を含む試料を注入関与朝食用シリアル中の糖の分析は、水8中に沈殿させました。これはまた、分岐した高分子電解質またはコポリマー12,13の分析にまで及びます。大規模な作業はまた、特にプロテオミクス14のためのタンパク質の分析のためにCE技術の開発、天然または合成ペプチド15およびタンパク質およびペプチド16のマイクロチップ分離のキラル分離を完了しました。分離分析はキャピラリー内で行われるので、わずかな試料の体積及び溶剤は、クロマトグラフィー5,6,17を含む他の分離技術より低いランニングコストを持ってCEを可能に用いられます。 CEによる分離が速いので、monitoを可能にします反応速度のリング。これは、改善された細胞接着18キトサンフィルム上のペプチドのグラフトの場合に実証されました。
キトサンは、キチンのN個の -deacetylation由来の多糖類です。キトサンの生体適合性21、18,20 19生体接着剤および細胞増殖基質としてキトサンフィルムは、様々な生物医学的用途に使用することができます。例えばフィブロネクチン、コラーゲンおよびラミニンなどの特定の細胞外マトリックスタンパク質への細胞接着は、直接に細胞22の生存にリンクされています。特に、異なる細胞型は、多くの場合、生存および適切な機能のために、異なる細胞外マトリックスタンパク質への付着を必要とします。キトサン膜への細胞接着は、フィブロネクチン23のグラフト化によって増強されることが示されました。しかし、このような大規模なタンパク質の調製、精製及びグラフト化が経済的に実行可能ではありません。小ペプチドの交互範囲HAVeは大きな細胞外マトリックスタンパク質の特性を模倣することができることが示され。例えば、フィブロネクチン模倣体などのペプチドRGD(アルギニン-グリシン-アスパラギン酸)およびRGDS(アルギニン-グリシン-アスパラギン酸-セリン)は、細胞接着24を促進し増加させるために使用されてきました。キトサンフィルム上へのRGDSの共有結合グラフトは、 生体内 18 でフィブロネクチンに付着することが知られている細胞のための改良された細胞付着をもたらしました。より大きなタンパク質を代入すると、同じ機能が大幅なコスト削減を提供していより小さいペプチドとフィブロネクチンが好き。
以前に18を発行し 、ここで、キトサンにグラフト化ペプチドを行いました。先に示したように、このアプローチはカップリング剤EDC塩酸(1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド)を使用して簡単かつ効率的なグラフト化を提供し、NHS(Nヒドロキシスクシンイミド)とRGDSのカルボン酸を官能化するために上にグラフトキトサンフィルム。このグラフト化方法の2つの利点が、それはキトサンまたはペプチドの任意の変更を必要としないことであり、将来の細胞培養アプリケーション18,20との互換性を最大にするために、水性媒体中で行われます。カップリング剤とペプチドを充電することができるように、CEは、反応速度論の分析に適した方法です。重要なことに、CEを介して反応速度論の分析は、グラフト反応のリアルタイムモニタリングを可能にし、したがって、最適化及びグラフト化の程度を定量化の両方を可能にします。
それは日常的に必要ではないが、CE分析の結果は、共有結合グラフトを実証するために、固体NMR(核磁気共鳴)分光法25,26を用いたキトサンフィルム上にグラフト化ペプチドの直接測定によってオフラインで検証することができますフィルム18上にペプチドの。しかし、固体NMR分光法と比較して、リアルタイムに分析することによって提供さCEは、リアルタイムでのペプチドの消費量の定量化、したがって反応の動態を評価する能力を可能にします。
上記の方法は簡単であり、グラフトの程度を間接的に定量化キトサンフィルム上にグラフト化ペプチドのリアルタイム分析を可能にします。実証された方法は、長い反応物または分析されるべき製品を充電することができるように、異なる化学反応のリアルタイム定量的評価に拡張することができます。
プロトコル
キトサンフィルムの調製
- 超純水で100mlに完全に氷酢酸の2グラムを、計り分けます。
- 2%メートル/ mの酢酸水溶液100mlを追加し、キトサン粉末のうち1.7グラムの重量を量ります。どちらかアルミホイルで、または暗闇の中で覆われて、室温で攪拌棒および磁気撹拌プレートで5日間撹拌します。
- 1時間、23℃で1076×gでキトサン分散液を遠心分離します。シリンジを用いて上清を回収し、沈殿物を捨てます。
- 室温の9センチのプラスチックシャーレに各フィルム、アリコートキトサン懸濁液を10ミリリットルのため。少なくとも7日間乾燥さ覆われたフィルムを残します。
- はさみを使用すると、1×1cmの正方形にドライフィルムをカット。注意:実験は、この段階で一時停止することができます。
リン酸緩衝生理食塩水(PBS)の調製
- 8グラムの塩化ナトリウムを秤量0.2グラムの塩化カリウム1.44グラムのナトリウム水素PHOS酸塩0.24グラムのリン酸二水素カリウム。
- 超純水800mlにこの秤量化学物質を溶解し、pH7.4に濃塩酸で溶液を滴定します。
注意:実験は、この段階で一時停止することができます。
pHは9.2で、75mMのホウ酸ナトリウム緩衝液の調製
- ホウ酸の3.0915グラムを量り分けます。超純水75 ml中に溶解します。
- 10 M以上の濃度の水酸化ナトリウム溶液で9.2のpHをホウ酸溶液を滴定します。
注意:濃水酸化ナトリウム溶液は腐食性であり、手袋をして取り扱ってください。 - 溶液100mlを得るために、超純水で完了する。これは、pH 9.2での500mMホウ酸ナトリウム緩衝液をもたらします。
- 75mMのホウ酸ナトリウム緩衝液に超純水で500 mMのホウ酸ナトリウム緩衝液を希釈します。注意:実験は、この段階で一時停止することができます。
キトサンFiは4準備グラフト反応のためのLMS
- 室温でのペトリ皿に2時間5mlのPBSで10平方キトサンフィルム(1×1センチ)すすぎます。
- この間、キャピラリー電気泳動装置(ステップ5)を調製し、検証します。
5.キャピラリー電気泳動機器の準備と検証
- 50μmの内径43.5センチメートル裸の溶融シリカキャピラリーを準備すると設定された長さで、キャピラリーのポリマー外側コーティングを弱めることによって(全長、検出ウィンドウへの効果的な長さは43.5センチメートル通常、35センチメートルです)鈍い器具は、次にキャピラリをスナップ。
- 入口から8.5センチメートルでのポリマーコーティングを燃やすためにライターを使用することにより、キャピラリーのためのウィンドウを作成し、それを冷却した後、エタノールでそれを拭いてください。軽量化と数ミリメートルのための各端部でキャピラリーのコーティングを燃やす、そしてそれが冷却した後、エタノールでそれを拭いてください。
- キャピラリーINSIを配置検出ウィンドウドと入口と出口に同じ長さでそれを配置し、カセットのスピンドルの周りに巻き付けることによりキャピラリーカセットに取り付けます。そして、キャピラリー電気泳動装置にカセットを取り付けます。
- 各分離するための方法のパラメータを設定します。ソフトウェアのメニューで、「方法」、次に「メソッド全体の編集」を選択します。 (例えば、25℃、10分、30キロボルト)分離のために用いられる温度、時間、電圧、およびバイアルを設定します。
- プレコンディショニングセクションにおいて、連続フラッシングセット(水中)、1M水酸化ナトリウムで10分、(水に)0.1 M水酸化ナトリウムで5分間、超純水及び75mMのホウ酸ナトリウム緩衝液で5分で5分間一連の分析の第一の方法のためのpH 9.2で。
- (水中)1 M水酸化ナトリウム、pHが9時75 mMのホウ酸ナトリウム緩衝液で5分間で1分:後続のメソッドの場合、セットにプレコンディショニングセクション内の連続フラッシュを設定します。2。
- 注入部では、すべてのメソッドのために10秒間30ミリバールの圧力で流体力学的注射のためのパラメータを設定します。分離部では、すべてのメソッドのための9分間、25℃で30 kVのに分離条件を設定します。
注:メーカーの間で変化してもよいCE機器を操作するための手順として、特定のCE機器のマニュアルを参照してください。日に1 M水酸化ナトリウム溶液を調製します。
- 注入し、(75mMのホウ酸ナトリウム緩衝液450μlの中に希釈した水に、10%v / vのジメチルスルホキシド10μlの(DMSO))ニュートラル内部標準を分離します。キャピラリーの有効性を確認するために、そして(材料のリストを参照してください10グラム∙L -1で超純水に溶解した)オリゴアクリレートの標準と同じように注入し、独立しました。グラフト反応を開始する準備ができるまで、ここでシーケンスを一時停止します。
キトサンフィルム上にRGDSの6グラフト
- ペプチドを秤量(1mgのRGDS)そしてカップリング剤(3 mgのEDC-HClおよび2mgのNHS)。
- 2時間PBS中キトサンフィルム浸漬開始後、ペプチド及びPBS 5ml中のカップリング剤を溶解します。
- この溶液の50μlのアリコートを取ります。アリコートに内部ニュートラル標準としての水中で10%(v / v)のDMSOの2μLを加えます。 CEとのアリコートを分析する(ステップ7を参照)。
- 5mlのPBSを削除するペトリ皿からキトサンフィルムをリンスするために使用。キトサンフィルムを含むペトリ皿にペプチドとカップリング剤5mlの溶液を加えます。
- パラフィンフィルムでペトリ皿を覆い、室温でオービタルシェーカー上に置きます。設定した時刻に反応媒体の50μlのアリコートを取ります。
注:CEとの合計分析時間は、15分では、このように一定分量を15分毎(または2つの反応が並行して監視される場合、30分毎など )をとることができます。- 各アルの内部ニュートラル標準としての水中で10%(v / v)のDMSOの2μLを加えますiquot。
注:一定分量は、すぐに彼らが取られるようにCEを用いて分析する必要があります(ステップ7を参照)。
- 各アルの内部ニュートラル標準としての水中で10%(v / v)のDMSOの2μLを加えますiquot。
- 揺れやアリコート除去の4時間後、シェーカーからペトリ皿を削除します。ペトリ皿からの反応媒体を削除します。キトサンフィルムをすすぐためにPBSの5ミリリットルを追加します。
- ペトリ皿からPBSを削除し、超純水でキトサンフィルムをすすぎ、それらを一晩乾燥させます。超純水を外し、プラスチック製のペトリ皿に-20℃でフィルムを保管。
グラフト反応の7モニタリングCEを使用しました
- すぐにセクション5.2のように分析条件を使用して、ペトリ皿から除去した後に注入し、反応媒体の別個のアリコート。
- 分離が完了した後、10分間超純水でキャピラリーをすすぎます。 10分間の空のバイアル(空気)と同一平面を介して乾燥させます。
注記:この実験は、この段階で一時停止することができます。
8.データトリート CE用tment
- 分離時の電流と(この場合はDMSO)電気モビリティマーカーの移動時間の両方がオリゴアクリレートの標準的な分離のために認められたものと類似していることを確認することにより、各分離の妥当性を確認してください。
注:最大10〜15%の変化(高い再現性が要求される場合、電気泳動移動度の値ではなく移動時間を使用する必要があります)期待される電流は約50μAの値と1.3分の移動時間値から許容可能です。 - 成功した各分離のために、右の輸出をクリックして適切な信号を選択し、特定のデータセットを選択することにより、キャピラリー電気泳動ソフトウェアからの生データをエクスポートします。
- (移動時間の関数としてのUV吸光度として提示)CEによって記録された生データを変換します。式(1)以下の電気泳動移動度μにX軸(移動時間t m)を変換します。
nは1 "SRC =" /ファイル/ ftp_upload / 54549 / 54549eq1.jpg "/>(1)
L dは検出器の長さであり、L tはキャピラリーの全長であり、Vは電圧であり、 そしてT EOは中性種(この場合はDMSO、内部標準)27の移動時間です。
28:Wは、(μ)は、以下の式(2)電気泳動移動度の分布に生データ(AUにおける吸光度)のY軸の変換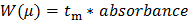 (2)
(2)
ペプチドグラフトされたフィルム18の9その他のキャラクタリゼーション
- ペプチドグラフト化キトサンフィルムを挿入し、4ミリメートル固体NMRローターに、自分自身の周りに巻か。フィルムを膨潤、ロータを閉じるためにリン酸緩衝生理食塩水で回転子を埋めます。数時間待ってください。
- 13でフィルムを分析</ SUP> C NMR分光法18。
結果
CEは、キトサンフィルム上のペプチド( 例えば 、RGDS)のグラフトの監視に適しています。適切なカップリング剤としては、キトサン上にグラフトされる( 図1)のペプチドを有効EDC・HCl及びNHSを含みます。 CEは、反応媒体から、目的の異なる分子を分離することができます。電気泳動上のピークを割り当てるには、純粋なRGDSは、EDC-HCl及びNHSは、?...
ディスカッション
ここで説明されたプロトコルのシンプルさは、広範囲のアプリケーションに、それは理想的に適しています。しかし、特に注意は、以下の重要なステップのに支払われる必要があります。
適切なCE機器の準備
日に毛細管及び機器の正当性を確認する直前に、未知試料の分離(ならびに分離の一連の終了時)に知られている標準を分離す?...
開示事項
著者は、彼らが競合する金融利害関係を持たないことを宣言します。
謝辞
MG, MO'C and PC thank the Molecular Medicine Research Group at WSU for Research Seed Funding, as well as Michele Mason (WSU), Richard Wuhrer (Advanced Materials Characterisation Facility, AMCF, WSU) and Hervé Cottet (Montpellier) for discussions.
資料
| Name | Company | Catalog Number | Comments |
| Water | Millipore | All water used in the experiment has to be of Milli-Q quality | |
| Chitosan powder (medium molecular weight) | Sigma-Aldrich | 448877 | lot MKBH1108V was used. Significant batch-to-batch variations occur with natural products such as polysaccharides |
| Acetic acid - Unilab | Ajax Finechem | 2-2.5L GL | laboratory reagent |
| Dimethylsulfoxide | Sigma-Aldrich | D4540 | laboratory reagent, slightly hazardous to skin, hazardous if ingested |
| Sodium hydroxide | Sigma-Aldrich | 221465 | laboratory reagent, corrosive |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide | Sigma-Aldrich | D80002 | Irritant to skin |
| N-hydroxysuccinimide | Sigma-Aldrich | 130672 | Irritant to skin |
| Sodium chloride | Ajax Finechem | 466-500G | laboratory reagent |
| Potassium chloride - Univar | Ajax Finechem | 384-500G | analytical reagent, slight skin irritant |
| Disodium hydrogen phosphate - Unilab | Ajax Finechem | 1234-500G | laboratory reagent, slight skin irritant |
| Potassium dihydrogen phosphate - Univar | Ajax Finechem | 4745-500G | analytical reagent, slight skin irritant |
| Oligoacrylate standard | custom made | See reference for synthetic protocol: Castignolles, P.; Gaborieau, M.; Hilder, E. F.; Sprong, E.; Ferguson, C. J.; Gilbert, R. G. Macromol. Rapid Commun. 2006, 27, 42-46 | |
| Boric acid | BDH AnalR, Merck Pty Ltd | 10058 | Corrosive |
| Hydrochloric acid - Unilab | Ajax Finechem | A1367-2.5L | laboratory reagent, corrosivie |
| Fused silica tubing | Polymicro (Molex) | TSP050375 | Flexible fused silica capillary tubing with standard polyimide coating, 50 µm internal diameter, 363 µm outer diameter |
| Agilent 7100 CE | Agilent Technologies | G7100CE | Capillary electrophoresis instrument |
| Orbital shaker | IKA | KS260 | |
| Electronic balance | Mettler Toledo | MS204S | |
| Milli-Q Synthesis | Millipore | ZMQS5VF01 | Ultrapure water filtration system |
| Parafilm | Labtek | PM966 | Parrafin wax |
参考文献
- Muthukumar, M. Theory of electrophoretic mobility of a polyelectrolyte in semidilute solutions of neutral polymers. Electrophoresis. 17, 1167-1172 (1996).
- Barrat, J. L., Joanny, J. F. . in Advances in Chemical Physics, Vol Xciv Vol. 94 Advances in Chemical Physics. , 1-66 (1996).
- Fu, S. L., Lucy, C. A. Prediction of electrophoretic mobilities. 1. Monoamines. Anal. Chem. 70, 173-181 (1998).
- Harvey, D. . Modern Analytical Chemistry. , (2000).
- Oliver, J. D., Gaborieau, M., Hilder, E. F., Castignolles, P. Simple and robust determination of monosaccharides in plant fibers in complex mixtures by capillary electrophoresis and high performance liquid chromatography. J. Chromatogr. A. 1291, 179-186 (2013).
- Oliver, J. D., Sutton, A. T., Karu, N., Phillips, M., Markham, J., Peiris, P., Hilder, E. F., Castignolles, P. Simple and robust monitoring of ethanol fermentations by capillary electrophoresis. Biotechnology and Applied Biochemistry. 62, 329-342 (2015).
- Thevarajah, J. J., Sutton, A. T., Maniego, A. R., Whitty, E. G., Harrisson, S., Cottet, H., Castignolles, P., Gaborieau, M. Quantifying the Heterogeneity of Chemical Structures in Complex Charged Polymers through the Dispersity of Their Distributions of Electrophoretic Mobilities or of Compositions. Anal. Chem. 88, 1674-1681 (2016).
- Toutounji, M. R., Van Leeuwen, M. P., Oliver, J. D., Shrestha, A. K., Castignolles, P., Gaborieau, M. Quantification of sugars in breakfast cereals using capillary electrophoresis. Carbohydr. Res. 408, 134-141 (2015).
- Miramon, H., Cavelier, F., Martinez, J., Cottet, H. Highly Resolutive Separations of Hardly Soluble Synthetic Polypeptides by Capillary Electrophoresis. Anal. Chem. 82, 394-399 (2010).
- Mnatsakanyan, M., Thevarajah, J. J., Roi, R. S., Lauto, A., Gaborieau, M., Castignolles, P. Separation of chitosan by degree of acetylation using simple free solution capillary electrophoresis. Anal. Bioanal. Chem. 405, 6873-6877 (2013).
- Taylor, D. L., Ferris, C. J., Maniego, A. R., Castignolles, P., in het Panhuis, M., Gaborieau, M. Characterization of Gellan Gum by Capillary Electrophoresis. Australian Journal of Chemistry. 65, 1156-1164 (2012).
- Thevarajah, J. J., Gaborieau, M., Castignolles, P. Separation and characterization of synthetic polyelectrolytes and polysaccharides with capillary electrophoresis. Adv. Chem. 2014, 798503 (2014).
- Sutton, A. T., Read, E., Maniego, A. R., Thevarajah, J., Marty, J. -. D., Destarac, M., Gaborieau, M., Castignolles, P. Purity of double hydrophilic block copolymers revealed by capillary electrophoresis in the critical conditions. J. Chromatogr. A. 1372, 187-195 (2014).
- Righetti, P. G., Sebastiano, R., Citterio, A. Capillary electrophoresis and isoelectric focusing in peptide and protein analysis. Proteomics. 13, 325-340 (2013).
- Ali, I., Al-Othman, Z. A., Al-Warthan, A., Asnin, L., Chudinov, A. Advances in chiral separations of small peptides by capillary electrophoresis and chromatography. J. Sep. Sci. 37, 2447-2466 (2014).
- Kasicka, V. Recent developments in capillary and microchip electroseparations of peptides (2011-2013). Electrophoresis. 35, 69-95 (2014).
- Taylor, D. L., Thevarajah, J. J., Narayan, D. K., Murphy, P., Mangala, M. M., Lim, S., Wuhrer, R., Lefay, C., O'Connor, M. D., Gaborieau, M., Castignolles, P. Real-time monitoring of peptide grafting onto chitosan films using capillary electrophoresis. Anal. Bioanal. Chem. 407, 2543-2555 (2015).
- Rinaudo, M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci. 31, 603-632 (2006).
- Li, Z., Leung, M., Hopper, R., Ellenbogen, R., Zhang, M. Feeder-free self-renewal of human embryonic stem cells in 3D porous natural polymer scaffolds. Biomaterials. 31, 404-412 (2010).
- Domard, A. A perspective on 30 years research on chitin and chitosan. Carbohydr. Polym. 84, 696-703 (2011).
- Shekaran, A., Garcia, A. J. Nanoscale engineering of extracellular matrix-mimetic bioadhesive surfaces and implants for tissue engineering. Biochim. Biophys. Acta Gen. Subj. 1810, 350-360 (2011).
- Custodio, C. A., Alves, C. M., Reis, R. L., Mano, J. F. Immobilization of fibronectin in chitosan substrates improves cell adhesion and proliferation. J. Tissue Eng. Regen. Med. 4, 316-323 (2010).
- Boateng, S. Y., Lateef, S. S., Mosley, W., Hartman, T. J., Hanley, L., Russell, B. RGD and YIGSR synthetic peptides facilitate cellular adhesion identical to that of laminin and fibronectin but alter the physiology of neonatal cardiac myocytes. Am. J. Physiol. Cell Physiol. 288, C30-C38 (2005).
- Lefay, C., Guillaneuf, Y., Moreira, G., Thevarajah, J. J., Castignolles, P., Ziarelli, F., Bloch, E., Major, M., Charles, L., Gaborieau, M., Bertin, D., Gigmes, D. Heterogeneous modification of chitosan via nitroxide-mediated polymerization. Polym. Chem. 4, 322-328 (2013).
- Gartner, C., Lopez, B. L., Sierra, L., Graf, R., Spiess, H. W., Gaborieau, M. Interplay between Structure and Dynamics in Chitosan Films Investigated with Solid-State NMR, Dynamic Mechanical Analysis, and X-ray Diffraction. Biomacromolecules. 12, 1380-1386 (2011).
- Castignolles, P., Gaborieau, M., Hilder, E. F., Sprong, E., Ferguson, C. J., Gilbert, R. G. High resolution separation of oligo(acrylic acid) by capillary zone electrophoresis. Macromol. Rapid Commun. 27, 42-46 (2006).
- Chamieh, J., Martin, M., Cottet, H. Quantitative Analysis in Capillary Electrophoresis: Transformation of Raw Electropherograms into Continuous Distributions. Anal. Chem. 87, 1050-1057 (2015).
- Maniego, A. R., Ang, D., Guillaneuf, Y., Lefay, C., Gigmes, D., Aldrich-Wright, J. R., Gaborieau, M., Castignolles, P. Separation of poly(acrylic acid) salts according to topology using capillary electrophoresis in the critical conditions. Anal. Bioanal. Chem. 405, 9009-9020 (2013).
- Chung, T. W., Lu, Y. F., Wang, S. S., Lin, Y. S., Chu, S. H. Growth of human endothelial cells on photochemically grafted Gly-Arg-Gly-Asp (GRGD) chitosans. Biomaterials. 23, 4803-4809 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved