Method Article
マウスにおける加速アテローム性動脈硬化症の誘導:ワイヤー傷害モデル
要約
本研究は、マウスにおける加速アテローム性動脈硬化の誘導のための侵襲的処置を説明する。電気またはクライオによる傷害を用いた他の方法と比較して、機械的誘発傷害は、再血管化療法後の修復の人間の状態を模倣し、関係する分子機構の研究に理想的である。
要約
アテローム性動脈硬化症は、動脈壁に発症する増殖性線維炎症性疾患であり、血流の不足または血流の欠如を誘発する。さらに、欠陥血管壁の破裂により、アテローム性動脈硬化症は、心筋梗塞または脳卒中の主な原因および最も頻繁な死因を表す閉塞性血栓形成を誘導する。心血管分野の進歩にもかかわらず、多くの疑問は未回答のままであり、アテローム性動脈硬化症の分子メカニズムとその効果についての理解を深めるためには、追加の基礎研究が不可欠です。限られた臨床研究のために、ステント移植、バルーン血管形成術、または内動脈切除術後のネオインティマ形成などの動脈硬化状態を再現する代表的な動物モデルが必要である。マウスは多くの利点を提示し、分子プロセスを研究するための最も頻繁に使用されるモデルであるため、現在の研究は、再血管化手順後の動脈における新内皮形成の人間の状態を代表する内皮性脱細モデルとしても知られている内皮性脱細の侵襲的処置を提案している。
概要
アテローム性動脈硬化症は心筋梗塞や脳卒中などの心血管イベントの根底にある主な病理である。急性心血管症候群を引き起こす主なメカニズムは、プラーク破裂、表面浸食、血栓形成である。プラークの発達に関連する複数の臨床状況があります:ネイティブアテローム硬化性プラーク、内動脈摘出後のレステノーシス、およびステント移植を伴う/無しのバルーン血管形成術後のレステノーシス1。動脈損傷後、炎症過程2,3 の抑制と内皮区画の回復は、さらなる合併症1を予防するために不可欠である。臨床研究は、倫理的な配慮、コスト、および基本的なメカニズムの知識の欠如のために組織および血液サンプルに限定されています。これらの理由から、臨床状態を再現できる動物モデル4-6の分子機構を研究する必要があります。アテローム性動脈硬化症の文脈における加速ネオインティマ形成の私達のモデルは、小動物7-11でこれらのモデルの実施における長年の経験の結果である。マウスモデルは、取り扱いの容易さ、動物の購入とケアに関連する低コストによる大型動物群を持つ能力、および様々なトランスジェニックおよびノックアウト株の可用性のために、研究のための最も魅力的なモデルです。
マウスモデルの主な欠点は、動脈硬化性疾患(頸動脈、大動脈、大腿動脈)を受けた主動脈の小さなサイズであり、血管を操作し、アテローム硬化性プラークを侵襲するために有資格の外科的専門知識とスキルを必要とする。そこで、加速ネオインティマ形成のモデルは、内動脈切除術またはステント移植後の残り口の文脈において、本論文で提案される、関心のある人材の導入を容易にするための段階的なガイドラインおよび提案を提示する。もう一つの欠点は、正常な動脈壁に脱潤がなされることであり、したがって、ネオインティマ形成は臨床状況と比較して中程度になることである。アポリポプロテインEノックアウト(Apoe-/-)マウスに高脂肪食を与えた高レベルの血漿コレステロールは、ネオインティマ形成に必要な適切な炎症促進環境を作り出す。
手術は実体顕微鏡で行われる。頸動脈は、腹側頸部領域の中央部切開によって露出される。頸動脈の上および周囲の解剖学的構造は、手術後の炎症を軽減するために最小限に操作される。頸動脈分岐が露出している。加速ネオインティマ形成を誘導するために、内部および外部の頸動脈は血流停止およびそれに続く一般的な頸動脈の脱潤のために準備される。結論として、この方法は、動物の手術における最小限の経験を持つ人員によって学ぶことができます。
プロトコル
本稿で紹介する実験は、ドイツの法律とヨーロッパの動物の治療ガイドラインに従って行われます。動物は、R.トルバ博士とA.トイブナー博士(動物福祉官)の監督の下、ドイツのアーヘン大学病院動物科学研究所の動物施設で飼育されています。
1. 動物のケア
- マウスを専門のケアユニットに保管し、食品への適切なアクセスと専門の獣医の制御と治療を確保します。動物が第三者から移動または購入された場合は、手続きを受け入れる前に1週間の宿泊期間を確認してください。
2. 高脂血症誘導
- 飼料6-8週齢、18-20g、女性(オプション)ApoE-/-- アテロ原性食(21%脂肪、0.15%コレステロール、19.5%カゼイン、wt/wt)を外科的処置の1週間前に、アテローム硬化性プラーク分析が行われるまで食事を継続する。
3. 手術準備
- 体重で100mg/kgケタミン、体重で10mg/kgキシラジンの腹腔内注射を使用してマウスを麻酔します。反射神経とウィスカーの動きの欠如によって手術前に適切な麻酔を確認します。少量の無菌眼軟膏を目に入れ、乾燥を最小限に抑えます。
- 滅菌材料や器具を使用して、手術中の感染を避けるために、無菌状態の維持を確保します。
- 腹側頸部領域でマウスを剃ります。皮膚を切開前にベタジンで消毒する。気管の上に、首の領域の中央値領域に1cmの皮膚切開を行います。
- 気管領域の適切なビューを確保するために2つの脂肪体を分離します。筋層を保持し、頸動脈を露出するリトラクターを使用します。存在する場合は、頸動脈を覆う薄筋層の鈍解解を行う。
- 鋭い湾曲した鉗子を使用して頸動脈を迷走神経および頸静脈から分離する。したがって、内部および外的頸動脈を有する分岐領域が目に見えるべきである。手術中の組織の乾燥を避けるために、0.9%NaClを使用してください。
4. ワイヤー傷害
- 頸動脈の下に長さ7cmの0/5シルク縫合糸を置き、大動脈弓に近い。開いたループを作成し、いつでも閉じる準備ができます。
- 外的頸動脈の周りに2つの0/7シルク縫合糸(それぞれ1.5cmの長さ)を配置します:分岐点の近くに1つのループ、そして可能な限り遠位のループを1つ。いつでも閉じることができるオープンループとして準備してください。
- 内側頸動脈の下に1つの0/7シルク縫合糸(長さ1.5cm)を置きます。オープンループとして準備し、いつでも閉じる準備ができています。
- マウスヘッドをオペレータに向かってマウステーブルに置き、否定中のガイドワイヤ挿入に適切な位置を確保します(図1A)。
- 顕微鏡的な観点の下で、ヘモスタット鉗子で0/5シルク縫合の端を保持し、引っ張ることによって、一般的な頸動脈を通る血流を停止する。
- 一般的な頸動脈合字の直後に、内頸動脈上に配置された縫合ループと外部頸動脈の遠位縫合糸をしっかりと閉じる(図1B)。
- 小さな切開(動脈切開、血管径の半分)を外頸動脈に遠位、2つのループの間、小さいはさみを使用して行う(図1C)。切開が大きすぎる場合は、トラブルシューティングの手順に従ってください(説明を参照)。
- 市販のガイドワイヤを使用するか、社内の専門担当者を使用してガイドワイヤを磨きます。14インチの研磨されたフレキシブルガイドワイヤーをアルコールで消毒し、0.9%NaClの液滴で湿らせて、容器に適切に滑り込むようにします。
- 外部頸動脈の横動脈切開術を介して一般的な頸動脈にガイド線を挿入する(図1D)。回転しながら船に沿ってガイドワイヤーを通過させることにより、内皮の否定を得る。この手順を 3 回繰り返します。各マウスの回転の振幅を同じに保ち、再現性を高める。
- 外頸動脈の近位ループをしっかりと閉じます。一般的な動脈の周りの縫合糸と内部頸動脈の周りの縫合線を切断することによって頸動脈の血流を回復する。
5. 縫合と回復
- リトラクタを取り除き、筋肉層と2つの脂肪体を生理学的位置に戻します。
- 心エコーの測定が必要な場合は、3つの分離された縫合糸0/6で皮膚を閉じます。イメージングが必要ない場合は、金属クリップを使用してスキンを閉じます。
- マウスを赤外光の下の左側に置いて、目が覚ますまで置きます。完全に回復するまで、動物を放置したり、他の動物の会社に放置しないでください。
- 将来の識別のために、ローカル システムを使用してマウスをマークします。地元の施設の動物福祉担当者に尋ねる。
6. アテローム硬化性プラークの分析
- 体重で100mg/kgケタミン、体重で10mg/kgのキシラジンを腹腔内注射を使用して、終点でマウスを麻酔します。反射神経とウィスカーの動きの欠如によって適切な麻酔を確認します。
- レトロ軌道または心臓穿刺による排泄を行い、血液を採取してさらなる分析を行う 2.
- ベタジンで皮膚を消毒します。胸腔を開き、心臓の右大腸を取り除きます。リン酸緩衝液を左心室を通して浸透し、残りの血液を血管から除去し、4%PFAを浸透して組織を固定する。
- 固定が必要ない場合は、2,4,11を洗浄した直後に頸動脈を外植する。目的の分析を用いて標準プロトコルを実行します:パラフィン埋め込み、凍結切除、mRNAまたはタンパク質分析など。
- 形態測定では、湾曲した鉗子と小さいはさみを使用して大動脈アーチに近似するように、分岐を含む頸動脈を慎重に除植し、最小限の操作で。
- 標準的な埋め込みプロトコルを使用してパラフィンブロックに頸動脈を埋め込む。横断的な切り離しを行うために、頸動脈を分岐の直立に置く。分岐から始まる5μmの厚いシリアルセクションをカットし、コーティングされた組織学的スライド上ですべてを収集します(図2A)。
- ラミナ2,4,11を強調するためにMovat染色を使用して10番目のセクションごとに染色します。すべての血管の顕微鏡写真を収集した後(10X目的を使用して)、図2Bに示すように、特別な設計されたソフトウェア2,4,11を使用して、各セクションの内層および外部層と同様に内腔を測定する。船舶の内在成長と媒体を計算します。
- 平滑筋細胞およびマクロファージ含量、または内皮回復を通常の免疫組織染色2を用いて、逐次切片で分析する(図2C)。2
結果
アテローム硬化性プラーク誘導手順は15〜20分を要し、主に処置中に出血が起こるため、最小限の死亡率を示す。手術後、マウスは20〜25分以内に麻酔から回復する。手術後、麻痺や摂食障害などの身体障害は認められない。
ワイヤー傷害は、バルーン脱毛またはステント移植後の血管病変を模倣する脱内皮化を誘発する。傷害直後、脱裸の血管壁は血小板細胞の層で覆われ、単球12の接着を仲介し支持する。メディアから活性化平滑筋細胞が増殖し、内皮空間に移動し、ネオインティマを形成する。平滑筋細胞の他の前駆細胞は血液から移行する(推定40%ネオインティマの成長に貢献します。プラークの形成は、完全な再内皮化後、通常はワイヤー損傷の4週間後に終了する。
ネオインティマの形成は、Movat染色を使用して評価することができる。図 2Bに示すように、歯垢のサイズは、ソフトウェアを使用してスライドごとに計算されます。総プラークサイズ(左頸動脈)は70,000~100,000μm²の間で変化し、制御容器のサイズ(右頸動脈)は7,000~8,000μm²の間で変化する可能性があります。これらの値は、外科医に大きく依存します。したがって、同じ研究の実験中に同じ外科医を使用することを強くお勧めします。
開発されたプラークは、主に増殖し、メディアから移行平滑筋細胞で構成されている ステント 残り緊張症に似ています。免疫染色法によって決定された細胞組成は、平滑筋細胞含有量が約30〜40%であり、マクロファージは負傷した血管のネオインティマの15〜25%に見られることを示している。再血管化は、内皮マーカーの染色後に測定することができ、そして、内腔の全周に対して染色された円周の割合として計算される。通常、再血管化は3週間後に80〜90%に達し、4週間後にほぼ完了するはずです(図2C)。その開発中にプラークの成長を追跡するために、同じ分析は、関心と研究対象に応じて、ワイヤー傷害後の各時点に対して繰り返すことができます( 表1を参照)。
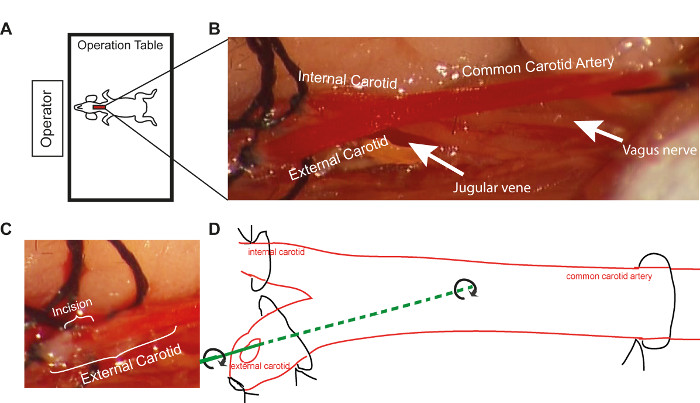
図 1.手術手順の概略表現。(A)ワイヤー傷害処置中のオペレータに対する操作テーブルの位置(B)一般的な頸動脈とその枝の拡大図、顕微鏡下に10倍の拡大(C)顕微鏡下での切開の大きさを10倍(D)10倍(D)のワイヤー傷害手順を用いたワイヤ傷害手順の概略表現。この図の大きなバージョンを表示するには、ここをクリックしてください。
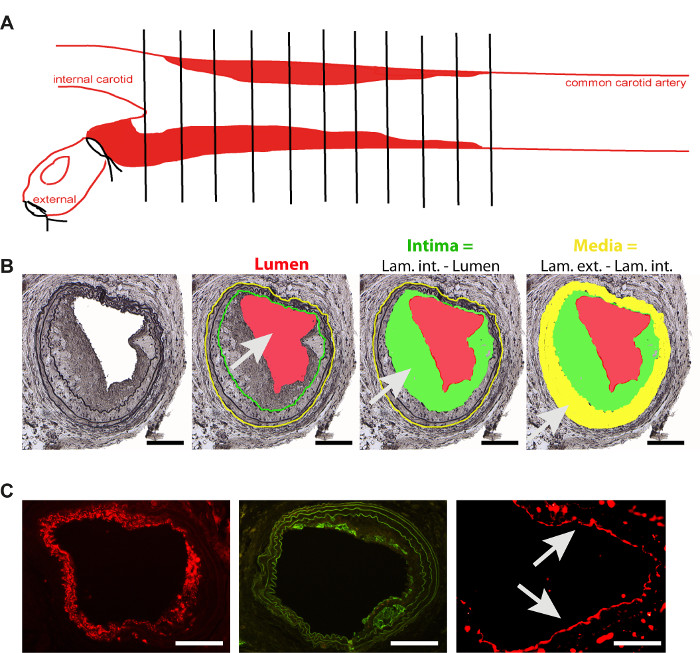
図 2.レステノーシスプラークの分析(A)一般的な頸動脈におけるプラーク分析の模式的表現は、ワイヤー傷害誘導(B)の4週間後にネオインティマ形成を行い、分析に使用される主なパラメータの電線損傷および模式的表現の4週間後に行った。インティマ(緑の領域)は、内腔(赤)とラミナ・インターナ(緑の線)の差です。メディア(黄色の領域)は、ラミネ・エクステルナ(黄色の線)とインターナ(緑の線)の差です。スケールバー100μm(C)ネオインティマ形成に関与する主な細胞タイプの染色の代表的な画像。C)平滑筋細胞(平滑筋アクチン-赤、スケールバー100μm)、マクロファージ(Mac 2-緑、スケールバー100μm)および内皮細胞(CD31-赤、矢印、スケールバー50μm)。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 時間 | トロンバス | プラーク (μm²) |
マクロファージ (プラークから% |
平滑筋細胞 (プラークから% |
再血管化 (円周の内腔) |
| 1日 | 存在 | 0 | 0 | 0 | 0 |
| 1週間 | - | < 30 000 | > 10 | < 50 | < 50 |
| 2週間 | - | < 50 000 | > 10 | < 50 | > 50 |
| 3週間 | - | < 70 000 | 15-25 | 30-40 | 80-90 |
| 4週間 | - | 70 000 – 100 000 | 15-25 | 30-40 | 完了 |
表 1.時間依存のプラークの開発。
| モデル | 動物 | 利点 | ディサンバンテージ |
| ダイエット誘発性在性アテローム性動脈硬化症 | 小さな |
|
|
| 大きな |
|
| |
| バルーン拡張 | 小さな |
|
|
| 大きな |
|
| |
| ワイヤー損傷 | 小さな |
|
|
| ステント注入 | 小さな |
|
|
| 大きな |
|
|
表 2.動脈損傷の存在モデルの利点と欠点
ディスカッション
本論文では、動物の手術経験が少ない人でも、ワイヤー傷害処置を行う上で有用なヒントを提供する。この手順を実行する上で重要な手順は、外的頸動脈の切開とワイヤーの挿入の 2 つの重要なステップです。外的頸動脈の切開は、十分な残りの材料を確保するために、分岐から可能な限り行われる必要がある(図1C)。切開は、容器全体を切断するリスクがあるため、大きすぎないようにしてください。第2の重要なステップは、血流が効率的に中止されない場合、動脈切開術中の出血のリスクが高く、ガイドワイヤーが挿入されないことです。また、内皮性内膜が起きない場合や、管腔内にガイドワイヤーが適切に導入されない場合は動脈破裂が起こる可能性があります。これを避けるために、ガイドワイヤーの表面は操作の前に注意深く磨かれなければならない。
プロトコルを最適化するために、外科医に向かってマウスヘッドを持つ手術台の位置は、適切なガイドワイヤ操作のためのより良いビュー、アクセシビリティと制御を保証します。また、再現性を高めるには、全ての研究で同じガイドワイヤーを使用する。ワイヤーサイズは変化しないので、研究に含まれるすべてのマウスに対して同じ性別、年齢、体重を使用して、マウス間の考えられるすべての違いを考慮し、排除することが重要です。その後、エバンス-ブルー染色は、外科医が脱潤の効率を決定するのに役立ちます。適切な機器の存在は、手順の成功のための前提条件です。この手順を実行するには、10倍の実体顕微鏡が不可欠です。ガイドワイヤーの適切な準備(例えば研磨)は非常に重要です。そのため、ガイドワイヤーの準備は、専門の技術担当者が可能な場合には行うことを強くお勧めします。
このプロトコルには多くのトラブルシューティング手順があります。分岐の近くに外頸動脈を切開する場合は、分岐の近くにエクステルナを慎重に結合するので、出血は起こらない。切断中、外的頸動脈が見えない。従って、絹縫合のレベルでの分岐を考える。シルクの縫合糸が消えたら、セクションを集める。外頸動脈の切開が大きすぎて血管が破裂した場合は、頸動脈コミュニスおよび内部頸動脈への血流が効果的に中断されることを確認し、鉗子を使用して血管の開口部を見つけようとします。ガイドワイヤーを導入し、否定を行った後、分岐の近くに容器を結合する。切断中に、縫合糸から絹が消え始めたときに収集を開始します。ガイドワイヤーで歯の引き出し中に動脈破裂が起こった場合は、ガイドワイヤーが適切に研磨されているかどうかを顕微鏡で確認してください。
ワイヤー傷害モデルと臨床状況の類似性にもかかわらず、多くのグループはマウスの在来アテローム性動脈硬化症に焦点を当てているか、小さな動物手術を行うことができる訓練を受けた人員がいないため、ラットやウサギのバルーン血管形成術などの侵襲的なアテローム性動脈硬化症誘導を選択する。ウサギ/ラットを使用する利点にもかかわらず、 例えば 、小型化された装置の必要性がない、ラットモデルもウサギモデルも、ネオインティマの成長とステント血栓症に関与する分子メカニズムを研究するという点で、様々なノックアウト株を提供しない。
マウスのステント内修復を研究するための既存のモデルは困難であり、高い外科的スキルを必要とし、出血や麻痺などの合併症のリスクが高い。例えば、大腿動脈を介した胸部大動脈への機械的損傷またはステント移植は、高い死亡率(35%)を伴う後肢麻痺または出血による 13-15.我々はまた、マウス16の頸動脈におけるステント移植について述べている。手順は似ています。しかし、分析のための組織処理は複雑であり、すべての実験室16で利用できるわけではありません。頸動脈は、手術手順のためだけでなく、超音波画像処理などの既存の画像化方法にも直接アクセス可能である。マウスにおける頸動脈における他の傷害誘導は、電気デバイス17を用いて行うことができる。この方法は、実行が容易であり、高い再現性を保証します。しかし、それはすべての血管層に傷害を誘発し、機械的損傷と同一ではない。バルーンアプリケーションには、 例えば 臨床実践に沿った血管径の調整が利点を有し、病理学的結果に強い影響を与えます。マウス風船は利用可能ですが、それらは非常に高価であり、したがって、広く使用されていません。代わりに、ワイヤー傷害は確立された方法であり、狭窄を模倣する。
脱潤は、アテローム硬化性の背景を有するが、正常な動脈壁に行われる。したがって、ネオインティマ形成は臨床状況に比べて中程度となる。前臨床モデルの数が多いのは、ヒトの病態生理学につながる細胞および分子メカニズムの全体を明らかにするために必要な基準をすべて満たすモデルがいずれもいなさることを示している( 表2参照)。
ワイヤー傷害手順を行った後、他の生物学的および分子的分析は、細胞、タンパク質、mRNA、マイクロRNA、遺伝子または他のバイオマーカーを同定するために行うことができるが、これはアテローム性動脈硬化症の新しい治療戦略を開発するために、特に血管損傷後の新内皮形成に対する治療標的として使用することができる。利用可能であれば、プラークの成長は、高周波超音波または他の高解像度画像技術を使用して監視することができる。さらに、この技術を習得することで、オペレータは、カラー配置、部分ライゲーション、ステント注入などの他の侵襲的なアテローム性動脈硬化症誘導モデルにプロトコルを適応させる機会を与える。
開示事項
著者による開示はありません。
謝辞
この研究は、RWTHアーヘン大学医学部内のIZKFアーヘン(E.A.L.のジュニア研究グループ)の学際的な研究センターによって支援されました。また、ロヤ・ソルタン夫人の免疫検査染色に対する助けに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Olympus | SZ/X9 | - |
| Forceps | FST, Germany | 91197-00 | standard tip curved 0,17 mm |
| Hemostat forceps | FST, Germany | 13007-12 | curved |
| Scissors | FST, Germany | 91460-11 | Straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | - |
| Retractors | FST, Germany | 18200-10 | 2.5 mm wide |
| Retractors | FST, Germany | 18200-11 | 5 mm wide |
| Ketamine 10% | CEVA, Germany | - | - |
| Xylazine 2% | Medistar, Germany | - | - |
| Bepanthene eye and nose cream | Bayer, Germany | - | - |
| Silicon tube | IFK Isofluor, Germany | custom-made product | diameter 500 µm, |
| section thickness 100 µm, | |||
| polytetrafluorethylene catheter | |||
| PROLENE Suture 6/0 | ETHICON | 8707H | polypropylene monofilament suture, unresorbable, needle CC-1, 13 mm, 3/8 Circle |
| 7/0 Silk | Seraflex | IC 1005171Z | - |
| Michel Suture Clips | FST, Germany | 12040-01 | - |
| Clip Applying Forcep | FST, Germany | 12018-12 | - |
| 14”Wire for Catheter | Abbot | 1000462H | Use 10 cm from stiff part and equalize the ends |
| Mice | Charles River | Apolipoprotein E -/- mice with C57/Bl6 background | - |
参考文献
- Simsekyilmaz, S., Liehn, E. A., Militaru, C., Vogt, F. Progress in interventional cardiology: challenges for the future. Thromb Haemost. 113 (3), 464-472 (2015).
- Kubo, N., McCurdy, S., Boisvert, W. A. Defective Fas Expression on Bone Marrow Derived Cells Alters Atherosclerotic Plaque Morphology in Hyperlipidemic Mice. Discoveries. 3 (1), e37 (2015).
- Saffarzadeh, M., et al. Characterization of rapid neutrophil extracellular trap formation and its cooperation with phagocytosis in human neutrophils. Discoveries. 2 (2), e19 (2014).
- Lindner, V., Fingerle, J., Reidy, M. A. Mouse model of arterial injury. Circ Res. 73 (5), 792-796 (1993).
- Schwartz, R. S., et al. Preclinical evaluation of drug-eluting stents for peripheral applications: recommendations from an expert consensus group. Circulation. 110 (16), 2498-2505 (2004).
- Schwartz, R. S., et al. Restenosis and the proportional neointimal response to coronary artery injury: results in a porcine model. J Am Coll Cardiol. 19 (2), 267-274 (1992).
- Curaj, A., et al. Noninvasive molecular ultrasound monitoring of vessel healing after intravascular surgical procedures in a preclinical setup. Arterioscler Thromb Vasc Biol. 35 (6), 1366-1373 (2015).
- Liehn, E. A., Schober, A., Weber, C. Blockade of keratinocyte-derived chemokine inhibits endothelial recovery and enhances plaque formation after arterial injury in ApoE-deficient mice. Arterioscler Thromb Vasc Biol. 24 (10), 1891-1896 (2004).
- Liehn, E. A., Zernecke, A., Postea, O., Weber, C. Chemokines: inflammatory mediators of atherosclerosis. Arch Physiol Biochem. 112 (4-5), 229-238 (2006).
- Simsekyilmaz, S., et al. Role of extracellular RNA in atherosclerotic plaque formation in mice. Circulation. 129 (5), 598-606 (2014).
- Wu, Z., et al. Rhodamine-loaded intercellular adhesion molecule-1-targeted microbubbles for dual-modality imaging under controlled shear stresses. Circ Cardiovasc Imaging. 6 (6), 974-981 (2013).
- Schober, A., et al. Crucial role of the CCL2/CCR2 axis in neointimal hyperplasia after arterial injury in hyperlipidemic mice involves early monocyte recruitment and CCL2 presentation on platelets. Circ Res. 95 (11), 1125-1133 (2004).
- Ali, Z. A., et al. Increased in-stent stenosis in ApoE knockout mice: insights from a novel mouse model of balloon angioplasty and stenting. Arterioscler Thromb Vasc Biol. 27 (4), 833-840 (2007).
- Chamberlain, J., et al. A novel mouse model of in situ stenting. Cardiovasc Res. 85, 38-44 (2010).
- Rodriguez-Menocal, L., et al. A novel mouse model of in-stent restenosis. Atherosclerosis. 209 (2), 359-366 (2010).
- Simsekyilmaz, S., et al. A murine model of stent implantation in the carotid artery for the study of restenosis. J Vis Exp. , e50233 (2013).
- Schroder, K., et al. NADPH oxidase Nox2 is required for hypoxia-induced mobilization of endothelial progenitor cells. Circ Res. 105 (6), 537-544 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved