このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ライブ細胞懸濁液の蛍光光度アッセイでFRETセンサーを用いて測定したGタンパク質選択的なGPCRの立体配座
要約
Simple methods to detect the selective activation of G proteins by G protein-coupled receptors remain an outstanding challenge in cell signaling. Here, Fӧrster resonance energy transfer (FRET) biosensors have been developed by pairwise tethering a GPCR to G protein peptides to probe conformational changes at controlled concentrations in live cells.
要約
Fӧrster共鳴エネルギー移動(FRET)の研究はGPCRシグナル伝達の研究においてますます一般的になっているベース。我々の研究グループは、アゴニスト刺激の後に生細胞にGαサブユニットとのGPCRとの相互作用を検出するために、分子内FRETセンサーを開発しました。ここでは、詳細以前に1を特徴とするβ2アドレナリン受容体および100μM塩酸イソプロテレノールで処理するとのGαsC末端ペプチドとの間のFRETの変化を検出するためのプロトコル。私たちのFRETセンサーは、全長GPCR、FRETアクセプターフルオロフォア(mCitrine)の直列からなる単一のポリペプチドである、ER / K SPASM(系統的なタンパク質親和性の強度変調)リンカ、FRETドナーフルオロフォア(mCerulean)、およびGαC末端ペプチド。このプロトコルは、詳細細胞調製物、トランスフェクション条件、機器の設定、分析の実行、およびデータ解析します。この実験設計は、小さなCHを検出し、アンジェFRETにおけるタンパク質 - タンパク質相互作用を示し、また、リガンドとGPCR-Gタンパク質のペアの両端の相互作用の強さを比較するために使用することができます。我々の測定の信号対雑音比を向上させるために、このプロトコルは、すべてのステップで高め精度を必要とし、再現可能な実行を可能にするためにここに提示されています。
概要
Gタンパク質共役受容体(GPCR)は、7回膜貫通型受容体です。ヒトゲノムだけでは、光、臭気物質、ホルモン、ペプチド、薬物および他の小分子を含む種々のリガンドによって活性化されたGPCRをコードする約800の遺伝子が含まれています。市場ターゲットのGPCRで現在のすべての医薬品の約30%は、彼らは多くの疾患状態2に大きな役割を果たしているため。この受容体ファミリーで行わ広範な仕事の何十年にもかかわらず、特にGPCR-エフェクターの相互作用を駆動する分子メカニズムに関して、フィールドで大幅な未解決の問題が残っています。現在までに、唯一の高解像度の結晶構造は、β2アドレナリン受容体(β2 -AR)およびGタンパク質3との間の相互作用への洞察を提供し、公開されています。一緒に過去30年間で大規模な調査では、この中で重要である一つの特定の構造コンポーネントを繰り返します相互作用:GαサブユニットのC末端。この構造は、GPCR 4及びGタンパク質選択5-6によって、Gタンパク質活性化の両方のために重要です。したがって、GαC末端は、GPCRのリガンド刺激と選択的Gタンパク質活性化の間の重要なリンクを提供します。
過去10年間の研究では、GPCRは、GPCRの立体配座のリガンド結合安定化のサブセットで、広範なコンフォメーションの風景を取り込むことを示唆しています。結晶学、NMRおよび蛍光分光法、および質量分析を含むいくつかの技術は、GPCRの立体配座風景を調べるために利用可能であるが、エフェクターの選択7での機能的意義を解明するアプローチの不足があります。ここでは、Gタンパク質の選択的GPCRコンフォメーションを検出するFӧrster共鳴エネルギー移動(FRET)ベースのアプローチを概説します。 FRETは、発光(ドナー)Aを重複して2つのフルオロフォアの近接性と平行な向きに依存していますND励起(アクセプター)スペクトル8。ドナーおよびアクセプターフルオロフォアは、コンフォメーションのタンパク質の変化またはタンパク質-タンパク質相互作用のいずれかの結果として互いに近くに来るように、それらの間のFRETが増加し、方法8の範囲を使用して測定することができます。 FRETベースのバイオセンサーは、GPCRフィールド9で広く使用されています。これらは、第三の細胞内ループ、およびGPCRのC末端にドナーとアクセプターを挿入することによって、GPCRにおけるコンホメーション変化を調べるために使用されてきました。センサーは別々 FRET対10でGPCRおよびエフェクター(Gタンパク質サブユニット/アレスチン)を標識することにより、GPCRとエフェクターとの相互作用を調べるために設計されています。いくつかのセンサは、Gタンパク質11の立体構造変化を検出します。これらのバイオセンサーは、コンフォメーションGPCRの変化やエフェクター、GPCR-エフェクターの相互作用動態、およびアロステリックリガンド12を含む未解決の質問の多くを尋ねるために、フィールドを有効にしています。私たちのグループアゴニスト主導の条件の下でGタンパク質に特異的GPCRの立体構造を検出することができるバイオセンサーを作成する際に特に興味がありました。このバイオセンサーは、(系統的なタンパク質親和性の強度変調)13 SPASMという名前の最近開発された技術に依存しています。痙攣テザリングそれらの有効濃度を制御するER / Kのリンカーを用いて、タンパク質ドメインの相互作用を含みます。フルオロフォアのFRETペアを有するリンカーに隣接する蛋白質12との間の相互作用の状態を報告することができるツールを作成します。以前に1 SPASMモジュールはGPCRにGαC末端テザーとFRETフルオロフォアとの相互作用をモニターするために使用された、mCitrineは(その一般的に知られている変異体、黄色蛍光タンパク質(YFP)、励起/発光ピークにより、このプロトコルで言及します励起/発光ピーク475分の430 nm)を(その一般的に知られている変異体シアン蛍光タンパク質(CFPによりこのプロトコルで呼ばれる)525分の490 nm)をmCerulean。 N末端からC末端へ、T彼の遺伝的にコード化された単一のポリペプチドが含まれています:全長GPCRは、アクセプター(mCitrine / YFP)のFRET、10 nmのER / Kリンカ、FRETドナー(mCerulean / CFP)、およびGαC末端ペプチド。本研究では、センサは、GPCR-リンカー長-Gαペプチドと略記されています。すべてのコンポーネントは、各ドメインの自由な回転を可能にする非構造化(のGly-Serで-Glyを)4リンカーによって分離されています。このようなセンサの詳細な特徴は、以前に2原型のGPCRを用いて行った:2 -ARとオプシンβ1。
このセンサは、一過性リガンドの存在下または非存在下でのHEK-293T細胞毎秒カウントの任意の単位におけるFRETペアの蛍光ベースの生細胞実験測定蛍光スペクトル(CPS)にトランスフェクトします。これらの測定は、フルオロフォア(YFP 最大 / CFP 最大 )の間のFRET比を計算するために使用されます。 FRETの変化(ΔFRET)を、平均FRET比を減算することによって計算されますリガンド処理されたサンプルのFRET比からの未処理のサンプル。 ΔFRETは(β2 -AR-10nmのペプチドなし対β2 -AR-10 NM-のGαsペプチド)の構築物間で比較することができます。ここでは、詳細、ライブHEK-293T細胞において、これらのセンサを表現し、その発現を監視し、設定、実行、および薬物処置条件に対する未処理のための蛍光ベースの生細胞のFRET測定の解析するためのプロトコル。このプロトコルは、100μMイソプロテレノール酒石酸水素で処理したβ2 -AR-10、NM-のGαsペプチドセンサに特異的であるが、異なるGPCR-Gαペアおよびリガンドのために最適化することができます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. DNAの準備
- 設計のセンサは、モジュール式クローニングスキームを用いて構築します。以前に1に詳述β2 -ARセンサ設計を参照してください。
- 1.9、260 / 2.0の230 - - 2.29、260 / 1.7の280を商業ミニプレップキットプロトコルに従ってDNAを調製し、濃度≥で、2 mMトリスHCl溶液、pHを8に750 ngの/μLを溶出します。
2.細胞培養の準備
- 培養HEK-293T-のFlp-nは37で、10%FBS(熱不活性化)(v / v)を、1%L-グルタミンサプリメント、20mMのHEPES、pH7.5で補充さ4.5グラム/ LのD-グルコースを含有するDMEM中の細胞5%CO 2の加湿雰囲気中でC°。後続のステップのための生物学的安全フード内で細胞を処理します。
- 細胞は6ウェルディッシュに継代する前に、コンフルエントな単層に成長することを可能にします。密集度を達成するための時間は、最初のプレーティング密度に依存します。そのプレートを使用6ウェルメッキにメッキの2日 - 1内の密集度に来ます。コンフルエント10cmの組織培養処理皿は、約4×10 6細胞/ mlの細胞密度を有します。細胞培養増殖の画像については、 図1を参照してください。
- 10ミリリットルのPBSで細胞を洗浄し、0.25%トリプシンでトリプシン処理(ディスカッション、第2項を参照してください)。組織培養処理6ウェルディッシュ中の培地2ml中のウェルプレート8×10 5細胞/ 16のために接着させる- 20時間。
3.トランスフェクション条件
- ( - 36〜20時間の間に)最適な発現を達成するために、時間の異なる量を必要とするかもしれない構築物についてトランスフェクションをずらします。統一された実験の時間のための条件を同期します。また、トランスフェクトしていない対照ウェルでの同等の細胞密度が分析中に、バックグラウンドノイズと散乱減算のために使用しなければなりません。
- 減少血清培地、DNA、トランスフェクション試薬:室温にトランスフェクション試薬を持参してください。
- で生物学的安全フードは次の順序で滅菌マイクロチューブに試薬を結合:100μlの低血清培地で2μgのDNAを混ぜます。混合物の表面またはチューブの側面に触れることなく、メディア/ DNA混合物へのトランスフェクション試薬の6μlのスパイク。ウェル当たり1トランスフェクション反応を設定します。一貫した発現レベルを達成するために(トランスフェクション試薬6μlの - - 3は、DNAの4μgの1)をトランスフェクション条件を最適化することができます。より最適化された比率については、 表1を参照してください。
- 30分 - 15のための生物学的安全フード内で室温で混合物をインキュベートします。放置すれば30分以上インキュベートし、反応を使用しないでください。
- 全体で十分に滴下様式で細胞への反応を加え、穏やかに完全な混合を確実にするために、6ウェルを振ります。ウェルあたり1の反応を追加します。
- 発現の20時間後、組織培養蛍光顕微鏡を用いて蛍光をモニターします。 40Xでの細胞内の10倍の対物レンズおよびタンパク質局在化と人口の発現を評価します。 OBS原形質膜(PM)におけるタンパク質の発現のためにerve。かなりの内在化が指摘されている場合は有意な発現がPMで検出されるまで、トランスフェクションを監視します。
4.試薬や機器の準備
- -80℃で100mMの薬物株式や店舗を準備します。イソプロテレノール酒石酸水素塩(300 mMのアスコルビン酸を含むのdH 2 O中の100mM)。直ちに低温室、およびフラッシュ凍結に/氷の上で行います。アリコートを作製し、1年まで使用することができます。
- セルバッファ(〜2ミリリットル/条件)を準備し、37℃の水浴中に保管してください。毎日新鮮ください。セルバッファの構成要素のための参考表2。
- 医薬品バッファ(10ミリリットル)を準備し、常温で保存。医薬品バッファ構成のためのリファレンス表2。
- 濃HClを用いて、酸洗浄キュベット。弱塩基(1 M KOH)で中和し、そして十分の dH 2 Oでキュベットを洗います
- いくつかで蛍光光度計の周りにワークステーションを準備10、200、1000μlのピペットチップ、超純H 2 Oで10分のカウントダウン、キュベット洗浄のためのヒント、繊細なタスクワイプでアクセス真空ライン、および噴霧ボトルに設定されたタイマーの箱
- 37°Cに蛍光光度計や熱ブロックの外部水浴を加熱します。
- 蛍光光度計をオンにします。 430nmで、帯域8nmのを励起するためにCFPコレクションの蛍光収集プログラムを設定します。放射範囲を450nm - 600nmで、帯域4nmで。 600nmで、帯域4nmの-のみセンサ制御などYFP収集のために( 説明を参照)を490nm、バンドパス8nmで、照射範囲500に励起を設定します。 CFP収集設定は、この実験におけるFRETスペクトルを取得するために使用されます。
- 下の図2に示すように、ヒートブロックで12 1.5ミリリットルマイクロ遠心チューブを置きます。これらの管は、細胞アリコート管用のホルダーです(500μlのマイクロ遠心チューブ。)ここに配置されたキュベットを緩和するホルダー1および図7に組織の小片を置きます。
注意:未処理の状態と交差汚染を防止するための薬剤の条件に対して個別のキュベットを使用してください。

図2. マイクロチューブを設定し、未処理試料のための熱ブロックキュベットにおける位置指令ポジション1です。細胞アリコート管は2位にある - 薬剤処理した試料6.キュベットは7位です。細胞アリコート管は位置にある8 - 12 この図の拡大版をご覧になるにはこちらをクリックしてください。
- ミニ37℃の水浴を作成するための水〜750μlの12から6と8 - ホルダー2を入力します。
- ミニ水浴( - 6、8から12ホルダー2)への細胞のアリコートのための10500μlをマイクロ遠心チューブを置きます。各チューブは、条件(5 untreateの個々の繰り返しになりますD、処理された5薬剤)。
- 発現のために細胞を監視する(ステップ3.6を参照してください)。
5.実験とデータ収集
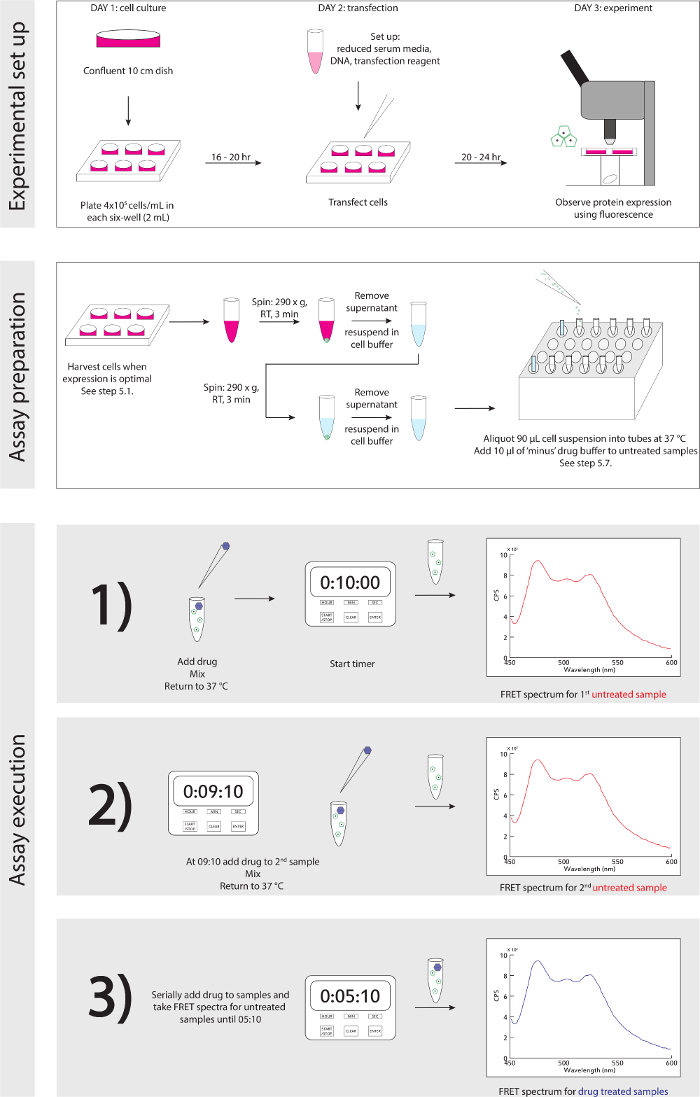
図3.実験模式図。実験のセットアップおよび実行するための詳細な段階的なガイド。 この図の拡大版をご覧になるにはこちらをクリックしてください。
- 実験の模式のための参考図3。細胞は、蛍光顕微鏡で検出されたタンパク質の発現に基づいて、収穫する準備ができたときは(ディスカッション、第4項を参照してください):生物学的安全フード内で、優しくP1,000とその文化の中で〜1メディアのミリリットル、再懸濁細胞を除去し、再懸濁を転送1.5ミリリットルマイクロ遠心チューブに。
注:それはN末端を消化し、得るようなトリプシンを使用しないでください/またはGPCRセンサーの結合ポケット。 - 再懸濁に適切な細胞密度を確保するために、細胞を数えます。 4×10 6細胞/ mlのために再懸濁容積を最適化します。
- 3分間、室温で290×gでのスイングバケット遠心機で細胞をスピン。遠心分離後、上清を取り除きます。
- GENTLY(37℃で保存)1ミリリットルセルバッファに細胞を再懸濁し、ステップ5.3を繰り返します。第2のスピンの間、-80℃から100 mMの薬剤ストックのアリコートを収集します。 1 mMの作業ストックのための薬剤の緩衝液中で100倍希釈し、RTで続ける:1にします。
- 2回目の遠心分離後、セルバッファ(4×10 6細胞/ ml)の1ミリリットルで上清と穏やかに再懸濁細胞を除去します。ブランクとして、細胞の1ミリリットルとセルバッファの1ミリリットルを使用して、分光光度計のサンプルの測定のOD 600。使い捨てのプラスチック製キュベット内の細胞を分配し、すぐに分光光度法以下のマイクロ遠心チューブに戻って転送します。
- コントロールトランスフェクトされていないセルの場合リットル条件スペクトル、静かにキュベットに細胞の90μlを添加し、励起430 nmのバンドパス8nmで、放射450でFRETスペクトルを取得、P1,000のピペットで1ミリリットルセルバッファ内の非トランスフェクト細胞を再懸濁 - 600 nmのバンドパス4nmで。細胞の新鮮な90μlの5リピートスペクトル - 3を収集します。サンプル間の超純H 2 Oでキュベットを、スペックの間、37℃で細胞の株式を保持し、各試料アリコートの間P1,000で穏やかに再懸濁し、すすぎます。
- ヒートブロックで12から6、8 - 実験条件、保有者2の500μlの管のそれぞれに一定分量トランスフェクトされた細胞の90μLをください。静か各アリコート間P1,000ピペットを用いて細胞のストックを再懸濁します。
- 未処理の条件サンプルについて6 - 細胞は、等分された後、2をチューブに薬物緩衝液10μlを追加します。
- 、チューブ8内に1 mMの薬溶液10μlを添加することにより、実験を開始し、10分からカウントダウンするタイマーを開始し、優しくP200のピペットでチューブを混ぜます。 37に近い管とリターンCのヒートブロック°。
- すぐに、チューブ2をピックアップP200(新しいチップを使用)で軽く混ぜ、未処理状態のキュベットに細胞懸濁液90μlを添加し、蛍光光度計で場所。
- 600nmで、帯域を4nm - 励起430 nmのバンドパス8nmで、放射450でのFRETスペクトルを取得。
- 10秒、1 mMの薬物溶液の10μlのチューブ9スパイク、静かに(新しいチップを使用)P200と混合し、ヒートブロックにチューブを戻す - 9分で。
- チューブ10とチューブ3と5.12と5.11 - を繰り返して、5.10を繰り返します。
- スペクトルは、すべての未処理の状態のサンプルのために収集され、そして薬物はすべての薬物条件試料に添加されるまで、( など 8時10分、7時10分)1分間隔で5.13 -を繰り返して、5.10を繰り返します。交差汚染を防止するために、各ピペットのステップのための新たなヒントを使用してください。
- 5分で - 10秒、蛍光光度計で薬剤処理した試料と場所のために別々のキュベットに細胞懸濁液90μlを添加、P200ピペットで穏やかにチューブ8(薬物条件)を混合始めます。
- Fを買収RETスペクトル(設定のためのステップ5.11を参照してください)。
- 残りの薬物条件サンプル( - 12チューブ9)のための1分間隔(4時10分、午前3時10分など )で5.16 -を繰り返して、5.15を繰り返します。
- 実験が終了した後、次の条件のために超純H 2 O、および再入荷チューブとキュベットを洗う徹底的に、プロジェクトファイルを保存します。洗浄ステップでクロスコンタミネーションを防ぐために注意してください。 H 2 Oのボトルにだけでなく、洗浄の間に真空ラインで先端を変更します。
6.データ解析
- 分析に使用されるSPC形式のデータファイルを保存してエクスポートします。解析プログラムはSivaramakrishnanラボ公開Webサイトからダウンロードできます。
- 分析プログラム(V9、V15)、トランスフェクトしていないサンプルファイル(非トランスフェクト細胞のスペクトル収集のためのステップ5.6を参照)、出力データファイル、およびデータ入力用のカンマ区切り値(CSV)ファイルを含む解析ソフトウェアのパスファイルを作成します。
- 次の情報を入力します。CSVファイルに含めて、各サンプルについて各条件( 表3のサンプルを参照)と指定します。
ファイル名 - 個々のSPCグラフファイル
受容体- GPCR構築物は試験した指名( 例えば、Β2)
バインダー-構造物のペプチド変異体を試験した指名( 例えば 、S)
アゴニスト - (N)を、未処理の指定または薬物処置(D)条件
ディレクトリ - 通常、日付が主催SPCファイルが保存されているパスフォルダ、
OD - 分光光度計からのサンプルの記録光学密度 - サンプルからのバッファと散乱ノイズを減算するトランスフェクトしていないサンプル(ステップ5.6)のファイル名を入力します。
- 解析プログラムに条件を入力します。
- 個々の条件(V9)内の条件(V15)を横切ってサンプルを分析するために実行するプログラム。
- INDIVIのOD値を増加または減少させることによって、データセット内の見かけ上の外れ値であるサンプルファイルを除外、または減算を調整デュアルファイル。
- (525ナノメートル/ 475 nm)を算出したFRET比にアクセスするための出力ファイルにエクスポートしたデータを。
- 処理された(薬物)の条件のために、個々のFRET比から未処理の状態の平均FRET比を減算することによりΔFRETを計算します。
Access restricted. Please log in or start a trial to view this content.
結果
実験の一般的な概略図が設定と実行は、図3に詳述されています。
センサの狭いダイナミックレンジのFRETの変化を検出するためには、に接着され、システムのニュアンスに付着することが重要です。細胞質は、タンパク質の発現と同様に、サンプリングの一貫性に不可欠である。 図1を 6ウェルメッキと凝集したパターンで成長しているトランス?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
このシステムにおけるFRET測定の緊密なダイナミックレンジは、このプロトコルのすべてのステップで敏感な品質管理の必要性を強調しています。成功したFRET実験を確保するために最も重要なステップは、アッセイの実行中に1)細胞培養、2)トランスフェクション3)タンパク質発現および4)タイムリー、正確なコーディネートです。
細胞の健康やメンテナンス/めっき?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、彼らが競合する利害を持っていないことを宣言します。
謝辞
RUMは、米国心臓協会の事前の博士フェローシップ(14PRE18560010)によって賄われていました。研究は、米国心臓協会サイエンティスト開発グラント(13SDG14270009)&SSにNIH(1DP2 CA186752-01&1-R01-GM-105646から01-A1)によって賄われていました
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| B2-AR-10 nm-Gas peptide sensor | Addgene | 47438 | https://www.addgene.org/Sivaraj_Sivaramakrishnan/ |
| GeneJET Plasmid Miniprep Kit | Fermentas/Fisher Sci | FERK0503 | Elute in 2 mM Tris elution buffer |
| HEK-293T-Flp-n cells | Life Technologies | R78007 | |
| Trypsin (0.25%) | Life Technologies | 25200056 | |
| DMEM- high glucose | Life Technologies | 11960-044 | Warm in 37 °C water bath before use |
| FBS, certified, Heat inactivated, US origin | Life Technologies | 10082147 | |
| Glutamax I 100x | Life Technologies | 35050061 | |
| HEPES | Corning | MT25060CL | |
| Opti-MEM | Life Technologies | 31985-070 | Reduced serum media; Bring to RT before use |
| XtremeGene HP transfection reagenet | Roche | 6366236001 | Highly recommended for its consistency. Bring to RT before use |
| FluoroMax 4 | Horiba | Use with FluorEssence V3.8 software | |
| 3-mm path length quartz cuvette | Starna | NC9729944(16.45F-Q-3/z8.5) | May require cuvette holder/adaptor for use in Fluorometer, available from Starna |
| Sc100-S3 Heated Circulating water bath pump | Fisher Scientific | 13-874-826 | Warm to 37 °C before use |
| Thermomixer Heat Block | Eppendorf | 22670000 | Warm to 37 °C before use |
| Ultrapure DNA/RNAse free water | Life Technologies | 10977015 | Use at RT |
| D(+)-glucose, anhydrous | Sigma | G5767 | |
| aprotinin from bovine lung | Sigma | A1153 | |
| leupeptin hemisulfate | EMD | 10-897 | |
| L-ascorbic acid, reagent grade | Sigma | A0278 | |
| (-)-isoproterenol (+)-bitartrate | Sigma | I2760 | Use fresh aliquot each experiment |
参考文献
- Malik, R. U., et al. Detection of G Protein-selective G Protein-coupled Receptor (GPCR) Conformations in Live Cells. J. Biol. Chem. 288, 17167-17178 (2013).
- Oldham, W. M., Hamm, H. E. Heterotrimeric G protein activation by G-protein-coupled receptors. Nat. Rev. Mol. Cell Bio. 9, 60-71 (2008).
- Rasmussen, S. G., et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature. 477, 549-555 (2011).
- Alexander, N. S., et al. Energetic analysis of the rhodopsin-G-protein complex links the α5 helix to GDP release. Nat. Struct. Mol. Biol. 21 (1), 56-63 (2014).
- Conklin, B. R., Farfel, Z., Lustig, K. D., Julius, D., Bourne, H. R. Substitution of three amino acids switches receptor specificity of Gqα to that of Giα. Nature. 363, 274-276 (1993).
- Conklin, B. R., et al. Carboxyl-Terminal Mutations of Gqα and Gsα That Alter the Fidelity of Receptor Activation. Mol. Pharmacol. 50, 855-890 (1996).
- Onaran, H. O., Costa, T. Where have all the active receptor states gone. Nat. Chem. Bio. 8, 674-677 (2012).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Lohse, M. J., Nuber, S., Hoffman, C. Fluorescence/bioluminescence resonance energy transfer techniques to study G-protein-coupled receptor activation and signaling. Pharmacol Rev. 64 (2), 299-336 (2012).
- Vilardaga, J. P., Bünemann, M., Krasel, C., Castro, M., Lohse, M. J. Measurement of the millisecond activation switch of G protein-coupled receptors in living cells. Nat. Biotechnol. 21, 807-812 (2003).
- Bünemann, M., Frank, M., Lohse, M. J. Gi protein activation in intact cells involves subunit rearrangement rather than dissociation. Proc. Natl. Acad. Sci. USA. 100 (26), 16077-16082 (2003).
- Stumpf, A. D., Hoffman, C. Optical probes based on G protein-coupled receptors - added work or added value. Brit. J. Pharmacol. 173, 255-266 (2016).
- Sivaramakrishnan, S., Spudich, J. A. Systemic control of protein interaction using a modular ER/K α-helix linker. Proc. Natl. Acad. Sci. USA. 108, 20467-20472 (2011).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Methods. 2 (12), 905-909 (2005).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved