このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ヒト全血中のナチュラルキラー細胞溶解活性のフローサイトメトリー分析
要約
This work describes an advanced workflow for the accurate and fast determination of NK (Natural Killer) cell count and NK cell cytotoxicity in human blood samples.
要約
NK細胞の細胞傷害性は、NK細胞機能の外部の介入の効果を決定するために広く使用される尺度です。しかし、このアッセイの精度および再現性があるため、ユーザのエラーのため、または実験的操作にNK細胞の感受性のいずれか、不安定と考えることができます。これらの問題を解消するために、最小限にそれらを減少させるワークフローを確立し、ここで提示されています。例示するために、我々は、運動の激しい試合に提出されたランナー(N = 4)から、様々な時点で、血液サンプルを得ました。まず、NK細胞は、同時にCD56のタグ付けと磁気ベースの選別を経て、直接全血からと1ミリリットル限り少ないから同定および分離されています。ソートされたNK細胞は、任意の試薬またはキャッピング抗体から除去されます。これらは、血液1ミリリットル当たりの正確なNK細胞数を確立するために計数することができます。第二に、ソートされたNK細胞(エフェクター細胞またはE)は、3,3'- Diotadeと混合することができます5 T:cyloxacarbocyanine過塩素酸(DIO)をアッセイ最適1でK562細胞(標的細胞またはT)をタグ付けされたE比、および各イベントの可視化および任意の偽陽性の排除を可能にするイメージングフローサイトメーターを用いて分析しましたまたは(例えばダブレットまたはエフェクター細胞など)偽陰性。このワークフローは、約4時間で完了し、さらにはヒト試料での作業は非常に安定した結果を可能にすることができます。ご利用の際は、研究チームは、ヒト対象にいくつかの実験介入をテストし、データの整合性を損なうことなく、いくつかの時点全体の測定値を比較することができます。
概要
ナチュラルキラー細胞は、自然免疫系の重要な構成要素です。それらは非常に規制されているが、それらは認識し、細胞間接触を介して前活性化1せずに異常な細胞を除去する能力を有します。そのようなものとして、それらは、感染に対する防御の迅速なラインを形成します。特に激しい運動は、一過性免疫系2、3、4、5を抑制することが示されています。 NK細胞は、効果的に疾患に高感度のウィンドウを作成し、この効果4、 図6、 図7を特に受けやすいです。したがって、前の介入の研究は、NK細胞機能への影響を削減するという目標との間または後の激しい運動は、運動選手のポスト競技の幸福のために特に重要です。
しかし、そのような介入の研究は、多くの要因によって複雑になる:1)NK細胞は、白血球区画の約1%、8まばらです。 2)NK細胞はストレスに非常に敏感であり、実験中に生存可能で安定した状態を維持するために生理学的条件に一定の暴露に依存しています。 3)標準的なアッセイは、フィコール勾配9として、NK細胞の細胞毒性を決定し、アッセイ10を解放するために、信頼できないと矛盾しています。ヒト試料の固有の変動は、これらの問題を配合します。介入の間に収集され、新鮮なヒトサンプルは、少なくとも動物サンプルまたは不死化細胞株と比較した場合、入手がかなり規制が困難です。これは、実験を繰り返したり、統計的な有意しきい値に到達するために研究コホートに参加者を追加する機会を減らすことができます。まとめると、これらの問題はfoを可能にする合理化されたプロトコルの必要性をサポートrの両方のハイスループットおよびヒト試料中のNK細胞溶解活性の高い信頼性解析。
無関係な要因への曝露を最小限に抑えながら、我々は、ヒト全血から識別するために必要な時間を短縮し、ワークフロー、隔離し、テストNK細胞を確立しました。減少またはNK細胞の細胞毒性の増加の検出を可能にするE比:方法は2楽器、磁気ベースのセルソーターとイメージングフローサイトメーター、およびアッセイ特異的な、最適化されたTの使用を最適化します。
プロトコル
注:すべての血液採取手順は、アパラチア州立大学(ASU)治験審査委員会(IRB)によって定められたガイドラインに従って行いました。
1.全血のコレクション
- 認定瀉血専門医は、世界保健機関(WHO)のガイドラインに従って血を引く必要があります。
- 二カリウムエチレンジアミン四酢酸(K 2 EDTA)を含む1 4ミリリットル採血管に血液を描画します。製造業者の指示に従って採血管を反転させます。分離までベンチトップロッカー上で室温で採血管を保管してください。
DIO標識標的細胞の調製
- 細胞の健康を確保するために、アッセイの前に数週間のために、10%ウシ胎児血清(FBS)および1%ペニシリンストレプトマイシンを補充した完全イスコフ改変ダルベッコ培地(IMDM)中でK562細胞を増殖させます。 concentratを調整細胞数と細胞のその後の通過の完了を経て、毎日3×10 5細胞/ mLの細胞のイオン。 2〜3日ごとに完全な培地交換を行います。
- 1血球計数器:アッセイの日に、1を用いて細胞数を実行します。
- K562フラスコから10μLを削除し、1.5 mLのチューブに配置します。
- 1:1の希釈係数に同じ1.5ミリリットルチューブにトリパンブルー色素の10μLを追加します。
- K562細胞およびトリパンブルー色素を混合する優しくフリックチューブ。
- K562細胞をトリパンブルー色素は、室温で1分間インキュベートすることができます。
- チューブから染色されたK562細胞の15μLを削除します。
- 細胞数のための血球計数器上にピペット。
- 四隅の四角内の細胞だけでなく、5乗の合計真ん中の正方形を数えます。
- 式を用いて細胞数を計算します。
総細胞/ mL =総細胞カウントX(希釈係数/正方形の数)X万/ mLの
- 無血清IMDM培地で1×10 6細胞/ mlの最終濃度で再懸濁し、K562標的細胞。
- 染色されていないK562標的細胞の場合、10×10 6 K562細胞の合計1×10 6細胞/ mLの密度で1 15 mLチューブにK562標的細胞の10 mLを加え。使用するための準備ができるまで、5%CO 2で37℃のインキュベーターに配置します。
- DIOはK562標的細胞を染色するために、K562の10ミリリットルを追加すると、10×10 6 K562細胞の合計1×10 6細胞/ mLの密度で1 15 mLチューブに細胞を標的とします。
- DIO染色し、穏やかにボルテックスに指定された15mlチューブに細胞懸濁液1mL当たり1μLDIOの細胞標識溶液を追加します。例えば、1×10 6細胞/ mLの容量で10×10 6 K562細胞/ mlにDIO細胞標識溶液10μLを追加します。
- 15mlチューブ中で、5%CO 2で37℃で20分間インキュベートK562-DIO溶液。
- 続きますインキュベーションる、15mlチューブを含むK562-DIO溶液に室温でリン酸緩衝生理食塩水(PBS)を3mlを加えます。
- 室温で135×gで10分間遠心します。
- 慎重千μlのボリューム調整可能なピペットを用いて細胞ペレットを乱すことなく、上清を除去します。
- 細胞ペレットを含む15 mLチューブをする新鮮なIMDMの10 mLを加え。
- 穏やかにボルテックスチューブは、細胞を再懸濁します。
- 繰り返しは2.7 2.10にさらに2回繰り返します。
- 5%CO 2で37℃インキュベーターに保管セル使用直前まで。
注:細胞は、最大24時間、インキュベーター中で保存することができるが、同じ日にそれらを使用することが好ましいです。
コントロールの調製
- 独立したと適切に標識された1.5ミリリットルチューブに以下を転送します。
- 1.5 mLチューブにラベルされた「ダブルポジティブ」に再懸濁DIO標識K562細胞を含む新鮮なIMDMの500μLを追加。
- 「DIOのみ」1.5 mLチューブをラベル付けに再懸濁DIO標識K562細胞を含む新鮮なIMDMの500μLを追加します。
- 「唯一のヨウ化プロピジウム(PI)、「1.5 mLチューブをラベル付けに再懸濁させた非標識K562細胞を含む新鮮なIMDMの500μLを追加します。
- 5分間55℃の水浴中で二重陽性およびPIのみチューブを置きます。
- 5分が経過した後、チューブを除去し、70%エタノールで拭いてください。
- 二重陽性およびPIのみ1.5 mLチューブにPIの10 Lを追加します。
- 30分間37℃のインキュベーター中で3つのすべてのK562標的細胞のコントロールを配置。
- 30分間のインキュベーションは、163×gで2分間、遠心分離、3つすべてのK562標的細胞対照を経過した後。
- 慎重に細胞ペレットを乱すことなく、上清を除去します。
- 新鮮なIMDM細胞培養培地の20μLの各制御を再懸濁し、そして少なくとも5%CO 2で37℃のインキュベーターに残します最適なDIO信号のための30分。
注:コントロールは今イメージングフローサイトメーターを介して実行する準備ができています。
4. NK細胞の自動分離
- 電池セパレータの電源を入れ、起動サイクルが完了することができます。
- すべての液体のボトルのイルミネーションが緑と廃液ボトルが空であることであることを確認してください。
- 室温15 mLチューブ用ラックを取得します。
注:選択は、サンプル容量に基づいています。例えば、以下3mlを15mlチューブのラックを使用するボリュームの以上3 mLを50 mLチューブのラックを使用するボリュームに対して。 - それに応じてラベルのサンプル管(サンプル/参加者1名につき、繰り返し):参加者1全血試料;参加者1陰性画分;参加者1陽性画分。
- 静かに「全血試料」15 mLのチューブにステップ1.2からの全血を1.5mLをピペット。
- ステップ4.5から適切に標識された15 mLの「全血試料」チューブを配置し、15 mLの「陰性画分」と表示し、チューブのラックのステップ4.4から「ポジティブフラクション "チューブ。行(R1)A:thefollowingの検体ラックのセットアップを使用して、全血試料、行(R2)B:陰性、非標識画分、行(R4)C:正、磁気標識された部分を。
- autolabelingのためMiniSampler上にセパレータラックを挿入します。
- メニューの「試薬」を選択し、バイアルを分離ラックに置かれる位置を強調表示します。
- 2次元コードリーダを有効にするには「試薬を読む」を選択します。
- コードリーダカバー0.5〜2.5センチメートル間の2次元コードリーダの前に適切な試薬バイアルを置きます。
注:例えば、NK細胞の分離のために必要な試薬はCD56です。 - 最適な読書のための2次元コードリーダの前の角度で試薬バイアルを保持します。
- 適切なセパレータラック位置に試薬バイアルを置きます。
- 画面上の分離]タブの下で所望の位置を強調表示します。
- ラベリングサブメニューから、AUを割り当てますtolabelingプログラム。
- ポジション1、2、3、および4をラックする細胞分離試薬CD56マイクロビーズを割り当てます。
- 「posselwb「分離プログラムを選択します。
- 「すすぎ」洗濯プログラムを選択します。
- テンキーを使用して「ボリューム」サブメニューで1,500μLのサンプル容量を挿入します。
- キーパッド上の「入力」オプションを選択します。
- 細胞分離を開始するには、「ファイル名を指定して実行」を選択します。
- 十分なバッファはすべてのサンプルを処理するために利用可能であることを確認し、「OK」を選択します。
5. NK細胞数に続いて細胞分離
- すぐに電池用セパレータを用いた細胞分離後、陽性画分を取得します。室温のままにしておきます。この画分は、所望の純粋なNK細胞集団が含まれています。
- 各個々のサンプルについて、ステップ2.2に従って血球計数器を用いて細胞数を実行します。
- 計算した後、細胞数を記録します。
6.細胞毒性アッセイサンプル調製
- 準備し、それに応じて、各サンプル/参加者のために1.5 mLのチューブにラベルを付けます。
- ピペットを各チューブにNK細胞およびDIO-標識さK562細胞の割合を所望します。
注:例えば、K562標的細胞及びNKエフェクター細胞の所望の比は1:5。 - 135×gで5分間遠心分離します。
- 慎重に細胞ペレットを乱すことなく、上清を除去します。
- 再懸濁NK-DIOは、インターロイキン-2(IL-2)及び2-メルカプトエタノール(2-ME)(不完全なNK細胞培地)なしでNK細胞培地500μL中のK562細胞の混合物を標識。
注:不完全なNK細胞培養培地は、L-グルタミン、リボヌクレオシド及びデオキシリボヌクレオシドなしに、重炭酸ナトリウムとの最小必須培地イーグルです。 - 各チューブにPIの5μLを追加します。
- 163×gで2分間遠心分離します。
- 2時間37℃で細胞をインキュベートします。
- 2時間のインキュベーションに続いて、centrifu163×gで2分間、GE。
- 慎重に細胞ペレットを乱すことなく、上清を除去します。
- 25μL不完全なNK細胞培養培地中で細胞を再懸濁し。
自発的(「S」)サンプルの7の準備
- ピペット1.5 mLのチューブにDIO標識K562細胞(1×10 6細胞/ mLの濃度)を500μl。
- 各チューブにPIの10μLを追加します。
- 163×gで2分間遠心分離管。
- 2時間37℃で細胞をインキュベートします。
- 2時間のインキュベーション、163×gで2分間遠心分離した後。
- 慎重に細胞ペレットを乱すことなく、上清を除去します。
- 25μlの不完全アルファ最小必須培地(α-MEM)細胞培養培地中で細胞を再懸濁し。
イメージングフローサイトメーター8.データ集録
- 楽器をオンにするためにフローサイトメトリーイメージングのフロントドア内側の緑のボタンを押してください。
- アルをオンにしますイメージングフローサイトメーターに関連付けられリットルコンピュータ。
- ソフトウェアサイトメーター撮影フローを起動します。
- システムをフラッシュし、サンプルラインを準備する「スタートアップ」ボタンをクリックします。
- 「スタートアップ」完了すると、「キャリブレーション」ウィンドウを閉じます。
- チャンネルを割り当てます。トップ左側に、それらを割り当てるために、各チャンネルをクリックしてください。
- Area_M06対生マックス・ピクセル_MC_6、Area_M02対生マックス・ピクセル_MC_2、AspectRatio_M01対Area_M05とFieldArea_M01対生の最大ピクセル_MC_5:右側には、4散布図を作成するために、散布図ボタンをクリックしてください。
- 最初の"ダブルポジティブ」コントロールを使用して、サンプルの分析を開始。
- クリックして「ロード」。
- サンプルローダーに3.9へのステップ3.4から「ダブルポジティブ」サンプルで1.5ミリリットルチューブを置きます。
- 「倍率」タブの下に対物レンズ40倍を選択します。
- 405 mWの電源をオンにし、642 mWのレーザー。
- 「明」のチャンネルをオンにします。
- クリックして「選択強度。」
- 検出器が過負荷にならないように、「ダブルポジティブ」コントロールサンプルに基づいて、405 mWのレーザーのための所望の強度を決定します。
注:例えば、この実験のための最適な強度は、11ミリワットとしました。
- 所望のセットアップが達成された後、データを取得します。
- 「取得ファイル」タブで、カスタムファイル名のテキストで入力します。データファイル(複数可)を保存するためのフォルダを選択します。
- 「収集」の横に取得するセルの数を入力します。典型的には、この数は、1,000〜10,000の間で変化します。
- クリックして「獲得。」
注:細胞の所望の数が取得されると、データファイルが自動的に以前に選択したフォルダに保存されています。
- DIOのみ制御-買収が完了したら、次のコントロールサンプルをロードします。
- クリックして「ロード」。
- サンプルローダーに「DIOのみ」のサンプルと1.5 mLのチューブを置きます。
- 選択した「倍率」タブの下に対物レンズ40倍にしておきます。
- 405 mWのレーザーがオンになったままにしておきます。
- 642 mWのレーザーと「明」のチャンネルをOFFにしてください。
注:ここで、所望のセットアップが達成されたことを、データを取得することができます。 - 「取得ファイル」タブで、カスタムファイル名のテキストで入力して、データファイル(複数可)を保存するフォルダを選択します。 「収集します。」の横に取得するセルの数を入力します。典型的には、この数は千です。
- クリックして「獲得。」
注:細胞の所望の数が取得されると、データファイルを自動的に以前に選択したフォルダに保存されています。
- 「PIのみ」対照試料を繰り返し手順8.10。実験試料は今収集する準備ができています。
- remainiハンドル以下のように「自発的な 'S'サンプル」を含む実験サンプルを、ngの:
- 選択した「倍率」タブの下に対物レンズ40倍にしておきます。
- 405 mWの642 mWのレーザーをONにしてください。
- 「明」のチャンネルをONにしてください。
- クリックして「設定強度。」
- 「取得ファイル」タブで、カスタムファイル名のテキストで入力して、データファイル(複数可)を保存するフォルダを選択します。カスタムファイル名のテキストで入力します。
- 横に取得するセルの数を入力し、「収集します。」
- 「取得」ボタンをクリックします。
注:細胞の所望の数が取得されると、データファイルを自動的に以前に選択したフォルダに保存されています。
- すべての実験サンプルのための手順を繰り返し8.12。
- すべての実験データやファイルが収集された後、システムを滅菌する「シャットダウン」ボタンをクリックします。
9.イマジングラムフローサイトメーターのサンプル分析
- 解析ソフトウェアアプリケーションサイトメーター撮影フローを開きます。
- 「ファイル」の下で、実験的.RIFファイルを開きます。
- ソフトウェアサイトメーターイメージングフローの報酬タブの下に「新しいマトリックスを作成」を選択する(ステップ8.10と8.11の間に作成されたDIO-のみの制御とPI-のみの制御)単色.RIFファイルを使用して、新しいマトリックスを作成します。
注:ソフトウェアは、それはチャネル補償を適用するために選択される、単一色のファイルを選択するためのプロンプトを表示し、マトリックスファイル(.ctmファイル拡張子)を作成するためにそれらをマージします。 - ソフトウェアの「ビルディングブロック」機能を使用して、ドットプロットを作成します。
- ゲートにフォーカスされたセルをドットプロット(周波数対BrightFieldGradient_RMS)を作成します。 「フォーカス」( 図1A)ゲートを呼び出します。
- 「フォーカス」ゲートを使用して、gの明視野アスペクト比対明視野エリアのドットプロットを作成します一重の細胞を食べました。 「シングル」( 図1B)のゲートを呼び出します。
- "シングル"ゲートを使用して、Intensity_MC_Ch5対Intensity_MC_Ch02のドットプロットを作成します。 DIO陽性細胞のみ(ターゲット、生きている)とPI-DIO二重陽性細胞(標的、死んだ)( 図1C)を識別し、ゲートには、このプロットを使用してください。
注:すべてのプロットはステップ9.4.1、9.4.2に記載され、9.4.3は、ソフトウェアの「ビルディングブロック」機能を使用して作成することができます。
- 各ゲートの細胞数にアクセスするには、ドットプロットの統計機能をクリックします。
- 次の式を使用して、自発的なサンプル中の死者の標的と実験サンプルの割合を計算します。
サンプル中の%死ん目標=(#deadターゲット×100)/(#ライブターゲット+ #deadターゲット) - 以下の式を用いて細胞毒性を計算します。
%細胞毒性= [(実験デッド自発死んだ)/(100-自発死ん)]×100
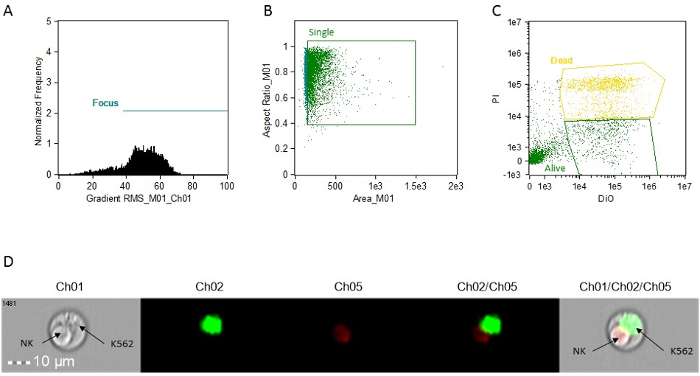
図1:細胞傷害活性分析のための代表的なヒストグラム、散布図や画像。 (A)フォーカス細胞分析。 (B)単一細胞分析。 (C)標的細胞染色解析。全ての測定は、各イベントに添付された画像を使用して作製されます。これは、単にグラフ上のイベントをクリックすることによって解析ソフトウェアでアクセスすることができます。 (D)ダブレットイベントの代表画像、アポトーシスNK細胞と生K562標的を示します。 CH01、明。 CH02、DIO。 Ch05、PI。 この図の拡大版をご覧になるにはこちらをクリックしてください。
結果
NK細胞数の決意
全血におけるNK細胞数の激しい走行の効果は、図2に記載の運動プロトコルを用いて、測定されました。血液サンプルは直ちに運動、運動後1.5時間、および初期採血後、最終的に24および48時間後に、運動前に描かれました。全血1ミリリットル当たりNK細胞の濃度は、各ランナー( 図3A)および各時点の平均( 図3B)
ディスカッション
本研究に記載された方法は、直接的(この特定の場合、長時間の運動で)刺激に応答して個々のNK細胞の特異的活性を測定します。典型的に、NK細胞は、マーカーの組み合わせを使用して選別密度勾配または細胞を使用して1つの血液から単離されます。これらの方法が広く使用されているが、それらは多くの欠点を持っている:彼らは、時間がかかり、複数の操作を伴い、かつ重くユーザー?...
開示事項
The authors have nothing to disclose.
謝辞
This project was supported by Agriculture and Food Research Initiative Competitive Grant no. 2100-68003-30395 from the USDA National Institute of Food and Agriculture.
資料
| Name | Company | Catalog Number | Comments |
| K-562 lymphoblasts | ATCC | CCL-243 | |
| Iscove's Modified Dulbecco's Media | ATCC | 30-2005 | High glucose, with L-Glutamine, with HEPES, Sterile-filtered |
| Alpha Minimum Essential medium | ATCC | CRL-2407 | Without ribonucleosides and deoxyribonucleosides but with 2 mM L-glutamine and 1.5 g/L sodium bicarbonate |
| Trypan Blue Solution 0.4% | Amresco | K940-100ML | Tissue culture grade |
| Propridium Iodide Staining Solution | BD Pharmingen | 51-66211E | |
| Vybranto DiO cell-labeling solution | Vybranto | V-22886 | |
| autoMACS Pro Separator | Miltenyi Biotec | 130-092-545 | |
| autoMACS Running Buffer | Miltenyi Biotec | 130-091-221 | |
| autoMACS Washing Buffer | Miltenyi Biotec | 130-092-987 | |
| autoMACS Columns | Miltenyi Biotec | 130-021-101 | |
| Whole Blood CD56 MicroBeads, human | Miltenyi Biotec | 130-090-875 | |
| ImageStream X Mark II Imaging Flow Cytometer | EMD Millipore | ||
| Speedbeads | Amnis Corporation | 400030 | |
| 0.4-0.7% Hypochlorite (Sterilizer) | VWR | JT9416-1 | |
| Coulter Clenz | Beckman Coulter | 8546929 | |
| 70% Isopropanol (Debubbler) | EMD Millipore | 1.3704 | |
| D-PBS (Sheath fluid) | EMD Millipore | BSS-1006-B (1X) | No calcium or magnesium |
| INSPIRE Software | EMD Millipore | Version Mark II, September 2013 | |
| Ideas Application Software | EMD Millipore | Version 6.1, July 2014 |
参考文献
- Cerwenka, A., Lanier, L. L. Natural killer cells, viruses and cancer. Nat Rev Immunol. 1 (1), 41-49 (2001).
- Nieman, D. C. Exercise, infection, and immunity. Int J Sports Med. 15, 131-141 (1994).
- Romeo, J., Warnberg, J., Pozo, T., Marcos, A. Physical activity, immunity and infection. Proc Nutr Soc. 69 (3), 390-399 (2010).
- Nieman, D. C. Marathon training and immune function. Sports Med. 37 (4-5), 412-415 (2007).
- Simpson, R. J., Kunz, H., Agha, N., Graff, R. Exercise and the Regulation of Immune Functions. Prog Mol Biol Transl Sci. 135, 355-380 (2015).
- Walsh, N. P., et al. Position statement. Part one: Immune function and exercise. Exerc Immunol Rev. 17, 6-63 (2011).
- Timmons, B. W., Cieslak, T. Human natural killer cell subsets and acute exercise: a brief review. Exerc Immunol Rev. 14, 8-23 (2008).
- Westermann, J., Pabst, R. Distribution of lymphocyte subsets and natural killer cells in the human body. Clin Investig. 70 (7), 539-544 (1992).
- Boyum, A. Isolation of leucocytes from human blood. Further observations. Methylcellulose, dextran, and ficoll as erythrocyteaggregating agents. Scand J Clin Lab Invest Suppl. 97, 31-50 (1968).
- McMillan, R., Scott, J. L. Leukocyte labeling with 51-Chromium. I. Technic and results in normal subjects. Blood. 32 (5), 738-754 (1968).
- Berk, L. S., et al. The effect of long endurance running on natural killer cells in marathoners. Med Sci Sports Exerc. 22 (2), 207-212 (1990).
- McAnulty, L. S., et al. Effect of blueberry ingestion on natural killer cell counts, oxidative stress, and inflammation prior to and after 2.5 h of running. Appl Physiol Nutr Metab. 36 (6), 976-984 (2011).
- Millard, A. L., et al. Brief Exercise Increases Peripheral Blood NK Cell Counts without Immediate Functional Changes, but Impairs their Responses to ex vivo Stimulation. Front Immunol. 4, 125 (2013).
- Janeway, C. A., Travers, P., Walport, M., Shlomchik, M. J. . Immunobiology: The Immune System in Health and Disease. 5th edn. , (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved