Method Article
聴覚弁別学習した後、マウス脳領域の高分解能定量的シナプスプロテオームプロファイリング
要約
The identification of molecules and pathways controlling synaptic plasticity and memory is still a major challenge in neuroscience. Here, a workflow is described addressing the relative quantification of synaptic proteins supposedly involved in the molecular reorganization of synapses during learning and memory consolidation in an auditory learning paradigm.
要約
The molecular synaptic mechanisms underlying auditory learning and memory remain largely unknown. Here, the workflow of a proteomic study on auditory discrimination learning in mice is described. In this learning paradigm, mice are trained in a shuttle box Go/NoGo-task to discriminate between rising and falling frequency-modulated tones in order to avoid a mild electric foot-shock. The protocol involves the enrichment of synaptosomes from four brain areas, namely the auditory cortex, frontal cortex, hippocampus, and striatum, at different stages of training. Synaptic protein expression patterns obtained from trained mice are compared to naïve controls using a proteomic approach. To achieve sufficient analytical depth, samples are fractionated in three different ways prior to mass spectrometry, namely 1D SDS-PAGE/in-gel digestion, in-solution digestion and phospho-peptide enrichment.
High-resolution proteomic analysis on a mass spectrometer and label-free quantification are used to examine synaptic protein profiles in phospho-peptide-depleted and phospho-peptide-enriched fractions of synaptosomal protein samples. A commercial software package is utilized to reveal proteins and phospho-peptides with significantly regulated relative synaptic abundance levels (trained/naïve controls). Common and differential regulation modes for the synaptic proteome in the investigated brain regions of mice after training were observed. Subsequently, meta-analyses utilizing several databases are employed to identify underlying cellular functions and biological pathways.
概要
学習は、メモリトレースおよびそれらのメンテナンスの形成に基づきます。広く1根底にあるメカニズムは、ニューロン間の既存のシナプスの連絡先の新規および/または再配置の活性依存形成を表してもよいことが認められています。分子レベルでは、様々なタンパク質修飾、細胞内relocalizationsおよびシナプスタンパク質の代謝回転の変化は1-4(ランプレヒトを、2004#8)に記載されています。しかし、ほとんどの研究は、これまでに選択されたタンパク質ではなく、グローバルが、複雑なシナプスのプロテオーム組成に焦点を当てました。本発明のアプローチは、学習実験後のマウスの脳領域におけるシナプスプロテオームの変更のための公正なスクリーニングを可能にします。シナプスアーキテクチャの学習誘発性の再編成の時点依存性分子のスナップショットをレンダリングするのに適しています。説明ワークフローは、特定の動物の行動の異なる専門家のチームワーク、タンパク質生化学、質量分析およびbioiが必要ですnformatics。
選択された学習パラダイム、 すなわち周波数変調音の弁別(FMTD)は、げっ歯類5でよく特徴付け聴覚弁別課題です。学習と、このシャトルボックスゴー/ノー・ゴー・タスクでの長期記憶の形成は、増加した皮質ドーパミンシグナル伝達およびタンパク質合成に依存の機構を持っています。したがって、スナネズミおよびマウスに関する最近のプロテオミクス研究は、皮質ではなく、おそらくFMTD学習とメモリ6-8の間に相互作用し、より基礎的な脳領域におけるシナプスのコンポーネントのドーパミンと学習誘発性プラスチックの再配列を明らかにしました。これは、メモリの形成は、種々の脳領域の複雑な相互作用に関与し、従って、示差的プロテオームレベルで、これらの領域内で調節されるかもしれないことを示しています。したがって、選択された皮質と皮質下のマウスの脳領域の解剖は、ワークフローに含まれています。
また、信頼性の高いcharacterizatiでも、シナプスタンパク質組成物中の弱変化の上で前とシナプス後コンパートメントの濃縮ではなく、ホモジネートまたは粗膜画分9の分析が必要です。したがって、前のプロテオーム解析に確立されたプロトコルを利用シナプトソームの調製は、検出レベルとシナプス特異的タンパク質10,11のためのダイナミック・レンジを増加させるために記載されています。
定量的な目的のためのラベルフリーの高分解能質量分析を使用するための必須の前提条件は、タンパク質試料の類似度が高いです。ではなくシナプスタンパク質組成の小さな変化を学習した後に発生することが予想され、ラベルフリーのアプローチは、訓練を受けたから得られた対応するタンパク質試料と未処理マウスを比較することが適切であろう。また、安定同位体( 例えば TMT、のiTRAQ、ICPLとSILAC)と同様にMS2ベースのラベルフリーの資格を使用して、タンパク質/ペプチドの条件-特定のラベル戦略ntification(SWATH)は有用であるが、彼らが選択したラベルフリーのアプローチよりも高価であるか、特別な質量分析のハードウェアを必要としています。
プロテオミクス上映は、多くの場合、複雑なデータセットを得ているため、バイオインフォマティクス処理が適切なデータ解釈のために推奨されます。追加のメタアナリシスは、パラダイムに関連した変化と関係する主要な細胞プロセスおよびシグナル伝達経路の特定の根底にある潜在的な分子メカニズムのより良い理解をサポートすることができます。適切な方法は、以下に記載されています。
プロトコル
動物被験体を含むすべての手順は、ドイツの連邦法、それぞれのEU規制及びNIHガイドラインの規定に従って行われた、とLandesverwaltungsamtザクセン/アンハルト(42502-2-1102 IFN)の倫理委員会によって承認されています。
1.聴覚学習
- シャトルボックス(FMTDパラダイム)注聴覚弁別学習は :マウスの処理中には、必ず手袋を着用してください。
- 食物ペレットへの自由なアクセスを持つ3つまたは4つのグループに家のC57Bl6 / Jマウスと透明なポリカーボネートケージ内に水をタップします。動物施設で暗サイクル:12時間の光を維持します。動物は、他の研究室から、会社から受け取っている場合は順化の少なくとも1週間を許可し、に定住。
- 一日あたり1シャトルボックスのトレーニングセッションを実行します。
- 動物施設で、そのホームケージからマウスを取り、防音室内の薄暗いシャトルボックスに入れてください。
- 聴覚弁別学習のための完全コンピュータ制御の学習スケジュールを使用してください。沈黙の3分の馴化期間で始まり、その後、トレーニングセッションを開始します。
- 上昇調の利用シーケンス - ゴー試験中のゴー刺激としては、(4 8kHzで、CS +):動物は(正しい応答は、ヒット)トーンプレゼンテーションの6秒以内にハードルを横断しなければなりません。シャトルボックスの格子床を介して配信300μA、 - 50の穏やかな足ショックによってミスを罰します。
- 動物はトーンプレゼンテーションの6秒の間にシャトルボックスの現在の区画内に残ることがあります:なし・ゴー・試験中にノー・ゴー・刺激として - (4 kHzの、CS-8)下降調のシーケンスを使用してください。シャトルボックスの格子床を介して配信300μA、 - 50の穏やかな足ショックにより誤警報を罰します。
- 20 5秒の試行間間隔を使用してください。
- 擬似ランダム化されたために、30ゴー試験およびセッションごとに30ノー・ゴー・試験を行い、1 SEようにssionは60件の試験で構成されており、約25分続きます。
- 動物施設におけるそのホームケージに戻す訓練を受けた動物を置きます。
- 脳解剖
- 頸椎脱臼(最初のセッションが終了した後、例えば 24時間)を使用して、トレーニングセッション、所望の数の後に所望の時点で動物を安楽死させます。動物を首を切ります。
- 速やかに次の工程を経て脳を解剖: 矢状縫合に沿ってまっすぐにハサミで最初の皮膚、その後、頭蓋骨をカットします。完全に強力な鉗子を使用して、脳組織をカバーする骨の部分を削除します。 spattleで脳を取り出します。
- 解剖のために、氷で満たされたペトリ皿に脳を置きます。聴覚皮質、前頭皮質、線条体およびメスや針を使用して実体顕微鏡下で海馬を解剖。
- 脳sに視覚ランドマークを使用して聴覚野のローカライズこのような血管や表面の形状とurface(ブレグマ-2.06 -3.4に、サイズrostrocaudal 2ミリメートル、背腹1.3ミリメートル)と、両側皮質の厚さの長方形の組織ブロックとして解剖。
- ランドマークとして視神経交叉を使用し、bulbusのolfactoriusから組織を除くブレグマ3.56と1.54の間に脳スライスとして前頭皮質を解剖。
- ブレグマ1.54と0.5の間に脳スライスとして線条体を解剖し、慎重に皮質組織を削除します。
- 小脳を介して針で脳を固定し、後頭葉で始まる皮質を巻出しにより、海馬を解剖。
- -80℃で液体窒素とストア内の衝撃凍結解剖脳サンプル。
2.シナプトソームの調製または代替的にシナプス後密度(PSD)富化フラクション
注: - 4°Cのすべての手順の間、0でサンプルおよびバッファーを保持します。緩衝液は、タンパク質のタンパク質分解を防止するために、新たに希釈されたプロテアーゼ阻害剤カクテルを含みます。タンパク質リン酸化も検討されている場合、ホスファターゼ阻害剤カクテルを添加しなければなりません。示されたすべてのg値は、全プロトコルを通してグラム(平均)として与えられています。
- 粗膜画分(図3A)の調製
- 転送は、(5mMのHEPES、320 mMのスクロース、pH7.4)で緩衝し、12ストロークで900rpmで組織をホモジナイズ冷1 mlの氷を含有する均質化容器に脳組織を解剖しました。
- 10分1,000×gで遠心分離サンプル。上清を保管してください。
- 再び10分間1,000×gで同じ前と均質化緩衝液の同体積の条件と遠心サンプルでペレットを再均質化します。対応する上清を兼ね備えています。主に核および細胞破片を含んでいるペレットP1を、捨てます。
- 12,000×gで20分間合わせた上清をスピン。廃棄supernaさらなる分画11のためのtantsまたは使用。
- 20分間、12,000×gで900回転とスピンで6ストロークでホモジナイザーを使用して、以前のように均質化緩衝液の同じ体積で再懸濁ペレット。上清を捨てます。ペレットP2は、粗膜画分を表します。
- 粗製の脳の膜画分からのシナプトソームの精製(図3A)
注:粗脳膜画分ミエリン、スクロース密度段階勾配超遠心分離を用いた光膜、シナプトソームおよびミトコンドリアに分離することができます。この5 mMトリス/ HClのpHを0.32 M、1.0 Mまたは1.2 Mのいずれかの濃度のショ糖を含む8.1バッファが必要とされています。- P2画分を製造するための遠心分離を行いながら、超遠心管にショ糖段階勾配を準備します。ガラスパスツールピペットを用いて、1.5ミリリットルの1.2Mのスクロース緩衝液で2.5ミリリットルの1.0Mのスクロース緩衝液及び副層で始まります。
- 再均質P2画分をグラデーションの上に6ストロークと負荷の手動での0.32Mスクロース緩衝液0.5mlインチ
- スイングバケットローターを用いて、超遠心機で2時間、85,000×gでスピン。
- 1.0Mのスクロース緩衝液(ミエリン、光膜)へのインターフェースでの材料などの人気の0.32Mショ糖層を捨てます。 1.0 / 1.2 Mスクロースバッファインタフェースでシナプトソームを収集します。チューブの底にペレットは、ミトコンドリアが含まれています。
- 慎重に混合し、1時間150,000×gでスピンし、1:1の比率でのシナプトソーム画分に0.32 Mショ糖バッファを追加します。シナプトソームは、ペレット内にあり、ここでさらに処理するために必要な緩衝液中に再懸濁することができます。
- PSD-濃縮画分の調製(図3B)
- PTFE(ポリテトラフルオロエチレン)乳棒で200μlの超遠心管中の100μlの抽出バッファー(5 mMトリス/塩酸のpH 8.1、0.5%トリトンX-100)で、単一の動物から、各特定の脳領域を均質化12ストロークで2000 rpmで。
- 、100μLの抽出バッファーを加え混合し、4℃で1時間インキュベートします。 1時間、100,000×gでスピンダウンし、200μlのピペットで注意深く上清S1を収集します。
- 12ストロークで2,000 rpmでのPTFE乳棒で再び100μlの抽出緩衝液と同じチューブでペレットP1を再均質化します。
- 100μlの抽出緩衝液を加え、1時間、100,000×gでピペットとスピンでよく混ぜます。
- 可溶性タンパク質画分にS1と上清S2を兼ね備えています。この画分は、サイトゾルタンパク質、0.5%トリトンX-100可溶性膜タンパク質と細胞外マトリックス分子を含みます。
- 50μlの5 mMトリス/塩酸pHは8.1で残ったペレットを再懸濁します。この画分のPSD、界面活性剤耐性膜、不溶性の細胞骨格要素、ミトコンドリアおよび核を含む細胞破片が含まれています。これは、シナプス後構造のコアを形成するのPSDだけでなく、シナプス前の重要な部分に富んでいますアクティブゾーンでの細胞マトリックス。 PSDの濃縮のための係数は約4であり、PSDの成分の濃縮は、以前に実証されています。 12
質量分析のための3のサンプル調製
- 溶解試料の正規化
注記:タンパク質濃度について試料の正規化は、最終的に弱いシナプスタンパク質発現の変化のために信頼性のある定量的データを得るために非常に重要なステップです。- (:5との聴覚皮質のために - 15 mgの組織使用20μlの材料の合計量に依存)8 M尿素および1氷上でインキュベート50μlの - シナプトソームまたは20内の動物の各脳領域のPSDに富む準備を溶かします超音波浴中の時間。
- ゲル内消化のために、SDSサンプルバッファで直接シナプトソームを溶解します。慎重にゲルの過負荷を回避するためにロードされた金額を計算します。この場合にはそれを考慮して、高い豊富な足場proteiNSは、ゲル電気泳動中とゲル内消化失われます。
- 2 M尿素の最終濃度を確実にするために取り外し可能な界面活性剤の1%希釈します。タンパク質のカルバミル化を防止するために、30℃よりも高い任意の温度を避けてください。
- 標準的な手順13,14に従って、サンプルのアリコート( 例えば 10μl)を用いたSDS-PAGEを行います。
- 製造業者のプロトコルに従って、クーマシーブルーでゲルを染色。手順は、メタノールと酢酸で固定および染色ステップを兼ね備えています。
- 透過モードで校正したゲルスキャナーで全レーンのため、各サンプルの光学密度を測定し、相対的なタンパク質の量を計算します。
- これらの計算によれば、サンプルを正規化します。
- 2つの異なる部分に、各サンプルを分割します。溶液内消化のためのゲル内消化のための三分の一と三分の二を使用してください。
- (:5との聴覚皮質のために - 15 mgの組織使用20μlの材料の合計量に依存)8 M尿素および1氷上でインキュベート50μlの - シナプトソームまたは20内の動物の各脳領域のPSDに富む準備を溶かします超音波浴中の時間。
- ゲル内消化
- ゲル分離
- 濃度調整のサンプルを利用した第二のSDS-PAGEを行います。正規の品質を確認するために二度目のゲルを染色し、定量化します。
- 異なる領域(8 /レーン)でゲル内の試料の各レーンを切り取りますが170キロダルトン以上の分子量範囲を除外します。別々のチューブにゲル片を転送します。
- ゲル内消化の有効性を容易にするために、鋭利なメスで小さなピース内の領域(約1×1 mm)をカットします。
- ダイジェスト15
- 50%アセトニトリル(ACN)及び50mMの炭酸水素アンモニウム(NH 4 HCO 3)からなる緩衝液150μlの- 50で10分間、ゲル片を数回(染色強度に応じて)洗浄します。
- 上清を除去します。 ACNでゲル片をカバーし、ゲル片が白くなり、縮小するまで20℃でインキュベートします。
- ACNを取り外し、5用のゲル片を再水和0.1 M NH 4 HCO 3の50μlの分ACNの同じボリュームを追加し、37℃でさらに15分間インキュベートします。
- 取り外して、完全に液体廃棄します。真空遠心分離でゲル片を乾燥させます。
- システイン残基を減少させるために56℃でNH 45分間、10mMのジチオスレイトール(DTT)および熱サンプルを含む4 HCO 350μlのゲル片を再水和します。
- 上清を取り出して、減少システインをcarbamidomethylateする暗所で30分間、55mMのヨードアセトアミド(IAA)を含む50μlのNH 4 HCO 3を追加します。
- 削除し、ゲル片上記のすべての液体を破棄し、50μlのNH 4 HCO 3およびACNで二回洗っ(1:1)10分間の残留IAAを削除します。真空遠心分離機中で乾燥したサンプル。
- タンパク質の限定消化のためにトリプシンの12.5 ngの/μLを含む25mMのNH 4 HCO 3を追加します。必要量は、ゲルpの大きさと量に依存しますieces。数分間インキュベートし、バッファが吸収されるかどうかを確認します。必要に応じて、ゲル片が完全に覆われるべきである場合にはより多くのバッファを追加します。 37℃で一晩(分。12時間)でインキュベートします。
- ペプチド抽出
- 10とオーバーレイゲル片- 25mMのNH 4 HCO 320μlのとACNの同じボリュームを追加します。超音波浴を使用して、氷上で10分間インキュベートします。その後、削除して、生成されたペプチドのほとんどを含んでいる上清を収集します。
- ゲル片を30%ACN / 0.1%トリフルオロ酢酸(TFA)を含有する抽出緩衝液100μLを加えます。超音波浴中でのインキュベーションを繰り返し、慎重にこの上清を収集します。
- 50%にACN濃度を増加させることにより、最後の抽出手順を繰り返します。超音波浴の10分後、スピンダウンし、上清を集めます。
- 抽出工程のすべての3つの対応する上清を合わせて、真空遠心分離でそれらを乾燥させます。ご了承くださいゲル分離の結果としてレーン/サンプルあたり8の領域は、このステップで再び一つのサンプルに結合されます。
- ゲル分離
- 溶液内ダイジェスト
- ダイジェスト
- 計算された量を使用するために、少なくとも3つの技術の反復のために十分な出発物質を得るために、正規化されたサンプルの( 例えば 、150μlの溶解液の100μlを、特定の脳領域からサンプルの再懸濁のために必要な材料の量および容積に依存します)ラベルフリー質量分析を行います。
- 25mMのNH 4 HCO 3で2 mMのDTTを加え、穏やかにサンプルをボルテックス。 20℃で45分間サンプルを減らします。
- システイン残基をcarbamidomethylateする10mMのIAAを追加します。混合し、20℃の暗所で30分間インキュベートします。
- 最後に、(25mMの酢酸中に1μg/μlのトリプシン)トリプシンストック溶液1μlを加え、12時間、20℃でインキュベートします。
- 固相抽出(SPE)-Purification
- 酸切断可能な界面活性剤を除去し、1%TFAの最終濃度になるようにサンプルを調整し、20℃で1時間インキュベートします。
- 遠心分離機サンプル10分間16,000×gで、慎重に上清を収集します。
- ラックにSPEカラムを配置し、2ミリリットルのメタノールで行列を平衡化。水中0.1%TFA(緩衝液B)の2ミリリットルで2回洗浄します。
- バッファBの2ミリリットルを追加し、サンプルをロードします。さらに3回洗浄します。
- 200μlの70%ACN / 0.1%TFAを添加することによって、ペプチドを溶出します。この手順を繰り返します。
- 両方の溶出液をプールし、真空遠心分離でそれらをドライダウン。
- ダイジェスト
- TiO 2のクロマトグラフィー16によるリン酸化ペプチド、濃縮
- 50中のTiO 2ビーズの2〜80%ACN / 2.5%TFA(緩衝液C)150μlの中で消化し、平衡化ゲル内または溶液内MGによって産生されたペプチドを溶解させますバッファC.μlの
- サンプルにビーズを追加し、20℃で1時間回転装置でインキュベートします。その後、(16,000×gで、1分)ビーズをスピンダウンし、上清を集めます。
- 穏やかに混合し、5分後にスピンダウンして、バッファCの100μlでビーズを3回洗浄します。上清を収集します。 80%の100μlのACN / 0.1%TFAで、この工程を3回繰り返して、それぞれ、(ACNなし)0.1%TFA100μlで3回洗浄しました。
- 、すべての10の上清を組み合わせた真空遠心分離でそれらを乾燥し、ステップ3.5に従ってさらに精製するためのホスホ-ペプチド-留分としてそれらを扱います。
- ビーズから400mMのNH 4 OH / 30%ACN20μlの結合したリン酸化ペプチドを溶出させます。この手順を3回繰り返し、ビーズをスピンダウンした後、すべての上清を収集します。
- ダイジェストゲルで、試料の溶液内消化のの溶出物を合わせて、 ホスホ- pとそれらを扱いますeptide濃縮画分。 8μlの - 4の最終容積まで真空遠心分離機でそれらを乾燥させます。
- 濃縮およびホスホ-ペプチド枯渇画分の脱塩マイクロSPEによって
- 0.1%TFA20μlの中で乾燥させたペプチドを溶解させます。
- 先端に20μlのACNを描くことによって、固定C 18 -マトリックスを平衡化します。先端に水中0.1%TFAを描くことによってマトリックスを洗います。プロセスを3回繰り返します。
- ゆっくり先端に酸性化し、サンプルをロードする(このステップを3回繰り返します)。
- 水に20μlの0.1%TFAでC 18 -マトリックス3回洗浄し、洗浄液を廃棄します。
- 繰り返しによりピペットチップからペプチドを溶出する(3回)70%ACNを20μl/ 0.1%TFAを描画し、別のチューブで、この溶出液を収集します。
- サンプルの溶出物を合わせて、真空遠心分離でそれらを乾燥させます。
4.プロテオーム解析
注:プロテオーム解析は、超HPLCを搭載したハイブリッド二重圧力リニアイオントラップ/オービトラップ質量分析計で行われます。 HPLCは、20μlの注入ループで冷却オートサンプラーから構成され、バイナリロードポンプ(μL流量範囲)、二元ナノ流分離ポンプ、バルブ及びデガッサスイッチング2つのマイクロ有するカラムヒーター。サンプルをまず250 NL /分でカラム( 例えば、75マイクロメートル×25センチ)の分離に続いて7マイクロリットル/分の流量で捕捉カラム( 例えば、100ミクロン×2センチ)に供されます。分離カラムの出口は直接質量分析計のイオン化源でナノスプレーインターフェースに位置コーティングされたピコエミッタ先端に連結されています。
- ナノ液体クロマトグラフィーおよびタンデム質量分析
- 少なくとも30分間、12μlの2%ACN / 0.1%TFAでペプチドサンプルを溶解させます。 15秒間スピンダウンし、バイアル(円錐、減少diameteをオートサンプラーために11μlの上清を移しますR)。
- 次のように制御するソフトウェア( 例えば、Xcalibur)でサンプルアプリケーション、クロマトグラフィー分離およびタンデム質量分析のための自動化された体制を設定します。
- 温度については、以下を使用しますオートサンプラ:5°C;カラムオーブン:45°C。
- 注射用以下を使用します。ボリューム:10μL;流量:7μL/分(2%ACN、0.1%TFA)。時間:8分。バルブの設定:トラップカラム - 廃棄物;質量スペクトル取得:オフ。
- 分離のために、以下を使用します。流量:設定250 NL /分バルブ:トラップカラム分離カラムを、質量スペクトル取得:上。
0分 - 100分:2%ACN、0.1%ギ酸 - 40%ACN、0.1%ギ酸
100分 - 105分40%ACN、0.1%ギ酸 - 95%ACN、0.1%ギ酸
105分 - 109分95%ACN、0.1%ギ酸
109分 - 120分:2%ACN、0.1%ギ酸 - 質量分析の設定については、次を使用します:フルMS:FTMS。解像度60,000; m / z範囲400 - 2000;ミズ/MS:リニアイオントラップ。最小信号閾値500;分離幅2ダ。ダイナミック除外時間30秒を設定します。一価のイオンは選択から除外されています。正規化衝突エネルギーを10ミリ秒までの時間を35%に設定し、そして活性化されています。
注:フルMSスキャンは最大15 LTQ MS / MSが最も豊富に検出されたペプチドイオンの衝突誘起解離(CID)を使用して実行されますが続いています。
- すべてのサンプルのための3つの技術的反復を実行します。
- タンパク質の同定とラベル無料定量化
- タンパク質同定および商用ソフトウェアスイート( 例えば 、PEAKSスタジオ)を利用したラベルフリー定量化に向けたプロセス質量分析生データ。他のほとんどのプロテオームソフトウェアパッケージとは対照的に、この特定のソフトウェアは、従来のタンパク質データベースのアラインメントにデノボ -sequencingアルゴリズムを使用しています。しかし、この工程は、簡単に他の一般的なソフトウェアパッケージによって置換することができます。
- ESSを使用してください表2に記載されているential設定。
- ホスホプロテオミクス
注:効率的かつ信頼性の高いホスホ - ペプチドの取得は、プロテオミクスワークフローの設定のいくつかの本質的な変更が必要です。- リン酸化ペプチド濃縮した後、乾燥決してサンプルを完全に。常に溶解したサンプルを保ちます。
注:リン酸化トレオニンまたはセリンのリン酸化 - エステル結合は非常に壊れやすいです。イオントラップ内で衝突誘起フラグメンテーションの間、これはリン酸のニュートラルロスになります。これにより、識別のために必要とされるペプチドの任意の更なる断片化を防ぎます。質量分析の設定で許可された広帯域の活性化にもリン酸基のニュートラルロスした後、リン酸化ペプチドの断片化を可能にします。それは、「擬似MS 3」の時間節約を行います。 MS / MSデータ中のホスホ部位決意は、特定の検証及び評価を必要とし、蛍光体3によって行うことができます。0。
- リン酸化ペプチド濃縮した後、乾燥決してサンプルを完全に。常に溶解したサンプルを保ちます。
5.バイオインフォマティクス - メタアナリシス
注:機能注釈とネットワーク解析を実行する前に、タンパク質のリストは、前処理されなければなりません。まず個別に各脳領域のための規制タンパク質やリン酸化ペプチドのリストをマージします。その後、誤解を防ぐために、各分画のためにすべての重複UniProtの-IDを削除します。
- GeneCodis 17と特異濃縮分析
- GeneCodisのWebベースのツールを開きます(http://genecodis.cnb.csic.es)
- 生物として「ハツカネズミ」を選択し、注釈などの「生物学的プロセスをGO」。
- 一定の割合のUniProtの-IDのリストを貼り付けます。送信して解析が実行されるまで待ちます。 「GO生物学的プロセスの特異濃縮分析」をクリックし、結果を表示します。
- 他の3つの分画のための手順を繰り返し5.1.3。
- 結果リストの間の任意の重複や交差点を表示するには必要なデータをフィルタリングするためにPerlやPythonのようなスクリプト言語を使用しています。特異濃縮分析のための同様のツール、プラグインBINGO(http://apps.cytoscape.org/とDAVID(https://david.ncifcrf.gov/)とCytoscape(http://www.cytoscape.org/)ですアプリ/ビンゴ)とClueGO(http://apps.cytoscape.org/apps/cluego)。
- GephiとGeneCodisデータのうち力ベースのグラフを生成する(https://gephi.org/)
注:グラフのデータはグラフ形式(.gexf、.graphml、.DOT、.gv、.gml)または手動で入力されたのいずれかで、ユーザによって提供されなければなりません。- グラフノードを生成します
- 手で:オープンGephiと「データラボラトリー」をクリックしてください。ノードを作成します。 「ノード」テーブルに切り替えるには、左側の「ノード」をクリックします。 「ノードの追加」をクリックします。用語の名前を入力します。 「OK」をクリック/ Enterキーを押します。
- 別の方法:保存GeneCodisはPCになります。スプレッドシートプログラムで.txtファイルを開きます。すべての行のexceを削除します。「Item_Details」(用語名)からPT。 「ラベル」に、ヘッダー "Item_Details」に変更します。 「.CSV」としてスプレッドシートを保存します。今Gephiで、「スプレッドシートのインポート」をクリックしてください。 Gephiのファイルブラウザからスプレッドシートを選択します。 「次へ」をクリックします。 「完了」をクリックしてください。
- エッジを経由してノードを接続します。
- 「エッジ」テーブルに切り替えるには、左の「エッジ」をクリックします。すべてのノード(用語)の場合:他の規約に遺伝子名を検索します。 1つまたは複数の遺伝子が共有されている場合は - >エッジを作成します。
- 「エッジを追加」をクリックします。 「無向」を選択します。ソースを選択し、ドロップダウン・リストからノードをターゲットにしています。 「OK」をクリック/ Enterキーを押します。複数の遺伝子が共有されている場合は、「重さ」(表)に豊かさを入力します。
- 力は、グラフィカルなレイアウトをベース。
- オープングラフデータファイルは、「無向」または手動で入力したデータを使用するグラフの種類を設定し、「概要」をクリックしない場合は、既にselecteD。
- 相互接続の豊富さに応じてノードのサイズを変更します。 、統計をクリックして「ネットワークの概要」の「並程度」(重みなしエッジ)または「平均加重度」(重み付きエッジ)のいずれかを実行します。 「外観」で、その後、サイズのボタンに、次の「属性」を選択し、「平均加重度」または「平均次数」に属性パラメータを設定し、「ノード」をクリックしてください。 [適用]をクリックします。
- 最後に:「レイアウト」の「フォースアトラス」を選択し、実行します。ノードが衝突している場合は、「反発力」に変更します。
- 絵にエクスポートします。
- スクリーンショット機能:「概要」、変更グラフ・レイアウト、エッジの厚さ、ラベルのサイズと「グラフ」ウィンドウの下部にあるメニューでスケーリングをクリックします。カメラの左ボタンをクリックし、画像を保存します。
- 「プレビュー」の書き出し機能:「プレビュー」をクリックしてください。 「ストレートデフォルト」にプリセットを変更します。設定の変更sの選択された好みを応じてエクスポートするには、「SVG / PDF / PNG」をクリックしてください。
- グラフノードを生成します
結果
図1は、聴覚弁別学習後のマウスの脳領域の定量的なシナプスプロテオームプロファイリングの完全なワークフローをまとめました。これは、シャトルボックス内の動物のトレーニングを開始します。 図2に示す例では、マウスは、効率的な学習を示し、4 番目のトレーニングセッションの有意FMトーン識別を示し始めました。動物は、脳領域の解剖のために選択された時点で屠殺されます。シナプスの必要な濃縮はどちらシナプトソーム調製することによって達成することができるか、PSD-濃縮方法は、低組織量のために開発された代替的PSD濃縮画分を調製することにより、両者が図3に詳細に記載さ、 例えば、1 -ラット脳12、18から2海馬スライス。それは、小さなチューブ、これらのチューブにフィッティングのPTFE乳棒、および乳棒に電力を供給するための実験室の掘削ドライブが必要です。
シナプトソームの特定のタンパク質組成物に、強く2の異なるが補完的な方法で試料調製を実行することをお勧めします。 PSDの足場は、多くの場合、高い化学量論に発生する非常に高分子量のタンパク質です。で-ソリューションダイジェストは、それらを効率的に抽出するための最良の方法ですが、生成されたペプチド混合物のオーバーサンプリングにつながる可能性があります。ゲル内これらの高分子量タンパク質を排除し、培地と低分子量を有するタンパク質の分析を支持することができ、並列に同じ試料の実行消化します。総合的な分析のためのタンパク質分解消化物の両方のタイプをお勧めします。
脳領域の組織の異なる量は、より良い比較のために適用された材料の調整を必要とする調査しました。 4調べた脳領域の中で聴覚野は一般的に制限する事実でありますまたは。他のすべての脳領域の材料は慎重にシナプトソームまたはPSDに富む画分の調製後に聴覚皮質の量に調整されなければならない(3.1.1を参照します。)。聴覚皮質(AC):マウスから調製したばかりの脳領域の典型的な重量は、次の通りである〜50ミリグラム。海馬(HIP):〜90ミリグラム。線条体(STR):〜120ミリグラムと前頭皮質(FC):〜100ミリグラム。
2.3節で説明したPSD-濃縮方法は、約1500種類のタンパク質と1匹の動物( 表1)のレベルでの脳領域ごとに約250の異なるリン酸化ペプチドの同定を可能にしました。 24時間の最初のトレーニングセッションの後のプロテオーム解析は、同定されたタンパク質の7.3%及びリン酸化ペプチドの5.8%は、有意(P <0.05)ナイーブ対照( 表1)と比較して、それらのシナプス発現の定量的変化を示したことを明らかにしました。ダウンレギュレーションのために目立つ傾向シナプス足場の化はFMTD学習の初期段階でシナプスアーキテクチャの顕著な再配置を指すことがあります。わずか22%が、二つ以上の脳の領域で調節されることが見出されたのに対し、調節タンパク質の大部分は、脳領域特異的な様式で変化しました。六選択された例は、 図4に示されています。
、「RhoAのシグナリング」、「Notchシグナル伝達」クラスリン依存性エンドサイトーシスシグナル伝達」、「軸索誘導シグナリング」、「カルシウムシグナル伝達」:IPAによる複雑な結果のメタ分析では、次の標準的な経路の特定の参加/操作のための証拠を提供します上皮アドヘレン接合の "、"改造 "、"グルタミン酸受容体シグナル伝達」、「GABA受容体シグナル」、「ドーパミン受容体シグナル」と「シナプス長期増強」。
シングル濃縮分析は、タンパク質輸送、細胞接着、リン酸化、エンドサイトーシス、小胞媒介輸送、前脳開発とaxonogenesisに関する前頭皮質の大幅な過剰出現生物学的プロセス( 図5)を明らかにしました。イオン輸送を含む聴覚皮質の生物学的プロセスでは、翻訳、mRNA輸送、タンパク質輸送および学習が目立ちました。海馬のタンパク質画分の分析は、イオン輸送、細胞周期、翻訳、リン酸化および神経系の発達に関連する著しく富化プロセスを検出します。線条体では、mRNA輸送を含む生物学的プロセスを過剰出現し、小胞媒介輸送、axonogenesis、タンパク質分解、タンパク質輸送およびエンドサイトーシスが見つかりました。
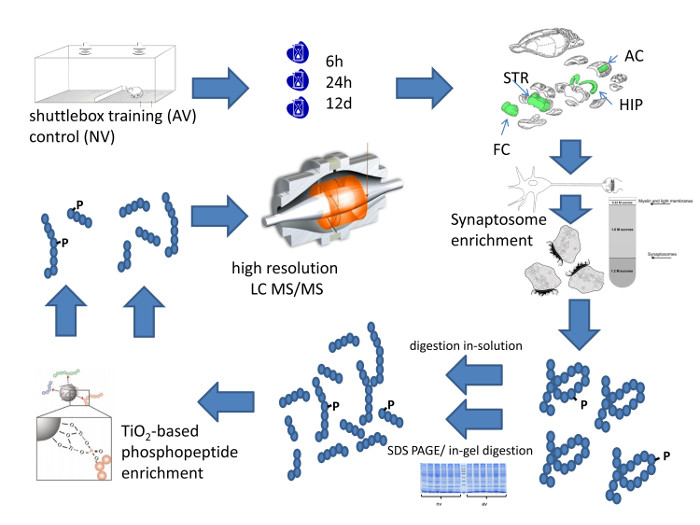
図1: 系統的のWorkFlo方法論的アプローチのワットこの図は、模式的に脳領域の特定のシナプスタンパク質組成物の高分解能定量的プロファイリングのワークフローをまとめたものです。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2:FM トーン弁別課題のマウスの性能の例。動物は、ヒットの増加率(青線)とトレーニングセッションの過程で誤警報(黒色の曲線)の減少率を示しています。重要な差別は、第四セッションから発生します。エラーバーは、SEMとして提供されます。 LARを表示するには、こちらをクリックしてください。この図のGERバージョン。

図3: シナプトソームとPSDに富む画分の調製。 A:シナプトソームの準備。 B:PSD-濃縮分画製剤。どちらの図も、脳組織からのシナプトソームまたは代わりにPSDに富む画分の製造の詳細なワークフローを説明します。 この図の拡大版をご覧になるにはこちらをクリックしてください。
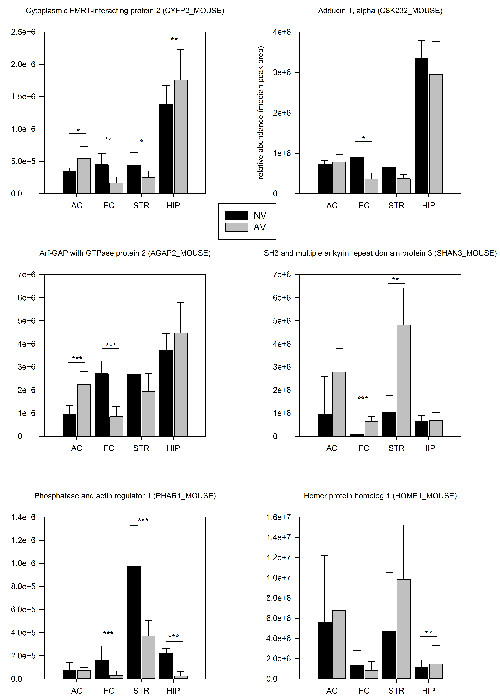
図4: 選択した定量的プロテオミクスの結果。選択されたタンパク質の相対的なシナプスの存在量は、マウスのTRA間で比較しますFMTDタスク(AV、N = 6)およびナイーブ対照マウス(NV、n = 6)が24時間最初のトレーニングセッションの後にINED。存在量の値は、タンパク質の三最も強いペプチドのピーク面積の中央値として計算しました。重要な存在量の変化(AV / NV; t検定)を有するタンパク質は、プロット内でマークされている:* P <0.05、** P <0.01、*** P <0.005。エラーバーはSDとして提供されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図5:GeneCodis / Gephiによって前頭葉のための生物学的経路の可視化。 3の最小タンパク質番号に「生物学的プロセス」に関連する遺伝子オントロジー(GO)データベース(http://geneontology.org)の唯一の重要な用語ここに示されています。ノードがGOタームを表し、ノードのサイズ、特定のノードの接続の線幅と数が他のノードと、このGOタームを共有するタンパク質の数を示しています。 Gephiの「フォースアトラス」方式に、関連するノードは、一緒に密接にクラスタリングされています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| 脳の領域 | 交流 | FC | HIP | 000 "顔=" Calibri "サイズ=" 3 "> STR | Σ |
| 同定されたタンパク質 | 1435 | 1758 | 1572 | 1507 | 6272 |
| 調節タンパク質(P <0.05) | 59 | 130 | 162 | 108 | 顔= "Calibri"サイズ= "3"> 459 |
| ↑AV / NV | 8 | 4 | 76 | 35 | 123 |
| ↓AV / NV | 51 | 126 | 86 | 73 | 336 |
| 識別さphosphomoti FS | 197 | 361 | 273 | 278 | 1109 |
| 規制phosphomotifsた(p <0.05) | 8 | 22 | 21 | 14 | 65 |
| ↑AV / NV | 4 | 00000 "顔=" Calibri "サイズ=" 3 "> 17 | 5 | 9 | 35 |
| ↓AV / NV | 4 | 5 | 16 | 5 | 30 |
表1:プロテオーム結果のまとめ。このテーブルには(NV、n = 6)が、それらのナイーブ対照と比較して、代表的なプロテオミクス訓練を受けたマウスの実験(AV、n = 6)が24時間最初のトレーニングセッションの後をまとめました。ザ459規制タンパク質の合計は重複規制を含んでいます。 283別の規則は、脳の特定のように決定しました。具体的には、57のタンパク質は、2つの脳領域に規定され、18タンパク質の規制は3脳領域で検出されたとわずか2タンパク質は、4つのすべての調べた脳領域に規制されています。
| 許容誤差 | |
| 前駆体の質量(フーリエ変換質量分析法) | 10 ppmの |
| フラグメントイオン質量(リニアイオントラップ) | 0.6ダ |
| ペプチドあたりの最大切れ残り | 3 |
| 修正された修正 | |
| ゲル内消化のサンプルについて | システインのカルバミドメチル化 |
| 溶液内消化のサンプルについて | Methylthiolatioシステインのn個 |
| 変数の変更 | メチオニンの酸化 |
| アスパラギンおよび/またはグルタミンの脱アミド | |
| データベース | UNIPROT / SPROT |
| 分類 | マウス |
| 統計的識別受け入れ設定 | |
| デノボ平均地元の信頼(ALC) | > 50% |
| ペプチド偽発見率(FDR、ESTに基づく。デコイ融合) | <1% |
| タンパク質の重要性(-10logPは、修飾されたT検定に基づきます) | > 20 |
| ユニークなペプチド/タンパク質 | ≥1 |
| 定量化の設定: | |
| 次の場合、定量化のために使用されるペプチド | |
| ペプチドの意義(-10logP) | > 30 |
| におけるペプチド同定 | サンプルの≥50% |
| ペプチドの信号品質 | > 1 |
| ペプチド平均面積 | > 1E5 |
| ペプチドの保持時間公差 | <5分 |
| 正規化 | 全イオン電流(TIC)によって |
表2:タンパク質同定のための設定(ステップ4.2.2)。
ディスカッション
研究では、マウスの異なる脳領域における学習と記憶の統合時のシナプスタンパク質の発現の変化の正確な定量的プロファイリングのために最適化された方法論的なワークフローを提供します。セットアップは、質量分析用の試料につき少なくとも3つの技術の反復の必要なアプリケーションのにもかかわらず、単一の動物のレベルでのタンパク質発現を研究する機会を提供します。
方法論は、アカウントに高分子量の足場タンパク質からなる前およびpostsynapseの特定のタンパク質組成を取るだけでなく、媒体や低い分子量をもつ重要なメディエーター蛋白質の。シナプトソーム調製物の溶液内消化物は、効率的な世代になると、それゆえ、足場由来ペプチドの過剰表現。これは、順番に、より小さなまたはより低い豊富なタンパク質の解析を抑制することができます。からSDS-PAGE画分の推奨調製並行してゲル内消化手順と組み合わせて、各試料のアリコートは、中、低存在量タンパク質の分析を容易にし、強くお勧め補完的な方法を表しています。試料由来の全ての画分の別個の質量分析適用後( 例えば 、溶液内消化、ゲル内消化、合成リンに富む画分)に対応するMS / MSデータセットは、PEAKSで合成し、タンパク質同定および定量するためのさらなる計算することができます。ソフトウェアまたは代替の一般的なソフトウェアパッケージ。
また、溶液内消化されたサンプルの生成、ゲル内消化由来試料の分画(サンプルレーンの別々に処理ゲルエリア)、画分の個々のアプリケーションを増加させることができる質量分析(イオン交換クロマトグラフィーによって)分析の深さ。しかしながら、この拡張ワークフローは劇的にLS-MS / MSデータ取得に必要な時間を増加させます。 GENERATIOのためプロテオームプロファイリングの指定された時間のコースを学習し、記憶形成時のシナプスタンパク質の再編成の詳細な分子配列のNが必要です。この時間経過は直後に、あるいは最初のトレーニングセッション中に開始し、動物のパフォーマンスは約後学習曲線の漸近レベルに達するまでクローズ噛み合っ時間枠をカバーすることができます。 8 -訓練の10日間(詳細は図2を参照)。
シナプスのタンパク質のリン酸化の変化の分析は、FMTD学習時に選択した時間枠に特に焦点を当てが必要です。一方で、タンパク質のリン酸化と脱リン酸化によってトリガーされることが知られているシナプスタンパク質の再編成を開始するシグナル伝達カスケードは、動物の訓練の非常に初期の段階で期待されています。一方、S内の接続およびアセンブリを調節呼ばれる複数のリン酸化されたシナプスのタンパク質の長期的な修正がありますynapticアーキテクチャ19、20。これらの翻訳後修飾があっても、メモリの統合の後の時点で予想されています。
このプロテオミクスワークフローによって生成された複雑なデータセットは、分子経路と重要な分子を、参加識別するために、バイオインフォマティクスの処理を必要とします。メタアナリシスは、学習と記憶のプロセスにおいて役割を果たしている重要な過剰出現経路を示しています。
開示事項
The authors have nothing to disclose.
謝辞
We wish to thank Yvonne Ducho and Kathrin Pohlmann for excellent technical assistance. This work was supported by the Deutsche Forschungsgemeinschaft (SFB 779) and by the State Saxony-Anhalt / European Regional Development Fund (ERDF) via the Center for Behavioral Brain Sciences (CBBS).
資料
| Name | Company | Catalog Number | Comments |
| 3 M Empore Solid Phase Extraction- Filter | 3M Bioanalytical Technologies | 4245SD | 7 mm/3 ml |
| Acclaim PepMap 100 | Dionex/Thermo Scientific | 164564 | 100 µm x 2 cm, C18 |
| Acclaim PepMap 100 | Dionex/Thermo Scientific | 164569 | 75 µm x 25 cm, C18 |
| Acetic acid | Carl Roth GmbH | 3738.1 | |
| Acetonitrile (ACN) | Carl Roth GmbH | AE70.2 | |
| Acrylamide (30%) | AppliChem | A0951 | |
| Ammonium hydrogen carbonate | Fluka | 9830 | |
| Ammonium hydroxide | Fluka | 44273 | |
| Ammonium persulfate (APS) | AppliChem | A2941 | |
| Biofuge pico | Heraeus GmbH | 75003280 | |
| Blue R-250 | SERVA Electrophoresis GmbH | 17525 | |
| Bromophenol Blue | Pharmacia Biotech | 17132901 | |
| C57BL/6J mice | Charles River | ||
| Cantharidin | Carl Roth GmbH | 3322.1 | |
| Centrifuge tubes for MLS-50 | Beckman Coulter | 344057 | |
| Centrifuge tubes for TLA 100.1 rotor | Beckman Coulter | 343776 | |
| Dithiothreitol (DTT) | AppliChem | A1101 | |
| Eppendorf 5417R centrifuge | VWR | 22636138 | |
| Eppendorf A-8-11 rotor | VWR | 5407000317 | |
| Formic acid | Fluka | 14265 | |
| GeneCodis | http://genecodis.cnb.csic.es/ | ||
| Gephi | https://gephi.org/ | ||
| Glycerol | AppliChem | A1123 | |
| Glycine | AppliChem | A1067 | |
| HALT Phosphatase Inhibitor Cocktail | Pierce /Thermo Scientific | 78420 | |
| HEPES Buffer solution | PAA Laboratories GmbH | S11-001 | |
| Homogenization vessel 2 ml | Sartorius AG | 854 2252 | |
| Hydrochloric acid | Sigma-Aldrich | H1758 | |
| Imidazole | Sigma-Aldrich | I2399 | |
| Ingenuity Pathway Analysis | Qiagen | ||
| Iodoacetamide (IAA) | Sigma-Aldrich | I1149 | |
| Laboratory drilling drive K-ControlTLC 4957 | Kaltenbach & Vogt GmbH | 182997 | |
| LTQ Tune Plus 2.7.0.1112 SP2 | Thermo Scientific | ||
| LTQ Orbitrap Velos Pro | Thermo Scientific | ||
| Macs-mix tube rotator | Miltenyi Biotech | 130-090-753 | |
| Magic Scan 4.71 | UMAX | ||
| Methanol | Carl Roth GmbH | AE71.2 | |
| MLS-50 rotor | Beckman Coulter | 367280 | |
| Optima MAX Ultracentrifuge | Beckman Coulter | 364300 | |
| PageRuler Prestained Protein Ladder | Thermo Scientific | 26616 | |
| PEAKS 7.5 | Bioinformatic Solutions | ||
| Phosphatase Inhibitor Cocktail 3 | Sigma-Aldrich | P0044 | |
| PhosphoRS 3.1 | IMP/IMBA/GMI | ||
| PhosSTOP | Roche | 4906845001 | |
| Plunger/pestle made of PTFE | Sartorius AG | 854 2651 | |
| PotterS homogenizer | Sartorius AG | 853 3024 | |
| Protease Inhibitor complete mini | Roche | 4693159001 | |
| Quantity One 4.5.1 | BioRad | ||
| RapiGest | Waters | 186002122 | |
| Shuttle box | Coulbourne Instruments | ||
| Sodium dodecylsulfate (SDS) | AppliChem | A1112 | |
| Sodium molybdate | Carl Roth GmbH | 274.2 | |
| Sodium tartrate dihydrate | Sigma-Aldrich | 228729 | |
| SONOREX RK 156 Ultrasonic Bath | BANDELIN electronic GmbH & Co. KG | 305 | |
| Soundproof chamber | Industrial Acoustics Company | ||
| Sucrose | Carl Roth GmbH | 4621.2 | |
| Tetramethyl ethylene -1,2-diamine (TEMED) | Sigma-Aldrich | T9281 | |
| Thermomixer basic | CallMedia | 111000 | |
| Titansphere TiO 5µm | GL Sciences Inc. Japan | 502075000 | |
| TLA 100.1 rotor | Beckman Coulter | 343840 | |
| Trifluoro acetic acid (TFA) | Sigma-Aldrich | T6508 | |
| Tris ( hydroxymethyl) aminomethane (TRIS) | AppliChem | A1086 | |
| Triton X-100 | Sigma-Aldrich | T8532 | |
| Trypsin Gold | Promega | V5280 | |
| Ultimate 3000 Ultra HPLC | Dionex/Thermo Scientific | ||
| Ultracentrifuge tube | Beckman Coulter | 343776 | |
| Unijet II Refrigerated Aspirator | Uniequip Laborgeräte- und Vertriebs GmbH | ||
| UNIVAPO 100 H Concentrator Centrifuge | Uniequip Laborgeräte- und Vertriebs GmbH | ||
| Urea | AppliChem | A1049 | |
| Water (high quality purifed) | Resistivity: > 18.2 MΩ*cm at 25 °C Pyrogens: < 0.02 EU/ml TOC: < 10 ppb | ||
| Xcalibur 3.0.63 | Thermo Scientific | ||
| ZipTipC18 Pipette Tips | MILLIPORE | ZTC18S960 |
参考文献
- Lamprecht, R., LeDoux, J. Structural plasticity and memory. Nat Rev Neurosci. 5 (1), 45-54 (2004).
- Bingol, B., Schuman, E. M. Synaptic protein degradation by the ubiquitin proteasome system. Curr Opin Neurobiol. 15 (5), 536-541 (2005).
- Richter, J. D., Klann, E. Making synaptic plasticity and memory last: mechanisms of translational regulation. Genes Dev. 23 (1), 1-11 (2009).
- Rosenberg, T., et al. The roles of protein expression in synaptic plasticity and memory consolidation. Front Mol Neurosci. 7, 86 (2014).
- Scheich, H., et al. Behavioral semantics of learning and crossmodal processing in auditory cortex: the semantic processor concept. Hear Res. 271 (1-2), 3-15 (2011).
- Kähne, T., et al. Synaptic proteome changes in mouse brain regions upon auditory discrimination learning. Proteomics. 12 (15-16), 2433-2444 (2012).
- Reichenbach, N., et al. Differential effects of dopamine signalling on long-term memory formation and consolidation in rodent brain. Proteome Sci. 13, 13 (2015).
- Kähne, T., et al. Proteome rearrangements after auditory learning: high-resolution profiling of synapse-enriched protein fractions from mouse brain. J Neurochem. , (2016).
- Li, K., et al. Organelle proteomics of rat synaptic proteins: correlation-profiling by isotope-coded affinity tagging in conjunction with liquid chromatography-tandem mass spectrometry to reveal post-synaptic density specific proteins. J Proteome Res. 4 (3), 725-733 (2005).
- Carlin, R. K., Grab, D. J., Cohen, R. S., Siekevitz, P. Isolation and characterization of postsynaptic densities from various brain regions: enrichment of different types of postsynaptic densities. J Cell Biol. 86 (3), 831-845 (1980).
- Smalla, K. H., Klemmer, P., Wyneken, U., Dermietzel, R. . The Cytoskeleton - Imaging, Isolation, and Interaction. , 265-282 (2012).
- Smalla, K. H., et al. The synaptic glycoprotein neuroplastin is involved in long-term potentiation at hippocampal CA1 synapses. Proc Natl Acad Sci U S A. 97 (8), 4327-4332 (2000).
- Shapiro, A. L., Vinuela, E., Maizel, J. V. Molecular weight estimation of polypeptide chains by electrophoresis in SDS-polyacrylamide gels. Biochem Biophys Res Commun. 28 (5), 815-820 (1967).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Shevchenko, A., Wilm, M., Vorm, O., Mann, M. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal Chem. 68 (5), 850-858 (1996).
- Thingholm, T. E., Larsen, M. R., Ingrell, C. R., Kassem, M., Jensen, O. N. TiO(2)-based phosphoproteomic analysis of the plasma membrane and the effects of phosphatase inhibitor treatment. J Proteome Res. 7 (8), 3304-3313 (2008).
- Carmona-Saez, P., Chagoyen, M., Tirado, F., Carazo, J. M., Pascual-Montano, A. GENECODIS: a web-based tool for finding significant concurrent annotations in gene lists. Genome Biol. 8 (1), 3 (2007).
- Bonn, S., Seeburg, P. H., Schwarz, M. K. Combinatorial expression of alpha- and gamma-protocadherins alters their presenilin-dependent processing. Mol Cell Biol. 27 (11), 4121-4132 (2007).
- Tweedie-Cullen, R. Y., Reck, J. M., Mansuy, I. M. Comprehensive mapping of post-translational modifications on synaptic, nuclear, and histone proteins in the adult mouse brain. J Proteome Res. 8 (11), 4966-4982 (2009).
- Li, L., et al. The differential hippocampal phosphoproteome of Apodemus sylvaticus paralleling spatial memory retrieval in the Barnes maze. Behav Brain Res. 264, 126-134 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved