このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
レーザーマイクロダイセクションRNA-のSeqのための実験デザイン:トウモロコシ葉の開発の分析からの教訓
要約
Many developmentally important genes have cell- or tissue-specific expression patterns. This paper describes LM RNA-seq experiments to identify genes that are differentially expressed at the maize leaf blade-sheath boundary and in lg1-R mutants compared to wild-type. The experimental considerations discussed here apply to transcriptomic analyses of other developmental phenomena.
要約
開発に重要な役割を持つ遺伝子は、しばしば、空間的および/または一時的に制限された発現パターンを有します。多くの場合、これらの遺伝子転写物は検出されないか、または差動で全体の植物器官のトランスクリプトーム解析に(DE)表現として識別されていません。レーザーマイクロダイセクションRNA-のSeq(LM RNA-のSeq)は、特定の発達のドメインにDEされる遺伝子を同定するための強力なツールです。しかし、顕微解剖と比較するための細胞ドメインの選択、およびmicrodissectionsの精度は、実験の成功に不可欠です。ここでは、2つの例は、トランスクリプトミクス実験のための設計上の考慮事項を説明します。 DEは、トウモロコシの葉の近位-遠位軸、及びliguleless1-R(LG1-R)でのDE遺伝子を同定するための第二の実験に沿っている遺伝子を同定するためのLM-RNA配列分析 変異体は、野生型と比較しました。これらの実験の成功に貢献の重要な要素は、組織学的およびSIで詳述しました。TUのハイブリダイゼーションは、同等の発生段階の葉原基の選択、分析されるべき領域の顕微解剖のための領域を選択するための形態学的なランドマークの使用を分析し、正確に測定されたドメインの顕微解剖。本稿では、LM、RNAのSeqによって発達ドメインの分析のための詳細なプロトコルを提供します。ここに示されたデータは、顕微解剖のために選択された領域が得られた結果にどのように影響するかを示しています。
概要
それは遺伝的解剖( 図1A)の影響を受けやすいブレードとシースとの間に明確な境界を持っているとして、トウモロコシの葉は、形態形成の間に発達フィールドの形成を研究するための理想的なモデルです。葉の開発、より小さなセルの線形バンド、preliguleバンド(PLB)の初期段階で、事前ブレードおよびプレシースドメインに葉原基を細分化します。フリンジのような小舌と三角耳介は、PLB( 図1A、C、D)から発生します。遺伝子スクリーニングは、ブレード・シース境界を崩壊させる変異を同定しました。例えば、劣性liguleless1(LG1)の変異は、小舌と耳介1、2、3、4( 図1B)を削除します。 in situハイブリダイゼーションLG1転写物がPに蓄積することを明らかにしましたそれ小舌の開発5、6のための優れたマーカー( 図1E)作りLBと新興小舌、。
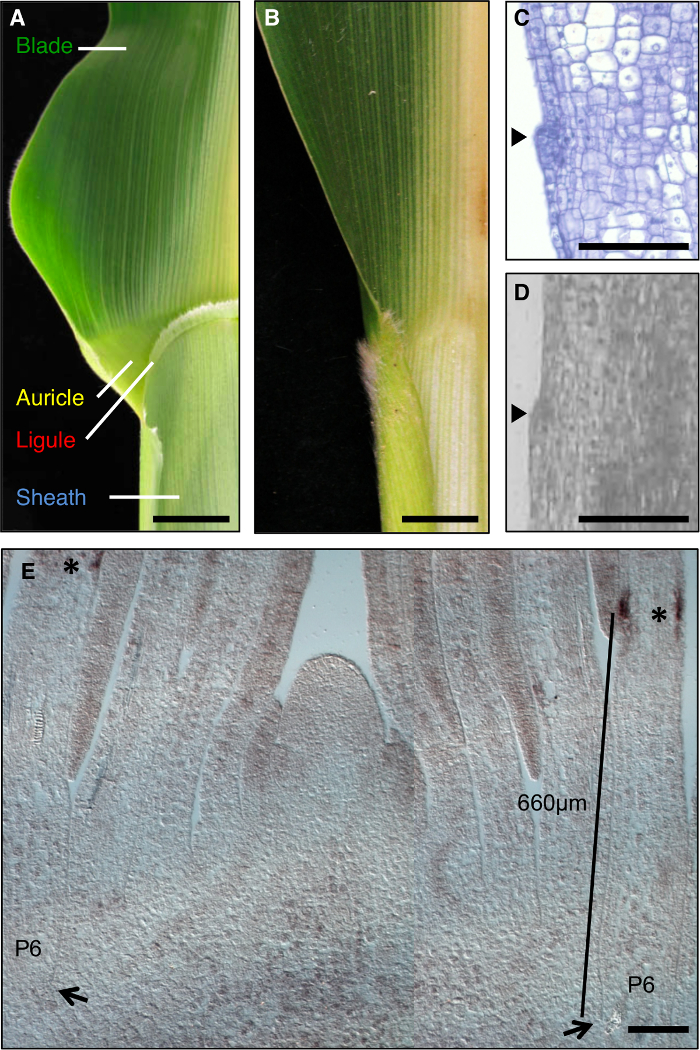
図1:野生型と liguleless1-R トウモロコシの葉。 (A)小舌と耳介の構造を示す成熟した野生型の葉のブレードシース境界領域。小舌と耳介の構造が存在しないことを示す成熟liguleless1-Rの葉の(B)ブレード・シース界領域。 AとBでの葉は中肋に沿って半分にカットされています。 (C)野生型の葉の原基の縦断面図。サンプルを処理し、組織学的分析のために染色されています。開始小舌は葉(矢じり)の面から突出するバンプとして明らかです。 (D)縦宗派野生型の葉の原基を介してイオン。本文中に記載されているように、サンプルは、LMのために処理されています。アローヘッドは、小舌を開始示しています。シュート頂側面縦断面のin situハイブリダイゼーション(E)LG1。アスタリスクは、P6の葉原基のPLBでLG1転写産物の蓄積を示しています。矢印は、P6原基のベースを示しています。バーでは、PLBへの原基のベースから測定値を示しています。 AとBの中のスケールバーは20ミリメートルを=。 CEでのスケールバー=100μmです。この図は、参照6(植物生物学者の著作権協会)から変更されています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
本研究では、LM RNA-のSeqを差動葉原基の他の部分に、IDEにブレードシース境界相対で(DE)に発現する遺伝子群を同定しました野生型の兄弟に比べてLG1-R変異体でDEですntify遺伝子。 LM-RNAのSeqは、特定の細胞または細胞のドメイン7に転写物の蓄積を定量化する方法です。直動システムは、レーザーやデジタルカメラと顕微鏡を組み合わせます。切片組織は、スライド上にマウントし、顕微鏡を通して見られます。 LMソフトウェアは、典型的には、ユーザが顕微解剖のために任意の選択した領域を概説することを可能にする描画ツールが含まれています。線に沿って、レーザーカット、および選択された組織は、スライドをオフに放り出さし、スライド上に懸架チューブにされています。 LMは、ユーザが特定の細胞層を含む正確なドメイン、さらには単一細胞8,9を顕微解剖することができます。次いで、RNAを顕微解剖組織から抽出することができます。その後、RNA-のSeq成分が抽出されたRNA 10から生成されたcDNAライブラリーを配列決定するために、次世代シーケンシングを利用して、= "外部参照"> 11。
LM RNA-seqのの主な利点は、転写物の正確に定義されたドメイン内の蓄積と同時に全体のトランスクリプトーム7のプロファイルを作成する能力を定量する能力です。技術は、関心領域は、多くの場合、微小な初期発生イベントをプローブに特に適しています。以前の研究は、植物9の発生過程を研究するためのマイクロアレイ技術、12、13と組み合わさLMを利用しています。 RNA-SEQが低発現される遺伝子を含む、広いダイナミックレンジにわたって転写を定量化するという利点を有し、かつ事前配列情報は、11を 10に必要とされません。また、LM RNA-のSeqは、遺伝子冗長性または喪失型の致死性に突然変異誘発画面でミスの可能性があることを発育に重要な遺伝子を強調するために可能性を秘めています機能変異体。
このような狭いsheath1(NS1)とカップ状cotyledon2(CUC2)などの発達に重要な遺伝子は、多くの場合、ただ1つまたは少数の細胞17の特異的な発現パターンを持っている18、19、20。多くは成熟した臓器に発生初期の段階でのみ発現し、されていません。全体の臓器や大規模なドメインを分析すると、これらの細胞特異的転写産物が希釈され、より多くの従来の分析で検出されない場合があります。正確に定義されたドメインの分析を可能にすることにより、LM RNA-のSeqは、これらの組織特異的遺伝子を同定し、定量化することを可能にします。
ここに記載した実験の成功に重要な要因は、分析のための適切な発達段階とドメインの選択を導いた徹底的な組織学的分析、および正確なmeasuremeましたLMための細胞組織のドメインのヌクレオチド。同等のドメインは、すべての複製のためにサンプリングしたことを確認するために、組織は、同じ発達段階での葉原基から回収し、顕微解剖されたドメインは、新興小舌( 図2)のような形態学的なランドマークと比較して測定しました。いくつかの遺伝子は、葉の基部の先端からの勾配で発現することが知られています。葉の近位-遠位軸に沿った異なる場所からサンプリングの正確なドメイン、変化を測定することにより、最小値( 図3A)に維持しました。同じサイズのドメインをmicrodissectingすることにより、細胞特異的転写物の希釈差によるばらつきも( 図3B)に減少しました。茎頂の側面縦断面は全てmicrodissectionsのために使用しました。これらは、( 図4)中肋マージンの軸に垂直な部分です。 SAMを含むセクションのみを使用することと同等の横方向の領域を確保し葉原基が分析されます。
処理され、LMのために切片サンプルでは、小舌伸長の最初の形態学的兆候が原因向軸表皮( 図1D、 図2)における周縁の細胞分裂に向軸側のバンプです。新興小舌を確実plastochron 7段葉原基で識別することができることを判断しました。私たちは、新興小舌と耳介を形成することになるすぐ遠位の細胞を含む全小舌の領域で発現する遺伝子、に興味を持っていました。同等の組織の選択が行われたことを確実にするために、小舌のバンプは、形態学的ランドマークとして使用し、小舌バンプを中心100μmの矩形はLM( 図2A、2B)のために選択しました。前ブレードとプレシースの同等サイズの矩形が同じ葉原基から選択されました。
liguleless変異植物の分析は異なるchalleを発表しましたNGE; LG1-R変異体は、したがって、この形態学的特徴は、LMための領域を選択するために使用することができなかった、小舌を形成しません。代わりに、野生型の葉の原基におけるLG1転写物の蓄積の領域を決定し、このドメインを含むであろう領域を定義しました。以前の研究は、PLBの位置は、成長条件に依存して変化することを示したので、これらの予備的な分析は、最終的な分析のために使用したのと同じ植え付けから苗木上で実施しました。 in situハイブリダイゼーションはLG1転写物がPLB P6の葉原基( 図1E)に蓄積することが示されました。私たちは、LG1式(紫の長方形、 図2A)のドメインを包含し、野生型とLG1-R植物からこれらの同等の領域を撮影した葉原基のベースからドメイン400〜900ミクロンを選択しました。 transcripを比較した場合、遺伝的背景と成長条件の変化を最小限に抑えるために、LG1-R及び野生型植物におけるT蓄積は、変異体と野生型同胞の分離ファミリーを使用しました。
プロトコル
注:組織は、LMのために固定されるのと同時に、組織学的分析のために組織を修正しました。後でLM案内します形態学的特徴のために染色した切片を調べます。野生型と変異体を比較すると、目的の遺伝子を(この場合LG1に)発現されるドメインを定義するために、in situハイブリダイゼーションまたは免疫学的に行います。
1.組織固定および処理
- 標準的な条件6の下で旧2週間にトウモロコシ苗の干潟を成長させます。
- 側部( 図4)のための茎頂を解剖。
- ちょうど土ライン以下の物品税の苗。
- カミソリの刃を使用して、1または2の成熟葉に囲ま稈の楕円形が見える( 図4B)になるまで、ステム(カット1、 図4A)の基部から薄いスライスを削除します。
- 約10mmベース(2をカットし、 図4A)の上に別のカットを行います。この10ミリメートルのセグメントは、SAMと若い葉原基が含まれています。
- ベースが上を向いているので、10ミリメートルのセグメントをオンにします。 2-3 mm厚の組織切片を(切断3、及び図4、 図4B)が得られるように、2つの切り込みは、横軸に平行します。外側の2つの部分を破棄し、固定および包埋のために中央のスライスを保持しています。
注:外葉をトリミングして廃棄することができます。
- 埋め込むための組織とプロセスを修正しました。
- その後の工程で使用するすべての材料がRNaseフリーであることを確認します。 (溶液1リットル当たり1ミリリットルDEPC時々振盪し、オートクレーブで一晩インキュベート)ジエチルピロカーボネート(DEPC)の溶液を扱います。少なくとも6時間、200℃以上のオーブン中でガラス製品焼くおよびRNaseの除染液でプラスチックウェアを扱います。
- 1日目:氷上のガラスバイアル中(酢酸:1エタノール3)ファーマーズ修正〜10ミリリットルで組織切片を浸し。すべてのサンプルが解剖された後、vacuu適用M気泡を除去し、固定液の浸透を支援します。ゆっくり真空を解放した後、10分間真空下で保持します。固定液を交換し、穏やかに振盪しながら4℃で一晩インキュベートします。
- 2日目:各〜10ミリリットル、ソリューションの次のシリーズでインキュベート1時間ごと、穏やかに振盪しながら、すべての。 4℃、4℃、4℃、4℃、4℃、100%エタノールでの100%エタノールでの100%エタノールで95%エタノール、1 85%エタノール:1エタノール:室温でキシレン、室温で100%のキシレン、室温で100%のキシレン。
注:キシレンは接触および吸入による毒性があります。ドラフト内で作業し、適切な手袋を使用しています。 - キシレンの約半分の体積に培地ペレットをパラフィン包埋組織を追加し、穏やかに振盪しながら室温で一晩インキュベートします。
- 3日目:ペレットが溶融するまで60℃のオーブンにバイアルを転送します。ソリューションを捨て、新鮮な溶融組織包埋剤と交換してください。培地を2回以上変更日中。
- 4日目:午前中に一度メディアを埋め込む変更組織。午後になるまで60℃のオーブンに戻ります。
- キャスト・ブロック
- 組織埋め込みステーションのホットプレート上に埋め込む金型を置きます。切断面を下に向けて、埋め込み型への組織サンプルを転送するために鉗子を使用してください。溶融パラフィンで金型を補充し、金型の上に埋め込みリングを配置します。パラフィンが凝固するまでコールドプレートに移します。シリカゲルと密閉容器に4℃でパラフィンブロックを格納します。
2.セクショニングと準備をスライドさせ
- ミクロトーム25に10μmの切片をカットします。
- リボンを調べ、中央値のセクションを選択します。中央値のセクションでは、葉原基に囲まれた細胞のドームのように表示されるSAMを、記載されたものです。
- スライド上のマウントセクション。
- LMのに適している場所スライド(いずれかのRNaseを含みませんか、焼成)42°Cの暖かいスライド及びスライドをカバーするために、50%エタノール溶液の数滴を加えます。
- セクションが展開するまでエタノール溶液のセクションをフロート。
注:フローティングエタノール溶液のセクションではなく、水はRNA分解を減少させる沈殿した状態でRNAを保持します。 - スライドを傾け、使い捨てのトランスファーピペットで吸引により過剰のエタノール溶液を除去。追加のエタノール溶液を移送するようにリントフリーワイプを使用してください。
- 数時間または一晩42℃で乾燥したスライド。ストアは、シリカゲルで密閉容器中、4℃で摺動します。
- 脱パラフィンは、使用当日にスライドします。
- 含む3ガラスコプリンジャーを準備し; 100%キシレン(キシレンI)、100%キシレン(キシレンII)、および100%エタノール(〜各溶液50ml)。
- スライドを転送するためにクリーンな鉗子を使用して、Iは2分間、2分間、キシレンII、および1分間の100%エタノール、キシレンにスライドを浸します。
- ドレインにスライド室温でリントフリーワイプ、空気乾燥にエス。
Plastochron 7葉の原基からブレード、小舌とシースサンプルの3顕微解剖
- LM顕微鏡のステージ上にスライドを固定します。スライドごとに5つのセクションを利用し、各反復のために5または6のスライドを使用してください。
注:単一の反復のための組織のプールは、図5に示されています。 - スライドを調べ、中央の参照点としてSAM頂点を使用して、各スライド上に5つの最も中央値のセクションを識別します。
注:これは、低倍率で行うことができ、通常5倍対物レンズで十分です。 - 10倍または20倍対物レンズを使用して、各セクションのplastochron 7葉原基に小舌の位置を特定します。小舌は、葉原基の向軸面から突出するバンプとして表示されます。 LMソフトウェアの描画ツールを使用してこの位置をマークします。鉛筆アイコンを選択し、適切なPOSITIにカーソルを移動上および描画するマウスをクリックしてドラッグします。
注:10Xや20Xの目的は、この以降に適しています。横方向のセクションを使用する場合は、各リーフ原基の両側には、各区画( 図2A)に存在します。 - 定規ツールと長方形の描画ツールを使用して、各セクション(赤長方形、 図2A、2B)の小舌を中心に100μmの高長方形を測定します。これらは、「小舌」のサンプルになります。
- 定規ツールを使用すること。定規のアイコンを選択し、測定対象物の一方の端にカーソルを移動し、クリックして、オブジェクトを測定するためにドラッグします。定規の長さが画面に表示されます。
- 四角形を描画するには、 、四角形のアイコンを選択し、長方形の一角であることをクリックして、適切な大きさの四角形を描画するためにドラッグしますポイントにカーソルを移動します。また、直線描画ツールを選択して、4本の直線を引きます。
- メジャー100μmの矩形は50μmの「小舌」の長方形の上方と下方に位置します。
注:これらは、「ブレード」と「シース」のサンプル、それぞれ(緑と青の長方形、 図2A、2B)となります。我々の組織学的データに基づいて、100μmの矩形は、全小舌の領域を包含する。ブレードシースの等価なサイズの部分は、組織の同様の量が毎に収集されたことを確認するために選択しました。 50μmのスペーサーには小舌地域組織が不注意ブレードまたはシースmicrodissectionsに含まれていないことを確認するために使用されました。
- 顕微解剖測定長方形( 図2D - 2F)7、8、9、別々のチューブに小舌、ブレードシースサンプルを収集。選択したドメインの輪郭に沿って組織切片を切断するためにレーザーカット機能を使用してください。 CATAを使用してくださいスライドオフとチューブの蓋( - 2F 図2D)に組織の矩形を推進するPULT機能。
Plastochron 7葉の原基からブレード、小舌とシース向軸表皮サンプルの4顕微解剖
- セクションを選択して、セクション3(上記)に記載されているように、plastochron 7小舌を中心に100μmの高いセグメントを測定するために、定規ツールを使用します。
- 描画ツールでアウトラインによって向高い各100μmの表皮細胞「ブレード」と「シース」セグメント(緑と青の選択、 図2C)のみを選択します。表皮は、外側の細胞層です。向軸側は、SAMに最も近いものです。
- 3.3節(赤選択、 図2C)に記載されているように「小舌」のサンプルについては、新興の小舌のバンプの細胞のみを選択します。
- ブレード、小舌とシェイ収集顕微解剖選択された領域、セクション3.5で説明したように別々のチューブ内番目表皮サンプル、。
LG1-Rおよび野生型兄弟からPlastochron 6葉の原基の5顕微解剖
- 変異体(LG1-R)および野生型植物の家族を分離育てます。
- セクション1.2から1.4で説明したように、LMのための茎頂を修正し、プロセス。分離それらを維持するために、別々のバイアル中の野生型および変異シュート頂点を修正しました。同じ植栽からの試料を固定し、in situハイブリダイゼーションのために処理されるべきです。
- LG1は、in situハイブリダイゼーション6、26、27 にLG1を実行することにより、野生型の兄弟で転写されている場所を特定。複数のサンプル( 図1E)で葉原基のベースからLG1転写産物の蓄積の位置を測定します。
- in situハイブリダイゼーションデータに基づき、リーフプリモの一部を選択しますLG1が転写された領域を包含するrdium。この場合、plastochron 6葉原基(紫の長方形、 図2A)のベース400から900ミクロン。
- セクション3.5で説明したように顕微解剖は、別々のチューブにLG1-Rおよび野生型サンプルを収集、葉原基の部分を選択しました。
6. RNA抽出バッファーを適用します。
- 顕微解剖された組織に50μlのRNA抽出緩衝液を適用し、RNA抽出を進めます。参照6で説明したようにRNA抽出、RNA増幅、ライブラリー構築、シーケンシングとバイオインフォマティクス解析を続行します。
結果
約1,000,000-1,500,000μm2の組織のそれぞれのために回収した。図2に概説LM方式を使用すると、すべてのセル-層LMに( 図5)を複製し、20万平方 μmあたりは、向軸表皮LMのために複製します。それぞれがLG1-Rおよび野生型葉原基のLMで複製するための約組織の250万μm2で収集しました。リニアRNA増幅の2ラウンドの?...
ディスカッション
実験計画は、RNA-seqの実験において重要な要因です。重要な考慮事項は、正確なドメイン(複数可)および発生段階(複数可)を分析するために、どのような比較が行われるです。出力は、典型的には2つ以上の条件との間でDEされている遺伝子のリストであるので、比較の観点から考えることが重要です。すべての実験と同様に、一度に1つの変数を変更することが重要です。例えば、比較す?...
開示事項
The authors have nothing to disclose.
謝辞
著者はコラボレーションを継続的かつ小舌開発について議論を刺激するためのS.メルルーサに感謝します。この作品は、国立科学財団助成MCB 1052051およびIOS-1848478によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Diethyl pyrocarbonate | Sigma-Aldrich | 159220 | Used for RNase treatment of solutions |
| Razor blades | Electron Microscopy Sciences | 72000 | |
| RNase Zap | Sigma-Aldrich | R2020-250ML | RNase decontamination solution |
| Ethanol absolute 200 proof | Fisher Scientific | BP28184 | |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | |
| Glass vials - 22 ml | VWR | 470206-384 | |
| Xylenes, histological grade | Sigma-Aldrich | 534056-4L | |
| Paraplast plus | Sigma-Aldrich | P3683-1KG | |
| Disposable base molds, 15 mm x 15 mm x 5 mm | VWR | 15154-072 | |
| Embedding rings | VWR | 15154-303 | |
| Silica gel packets | Electron Microscopy Sciences | 71206-01 | Desiccant for storage of paraffin blocks |
| Oven | Fisher Scientific | 15-103-0503 | Oven must maintain temperature of 60 °C |
| Paraffin embedding station | Leica | EG1160 | |
| Microtome | Leica | RM2235 | |
| Slide warmer | Electron Microscopy Sciences | 71317-10 | |
| Coplin jars | Electron Microscopy Sciences | 70316-02 | |
| Laser microdissector | Zeiss | ||
| KIMWIPES™ Delicate Task Wipers | Kimberly-Clark Professional | 34120 | Lint-free wipes for wicking excess solutions from microscope slides |
| Membrane Slide 1.0 PEN | Zeiss | 415190-9041-000 | Slides for laser microdissection |
| Adhesive Cap 200 opaque | Zeiss | 415190-9181-000 | Tubes for laser microdissection |
| PicoPure RNA Isolation Kit | ThermoFisher Scientific | KIT0204 |
参考文献
- Becraft, P. W., Bongard-Pierce, D. K., Sylvester, A. W., Poethig, R. S., Freeling, M. The liguleless-1 gene acts tissue specifically in maize leaf development. Dev Biol. 141 (1), 220-232 (1990).
- Sylvester, A. W., Cande, W. Z., Freeling, M. Division and differentiation during normal and liguleless-1 maize leaf development. Development. 110 (3), 985-1000 (1990).
- Moreno, M. A., Harper, L. C., Krueger, R. W., Dellaporta, S. L., Freeling, M. liguleless1 encodes a nuclear-localized protein required for induction of ligules and auricles during maize leaf organogenesis. Genes Dev. 11 (5), 616-628 (1997).
- Emerson, R. A. The inheritance of the ligule and auricle of corn leaves. Neb. Agr. Exp. Sta. An. Rep. 25, 81-85 (1912).
- Moon, J., Candela, H., Hake, S. The Liguleless narrow mutation affects proximal-distal signaling and leaf growth. Development. 140 (2), 405-412 (2013).
- Johnston, R., et al. Transcriptomic Analyses Indicate That Maize Ligule Development Recapitulates Gene Expression Patterns That Occur during Lateral Organ Initiation. Plant Cell. 26 (12), 4718-4732 (2014).
- Schmid, M. W., et al. A powerful method for transcriptional profiling of specific cell types in eukaryotes: laser-assisted microdissection and RNA sequencing. PLoS One. 7 (1), e29685 (2012).
- Kerk, N. M., Ceserani, T., Tausta, S. L., Sussex, I. M., Nelson, T. M. Laser capture microdissection of cells from plant tissues. Plant Physiol. 132 (1), 27-35 (2003).
- Nakazono, M., Qiu, F., Borsuk, L. A., Schnable, P. S. Laser-capture microdissection, a tool for the global analysis of gene expression in specific plant cell types: identification of genes expressed differentially in epidermal cells or vascular tissues of maize. Plant Cell. 15 (3), 583-596 (2003).
- Marioni, J. C., Mason, C. E., Mane, S. M., Stephens, M., Gilad, Y. RNA-seq: an assessment of technical reproducibility and comparison with gene expression arrays. Genome Res. 18 (9), 1509-1517 (2008).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: a revolutionary tool for transcriptomics. Nat Rev Genet. 10 (1), 57-63 (2009).
- Brooks, L., et al. Microdissection of shoot meristem functional domains. PLoS Genet. 5 (5), e1000476 (2009).
- Cai, S., Lashbrook, C. C. Stamen abscission zone transcriptome profiling reveals new candidates for abscission control: enhanced retention of floral organs in transgenic plants overexpressing Arabidopsis ZINC FINGER PROTEIN2. Plant Physiol. 146 (3), 1305-1321 (2008).
- Li, P., et al. The developmental dynamics of the maize leaf transcriptome. Nat Genet. 42 (12), 1060-1067 (2010).
- Eveland, A. L., et al. Regulatory modules controlling maize inflorescence architecture. Genome Res. 24 (3), 431-443 (2014).
- Takacs, E. M., et al. Ontogeny of the maize shoot apical meristem. Plant Cell. 24 (8), 3219-3234 (2012).
- Aida, M., Ishida, T., Tasaka, M. Shoot apical meristem and cotyledon formation during Arabidopsis embryogenesis: interaction among the CUP-SHAPED COTYLEDON and SHOOT MERISTEMLESS genes. Development. 126 (8), 1563-1570 (1999).
- Ishida, T., Aida, M., Takada, S., Tasaka, M. Involvement of CUP-SHAPED COTYLEDON genes in gynoecium and ovule development in Arabidopsis thaliana. Plant Cell Physiol. 41 (1), 60-67 (2000).
- Takada, S., Hibara, K., Ishida, T., Tasaka, M. The CUP-SHAPED COTYLEDON1 gene of Arabidopsis regulates shoot apical meristem formation. Development. 128 (7), 1127-1135 (2001).
- Nardmann, J., Ji, J., Werr, W., Scanlon, M. J. The maize duplicate genes narrow sheath1 and narrow sheath2 encode a conserved homeobox gene function in a lateral domain of shoot apical meristems. Development. 131 (12), 2827-2839 (2004).
- Bonner, W. A., Hulett, H. R., Sweet, R. G., Herzenberg, L. A. Fluorescence activated cell sorting. Rev Sci Instrum. 43 (3), 404-409 (1972).
- Birnbaum, K., et al. A gene expression map of the Arabidopsis root. Science. 302 (5652), 1956-1960 (2003).
- Brady, S. M., et al. A high-resolution root spatiotemporal map reveals dominant expression patterns. Science. 318 (5851), 801-806 (2007).
- Carter, A. D., Bonyadi, R., Gifford, M. L. The use of fluorescence-activated cell sorting in studying plant development and environmental responses. Int J Dev Biol. 57 (6-8), 545-552 (2013).
- Ruzin, S. E. . Plant microtechnique and microscopy. , (1999).
- Jackson, D., Veit, B., Hake, S. Expression of maize KNOTTED1 related homeobox genes in the shoot apical meristem predicts patterns of morphogenesis in the vegetative shoot. Development. 120, 405-413 (1994).
- Javelle, M., Marco, C. F., Timmermans, M. In situ hybridization for the precise localization of transcripts in plants. J Vis Exp. (57), e3328 (2011).
- Day, R. C., McNoe, L., Macknight, R. C. Evaluation of global RNA amplification and its use for high-throughput transcript analysis of laser-microdissected endosperm. Int J Plant Genomics. , 61028 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved