このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
薬物治療と
要約
Small laboratory fish have become popular models for bone research on the mechanisms underlying human bone disorders and for the screening of bone-modulating drugs. In this report, we describe a protocol to assess the effect of alendronate on bone cells in medaka larvae with osteoporotic lesions.
要約
骨形成する骨芽細胞は骨基質の代謝回転を調整するために、骨格の恒常性を制御するために、骨吸収破骨細胞と対話します。メダカとゼブラフィッシュの幼生が広く、骨形成、変性、及び修理中に骨細胞の挙動を分析するために使用されます。それらの光学的透明度は、蛍光標識された骨細胞と鉱化骨格のマトリックスに結合した蛍光色素の可視化を可能にします。私たちの研究室では、熱ショック誘導性プロモーターの制御下で破骨細胞誘導因子核因子κBリガンド(RANKL)の受容体活性化剤を発現するトランスジェニックメダカを生成しました。 カテプシンK(CTSK)プロモーターの制御下にnlGFP発現とレポーターラインで可視化することができる活性化された破骨細胞の過剰形成におけるRANKL結果の異所性発現。 RANKL誘導および異所性破骨細胞形成は、重度の骨粗しょう症のような表現型につながります。化合物のトランスジェニックメダカの李CTSK表現NEは:nlGFPは時期尚早骨芽細胞におけるオステリックス (OSX)プロモーターの制御下に破骨細胞、ならびにmCherryをで、両方の細胞型の相互作用を研究するために使用することができます。これは、骨変性及び修理の条件の下で細胞の挙動のin vivoでの観察を容易にします。ここでは、一般にヒトの骨粗鬆症の治療に用いられる薬剤をテストし、ライブイメージングのためのプロトコルを記述するために、このシステムの使用を記載しています。メダカのモデルは、細胞培養やマウスでの研究を補完するものであり、骨格系における薬物作用のin vivo分析のための新規なシステムを提供しています。
概要
脊椎動物の骨格は、臓器のための構造的支持および保護を提供する移動性を可能にし、カルシウムの供給源として役立ちます。人生を通して、細胞外骨基質を連続的に骨の安定性と剛性を維持するために引き渡されます。このプロセスは、緊密に協調活動と骨形成骨芽細胞と骨吸収破骨細胞の相互作用を必要とします。骨芽細胞は、多能間葉系前駆細胞に由来し、類骨、骨マトリクス10のタンパク質性部分を形成するためにコラーゲンを生成しています。骨芽細胞は、骨ホメオスタシス7を制御するために必要とされる細胞型、両方のバランスのとれた活性を達成するために、破骨細胞と相互作用します。そのため、これらの複雑な規制の相互作用のため、薬物治療と骨の恒常性への応答は、完全にin vitro試験で使用して検査することはできません。したがって、動物モデルが強く求められています。細胞培養の設定と比較して、in vivoモデルで提供することができます骨環境内の多細胞ネットワークに貴重な洞察力。
多数のマウスモデルは、骨粗しょう症16を含むヒト骨障害の様々なために存在します。しかし、マウス胚の大きさとアクセシビリティは、骨格のプロセスのライブイメージングのための重大な制限を表します。小型硬骨魚、一方、in vivoイメージングのための魅力的な代替手段としての役割を果たす。ゼブラフィッシュ( ゼブラフィッシュ )とメダカ( メダカ )は、過去20年間17、19、22、24を介して骨格研究のための人気の動物モデルとなっています。硬骨魚および哺乳動物における骨は、構造上および生理学的レベルの両方で、非常に類似しており、重要な調節遺伝子およびシグナル伝達経路の多くは3保存されています。哺乳動物のように、硬骨魚を注意深く骨芽細胞および骨形成および吸収26のバランスをとるために、破骨細胞の活性を調節します。 Fi接続の最も重要なのは、光学的透明性shの幼虫は、骨細胞と生きている動物における細胞プロセスの観察を容易に石灰化骨格マトリックス8、9、12、21、23、標識する蛍光レポーターの使用を可能にします。また、遺伝的ツールの一連の魚類における生物医学的に関連した研究を容易にするために生成されています。特にメダカ、CRISPR / Cas9 2、6をトレースする細胞系統、および部位特異的な遺伝子導入14が最近確立され、広く使用15に今あるされていることにより、標的遺伝子の突然変異のための方法のために。
小型硬骨魚類の幼虫が正常にいくつかの薬理学的に関連する薬1、18の発見につながった化学スクリーンのために使用されてきました。
稚魚DMSOの低濃度に耐性であり、皮膚を介して、または消化管1,5のいずれかを介して、彼らの水生環境から化合物を吸収することができます。私たちの研究室以前の担当者様々な骨芽細胞と破骨細胞特異的プロモーターの制御下で、骨細胞に蛍光レポーターを発現するトランスジェニックメダカ系統をorted。 20、21、成熟骨芽細胞( オステオカルシン 、OSC)27、および破骨細胞( カテプシンK、CTSK)24;これらは、早期骨芽細胞( オステリックス 、OSX コラーゲン10A1、col10a1) が挙げられます。我々はまた、熱ショック誘導性プロモーター24の制御下で破骨細胞誘導因子核因子κBリガンドの受容体アクチベーター(RANKL)を発現するトランスジェニック系統を生成しました。
このシステムにおけるRANKLの誘導は、活性破骨細胞の異所性の形成をもたらします。これは、椎体で大幅に削減鉱化と、骨吸収の増加と重度の骨粗しょう症様表現型につながります。我々は最近、TW、このモデルにおける破骨細胞活性は、ビスフォスフォネートのエチドロン酸とアレンドロネートによって遮断することができることを示しました一般に、ヒト骨粗鬆症の治療に使用されるO薬は、このように骨粗鬆症27に適したモデル系としてメダカを検証します。
それらの大ひなサイズ、急速な発展、及び胚の小さなサイズのために、トランスジェニックメダカの幼虫は、骨粗しょう症薬の大規模スクリーニングのため、および骨細胞の挙動のin vivo分析のために独自に適しています。メダカにおける研究は、このように効率的に細胞培養およびヒトの骨疾患のための新たな治療標的と新しい治療法を発見することを目的としているマウスでの実験を補完することができます。
本研究では、我々は共通の骨粗しょう症薬、アレンドロネートでメダカ骨レポーター幼虫を治療するためのプロトコルについて説明します。また、搭載され、骨基質と骨細胞のライブイメージングのために用意されている方法の処理された幼虫を詳細に説明します。これらのプロトコルは、簡単にその骨同化または再吸収抑制薬などの作業のいずれかの他の小さな化学化合物に適合させることができます。
プロトコル
全ての実験は、シンガポール国立大学(R14-293)の承認制度動物実験委員会(IACUC)プロトコルに従って行いました。
1.魚の飼育や胚のコレクション
- nlGFP 24、RANKL:HSE:CFP 24、およびOSX:26℃でmCherryを21シングルまたは化合物、遺伝子組み換えメダカ制御光周期(14時間の明、暗10時間)の下で産卵を誘発するWT、CTSKを上げます。
- 光がオンにされた後、毎日の産卵は、最初の30分の間に行われます。卵は、フィラメントを介して一緒に固執し、数時間のために女性の腹部に付着します。卵のクラスタを運ぶ成人女性をキャッチするために細かいメッシュのネットを使用してください。魚は簡単にネットで休むし、その後静かに慎重に女性の腹部から受精卵のクラスタを削除するには、魚の腹部をマッサージしてみましょう。
注:健康メダカ女性約5ヶ月間20卵を毎日 - 10を生成することができます。 - 60ミリメートルのプラスチックペトリ皿に卵を置きます。 19.3のNaCl、0.23のKCl、0.13mMの硫酸マグネシウム、0.2 mMののCa(NO 3)2、および1.7 mMのHEPES、pHは、0.3X Danieauのソリューション(魚培地10mL - 5で胚を洗浄するためにプラスチックピペットを使用してください7.0)。真菌増殖を防ぐために、0.25%の1 mLの魚培地2.5 Lに(w / v)のメチレンブルーのストック溶液を加えます。
- ゆっくりアタッチメントフィラメントの結び目を形成するために、卵のクラスタをロールバックします。個々の胚( 図1A)を得るために慎重に受精卵クラスタから添付ファイルのフィラメントを除去するために鉗子を使用してください。
- 岩松2004年13に従って胚を上演。
- 文化20から28℃のインキュベーターで60ミリメートルのプラスチックペトリ皿当たり30の胚。胚の正常な発展を確保するために、毎日培地を変更します。
注:孵化ステージの周りの時間(8から9のD postfertilization、DPF)生存のために特に重要です。きれいなメディアを保つために、良好な幼虫の生存率を確保するために自由に浮遊絨毛膜を取り外します。
2.トランスジェニック胚のスクリーニング
- 40X倍率を用いた蛍光レポーター発現のためのトランスジェニック胚をスクリーニングするための蛍光イメージングおよびGFP、RFP、およびCFPフィルター用の水銀ランプを備えた実体顕微鏡を使用してください。
- 視覚的にOSXを識別:mCherryをレポーター発現によるmCherryを胚の初期段階で形成後部ヘッド( 図1B、矢印)、および副蝶形骨の両側に、このような擬鎖骨などの頭骨を、腹側頭蓋内の中央の位置で( 図1B、矢印)。
注:レポーターの発現は5 DPF以降21から始まります。 - CTSKを特定します。nlGFPヘッドに強いnlGFPの発現による胚( 図1C、矢印)とテール( 図1C、矢印)から出発6 DPF。
注:内因性破骨細胞はわずか21 DPF後に形成します。この初期の段階(6 DPF)でnlGFP発現細胞は破骨細胞ではなく、他の、これまでに特徴付けられていない、陽性細胞24を CTSK。 - RANKLを特定します。HSE:ユビキタスCFPの発現によるCFPトランスジェニック胚を2 DPFで以降のスクリーニング目的のために実施し、39℃で20分間の短い熱ショック処理、後。
注:RANKLとCFP導入遺伝子は同じ双方向の熱ショックエレメント(HSE)の制御下にあります。 CFPの発現が成功したRANKL誘導24を示しています。 - その結果、骨粗しょう症様の表現型24につながる幹線領域で異所性破骨細胞の多数を誘導するために、後9 DPFで2時間熱ショック処理または- 1.5を実行します。
注:休止状態の破骨細胞前駆細胞の異所性活性化に9 DPF結果に誘起されるトランスジェニックRANKL発現を、内因的にトリガされません21 DPFの前に。安定した39℃の条件を得るために水浴を使用してください。胚が水面に浮くメダカを含むペトリ皿をしてみましょう。ペトリ皿の蓋が皿の沈没を防ぐために乾燥していることを確認してください。 - このようなRANKLなどの化合物ラインから画面胚:HSE:CFP / CTSK:nlGFPダブルトランスジェニックとOSX:mCherryを/ RANKL:HSE:CFP / CTSK:nlGFPトリプルトランスジェニック、各個々の導入遺伝子の発現パターンに応じました。
注:ヘミ接合およびホモ接合トランスジェニック胚は、レポーター導入遺伝子の異なる蛍光レベルによって区別されました。ホモ接合体の胚は、約ヘミ接合性トランスジェニックのものに比べて倍増した蛍光強度を有していました。 HSE:CFPとCTSK:RANKLの両方に対してホモ接合した複合線nlGFPは数世代にわたって繰り返さincrossingによって得ました。 mCherryを/ RANKL:HSE:CFP / CTSK:トリプルトランスジェニックOSX用のnlGFP魚、ホモ接合RANKL:HSE:CFP / CTSK:mCherryをキャリア:nlGFP魚がホモ接合OSXと交配しました。得られたヘテロ接合トリプルトランスジェニック子孫は上昇し、RANKLについてホモ接合胚を得るためにincrossedた:HSE:CFPを。 RANKL:HSE:CFPの導入遺伝子は、異所性破骨細胞の効率的な誘導を得るために、ホモ接合でなければなりません。
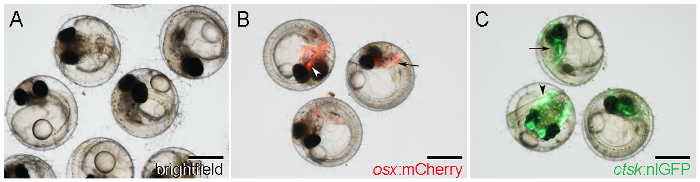
図1:WT及び7 D Postfertilizationでのトランスジェニックメダカ胚(DPF)。 。 WT胚は、明視野照明で観察されました。 B。 OSX示すトランスジェニック胚:擬鎖骨(矢印)と副蝶形骨(矢印)の周りにmCherryを発現します。 C。 CTSKを示すトランスジェニック胚:nlGFP頭の中での式(矢印)とテール(矢印)。スケールバー:500μmで。025 / 55025fig1large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
メダカ幼虫の3ビスホスホネート治療
- 用量反応試験のためのビスフォスフォネート(BPの)の異なる濃度を含む溶液を準備します。
注:このプロトコルで使用される例示的なBPは、アレンドロネートです。- ストック溶液を調製するためには100μg/ mLの濃度で魚培地中のアレンドロネートを溶解します。
- 完全な溶解を確実にするために、ボルテックスミキサーを使用してください。 4℃の原液を保管してください。
- 一連の濃度に魚媒体と原液を希釈することによって、異なる作業溶液を調製する( すなわち 、25、37.5、50、62.5、及び75 / mlの)。
注:異なる薬物このメダカ幼虫システムを使用して試験する時に考慮されなければならない別の吸収、分布、代謝、および排泄(ADME)のパラメータを有してもよいです。また、薬物の溶解性および安定性が変化し得る場合水溶液として適用されます。あまり水溶性化合物は、最初にDMSOなどの有機溶媒に溶解する必要がある場合があります。この場合には、ストック溶液を、さらに魚の培地で希釈してDMSOで調製されます。水(魚培地)中で作業ソリューションは、いくつかの週のために冷蔵庫に保存することができることに注意してください。しかし、DMSOを含む溶液は、結晶化を防止するために、室温で保存する必要があります。
- その後のBP(アレンドロネート)治療のために(6幼虫/ウェル)を6ウェルプレートにメダカの幼虫を転送します。
- 慎重にきれいなプラスチックピペットを用いて、魚の培地を除去し、各ウェルにアレンドロネート少量の溶液(約0.5 ml)を追加します。
- あまり集中アレンドロネートソリューションのために特に重要である追加されたBP溶液が希釈されるかもしれないとして残った魚媒体を、避けてください。
- きれいなプラスチックピペットを用いて各ウェルから(0.5 mlまで)アレンドロネートの少量の溶液を取り出して、より大きなvoluに置き換えますアレンドロネートソリューションの私(4 mL)で。
- 正常な胚の発達を確保するために、培地を毎日変更します。
石灰化骨マトリックスの4ライブ染色
- それぞれ、1%および0.1%ストック溶液を調製するために魚の培地50mlにまたはカルセイン0.05gを、アリザリンコンプレクソン0.5gの(アリザリン-3-メチルイミノ二酢酸ALC)を溶解します。完全な溶解を確実にするために、ボルテックスミキサーを使用してください。
注:メチレンブルーを添加することなく魚媒体がこの中で使用されて以降は、幼虫で自己蛍光を低減します。 - 染色液をフィルタするために注射器と単回使用フィルタ(0.2μm)を使用してください。室温で暗所で濾過した溶液を保管してください。
注:濾過し、明確なALC染色溶液の色がオレンジ色に黄色の暗いです。濾過し、澄んだカルセイン溶液の色は明るい黄色です。溶液は、数ヶ月のために使用することができます。 - 魚媒体でフィルタリングALCまたはカルセインストックソリューション1:10に希釈9と17 DPFの間に幼虫が使用されている場合、28℃のインキュベーターに2.5時間(0.01%カルセイン溶液) - 2時間(0.1%ALC溶液)または2 - および1.5のためのメダカの幼虫をインキュベートします。暗闇の中でサンプルを保管してください。
- きれいなプラスチックピペットを用いて、新鮮な魚媒体に幼虫を転送します。
- きれいなプラスチックピペットで魚の培地を除去し、新鮮な魚媒体を追加します。 3に対して、この手順を繰り返し - (それぞれ、ALCまたはカルセイン)なし赤や黄色に染色されたソリューションまで、4回には残されています。媒体からの落射蛍光を回避するために、イメージングのためにそれらをマウントする前に60分 - 30のための魚の培地中の幼虫のままにしておきます。
注:0.1%ALC染色溶液は、拡張露光時間のためのメダカの幼虫に有害です。より長い2時間のインキュベーション時間が幼虫の生存に影響を与えます。濃度及び染色時間は、したがって、最適な胚の生存および染色の結果を達成するためには種々の段階のために最適化される必要があります。
5.ライブ蛍光イメージング P>
- 魚の培地中で0.01%トリカイン(3-アミノ安息香酸エチルメタンスルホン酸)とメダカの幼虫を麻酔。
注:麻酔幼虫は5の後に固定化さ - トリカイン溶液中で10分、通常はその側面や背中のいずれかを横たわっています。 - 関心領域に応じて幼虫を向けるためにプラスチックmicroloaderを使用してください。このプロトコルで使用される幼虫の向きが横方向です。
- イメージングのための蛍光照明で実体顕微鏡を使用してください。画像を撮影するときに幼虫(頭、前部胴体、後部トランク、および尾)の異なる部分を中心に、高倍率を使用してください。適切な画像処理ソフト( 図3Gでのインセット)を使用して、重複領域で個々の画像を一緒にステッチ。
注:これは、正しい焦点面内のすべての関連する身体部分の画像品質を改善するのに役立ちます。 - 撮影後の回復のために魚媒体に幼虫を返します。
- 彼らは、固定化になるまで10分 - 5のための魚の培地中の0.01%トリカインで幼虫を麻酔。
- 電子レンジで加熱することにより、魚の培地中1.5%アガロースに低融点溶解します。約30°Cにこのソリューションを冷却します。
- 液体1.5%低融点ガラス底ペトリ皿に魚媒体にアガロースの1ミリリットル - 0.5を追加します。きれいなプラスチックピペットを用いて、溶液中に麻酔幼虫を転送します。
注:液体の低融点アガロースの温度が幼虫に害を与えないために十分に低いことを特別な予防策を取ります。 - アガロースが固化する前に、ペトリ皿の底に幼虫をプッシュするプラスチックmicroloaderを使用して、関心領域に応じて幼虫を向けます。このプロトコルで使用される幼虫の向きが横方向です。
注:アガロースが完全に固化した後、サンプルは、共焦点ライブイメージングのための準備が整いました。 - ACQする共焦点顕微鏡を使用して、uire画像。
- mCherryをとALC染色分析のため543 nmのレーザーラインを使用してください。 nlGFPのための488 nmのレーザーラインを使用し、カルセイン染色を分析します。
- 撮影後、ペトリ皿に魚媒体を追加し、慎重にアガロースから幼虫を除去するために、微細な注射針(27 Gのx 1.5 ")のペアを使用する。残留的に回復するために魚の媒体とのシャーレにアガロース添付して幼虫を転送。
- 画像解析ソフトウェア27を用いて画像を処理します。
結果
豊富な卵の数だけでなく、幼虫の小さいサイズは、メダカ薬物スクリーニングのための優れたモデルを作ります。単一の6ウェルプレートは、統計的に有意なデータを提供するのに十分であった36幼虫までの培養に使用しました。骨格の分析のために魚を使用してのもう一つの大きな利点は、ライブイメージングを行うことの可能性です。稚魚の透明度は、骨細胞、ならびに石灰化を可視化す?...
ディスカッション
プロトコル内の重要なステップ
異なるサンプルを比較した場合、熱ショック処理の条件は、一貫して安定していることが必須です。安定した温度条件は、CTSKについてスクリーニングすることにより確認することができ、その結果、同程度の破骨細胞形成を、トランスジェニック幼虫にRANKL誘導の同様のレベルを保証すると:nlGFP発現。最終的に、これは、ALC染色によ?...
開示事項
著者は、彼らが何の競合や金融利害関係を持たないことを宣言します。
謝辞
このプロジェクトは、教育のシンガポール省(MOE、認可番号2013-T2-2-126)と国立衛生研究所からの助成金、アメリカ(NIH、助成金番号1R21AT008452-01A1)によって賄われていました。 TYは、生物科学のNUS学科から大学院の奨学金を受けました。私たちは一定のサポートのためにバイオイメージング科学NUSセンター(CBIS)の共焦点ユニットに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Alendronate | Sigma | A4978 | |
| alizarin-3-methyliminodiacetic acid, Alizarin Complexone | Sigma | A3882 | |
| Calcein | Sigma | C0875 | |
| ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma | A5040 | |
| ImageJ (1.4.3.67) | National Institute of Health (NIH) | https://imagej.nih.gov/ij/ | |
| LSM 510 Meta confocal | Zeiss | ||
| LSM Image Browser (4.2.0.121) | Zeiss | http://www.zeiss.com/microscopy/en_de/downloads/lsm-5-series.html | |
| Micro-loader | Eppendorf | 5242956003 | Eppendorf ep T.I.P.S 20 μL |
| NIS-Elements BR 3.0 software | Nikon | ||
| Photoshop CS6 (13.0.0.0) | Adobe | ||
| SMZ1000 stereomicroscope | Nikon |
参考文献
- Ablain, J., Zon, L. I. Of fish and men: using zebrafish to fight human diseases. Trends Cell Biol. 23 (12), 584-586 (2013).
- Ansai, S., Kinoshita, M. Targeted mutagenesis using CRISPR/Cas system in medaka. Biol Open. 3 (5), 362-371 (2014).
- Apschner, A., Schulte-Merker, S., Witten, P. E. Not all bones are created equal-using zebrafish and other teleost species in osteogenesis research. Methods Cell Biol. 105, 239-255 (2011).
- Bajoghli, B., Aghaallaei, N., Heimbucher, T., Czerny, T. An artificial promoter construct for heat-inducible misexpression during fish embryogenesis. Dev Biol. 271 (2), 416-430 (2004).
- Barrett, R., Chappell, C., Quick, M., Fleming, A. A rapid, high content, in vivo model of glucocorticoid-induced osteoporosis. Biotechnol J. 1 (6), 651-655 (2006).
- Centanin, L., Ander, J. J., Hoeckendorf, B., Lust, K., Kellner, T., Kraemer, I., Urbany, C., Hasel, E., Harris, W. A., Simons, B. D., et al. Exclusive multipotency and preferential asymmetric divisions in post-embryonic neural stem cells of the fish retina. Development. 141 (18), 3472-3482 (2014).
- Charles, J. F., Aliprantis, A. O. Osteoclasts: more than 'bone eaters. Trends Mol Med. 20 (8), 449-459 (2014).
- DeLaurier, A., Eames, B. F., Blanco-Sanchez, B., Peng, G., He, X., Swartz, M. E., Ullmann, B., Westerfield, M., Kimmel, C. B. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505-511 (2010).
- Du, S. J., Frenkel, V., Kindschi, G., Zohar, Y. Visualizing normal and defective bone development in zebrafish embryos using the fluorescent chromophore calcein. Dev Biol. 238 (2), 239-246 (2001).
- Eriksen, E. F. Cellular mechanisms of bone remodeling. Rev Endocr Metab Disord. 11 (4), 219-227 (2010).
- Hockendorf, B., Thumberger, T., Wittbrodt, J. Quantitative analysis of embryogenesis: a perspective for light sheet microscopy. Dev Cell. 23 (6), 1111-1120 (2012).
- Inohaya, K., Takano, Y., Kudo, A. The teleost intervertebral region acts as a growth center of the centrum: in vivo visualization of osteoblasts and their progenitors in transgenic fish. Dev Dyn. 236 (11), 3031-3046 (2007).
- Iwamatsu, T. Stages of normal development in the medaka Oryzias latipes. Mech Dev. 121 (7), 605-618 (2004).
- Kirchmaier, S., Hockendorf, B., Moller, E. K., Bornhorst, D., Spitz, F., Wittbrodt, J. Efficient site-specific transgenesis and enhancer activity tests in medaka using PhiC31 integrase. Development. 140 (20), 4287-4295 (2013).
- Kirchmaier, S., Naruse, K., Wittbrodt, J., Loosli, F. The genomic and genetic toolbox of the teleost medaka (Oryzias latipes). Genetics. 199 (4), 905-918 (2015).
- Komori, T. Animal models for osteoporosis. Eur J Pharmacol. 759, 287-294 (2015).
- Mackay, E. W., Apschner, A., Schulte-Merker, S. A bone to pick with zebrafish. Bonekey Rep. 2, 445 (2013).
- MacRae, C. A., Peterson, R. T. Zebrafish as tools for drug discovery. Nat Rev Drug Discov. 14 (10), 721-731 (2015).
- Mitchell, R. E., Huitema, L. F., Skinner, R. E., Brunt, L. H., Severn, C., Schulte-Merker, S., Hammond, C. L. New tools for studying osteoarthritis genetics in zebrafish. Osteoarthritis Cartilage. 21 (2), 269-278 (2013).
- Renn, J., Buttner, A., To, T. T., Chan, S. J., Winkler, C. A col10a1:nlGFP transgenic line displays putative osteoblast precursors at the medaka notochordal sheath prior to mineralization. Dev Biol. 381 (1), 134-143 (2013).
- Renn, J., Winkler, C. Osterix-mCherry transgenic medaka for in vivo imaging of bone formation. Dev Dyn. 238 (1), 241-248 (2009).
- Schilling, T. F., Kimmel, C. B. Segment and cell type lineage restrictions during pharyngeal arch development in the zebrafish embryo. Development. 120 (3), 483-494 (1994).
- Spoorendonk, K. M., Peterson-Maduro, J., Renn, J., Trowe, T., Kranenbarg, S., Winkler, C., Schulte-Merker, S. Retinoic acid and Cyp26b1 are critical regulators of osteogenesis in the axial skeleton. Development. 135 (22), 3765-3774 (2008).
- To, T. T., Witten, P. E., Renn, J., Bhattacharya, D., Huysseune, A., Winkler, C. Rankl-induced osteoclastogenesis leads to loss of mineralization in a medaka osteoporosis model. Development. 139 (1), 141-150 (2012).
- Wakamatsu, Y., Pristyazhnyuk, S., Kinoshita, M., Tanaka, M., Ozato, K. The see-through medaka: a fish model that is transparent throughout life. Proc Natl Acad Sci USA. 98 (18), 10046-10050 (2001).
- Witten, P. E., Huysseune, A. A comparative view on mechanisms and functions of skeletal remodelling in teleost fish, with special emphasis on osteoclasts and their function. Biol Rev Camb Philos Soc. 84 (2), 315-346 (2009).
- Yu, T., Witten, P. E., Huysseune, A., Buettner, A., To, T. T., Winkler, C. Live imaging of osteoclast inhibition by bisphosphonates in a medaka osteoporosis model. Dis Model Mech. 9 (2), 155-163 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved