このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
流れ誘導性の肺動脈性肺高血圧症のためのラットモデルにおけるシャント手術、右心カテーテル、および血管形態計測
要約
This protocol describes a surgical procedure to create a model for flow-induced pulmonary arterial hypertension (PAH) in rats and the procedures to analyze the principle hemodynamic and histological end-points in this model.
要約
In this protocol, PAH is induced by combining a 60 mg/kg monocrotalin (MCT) injection with increased pulmonary blood flow through an aorto-caval shunt (MCT+Flow). The shunt is created by inserting an 18-G needle from the abdominal aorta into the adjacent caval vein. Increased pulmonary flow has been demonstrated as an essential trigger for a severe form of PAH with distinct phases of disease progression, characterized by early medial hypertrophy followed by neointimal lesions and the progressive occlusion of the small pulmonary vessels. To measure the right heart and pulmonary hemodynamics in this model, right heart catheterization is performed by inserting a rigid cannula containing a flexible ball-tip catheter via the right jugular vein into the right ventricle. The catheter is then advanced into the main and the more distal pulmonary arteries. The histopathology of the pulmonary vasculature is assessed qualitatively, by scoring the pre- and intra-acinar vessels on the degree of muscularization and the presence of a neointima, and quantitatively, by measuring the wall thickness, the wall-lumen ratios, and the occlusion score.
概要
この方法の目的は、ラットにおける重度、流れによって誘発される肺動脈高血圧症の再現可能なモデルを作成するために、その原理血行動態及び組織病理学的エンドポイントを測定することです。
肺動脈性肺高血圧症(PAH)、右心室不全や死に至る肺血管抵抗の漸進的増加を含む臨床症候群です。肺高血圧疾患(PH)の上位疾患スペクトラムの中で、PAHは治癒1せずに残っている最も深刻なフォームと1です。 PAHにおける基礎となる動脈症は、血管内腔を閉塞血管リモデリングの典型的な形が特徴です。通常の非muscularized血管のMuscularizationと内側容器層の肥大はPAHの初期疾患現象とみなされ、また、PH 2の他の形態で見られる、と3可逆的であると考えられています。 PAH Aとしてdvances、内膜層は、最終的に特徴的な新生内膜病変2を形成し 、改造を開始します。新生内膜型肺血管リモデリングは、PAHに排他的であり、現在4不可逆的であるとみなされています。
PAHは稀な疾患であるため、その病理生物学的理解の進歩と新しい治療法の開発は、動物モデルに大きく依存してきました。ラットにおけるmonocrotalin(MCT)モデルがされている単純な単一のヒットモデルであり、まだ、頻繁に使用されます。 MCTは、肺動脈と地域炎症5への損傷を引き起こす毒素です。 4週6から60ミリグラム/キロのMCTは、3後の平均肺動脈圧(MPAP)の増加、肺血管抵抗(PVR)、および右心室肥大(RVH)につながります。組織形態は、新生内膜病変5せずに孤立した内側の肥大によって特徴付けられます。 MCTそれは一般的に、後者のように示されるが、ラットモデルは、このように、適度なPHの形ではなく、PAHを表します。
先天性左から右へのシャント(PAH-CHD)に関連付けられているPAHの小児では、肺の血流が新生内膜病変7、8、9の開発に不可欠なトリガとしてみなされている増加しました。ラットでは、腹部大動脈及び大静脈、第1990 10に記載された技術との間のシャントを作成することによって誘導することができ、肺の血流を増加させました。増加した肺の流れを作成するための選択肢が一方的摘術により、または肺動脈吻合部11に鎖骨によるものです。これらのモデルの概念の欠点は、または起因する肺血管系の医原性損傷の肺切除によって誘発され、残りの肺および適応経路活性化の潜在的な代償成長から成り肺動脈吻合に、両方の増加した肺の血流の影響を混乱させる。
大動脈大静脈シャントが作成され、MCT投与ラットにおける第二のヒットとして誘発される肺の血流を増加させると、特徴的な新生内膜病変が発生し、増加した後にPAHの重症型と関連した右心室不全(RVF)は、3週間の開発します12を流れます。このモデルにおけるPAHの血行力学的進行は心エコー検査および右心カテーテル法によってインビボで評価することができます。血管の組織形態学、血管壁の厚さ、動脈閉塞の程度、および右心室不全のためのパラメータは、PAHのex vivo特徴付けの柱を形成します。
この方法は、大動脈大静脈シャント(AC-シャント)手術、右心カテーテル法、および血管組織形態の定性的および定量的評価のための詳細なプロトコルを記述しています。
プロトコル
動物を対象とする手順は、動物実験のためにオランダ中央委員会と大学医療センターフローニンゲンでの動物保護委員会(NL)によって承認されています。 180〜300 gの量の両方のWistar及びルイスラットを使用しました。
1.住宅と順化
- ケージ当たり5のグループ内の中央動物施設、家のラットに到着した後。 7日間の順応期間中は、人間の取り扱いにラットを慣らすが、任意の実験手順を実行しないでください。
無菌Monocrotalinの調製および注射
- 60 mg / mlでmonocrotalin(MCT)溶液1mLに対して、2 mLのチューブにmonocrotalin 60mgの重量を量ります。 0.9%のNaCl 700μLを追加します。 1 M HClを200μLを追加します。ホットランニング水道水とボルテックスその下のチューブ内の溶液を温めます。 7.0に向けてpHを6 NのNaOHを使用してください。げっ歯類への注入のためのMCTの調製のための滅菌技術を使用してください。
- 首のキロ皮下あたり滅菌60ミリグラム/ mLのMCT溶液(300グラムのラットでは60 mg / mlでMCTの0.3 mL)を1mLのを注入します。注:私たちは、注入量が適切でないことを大きなチャンスによる小さいボリュームを使用しません。
3.大動脈 - 大静脈シャント手術
- 麻酔。
- 5%イソフルラン/ 100%O 2(流量:1リットル/分)での誘導チャンバーを記入し、チャンバー内にラットを置きます。後肢足指のピンチを実行することによって、麻酔の適切な深さを確認してください。ラットを計量。
- 約8センチ3センチ幅である領域の上腹部を剃るし、清掃してください。滅菌マットで覆われたヒートマット(37°C)にその背中にラットを置きます。
- 3%イソフルラン/ 100%O 2(:1 L /分の流れ) - 2で換気マスク/フードで鼻を置きます。後肢足指のピンチを実行することによって、麻酔の深さを確認してください。麻酔下ながら乾燥を防ぐために、眼軟膏を適用します。
- シャントスールGeryの。
- 消毒のための塩素-hexidineで皮膚をスクラブ。キロブプレノルフィン皮下術後鎮痛のための0.01 mgの/注入します。
- 手術のために滅菌器具を使用してください。ちょうど性器上記にまで延びているダイヤフラムの下に1cmで出発、正中線上腹部の#10手術用メスの刃で切開を行います。
- 滅菌、濡れたガーゼ(0.9%のNaCl)で腸をカバーし、綿棒で腸を持ち上げ、および動物の左側に配置します。
- 腹部大動脈と周囲の組織に下大静脈を取り付ける膜を分離するために綿棒を使用してください。
注:大動脈と大静脈の間の膜を分析しないでください。 - トゲ鉗子を使用して、唯一の大動脈の右側にだけ針が挿入されるサイト上で、ちょうど分岐の上に血管周囲の大動脈脂肪を取り除きます。
- 2ミリメートルのsupeから大動脈と大静脈を分離するために綿棒を使用してください針がBiemerクランプのためのスペースを作成するために挿入されるサイトにrior。
- このエリアでは、最初の大動脈の周りの緩い結紮糸(5-0縫合糸)を配置。切開( 図1A)にコッヘルが優れ置き、それにコッヘルクランプを配置することによって、合字の張力を作成し、。 Biemerは合字(Figur電子の1A)にだけ優れたクランプ置きます。
- 綿棒を使用して、フロー( 図1A)を妨害するよう遠位にできるだけ大静脈を圧縮します。外側( 図1A)の方を向いてオリフィスを有するベンド45度の角度に針(このプロトコルで18 G)、。
- 90度の角度で、左( 図1A)に針ポインティングのオリフィスと、ちょうど分岐の上、大動脈内に針を挿入します。左に針の先端を操作し、大静脈に挿入します。
注:針の先端は現在VISIでなければなりません大静脈( 図1B)にBLE。 - 血栓症を防ぐために、挿入部位のうち、大動脈内の残りの血液をプッシュするために第2綿棒を使用してください。接着剤が十分に固執するようにするために、滅菌ガーゼでシャントの周りの領域を乾燥させます。
- 大動脈のうち、全体の針を引き、直ちに大動脈における穿刺部位に組織接着剤のドロップを適用します。組織に綿棒を接着しないように注意してください。大動脈のクランプを解除。
- 上の引っ張り、シャントを大動脈近位に結紮糸を解放することによって、手動でシャントを確認します。ゆるみは明るい赤にシャントに大静脈遠位を着色し、シャントサイトで乱流を作成する必要があります。
注:締め付けが戻って暗赤色の大静脈に血液を向けるだろう。 - バック動物で腸を置きます。再吸収可能な4-0縫合糸で筋層と皮膚を閉じます。麻酔から回復するために、100%O 2で動物を換気します。
注:ANIのままにしないでくださいそれは胸骨横臥位を維持するのに十分な意識を取り戻したまで無人MAL。
- シャム手術。
- 大動脈への針の挿入を除いて、上記の手順のすべてを実行します。
- 手術後のケア。
- 単一のケージにし、翌朝まで37℃のインキュベーターにラットを置きます。
- 手術後6時間の周囲には、術後の鎮痛のためにブプレノルフィン皮下/キログラム0.01ミリグラムを注入。ラットが不快感の兆候を示している場合は、次の朝を繰り返します。
注:最初の3日間の手術後、ラットは、食べて、(固形飼料または飲料水を薬剤と混合した場合、これは特に重要です)あまり飲む傾向にあります。ほとんどのラットは3日、手術後に正常な挙動を示します。ない場合は、密接に監視します。 1週間で15%を超える体重減少が、異常とみなされ、かつ麻酔下にある間、そのようなラットは、循環血液量の抽出により安楽死されるべきです。
4。 PAHの開発
注:このプロトコルでは、動物は麻酔下ながら、循環血液量の抽出によって安楽死させます。
- 増加肺血流への早期の細胞および機能的応答( 例えば、遺伝子のアップレギュレーションまたは初期転写因子)のための手術(MF8)の後に1日を生け贄に捧げます。
- 早期のPAH血管表現型(新生内膜病変のない内側肥大)のための手術(MF14)後1週間を生け贄に捧げます。
- RVPとMPAPにおける軽度の標高と進行期PAH血管表現型(マークされた内側肥大および新生内膜形成)のための手術(MF21)後2週間生け贄に捧げます。
- 末期PAH血管表現型(マークされた新生内膜閉塞)とRVPとMPAPに強い標高のための手術(MF28)後3週間生け贄に捧げます。右心室不全の臨床徴候は、この段階では一般的です。
- 28日目の後にサクリファイス(MF-RVF)、臨床的呼吸困難、重度の無気力、および体重減少(<1週間で10%)として定義されるPAH関連右心室不全(RVF)のために。これらの兆候の一つが存在する場合、ラットを終了します。頻繁に、ラットは日28と35との間にこれらの症状を発症、無防備放置すれば、この時間間隔の間に自然に死にます。
5.右心カテーテル法
- 麻酔。
- 5%イソフルラン/ 100%O 2(流量:1リットル/分)での誘導チャンバーを記入し、ボックス内にラットを配置します。後肢足指のピンチを実行することによって、麻酔の適切な深さを確認してください。ラットを計量。
- 心エコー検査プロトコル、胸部と腹部のために、ひげをそるとラットの右腹側に首をきれいに。
- ヒートマット(37°C)にその背中にラットを置き、2と換気マスク/フードに鼻を置く- 3%イソフルラン/ 100%O 2(流量:1リットル/分)。鼻は、研究者の方に直面しなければなりません。
- 麻酔の深さを確認してください。重度のPHラットに注意してください。心拍数が減少した場合、麻酔の深さを減少させます。好ましい、20分以内にすべての測定を実行。麻酔下ながら乾燥を防ぐために、眼軟膏を適用します。
- 心エコー検査プロトコル。
- ブリテンらによって記載されたプロトコルに従って、心エコー検査を行います。 Joveの13インチ
- カテーテルプロトコル。
注:このプロトコルは、予め形成されたチップで剛性のカニューレを使用して先端からボール2ミリメートルと15センチのシリコンカテーテルを案内するために20度曲げます。内側に少し曲げ、そのオリフィスを有する20-G 針が右頸静脈にカニューレを挿入するために使用されている(材料のリストを参照してください)。 PAHの進行及び制御のいずれかの相のラットは、このプロトコルで使用することができます。- 塩化hexidineで首を消毒します。右腹側で#10手術用メスの刃を用いて1.5 cmの切開を行います首の、右鎖骨から下顎の骨に。
- ハサミを用いて組織を広げます。頸静脈が表示されるまで、ピンセットを使用して、静かに離れて組織を引っ張ります。破片の鉗子を使用して、頸静脈の周りに膜を解剖。
- 容器の周りに緩い結紮糸(5-0縫合糸)を配置することにより、頸静脈に緊張を置きます。緊張を高め、換気マスク( 図 2A)に合字をテープで固定します。
- 挿入部位の下流に、カニューレは、漏れや圧力の損失を防止するために、 その場にある後締め容器の周囲に緩い結紮を置きます。
- 鉗子のハンドルを使用して、わずかにカテーテルを用いてカニューレを行うために内部にオリフィスを有する20-G針の先端を曲げます。
- 静脈に20-G針の先端を導入し、迅速に容器内にカテーテルを含むカニューレを配置します。針を引き抜き、その後、合字を閉じますそれはステップ5.3.4で調製しました。
- 頸静脈にカテーテルを含むカニューレを実施します。カニューレの先端が20度曲線である(ステップ5.3.5を参照してください)。鎖骨下カニューレを操縦し、右心房( 図2C)を入力する少しを進めます。
- 右心室を入力するには、心臓( 図2D)に向かって、左にカニューレの先端を指します。ベッドサイドモニタでは、RVの圧力曲線は、 図2Dに一致する 、表示されます。
- RVの圧力曲線が一定の場合、収縮期および拡張期の右心室圧1を書き留め(sRVP1 / dRVP1)。
- 左と上方向へのカニューレの先端を操作します。カニューレ( 図2E)内にカテーテルを進めます。
- 主肺動脈(PA)へのカテーテルを進めます。肺動脈弁を通過するときに抵抗が感じされるべきではありません。
注:カテーテルは、主肺動脈、Dに入り、iastolicの圧力が上昇します。ベッドサイドモニタでは、PAの圧力曲線は、 図2Eに一致する 、表示されます。 - PAの圧力曲線が一定の場合、収縮期、拡張期を書き留め、およびPA圧1(sPAP1、dPAP1、mPAP1)を意味します。
- カテーテルの先端にボールが肺動脈にくさび止めされるまでさらにカニューレ内にカテーテルを進めます。ベッドサイドモニタの低下への圧力曲線を観察し、 図2Fにおけるウェッジ圧力曲線と一致しています。
- ウェッジ圧力曲線が一定の場合、収縮期、拡張期を書き留め、およびウェッジ圧力を意味します。
- ゆっくりとカテーテルを引いて、その後、ベッドサイドモニタに表示されているように、sPAP2、dPAP2、mPAP2、sRVP2、およびdRVP2の値を測定し、書き留めます。
- RVで、わずかに測定するために、カニューレとカテーテルを引き戻すときに右心房圧(RAP)を意味します。曲線は、図2AのRAP曲線と一致する必要があります。
NOTE:このプロトコルでは、ラットを麻酔下にある間循環血液量の抽出によりカテーテルプロトコルの後に安楽死させます。
6.形態評価および形態計測
注:このプロトコルでは、動物は麻酔下ながら、循環血液量の抽出によって安楽死させます。 PAHの進行及び制御のいずれかの相のラットは、このプロトコルで使用することができます。
- 屠殺後、約5mm気管支分岐部と心臓に肺を接続する船の上に気管を切断することによって肺を取り出します。冷生理食塩水で肺を置きます。左肺を解剖。分岐部に左主気管支をカットします。
- 、4%パラホルムアルデヒドで50-mLシリンジを埋めるシリンジにカニューレでチューブを取り付け、作業テーブルの上メートル程度の注射器を掛けます。受動的にパラホルムアルデヒドで肺を埋めるために左主気管支にカニューレを取り付けます。注意してパラホルムアルデヒドを扱います。
- 48時間パラホルムアルデヒドで左肺をインキュベートします。
- (70%エタノール(1時間)、80%エタノール(1時間)、90%エタノール(1時間)、100%エタノール(3 H)、キシロール(2時間)、そしてパラフィン中に連続的にインキュベートすることによって、左肺を脱水2時間)。
- カセットが直面している肺門と、パラフィンに左肺を埋め込みます。
- 製造業者の使用説明書29に従って、Verhoeffまたはエラス・ファン・ギーソン染色を用いてパラフィン包埋し、4μmの肺切片を染色します。弾性板はよく( 図3のように)区別されていることを確認します。 40Xの倍率で染色した切片をスキャンします。
- 4象限に肺を分割します。各象限では、外径<50ミクロン(イントラ腺房)と外径10隻> 50ミクロン(プレ腺房)で10隻を発見。画像(肺あたり2×40画像)を取ります。ランダムに20倍の倍率と写真まであらゆる容器内のズームこの視野で選択バイアスを最小化します。
- > 2の最長/最短径の比、不完全な円形、または血管壁の4分の1以上の崩壊を持っている血管を除外します。
注:除外容器の例は、同じ倍率(40X)上の各画像を作成し、スケールバーを含む図3bに示されています。 - ImageJのと最初の画像を開きます。 「Analyseを 」を介してスケールを設定するためには画像中のスケールバー上の直線を描きます そして、「スケールを設定します 。」 「 既知の距離 、「画像のスケールバー上の値を使用します。長さの単位としてマイクロメートル(μm)を使用します。グローバルにスケールを設定します。
- 「 フリーハンド選択を 、「使用方法 管腔面積( 図3)の内側の境界に線を引きます、 そして、「測定」を使用 (CRTL m)は、この領域を測定します。そして、外側ELASTの周りに線を引きます総血管面積を測定するICラミナ( 図3)。
- (管腔と外径を計算します
 )を使用して、
)を使用して、  。
。 - 使用した壁の厚さを計算します
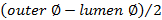 。
。 - 使用した壁/ルーメン比を計算します
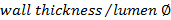 。
。 - 使用して閉塞スコアを計算します
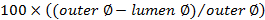 。
。 - muscularizationに容器をスコア(なし、部分的、または合計muscularization)( 図3B)。
注:半分以上の円周のための二重の弾性板との船舶が完全にmuscularizedとして定義されています。半周未満の二重弾性板と血管が部分的にmuscularizedとして定義されています。 - neoiの存在に容器のスコアntima(yesまたはno)( 図3C)。
注:(多くの場合、偏心)管腔閉塞と組み合わせ明確に定義された内弾性板のない船舶は、新生内膜病変として定義されています。
結果
代表的な結果を図4に示されています。コントロール(N = 3)、MF8(N = 5)、MF14(N = 5)、MF28(N = 5)、およびMF-RVF(:示された結果は、以下の群内のLewisラットにおけるMCT + FLOWの特性を示しますN = 10)。統計分析は、ボンフェローニ補正を用いて、一方向ANOVAを用いて行きました。
60ミリグラム/キログラムMCT?...
ディスカッション
この方法は、流れ誘発性PAHおよびPAHと、このモデルを特徴付ける原則血行動態及び組織病理学的エンドポイントを評価するためのテクニックを作成するために、MCTで前処置したラットにおける大動脈大静脈シャントの外科的手順を説明します。
プロトコルおよびトラブルシューティングの中で重要なステップ
手術と術後。大動脈大静脈シャント手術中?...
開示事項
The authors have nothing to disclose.
謝辞
This study was supported by the Netherlands Cardiovascular Research Initiative, the Dutch Heart Foundation, the Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development, and the Royal Netherlands Academy of Sciences (CVON nr. 2012-08, PHAEDRA, The Sebald fund, Stichting Hartekind).
資料
| Name | Company | Catalog Number | Comments |
| Shunt Surgery | |||
| Sterile surgical gloves | |||
| Duratears Eye ointment | Alcon | 10380 | |
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Histoacryllic tissue glue | B. Braun Medical | 1050052 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Safil 4-0 sutures violet resorbable | B. Braun Medical | ||
| 18 G needle | Luer | NN1838R BD | tip bent in 45 degrees orifice to the outside |
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Temgesic Buprenorphine | RB Pharmaceuticals | 5429 | subcutaneous injection |
| Sodium Chloride 0.9% | |||
| Ventilation mask Rat | |||
| Scalple blade | |||
| Biemer clamp 18 mm, 5 mm opening | AgnTho | 64-562 | |
| Heat mat | |||
| Kocher Clamp | |||
| Shaving machine | |||
| Microscope | Leica | ||
| Right Heart Catheterization | |||
| Sterile surgical gloves | |||
| Eye ointment | Duratears | ||
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Needle 20 G | Luer | Tip slightly bent to the inside | |
| Cannula 20 G | Luer | to introduce catheter, tip pre-formed in 20 degrees | |
| Silastic Catheter 15 cm long | 0.5 mm ball 2 mm from tip | ||
| Pressure transducer | Ailtech | ||
| Bedside monitor Cardiocap/5 | Datex-Ohmeda | ||
| Shaving machine | |||
| 10 mL Syringe | |||
| Sodium Chloride 0.9% | for flushing | ||
| Vascular Morphology | |||
| 50 mL Syringe | |||
| 4% Formaldehyde | |||
| 18 G cannula with tube | |||
| Verhoef staining kit | Sigma-Aldrich | HT254 | http://www.sigmaaldrich.com/catalog/product/sigma/ht254?lang=en®ion=US |
| Digital slide scanner | Hamamatsu | C9600 | |
| ImageJ | |||
| Elastic (Connective Tissue Stain) | Abcam | ab150667 | http://www.abcam.com/elastic-connective-tissue-stain-ab150667.html http://www.abcam.com/ps/products/150/ab150667/documents/ab150667-Elastic%20Stain%20Kit%20(website).pdf |
参考文献
- Hoeper, M. M., Bogaard, H. J., Condliffe, R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol. 62, D42-D50 (2013).
- Stacher, E., Graham, B. B., Hunt, J. M., et al. Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med. 186 (3), 261-272 (2012).
- Levy, M., Maurey, C., Celermajer, D. S., et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease. J Am Coll Cardiol. 49 (7), 803-810 (2007).
- Sakao, S., Tatsumi, K., Voelkel, N. F. Reversible or irreversible remodeling in pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 43 (6), 629-634 (2010).
- Gomez-Arroyo, J. G., Farkas, L., Alhussaini, A. A., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Jones, J. E. Serial noninvasive assessment of progressive pulmonary hypertension in a rat model. Am J Physiol - Heart Circ Physiol. 283 (1), 364-371 (2002).
- Hoffman, J. I., Rudolph, A. M., Heymann, M. A. Pulmonary vascular disease with congenital heart lesions: Pathologic features and causes. Circulation. 64 (5), 873-877 (1981).
- van Albada, M. E., Berger, R. M. Pulmonary arterial hypertension in congenital cardiac disease--the need for refinement of the evian-venice classification. Cardiol Young. 18 (1), 10-17 (2008).
- Dickinson, M. G., Bartelds, B., Borgdorff, M. A., Berger, R. M. The role of disturbed blood flow in the development of pulmonary arterial hypertension: Lessons from preclinical animal models. Am J Physiol Lung Cell Mol Physiol. 305 (1), L1-L14 (2013).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovasc Res. 24 (5), 430-432 (1990).
- Okada, K., Tanaka, Y., Bernstein, M., Zhang, W., Patterson, G. A., Botney, M. D. Pulmonary hemodynamics modify the rat pulmonary artery response to injury. A neointimal model of pulmonary hypertension. Am J Pathol. 151 (4), 1019-1025 (1997).
- van Albada, M. E., Schoemaker, R. G., Kemna, M. S., Cromme-Dijkhuis, A. H., van Veghel, R., Berger, R. M. The role of increased pulmonary blood flow in pulmonary arterial hypertension. Eur Respir J. 26 (3), 487-493 (2005).
- Brittain, E. Echocardiographic assessment of the right heart in mice. JVis Exp. (e81), (2013).
- Dickinson, M. G., Bartelds, B., Molema, G., et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension. Am J Pathol. 179 (5), 2199-2209 (2011).
- Borgdorff, M. A., Bartelds, B., Dickinson, M. G., Steendijk, P., de Vroomen, M., Berger, R. M. Distinct loading conditions reveal various patterns of right ventricular adaptation. Am J Physiol Heart Circ Physiol. 305 (3), H354-H364 (2013).
- Ruiter, G., de Man, F. S., Schalij, I., et al. Reversibility of the monocrotaline pulmonary hypertension rat model. Eur Respir J. 42 (2), 553-556 (2013).
- van Albada, M. E., Bartelds, B., Wijnberg, H., et al. Gene expression profile in flow-associated pulmonary arterial hypertension with neointimal lesions. Am J Physiol Lung Cell Mol Physiol. 298 (4), L483-L491 (2010).
- Dickinson, M. G., Kowalski, P. S., Bartelds, B., et al. A critical role for egr-1 during vascular remodelling in pulmonary arterial hypertension. Cardiovasc Res. 103 (4), 573-584 (2014).
- van der Feen, D. E., Dickinson, M. G., Bartelds, M. G., et al. Egr-1 identifies neointimal remodeling and relates to progression in human pulmonary arterial hypertension. Jheart lung transplant. 35 (4), 481-490 (2016).
- Rungatscher, A. Chronic overcirculation-induced pulmonary arterial hypertension in aorto-caval shunt. Microvasc Res. 94, 73-79 (2014).
- O'Blenes, S. B., Fischer, S., McIntyre, B., Keshavjee, S., Rabinovitch, M. Hemodynamic unloading leads to regression of pulmonary vascular disease in rats. J Thorac Cardiovasc Surg. 121 (2), 279-289 (2001).
- Sakao, S., Taraseviciene-Stewart, L., Lee, J. D., Wood, K., Cool, C. D., Voelkel, N. F. Initial apoptosis is followed by increased proliferation of apoptosis-resistant endothelial cells. FASEB J. 19 (9), 1178-1180 (2005).
- Spiekerkoetter, E. FK506 activates BMPR2, rescues endothelial dysfunction, and reverses pulmonary hypertension. J Clin Invest. 123 (8), 3600-3613 (2013).
- Nickel, N. P., Spiekerkoetter, E., Gu, M., et al. Elafin reverses pulmonary hypertension via caveolin-1-dependent bone morphogenetic protein signaling. Am J Respir Crit Care Med. 191 (11), 1273-1286 (2015).
- Meloche, J., Potus, F., Vaillancourt, M., et al. Bromodomain-containing protein 4: The epigenetic origin of pulmonary arterial hypertension. Circ Res. 117 (6), 525-535 (2015).
- Happé, C. M. Pneumonectomy combined with SU5416 induces severe pulmonary hypertension in rats. Am J Physiol Lung Cell Mol Physiol. 310 (11), L1088-L1097 (2016).
- Ranchoux, B., Antigny, F., Rucker-Martin, C., et al. Endothelial-to-mesenchymal transition in pulmonary hypertension. Circulation. 131 (11), 1006-1018 (2015).
- de Raaf, M. A. SuHx rat model: Partly reversible pulmonary hypertension and progressive intima obstruction. Eur Respy J. 44 (1), 160-168 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved