Method Article
カエルの神経筋終末へのカルシウム色素の神経切片への積載:カエル神経筋接合部におけるカルシウムの一時的な位置合わせ
要約
ここでは、カエルの神経切開部から神経終末にカルシウム感受性色素を充填する方法について説明します。末梢神経終末における速いカルシウム過渡状態の記録および分析のためのプロトコルも提示する。
要約
シナプス前神経末端におけるシナプス前カルシウムレベルを測定する最も実現可能な方法の1つは、光記録である。これは、細胞内の遊離カルシウム濃度に応じて発光強度または波長を変化させるカルシウム感受性蛍光色素の使用に基づいています。カルシウム色素で細胞を染色するために使用されるいくつかの方法がある。最も一般的なものは、マイクロピペットを介して染料を装填する工程、または色素のアセトキシメチルエステル形態と予めインキュベートする工程である。しかしながら、これらの方法は、発生する方法論的問題のために、神経筋接合部(NMJ)にはあまり適していない。この記事では、カエルの神経の断端を介してカルシウム感受性色素を神経終末に装填する方法を紹介します。神経終末への外部カルシウムの侵入およびその後のカルシウム色素への結合はミリ秒の時間スケール内で起こるので、これらの相互作用を記録するために高速イメージングシステムを使用する必要があるns。ここでは、高速CCDカメラでカルシウム過渡現象を記録するためのプロトコルについて説明します。
概要
カルシウムイオン(Ca 2+ )は、メディエーター放出1,2,3,4,5の開始、維持および可塑性を含む、多くのニューロンシグナル伝達プロセスに関与する。活動電位が到着すると、細胞外Ca 2+が神経末端に入り、神経伝達物質放出を開始する。いくつかのシナプスでは、カルシウム電流は、電気生理学的方法6,7,8によって直接測定することができる。神経筋接合部(NMJ)の場合、神経終末の微細なサイズのために、直接パッチクランプおよび2電極電圧クランプ技術を使用することはできない。
NMJの神経終末からの内向きのCa 2+電流の記録は、間接的な電気的方法イオロジー法9,10 。しかしながら、これらの方法は、ナトリウムおよびカリウムイオンチャネルブロッカーによるシナプスの前処理を必要とする。光学的方法は、神経終末におけるイオン電流の薬理学的分離を必要とせず、活動電位によって誘発されたCa 2+流入の記録、および軸索血小板11,12,13,14におけるCa 2+イオンのその後の上昇を可能にする。これらの方法は、遊離Ca 2+イオンの結合時の特定のCa 2+感受性色素の蛍光の変化の記録に基づいている15,16,17,18,19。
Ca 2+インジケータをCにロードすることができます実験の目的に応じて、さまざまな方法で習得できます。研究者は、膜透過性染料形態20,21 、パッチピペット22またはマイクロインジェクション23,24,25を介して装填する浴適用を使用する。しかしながら、これらの方法は全て、シナプス構築物における特異性のためにNMJの場合にいくつかの制限がある。 NMJにとって、最も便利で成功した方法は、神経断端を通して染料を充填することであり、前方充填法26,27,28,29である。この技術は、様々な蛍光色素を末梢神経終末にロードするために使用することができる。この方法は、 ショウジョウバエの神経末端28 、トカゲ運動神経28 、及びカエルモーター神経端子17,26,27,30を含む。研究対象のオブジェクトによっては、詳細が異なる場合があります。ガラスマイクロピペットを幼虫28の小さな神経に使用することができる。いくつかの研究者は、筋肉を神経支配する神経の新たに切断された端部を色素で予め充填された井戸に浸漬する方法27,28を記載している。次いで、調製物を数時間放置して染料を浸漬する。色素は軸索に浸され、神経末端に輸送される。本論文では、蛍光標識をカエルモーターの神経終末に神経断端を通して装填する方法について述べる。我々のプロトコールは、組織と色素とのインキュベーションのためにプラスチックピペットチップを使用する。我々はまた、Ca 2+蛍光traを取得および分析する方法を記載するnsients。
プロトコル
実験は、 Rana ridibundaカエルの筋肉皮膚の孤立した神経筋調製物で行った。両方の性別の動物のサイズは約5-9cmであった。実験手順は、実験動物のケアおよび使用のためのNIHガイドに従って、カザン連邦大学およびカザン医科大学の実験動物の使用に関するガイドラインに従って実施した。この実験プロトコルは、欧州共同体理事会指令86/609 / EECの要件を満たし、カザン医科大学の倫理委員会によって承認された。
1.ソリューションの準備
- リンガー溶液の調製。
- リンゲル溶液:113.0mM NaCl、2.5mM KCl、3.0mM NaHCO 3 、および1.8mM CaCl 2を調製する。 pHを7.2-7.4に調整する。
- 低いCa 2+を含むリンゲル溶液を調製する。 2+含量:113.0mM NaCl、2.5mM KCl、3.0mM NaHCO 3、6.0mM MgCl 2、0.9mM CaCl 2 。 pHを7.2-7.4に調整する。
- 色素装填溶液の調製。
- HEPES-Naを含む水系溶液を10 mM(pH 7.2-7.4)で調製する。
- 14μLのHEPES溶液を染料30と共にバイアルに加える。
注:Ca 2+インジケーター色素は、500μLのバイアルに500μgの粉末を入れたものです。 - ボルテックスしてスピンダウンして完全に混合します。
- 溶液を希釈して、Ca 2+指示薬の最終濃度を30mMに下げる。 -20℃で光および貯蔵に暴露されないようにする。
2.染料充填手順
- 皮膚の胸筋を胸腹の神経片で解剖する 。
注:解剖の手順は利用可能ですBlioch らによる論文の無償ダウンロード、1968 31 。- 解剖の手順には、2つの細かい鉗子と角膜のはさみを使用します( 表の表を参照)。解剖した組織を、リンゲル溶液で予め充填したシリコンエラストマーでコートしたペトリ皿に移し、細いステンレススチール製のピンで組織を固定し、それを皿の中にわずかに引き伸ばす。
- ペトリ皿にリンゲル溶液の新しいアリコートを再充填する。結合組織を除去する。神経を損傷しないでください。
- 充填ピペットを準備する:かみそりの刃を使用して、標準プラスチック10μLピペットチップの円錐部分の〜2mmの長さの部分を切り取ってください。
- ペトリ皿に充填ピペットをマウントするための粘土模型を準備します。
- ピペットチップから作られたシリコンチューブとプラスチック接続アダプターを介して充填ピペットの背面をプラスチックシリンジに接続します。
- 前にdあなたのローディング手順は、プラスチックピペットを使用して、ペトリ皿からリンガーのソリューションを削除します。微細な注射器を用いて筋肉 - 神経製剤を乾燥させる;これは、その後の充填ピペットの充填時にCa 2+色素の希釈を防止する。
- 冷凍庫からCa 2+指示薬バイアルを取り出し、室温で暗所で解凍させる。
- 低倍率(10倍)の実体顕微鏡制御下で、筋肉と神経との間の接合を検出する。細かいピンセットとはさみで、 胸鰭の腹側の神経を筋肉の表面近くに切断します(ステップ2.1参照)。約2mmの神経切手を残す。
- モデリングクレイを使用して、ペトリ皿上のチュービングおよびシリンジに取り付けられた充填ピペットを固定します。
- ピペットの先端を神経切開の近くに動かします。
- それをつまらないで、静かに充填ピペットの先端に神経断端を吸引する。
- 鈍い部分から吸引チューブを取り外す充填ピペットの端。
- 長い針が付いたシリンジを使用して、充填ピペットから余分な溶液を注意深く取り出します( 材料表を参照)。神経切れを挟まないでください。
- 先端部に神経断端が吸引された状態で、充填ピペットの先端を垂直に少し持ち上げます。
- 石油ゼリーを使用して、充填ピペットチップの外側から神経断端の吸引された部分を断熱する。
- 必要に応じて、充填ピペットで絶縁された神経断端を乾燥させる:長い針を備えた注射器を用いて充填ピペットから余分な溶液を静かに吸引する。
- ピペットチップが長いピペットを使用して、0.5μLの色素負荷溶液(ステップ1を参照)を引き出します。
- ピペットチップを充填ピペットに静かに挿入します。混合物を神経断端に直接放出する。
- 充填ピペットの開放端を石油ゼリーでシールする。
- リンガーの小さなアリコートを加える調製物を濡らしたままにするためにペトリ皿への凍結。
- 調製物を室温で暗く湿った条件下で5時間インキュベートする。
- 充填液を充填したピペットを取り出し、リンゲル液で調製物をすすぎ、8℃の冷蔵庫に一晩放置する。
3.顕微鏡のための組織の準備
- 調製物をシリコンエラストマーでコーティングしたチャンバーにマウントし、鋼製のマイクロニードルでわずかに引き伸ばすように固定します。
- 新しいリンガー溶液のアリコートで組織をすすぐ。
- 神経を刺激するために吸引電極を使用する。電極の構築は、Kazakov らによる論文の無償ダウンロードから入手可能である。 、2015 32 。電極の先端を神経の切断端に近づけて配置し、電極の穴に神経断端を吸引する。
- 準備室を顕微鏡ステージに取り付けます。プラック温度プローブと、チャンバ内の入口および出口の点火。
- ペルチエ素子に電源コードを接続します。
- 準備を盛り上げるには、単純な重力駆動システムを使用します。余分な溶液を除去するには、灌流吸引ポンプをオンにします。
- サーモコントローラユニットの電源を入れます。
- 温度コントロールを20°Cに設定します。
- 紫外線防護シールドを取り付けます。
- 刺激ワイヤー電極を電気刺激装置に接続し、顕微鏡下で4倍の対物レンズを用いて筋肉収縮を観察する。
- Ca 2+およびMg 2+の含有量が低いリンゲル液で灌流システムを満たす。
注:このソリューションは、筋肉の収縮を防ぐために使用されます。外部カルシウムの濃度の減少および外部マグネシウムの上昇は、Ca 2+過渡応答の振幅の減少をもたらす。しかしながら、以前の経験に基づいて、0.9mM CaCl 2および6mMのMgCl 2は、Ca 2+過渡応答の振幅を確実に解消するのにはまだ十分である。例えば、ニコチン性アセチルコリン受容体の特異的ブロッカーであるd-ツボクラリンまたはアルファ - ブンガロトキシンの使用は、筋肉の痙攣を完全にまたは部分的に遮断するであろうしかし、これらの毒素の添加は、シナプス前カルシウム浸入にも影響し得る33 。これを避けるために、μ-コノトキシンGIIIAを使用することができます27 。 - ポンプを入れ、低Ca 2+および高Mg 2+を含むリンゲル液で調製物の灌流を開始する。
- 顕微鏡の40×対物レンズに切り替えます。
- スイッチをオンにする彼はモノクロメーター( 表の表を参照)。
- モノクロメータ制御ソフトウェアで488 nmの発光波長と連続照明モードを選択します。
- 蛍光モードでの高倍率下で、神経末端に色素が充填されていることを確認する。
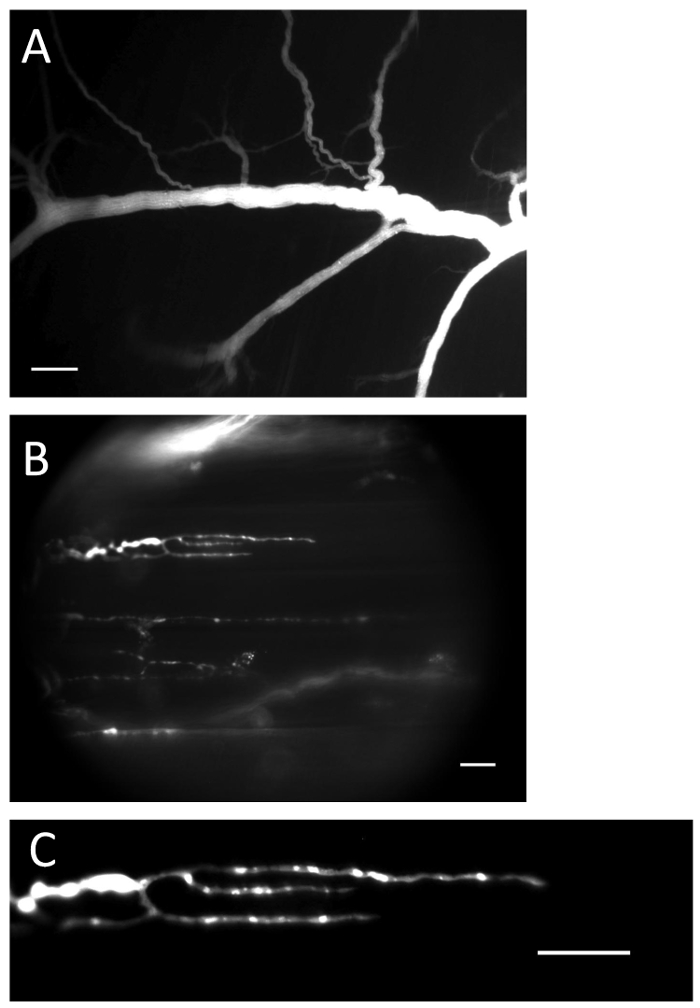
図1 :Ca 2+指示薬が充填された神経および末端。 ( A )負荷操作後にCa 2+指示薬を充填した神経。スケールバー=200μm。 ( B )Ca 2+指示薬で満たされた神経終末。スケールバー=20μm。 ( C )Ca 2+ -指示薬の蛍光は、神経終末にはっきりと見える。スケールバー=20μm。_blank ">この図の拡大版を見るには、ここをクリックしてください。
- Ca 2+およびMg 2+の低濃度溶液中で調製物を少なくとも30分間平衡化させる。
4.デジタルCCDカメラによるビデオキャプチャ
注:蛍光信号の取り込みの詳細は、顕微鏡とカメラの種類ごとに異なりますが、主な考慮事項は画像取り込み速度です。
- NMJにおける単一のCa 2+過渡状態の記録のための最小捕捉周波数として1kHzを使用する。
注:蛍光イメージングには高速デジタルCCDカメラが必要です( 材料表を参照)。ここでは、カメラ、モノクロメータ、および刺激装置の同期にデータ収集システムとソフトウェア( 表の表を参照)を使用しました。要するに、このプロトコルは、データのデジタル出力上に同期パルスを生成することを可能にするシャッターを開放し、ビデオ信号を捕捉し、刺激を開始するための捕捉システムを含む。すべての時間的パラメータは、プロトコルおよび/または装置上で設定することができる。典型的なプロトコルは、1kHz(80x80ピクセル)で取得された一連の500フレームです。励起光による照明は、Ca 2+インジケータを漂白し、細胞組織を光分解することができる。したがって、励起光への長時間の暴露を避けてください。このプロトコルでは、シャッターはビデオのキャプチャに必要な時間だけ開いています。特定の神経末端あたり20シリーズを取得します。ここでの目的は、対照群および薬物送達後の同じ部位をモニターすることである。 - 顕微鏡の4倍対物レンズの下で、明視野法を使用して筋肉と神経分岐を視覚化します。
- 40倍の対物レンズに切り替え、落射蛍光法と488 nmの励起波長を使用して、色素が充填された神経終末を探します。関心のある神経終末領域を特定する。
- 三眼チューブで顕微鏡で、光路交換レベルを選択します:100%光をカメラに照射します。
- CCDカメラの取得ソフトウェアを起動します。
- 「ライブ」モードでは、ROIを見つけてフォーカスを調整します。
- メニューの「変更」の設定を選択します。
- 「基本設定」は、毎秒1,000フレーム(fps)で、80 x 80の解像度で使用してください。
- 入力フレーム数を500に設定します。
- 実験の名前を入力します。
- 「外部トリガ」を選択します。
- プリトリガ時間を10 msに設定します。
- リピート数を20に設定します。
- モノクロメータ制御ソフトウェアでは、488 nmの発光波長と「外部トリガ照明」モードを選択します。
- データ収集ソフトウェアを実行します。
- 刺激プロトコールをロードする。
- ビデオを録画する前に、ビデオキャプチャソフトウェアを使用して暗いフレームをキャプチャします。
- 刺激プロトコルを実行します。
- ROIとチェクを選択k記録された信号。
5.データ分析
注:データ解析には、CCDカメラソフトウェアとImageJを使用します。データは表計算プログラムで曲線として表されます。 CCDカメラソフトウェアでは、平均20回繰り返して結果をImageJサポートファイルにエクスポートします。 ImageJで、ROIと背景を選択します。 ROIからバックグラウンドを差し引く。データを比(ΔF/ F 0 -1)×100%として表し、ΔFは刺激中の蛍光の強度であり、F 0は静止時の蛍光の強度である。
- CCDカメラの取得ソフトウェアで、ファイル>平均ファイルをクリックします。ファイルを選択して平均します。
- [フィットファイルとして保存]をクリックして、平均化したファイルを.fitファイルとして保存します。
- ImageJソフトウェアを実行します。次の手順を実行します。
- 画像/調整/輝度/コントラストをクリックします。
- [イメージ]> [スタック]> [ツール]> [;スタックソーター。
- 分析>ツール> ROIマネージャーをクリックします。
- 平均化された.fitファイルをImageJウィンドウにドラッグアンドドロップします。
- ウィンドウを拡大すると、より見やすくなります。
- カーソルを動かすことによって、最後のフレームを選択して削除します(これはダークフレームです)
- 背景と思われる領域上の矩形ROIを選択します。それをROIマネージャーに追加する
- More> Multi Measureをクリックして背景を測定します。意味に注意してください。データをコピーしてスプレッドシートプログラムにエクスポートし、比率のしきい値の平均値を計算します。
- 「Process」→「Main」→「Subtract」をクリックして、スタックからしきい値を減算します。しきい値の平均値を入力します。
- 神経終末を囲む四角形のROIを選択します。これをROIマネージャーに追加します。
- More> Multi Measureをクリックして測定します。意味に注意してください。それをスプレッドシートプログラムにコピーしてエクスポートします。
- 信号の平均オフセット。
注記:最初の数十点は刺激なしでベース色素の蛍光を示す。これは安静時の蛍光である。 - 安静時の蛍光で信号を分割します。
- "1"を減算して100%を掛けます。
- シグナルをプロットし、Ca 2+過渡応答の振幅を計算する。
結果
色素負荷および運動神経刺激後、神経終末において蛍光シグナルの振幅の増加(Ca 2+過渡)が検出され得る( 図2参照)。 Ca 2+過渡応答のパラメータを表1に示す 。定量的に、我々の研究で測定されたCa 2+過渡応答のパラメータは、冷血動物のシナプスで他の科学者によって得られたデータに近い15,34。 Ca 2+トランジェントのパラメータは、Ca 2+の色素との結合速度およびその後の解離に依存する。 Ca 2+の神経終末への進入速度、色素との相互作用、および細胞質内の拡散はすべて、Ca 2+の一過性の立ち上がり時間に影響を及ぼす。蛍光シグナルの減衰時間は、色素の親和性に依存し、細胞内緩衝液とのCa 2+相互作用の速度、およびイオンポンプ35による除去を含む。 Ca 2+過渡応答の振幅解析は、神経伝達物質の放出に関与するカルシウム侵入に対する様々な物質の影響を研究するために使用することができる33 。

図2 :平均Ca 2+ カエルNMJで測定される一過性。 Ca 2+過渡応答は、13のカエルNMJからのシグナルの平均に基づいて計算した。 この図の拡大版を見るには、ここをクリックしてください。
| ピークΔF/ F(%) | 立ち上がり時間20%-80%(ms) | τ(ms) |
| 12,6±1,1(n = 13) | 4.6±0.5(n = 13) | 115.3±8.3(n = 13) |
表1: Ca 2+過渡応答 の 平均化された パラメータ 。データは平均±SEとして示されている。 nは別個のNMJにおける測定の数である。ピークΔF/ Fは、ΔF/ Fの平均振幅である。
ディスカッション
本論文では、カエルの神経終末へのCa 2+感受性色素負荷を神経断端を通して行う方法を提示した。装填手順の終わりまでに、神経の近位部分の全ての末端に有意な蛍光レベルがある。プローブの末端内濃度は40〜150μMの間で変動すると推定されている17 。
インキュベーション手順は、室温で2段階、次いで冷蔵庫でより低い温度で実施される。室温で染料との組織インキュベーションの時間を制御することが重要である。神経断端の実際の長さ、特定の色素、および温度に依存して、インキュベーション時間は変化し得る。過度に露出すると、神経断端に近い近位部の端子に過負荷がかかります。しかし、神経の中間部分では、満足のいく負荷のある端末を見つけることは可能である。その間冷蔵庫で長時間インキュベートすると、色素は神経終末に均等に分布します。
私たち自身の観察33,35ならびに他の研究者30のデータは、シナプス後応答の振幅またはミニエンドプレート電位の頻度に対する負荷手順の感知可能な影響の欠如を証明する。良好な寿命が、装填された調製物に記録された。私たちが注目したい重要な点がいくつかあります。色素が切断された神経の軸索に入ることを可能にするために、切除後数分以内に色素負荷溶液に神経断端を置くことは非常に重要である。恐らく神経軸索の再封鎖のために遅延が無効な負荷を引き起こす可能性がある(27,36)。一部の研究者は、100mM EDTA(Ca 2+ - およびMg 2+ - キレート剤)切断された軸索が再シールされるのを防ぐために、神経の切除直後。緩衝液を1〜2分後に除去し、色素充填溶液37と交換する。装填手順のためにプラスチックチューブの代わりに石油 - ゼリーを使用することにより、より短い神経断端の使用が可能になる。このアプローチを使用している間、それは色素でHEPES溶液に浸された後に切断され、色素溶液27,28中の二価イオンの欠如のために軸索は再シールされない。
我々の研究では、デキストランの代わりにCa 2+指示薬の水溶性塩形態を用いた。デキストランコンジュゲートは、塩形態よりも緩徐に軸索に拡散する。しかしながら、デキストランコンジュゲートの使用は、色素区画化および神経およびNMJによる処理を減少させる。カルシウムグリーン1〜3,000MWデキストランコンジュゲートは良好な拡散速度を有し、コンパートメント化の低減を実証する up class = "xref"> 38。
組織の蛍光照射の長期間を避けることは、その健康と生存に影響するため、非常に重要です。可視光チャネルのノマルスキ光学系を使用して神経端末を検索します。記録中は、絞りを使って照射野を制限します。
このローディング方法は、長いインキュベーションに耐えることができる調製物にのみ適していることは注目に値する。研究がより壊れやすい組織( 例えば、温血動物のシナプス)で行われているときに色素負荷時間を短縮するためには、神経断端の長さを縮小し、マイクロピペットを用いて負荷29,39を行うことが必要である。
このローディング技術は、単一神経刺激およびリズミックシナプス活性の両方の下で蛍光指示薬を用いて、細胞質ゾルCa 2+の変化をイメージングするのに適しているCa 2+ -過渡振幅の分析を用いて、神経伝達物質放出に関与するカルシウムの侵入に対する異なる物質の影響を研究することができる33 。
開示事項
著者は何も開示することはない。
謝辞
この研究は、ロシア政府のカザン連邦大学の競争的成長プログラムとロシア基礎研究基金(16-04-01051; 16-34-00817; 15-04-02983)の助成を受けて実施されました。私たちは、原稿の以前のドラフトに関する有益なコメントを提供した4人の匿名の査読者に感謝します。 Yuliya Aratskayaには音声録音に感謝の意を表します。 Victor Ilyin博士に多くの有益なコメントをいただき、フィナーレ編集の助けに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Ca2+ indicator | Molecular Probes, USA | Oregon Green 488 BAPTA-1 hexapotassium salt, O6806 | 500 μg |
| Silicone Elastomer | Dow Corning, USA | Sylgard 184 elastomer | |
| Pipette | Biohit, Russia | 720210 | 0.5-10µL |
| Pipette tip | Fisher Scientific, USA | 02-707-175 | 10µL |
| Pipette tip | Biohit, Russia | 781349 | 10µL |
| Razor Blade | Fisher Scientific, USA | 12-640 | |
| Minutien Pins | Fine scince tools, Canada | 26002-20 | |
| Corneal Mini-Scissors | MT MEDI CORP, Canada | S-1111 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9610 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9611 | |
| Modelling clay | local producer | can be replaced by any local producer | |
| Petroleum jelly | local producer | can be replaced by any local producer | |
| Microspin FV 2400 | Biosan, Latva | BS-010201-AAA | |
| Multi-spin MSC 3000 | Biosan, Latva | BS-010205-AAN | |
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40mm |
| Syrynge | local producer | 0.5 ml | |
| HEPES | Sigma-Aldrich, USA | H0887 | 100ml |
| Microscope, BX51 | Olympus, Japan | ||
| Data acquisition system | Molecular Devices, USA | Digitdata 1550 | |
| software | Molecular Devices, USA | pClamp software, Version 10 | protocol can be download from : http://kpfu.ru/portal/docs/F_230007060/Video.capture.with. RedShirt.Neuro.CCD.camera.pro |
| Bath and bath temperature controler | Experimental Builder | can be replaced by any chamber with temperature control. For example from https://www.warneronline.com/ | |
| Monochromator | Till Photonics, Germany | Polychrome V | no longer available, can be replaced by other sutable stable light source 488 nm |
| monochromator control software | Till Photonics, Germany | Polycon | |
| Digital CCD camera | Redshirt imaging, USA | Neuro CCD SMQ | |
| Model 2100 Isolated Pulse Stimulator | A-M Systems, USA | ||
| Acquisition software for CCD camera | Redshirt imaging, USA | Turbo SM software | |
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel |
参考文献
- Llinás, R., Sugimori, M., Silver, R. B. Microdomains of high calcium concentration in a presynaptic terminal. Science. 256, 677-679 (1992).
- Augustine, G. J. How does calcium trigger neurotransmitter release?. Curr Opin Neurobiol. 11, 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37, 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Curr Opin Neurobiol. 15, 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Curr Opin Cell Biol. 22, 496-505 (2010).
- Borst, J. G., Sakmann, B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 383, 431-434 (1996).
- Borst, J. G., Sakmann, B. Calcium current during a single action potential in a large presynaptic terminal of the rat brainstem. J Physiol. 506, 143-157 (1998).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J Neurosci. 17, 2990-3001 (1997).
- Molgó, J., Mallart, A. Effects of Anemonia sulcatatoxin II on presynaptic currents and evoked transmitter release at neuromuscular junctions of the mouse. Pflugers Arch. 405 (4), 349-353 (1985).
- Slutsky, I., Rashkovan, G., Parnas, H., Parnas, I. Ca2+-independent feedback inhibition of acetylcholine release in frog neuromuscular junction. J Neurosci. 22 (9), 3426-3433 (2002).
- Haugland, R. P., Gregory, J. Indicators for Ca2+, Mg2+, Zn2+ and other metal ions. Handbook of fluorescent probes and research products. , 771-826 (2002).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods Cell Biol. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harb Protoc. 2010 (3), (2010).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. J Physiol. 505, 585-592 (1997).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophys J. 74, 1549-1563 (1998).
- Suzuki, S. Ca2+ dynamics at the frog motor nerve terminal. Pflug Arch Eur J Phisiol. 440, 351-365 (2000).
- Sabatini, B. L., Oertner, T. G., Svoboda, K. The life cycle of Ca2+ ions in dendritic spines. Neuron. 33, 439-452 (2002).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. Single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. J Neurosci. 31, 11268-11281 (2011).
- Regehr, W. G., Yuste, R., Konnerth, A. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in neuroscience and development: a laboratory manual. , 307-314 (2005).
- Macleod, G. T. Topical Application of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 786-790 (2012).
- Eilers, J., Konnerth, A. Dye loading with Patch Pipettes. Cold Spring Harb Protoc. 2009 (4), 277-281 (2009).
- Coleman, W. L., Bill, C. A., Simsek-Duran, F., Lonart, G., Samigullin, D., Bykhovskaia, M. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. J Physiol. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct Injection of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 797-801 (2012).
- Talbot, J. D., David, G., Barrett, E. F., Barrett, J. N. Calcium dependence of damage to mouse motor nerve terminals following oxygen/glucose deprivation. Exp Neurol. 234 (1), 95-104 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca2+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10, 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. alpha-Latrotoxin releases calcium in frog motor nerve terminals. J Neurosci. 20 (23), 8685-8692 (2000).
- Newman, Z., Malik, P., Wu, T. Y., Ochoa, C., Watsa, N., Lindgren, C. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur J Neurosci. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harb Protoc. 2012 (7), 3440-3450 (2012).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Blioch, Z. L., Glagoleva, I. M., Liberman, E. A., Nenashev, V. A. A study of the mechanism of quantal transmitter release at a chemical synapse. J Physiol. (1), 11-35 (1968).
- Kazakov, A., Aleksandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. 40 (9), 13-16 (2015).
- Khaziev, E. Acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Front Physiol. 7 (621), 1-10 (2016).
- Bélair, E. L., Vallée, J., Robitaille, R. Long-term in vivo modulation of synaptic efficacy at the neuromuscular junction of Rana pipiens frogs. J Physiol. 569 (1), 163-178 (2005).
- Samigullin, D., Fatikhov, N., Khaziev, E., Skorinkin, A., Nikolsky, E., Bukharaeva, E. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Front Synaptic Neurosci. 6 (29), 1-10 (2015).
- Angleson, J. K., Betz, W. J. Intraterminal Ca2+ and spontaneous transmitter release at the frog neuromuscular junction. J Neurophysiol. 85 (1), 287-294 (2001).
- Shahrezaei, V., Cao, A., Delaney, K. R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J Neurosci. 26 (51), 13240-132499 (2006).
- Troncone, L. R., et al. Promiscuous and reversible blocker of presynaptic calcium channels in frog and crayfish neuromuscular junctions from Phoneutria nigriventer spider venom. J Neurophysiol. 90 (5), 3529-3537 (2003).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Sudakov, I. A., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoSci. 7 (1), 162-166 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved