Method Article
イメージングフローサイトメトリーを使用したT細胞同種反応性の測定
要約
この論文は、イメージングフローサイトメトリーを使用して、T細胞の混合集団におけるアロ反応性を測定するための方法を記載しています。
要約
移植レシピエントにおけるドナー抗原に対する免疫学的反応性の測定は、成功の減少や免疫抑制の撤退のために重要である可能性が高いです。混合白血球反応(MLR)、限界希釈アッセイ、およびトランスインビボ遅延型過敏症(DTH)アッセイは全て、この問題に適用されているが、これらの方法は、予測能力及び/又はそれらの有用性を低下させる重大な実用上の制限が制限されています。 イメージングフローサイトメトリーは、蛍光顕微鏡の撮像機能を備えたフローサイトメトリーのマルチパラメトリック定量的な力を兼ね備えた技術です。我々は最近、ドナー抗原提示細胞(APC)との成熟した免疫シナプスを形成することができるレシピエントT細胞の割合を定義するために、撮像フローサイトメトリー法を使用しました。よく特徴付けられたマウス心臓移植モデルを用いて、我々は示されたそのT-APCのmembrうちインビトロ免疫シナプスの周波数ANE接触イベントは強く同種移植片拒絶反応、耐性の結果、および移植の生存が誘導制御性T細胞に依存状況を予測しました。 T-APCの接触の頻度は、急性拒絶反応の際にマウスからT細胞を増加し、同種抗原に応答しないレンダリングされたマウスからのT細胞を減少しました。 インビトロ系に調節性T細胞の添加は、長期T-APCの接触を減少させました。決定的に、この効果はまた、天然のヒト化マウスモデルにおけるヒト組織の拒絶反応を制御することが知られている制御性T細胞を、発生、拡大ヒトポリクローナルで見られました。このアプローチのさらなる開発は、移植レシピエントにおけるアロ反応性T細胞コンパートメントのより深い特徴付けを可能にすることができます。将来的には、ヒト細胞を用いたこの方法のさらなる開発及び評価は、免疫抑制の最小化のために患者を選択するために使用されるアッセイのための基礎を形成してもよく、寛容原の影響を測定するために使用することができますクリニックにおけるICの治療法。
概要
固形臓器移植は、腎臓、肝臓、心臓、および肺の末期疾患の患者のケアを形質転換しました。 免疫抑制剤が使用されていない場合はメジャーとマイナー組織適合性抗原での格差に起因して、しかし、同種移植片は、速やかに受信者のT細胞によって拒否されています。これらの薬剤は、癌および臓器不全のリスクを含む多数の副作用を、持っています。主要な臨床目標は、同種移植片拒絶を防止するために必要な最小レベルまで免疫抑制の用量を低下させることです。このレベルは、自然免疫系の活性化の程度に依存して変化する可能性があります。ドナー - 受信者アロ抗原ミスマッチの程度;そして、患者間の免疫機能の違い、薬物動態、および薬力学。
残念ながら、移植臨床医は、正確に個々の患者1にドナー反応性を評価するための任意のツールを持っていません。 ミックス白血球反応(MLR)は、ドナー反応性を検出することができるが、それは確実にグラフト結果2,3を予測することができません。 、限界希釈アッセイ、サイトカインELISPOTS、およびトランスビボアッセイのいずれかが応答の限られた範囲を測定または動作公差9、10、11に関連した4、5、6、7、8つの .Gene発現プロファイルを明らかにした署名は実用的ではありません12及び拒絶13、14、15、これらは常に集団16を横切って一般化されず、最終的に個々の患者に限られた有用性を有していてもよいです。 配列ベースANALYMLR 18における末梢血17または増殖中のT細胞のT細胞受容体(TCR)のSESも開発が、さらなる検証が必要とされています。
概念的には、ドナー抗原によるレシピエントT細胞活性化において最も早く必要なステップを検出するアッセイを有することが望ましいであろう。 アーティファクトを導入することができる(MLRのように)日にわたって細胞を培養するため、そのような試験は、理想的には、このような増殖またはエフェクター機能などの下流の事象の測定を必要としません。テストは純粋に記述的評価から、T細胞機能のいくつかの要素に依存することに等しく、しかし、それはまた、望ましいであろう ( 例えば、TCR配列)はアネルギー性と機能性T細胞を区別することができないかもしれません。
多くの研究は、長期T-APC接触が不可欠である第一の免疫シナプスの形成のために必要とされることが示されていますT細胞応答19、20、21、22のステップ。マウスCD4 + T細胞の10%同種骨髄由来樹状細胞(BMDCを)23との長期的なコンタクトを形成する-私たちは、最近、 インビトロタイムラプス撮影の動的中、約5は、と報告しました。 長時間接触の頻度は、マウスで以前に同じ抗原に対して耐性のに対し、移植片を拒絶した動物において増加し、それは非移植マウス23に見られるレベルに留まりました。 長期の相互作用は、レシピエントTregの存在下で還元し、その非存在下では増加し、我々は、ヒトT細胞および同種異系の単球由来DC(MoDCを)23を使用して同様の現象を観察しました。
しかし、長時間コンタクトの列挙は、ポリクローナルT細胞populatio内で行わNは時間がかかり、労働集約的です。したがって、我々は、画像の使用は、同種免疫シナプス形成を調べるために、フローサイトメトリーを行いました。イメージングフローサイトメトリーは、蛍光顕微鏡の単一細胞イメージング能力を持つ従来のフローサイトメトリーのマルチパラメトリックデータの取得および解析機能を組み込んでいます。この技術は、モノクローナルT細胞24、26、27又はスーパー抗原28の存在下における免疫シナプス形成を研究するために他の研究者によって使用されてきました。アロ反応性T細胞は、一般に、総T細胞レパートリー29、30、31、32の5〜15%を表すと推定されるのに対し、このような設定では、しかし、T細胞応答の頻度は、30から100パーセントの範囲です。重要なことに、我々は、イメージングフローサイトメトリー、AVを生成することができることを示しましたERY匹敵アロ反応性T細胞の頻度23の尺度およびポリクローナルT細胞集団内のシナプス周波数の変化は、グラフト結果23の予測されます。現在、このアプローチは、CD4 + T細胞の直接の同種反応性を測定するために最適化されているが、原理的に、また、CD8 + T細胞および間接的な経路を調べるために開発することができます。間接アロ反応性は、移植後33長い時間でますます関連するようになると考えられています。我々は現在、患者でのテストを可能にするヒト細胞を、使用するには、この方法を開発しています。したがって、将来的には、全体的なアプローチは、移植前に移植レシピエントにおけるT細胞応答の機能評価のために有用であり得ます。すぐに移植した後、そして長期的に、薬剤の最小化が重要な目標となったとき。
プロトコル
1.必要な試薬類を準備します
- 2%ウシ胎児血清(FBS)(「洗浄緩衝液」)を含有するリン酸緩衝生理食塩水(PBS)を調製します。 0.1%の非イオン性界面活性剤を含有する、2%FCSを含むPBSを調製し(「PERM-洗浄緩衝液」を、材料の表を参照のこと)。 1.5%ホルムアルデヒドを含むPBSを準備します。
注:注意!ホルムアルデヒドは、腐食性、潜在的に発癌性であると、適切な個人用保護具を着用したまま処理する必要があります。 - PBSは、磁気細胞分離(「MCSバッファ」)、2%FBSおよび0.5mMエチレンジアミン四酢酸(EDTA)を含有する調製。
- ジメチルスルホキシド(DMSO)中で50μg/ mlのファロイジン - フルオレセインイソチオシアネート(FITCファロイジン)を準備。 1mg / mlの核染色を準備(DMSOまたはビス-ベンズイミド色素で、例えば 1mg / mlの7-アミノアクチノマイシンD(7-AAD);材料の表を参照)をDMSO。目的の細胞のための適切な蛍光色素標識抗体を調製し、イメージングフローサイトメーター。
- 抗原提示細胞または前駆細胞の供給源としてT細胞と同種の動物組織( 例えば、脾臓および骨髄)の供給源として動物組織( 例えば、リンパ節および脾臓)を得ました。
- 細胞培養培地( 例えば、ロズウェルパーク記念研究所培地(RPMI)1640または10%FBSを補充したダルベッコ改変イーグル培地(DMEM))、50μMの2-メルカプトエタノール、ペニシリン、およびストレプトマイシンを準備し得る24および/または96ウェル細胞培養プレート。
2.抗原提示細胞を準備します
注:理論的には、任意のAPC集団はこの方法で調べることができます。未熟マウス骨髄由来樹状細胞(DC)APCは、この場合に訴えられたよう。多くのプロトコルは、(例えば、34および35を参照のこと)、これらの細胞を生成するために存在します。簡単に言えば、以下のプロトコルを使用しました。
- RPMへの大腿骨と脛骨からフラッシュ骨髄I 1640またはDMEM。
- 骨およびデブリの小片を除去するために70μmのセルストレーナーを通して浮遊細胞を渡します。
- 遠心分離により細胞をペレット化し、次いで、室温で5分間塩化アンモニウム緩衝液を用いて赤血球を溶解します。
- 遠心分離(400×gで、5分間)により細胞をペレット化し、細胞ペレットを再懸濁します。
- 遠心分離(400×gで、5分間)によって洗浄緩衝液、ペレットを10mLの、細胞ペレットを再懸濁 - 5で細胞を洗浄します。
- ビオチン化抗CD3(5μg/ mlの)、抗B220(5μg/ mlの)、抗MHCクラスII(を1μg/ mL)で、そして抗CD11bで細胞を標識することによって、細胞分離カラム上造血前駆体を豊か(5μg/ mlの)抗体。
- 遠心分離(400×gで、5分間)により細胞をペレット化し、細胞ペレットを再懸濁。
- 10分間4℃(材料の表を参照)、抗ビオチン磁性マイクロビーズで細胞をインキュベートします。
- 洗浄し、細胞をペレット化(400×gで、5分間)および、suspen再大きな正の選択(LS)磁気細胞分離カラムMCS緩衝液3mLでプライミングされ、その磁石に入れを用いて標識細胞を除去する前に、MCS緩衝液1ml中のDそれら。 MCS緩衝液3mLでカラムを3回洗浄します。フロースルーは、所望の細胞を含有するであろう。
- 培養RPMI 1640またはDMEM中で6日間カラムを通過する細胞は、2 / mlの組換えマウス顆粒球マクロファージコロニー刺激因子(GM-CSF)および2 ngの組換えヒトトランスフォーミング増殖因子β1(TGFβ1)/ mLのを補充しました。 2 NG / mLのGM-CSFおよびTGFβ1を含有する新鮮な完全培地で2日ごとに培地の半分を交換してください。
注:ヒトTGFβ1は、マウスの細胞で活性を有しています。データは、これらの未成熟DCを使用して生成されています。他の細胞( 例えば、B細胞および成熟DC)は、抗原提示細胞として適しているかもしれませんが、このアッセイでテストされていません。 - 90%血清/ 10%DMSO及び液体窒素中店でDCを凍結保存。上の回復使用日。使用する前に、トリパンブルー排除を使用して、血球計数器で実行可能なDCの数を数えます。適切な密度で培養培地中で細胞ペレットを再懸濁部4において使用する前に(ステップ4.1参照)。
3. T細胞を調製
- 細胞への活性化または抑制シグナルを伝達する不注意を避けるために、負の選択方法を使用します。
注:この例では、CD4 + T細胞を、分析のために調製されます。- マウス脾臓からCD4 + T細胞を調製するために、注射器のプランジャーを用いて70ミクロンの細胞ストレーナーを通して脾臓をマッシュ。洗浄バッファーで細胞ストレーナーを洗浄します。
- 遠心分離により懸濁した細胞(400×gで、5分間)をペレット化し、次いで、室温で5分間塩化アンモニウム緩衝液中でペレットを再懸濁することによって赤血球を溶解します。
- 遠心分離(400×gで、5分間)により細胞をペレット化し、ペレットを再懸濁。
- セルを洗います5 S - 遠心分離によって洗浄緩衝液及びペレットを10mL(400×gで、5分間)。ペレットを再懸濁。
- CD8、主要組織適合性複合体クラスII(MHC II、を1μg/ mL)で、およびCD19(5μg/ mlの)に対するビオチン化抗体で細胞を染色します。 4℃で10分間インキュベートします。
- 遠心分離(400×gで、5分間)によって洗浄緩衝液及びペレットを10mLの細胞を洗浄します。ペレットを再懸濁。
- 製造業者の指示に従って抗ビオチン磁性マイクロビーズ(材料の表を参照)で細胞をインキュベートします。
- 遠心分離(400×gで、5分間)によって洗浄緩衝液及びペレットを10mLの細胞を洗浄します。ペレットを再懸濁。
- MCS緩衝液1ml中に細胞を再懸濁し、マグネットで3mLのMCSの緩衝液でプライミング磁気細胞分離カラム上にCD4 + T細胞を濃縮します。 MCS緩衝液3mLでカラムを3回洗浄します。カラムのフロースルーは、濃縮T細胞が含まれています。
- 標準フローcytomeにより、負に選択された細胞のアリコートを使用して、T細胞の純度を評価し、試みます。蛍光色素 - ストレプトアビジンコンジュゲート(カラム上で除去されているはずの任意のビオチン標識された細胞を同定するため)および目的のT細胞集団を同定するための抗体または抗体(この場合はCD4)を用いて細胞を染色。 ≥85%の純度が許容される23です。
- トリパンブルー排除(≥90%の生存率が許容される)によって血球計でT細胞を数えます。
注:MCSバッファは、アッセイの前に削除する必要がありEDTAが含まれています。これを達成するために、遠心分離(400×gで、5分間)により細胞をペレット化し、洗浄緩衝液1mlで洗浄します。再び細胞をペレット化し(400×gで、5分間)し、適切な密度で培養培地中に再懸濁し(ステップ4.1参照)。
- トリパンブルー排除(≥90%の生存率が許容される)によって血球計でT細胞を数えます。
4. T細胞およびDCを共培養
- 1 T:2でシードT細胞およびDCを24ウェルまたは96ウェル細胞培養プレート中のDC比。確認しておいて最終培養容積は≤50024ウェルプレート用μLまたは96ウェルプレート用≤50μLです。
注:小規模なボリュームは、細胞間相互作用を促し、その後の固定バッファ用のスペースを確保します。- 経験的に、正確な細胞数を調整したが、一般的な指針として、1×10 6 T細胞およびウェルあたり0.5×10 6のDC(96ウェルプレート)を使用します。少数の細胞を使用する免疫シナプスの列挙が難しくなるため、これらは、細胞の最小数の考慮されるべきです。
- 細胞数を増やすには、ステップ5(固定) した後、複製ウェルとプールを設定。
注:複製ウェルをセットアップするとき、すべてのウェルで全てのウェルで最初にしてシードT細胞を樹状細胞に接種することをお勧めします。これは、ウェル間のインキュベーション時間の矛盾を最小限に抑えます。
- 細胞数を増やすには、ステップ5(固定) した後、複製ウェルとプールを設定。
- 経験的に、正確な細胞数を調整したが、一般的な指針として、1×10 6 T細胞およびウェルあたり0.5×10 6のDC(96ウェルプレート)を使用します。少数の細胞を使用する免疫シナプスの列挙が難しくなるため、これらは、細胞の最小数の考慮されるべきです。
- 5%CO 2雰囲気中、37℃で4時間、プレートをインキュベートします。
- 各ウェルにPBS中の1.5%ホルムアルデヒドの3回の培養体積を追加し、室温で30分間インキュベートします。 TTは、細胞 - 細胞相互作用の破壊を最小限にするために前板からそれらを除去する細胞を固定することが重要です。
- その後の洗浄および染色のためにチューブにプレートに細胞を移します。この段階では、単一の染色コントロールの追加の細胞を取っておきます。離れてこれらのコントロールから、全培養は、抗体カクテル(ステップ4.1.1を参照)で染色されるべきです。
6.染色細胞
- 室温で30分間、所望の蛍光標識抗体のカクテルを含有する洗浄緩衝液100μlで染色細胞は、光から保護しました。
注:カクテルは、T細胞特異的およびAPC特異的抗体が含まれます。蛍光色素は、それらがイメージングフローサイトメータの構成を使用して区別することができるように選択されるべきです。トンでここに示されている彼の実験、青色蛍光団共役CD11bおよびAPC共役CD90.2(5μg/ mlの)を使用した(5μg/ mlのは、材料の表を参照のこと)。 - 400×gで5分間、洗浄緩衝液及び遠心1mLに細胞を洗浄します。 上清をデカントします。 0.05~0.5μgの/ mLでファロイジンFITC含有PERM-洗浄緩衝液中で細胞を再懸濁し、光から保護し、室温で30分間インキュベートします。
注:約0.1μg/ mLでのファロイジンFITC濃度はマウス細胞ではうまく機能するが、適切な濃度は、サプライヤ、細胞タイプによって異なり、及びイメージングフローサイトメーターが期待されます。 - 400×gで5分間PERM /洗浄緩衝液および遠心1mLに細胞を洗浄します。上清をデカントします。適切な濃度の核染料( 例えば、約25 / mlの7-AAD)を含むPERM /洗浄緩衝液中で細胞を再懸濁し、光から保護し、室温で30分間インキュベートします。
- セルを洗います400×gで5分間PERM /洗浄緩衝液および遠心1mL中のS。上清をデカントします。洗浄緩衝液、ペレットに細胞を1回洗浄し、50に再サスペンド - 小、キャップされたマイクロ遠心チューブに細胞を移す、洗浄緩衝液100μL。
- 直ちにデータ収集に進むまたはフローサイトメーター撮像前に取得に数日間まで光から保護し、4℃で細胞を保存します。
注:細胞が正常に7日間まで、このように格納されています。長期保存が可能かもしれないが、テストされていません。
7.獲得データ
- 製造元の指示に従ってイメージングフローサイトメーターを初期化して設定します。任意のデータを収集する前にフローコアの安定性を確保します。
- 明視野画像取得のための1つのチャネルを予約。明視野チャンネルがオフで単染色制御データを取得します。
- 「ロード」ボタンとinseをクリックしてください完全に染色された試料ホルダーに(必要なすべての蛍光色素で染色された試料)を含有するチューブを室温。
- 「ワークスペース」ウィンドウで、選択してアスペクト比が1に近いある領域とゲートシングレット上アスペクト比を有する新たな散布図を作成し(横軸におけるチャネルの強度)に使用される各チャネルのための新しい散布図を作成します。
- 各蛍光色素について、陽性集団をチェックし、必要であれば、「イルミネーション」ボックスにレーザー電圧を調整します。
- チューブをアンロードし、初のシングル染色されたチューブをロードします。
- 「取得設定」ボックスで、サンプル名を入力し、収集されなければならないイベントの数を設定します。それは(補償制御のための)単一の染色である場合1,000 - 2,000イベントが十分です。
- 「チャンネル」ボックスで、各サンプルを用いて染色されたチャンネルを選択します。シングルステインコントロールの場合、すべてのチャネルがbrightfで選択する必要がありますieldおよび側方散乱オフ。 「取得」ボックスの下に「録音」ボタンをクリックします。イベントの数が指定されたしきい値に達した場合、買収は自動的に停止します。
- チューブをアンロードするために「戻る」ボタンをクリックしてください。各単一染色制御用7.2.6 - を繰り返して、7.2.4を繰り返します。サイトメーターおよびソフトウェアに応じて、取得中、図1に示したゲートの全て設定することはできないかもしれない(より正確なゲーティングは、分析中に実行されると、セクション8を参照します)。
- (ステップ7.2)で単染色した試料の場合と同様のサンプルを取得するが、「チャネル」ボックスに、明視野チャネルを含む必要なすべてのチャネルを選択。
- データを記録する前に、チャネル強度が所望の細胞集団を同定するための適切であることを確認するチェック。そうでない場合、ステップ7.2で説明したように、レーザー設定と新しい設定を使用して再記録単染色コントロールを調整します。
- それぞれについて、サンプルは、数十のイベントの何千ものを取得します。
注:ほとんどの条件下では、細胞-細胞接触イベントは、総細胞数(ほとんどは単一細胞である)の少数派です。一般的には、最終的な膜のコンタクトゲート少なくとも100個の事象を有することが望ましいです。
8.データの分析
- (;材料の表を参照してくださいユーザーアカウントが作成されなければならない)、製造元のWebサイトから無料で入手可能な分析ソフトウェアを使用してサイトメータイメージングフローに取得したデータを分析します。
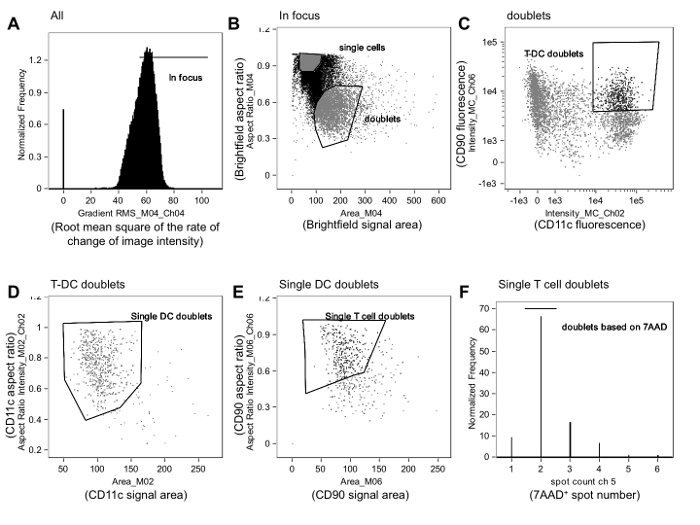
図1のゲーティング戦略は、アロ反応性免疫シナプスを識別するために使用されます。イベントがルートに基づいて、細胞画像を確認して、すべてのイベントからのゲートされる合焦A.を明ちゃんを用いた画像強度プロファイル(勾配RMS)の変化率の二乗平均しますNEL(チャンネル4、CH04)、テキストに記載されているように。 B.を合焦イベントのうち、ダブレットは、明視野チャンネルのための領域に対するアスペクト比をプロットすることによって単一の細胞から区別されます。ダブレットが0.5に近い、より大きな面積を有しながら、単セルは、密接1のアスペクト比をクラスター化し、より小さい面積を有しています。 C。 APCの蛍光強度は(この場合には、樹状細胞(DC)マーカー、のCD11c)を(この場合、CD90.2)T細胞マーカーの蛍光強度に対してプロットされ、そして二重陽性事象がゲートされます。ゲートの国境は、国境近くのイベントの画像をレビューすることによって洗練することができます。それらはAPCマーカー(CD11cの、CH02)の面積に対する縦横比をプロットすることによってのみAPCを含むようD. T-APCダブレットは、その後、精製されています。彼らはエリアに対するアスペクト比をプロットすることによってのみつのT細胞を含むようにE.これらの単-APCダブレットは、その後、精製されT細胞マーカーの(CD90.2、CH06)。 F.最後に 、唯一の2つの核を含むイベントは、わずか2 7-AAD陽性スポット( すなわち、核)を含有し、イベントを核染色チャンネル(7-AAD、Ch05)上のスポット数のヒストグラムをプロットし、ゲーティングすることによって選択されています。 図2で説明したように、このゲートのイベントは、膜接触およびシナプス形成のために分析されます。データは、処置割り当てに対して盲検で分析し、以前に公開された実験23からのものであるしました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
注:ゲーティング戦略は、このセクションに記載されており、 図1に示されています。サイトメトリーデータの撮像フローの分析は、治療割り当てに関して盲検様式で行われるべきです。我々は、免疫シナプスと非synaptiと信じていますが、C接点(下記参照及び2及び3 図 )、画像解析に固有の主観性に起因するバイアスを最小限に抑えるべきであるブラインド一般に容易に区別されます。
- 補償ウィザードにシングルステインコントロール・データ・ファイルをロードすることによって補償行列を生成します。単一染色ファイルをロードした後、実験に使用される蛍光のチャンネルを選択します。
注:ソフトウェアが自動的に補償行列を生成し、これは、手動で正しい正の集団を選択したことを確認するために検証する必要があります。- 行列の値をダブルクリックして、解析領域にグラフを追加します。必要に応じて、任意の死細胞/二重/偽陽性を除外するために、新たなゲートを作成します。この新しい洗練された陽性集団は、各チャネルのドロップダウンメニューで、マトリックスボックスで選択することができます。
- 各チャンネルのためにこれを繰り返します。 compensatioを保存するために「完了」をクリックします。N行列(.ctmファイル)。
- 解析ソフトウェアに.rifファイルをロードし、補償マトリックスを適用することにより、RAWファイル(.rif)からデータ解析ファイル(.daf)を得ました。
- データがロードされると、T細胞APCの接触イベントを識別するためにゲーティング行います。
注:典型的なゲーティング戦略は、インフォーカスイベントを識別するサイズ条件(イベントのアスペクト比対面積)に基づいて、二重に選択し、T細胞のための二重陽性である事象としてT細胞APCダブレットを選択することを含むとAPCマーカー( 図1A-C)。
注:アスペクト比がダブレット(0.5に近い比)からの単一細胞(1に近い比)の識別を可能にする、その高さにイベントの幅の比です。 - 明視野チャンネル( 図1A)の撮像強度プロファイル(勾配RMS)の変化率の二乗平均平方根をプロットすることによりインフォーカスイベント識別。目をクリックします電子勾配RMSヒストグラムは、個々のビン内の細胞のイベントを表示し、焦点外のイベントを除くゲートを配置します。
- 明視野チャンネルのアスペクト比対面積をプロットし、イベントの形状と大きさ( 図1B)に基づくダブレットを特定ゲートを描きます。ちょうどこのゲートの境界線の内側と外側のイベントの画像の見直しは、ゲートのサイズと位置を調整するために、アナリストを助けることができます。次いで、T細胞マーカーの強度が一つの軸に表示され、APCマーカーの強度が他の上に表示されるこれらのダブレットイベントのプロットを構築します。両方のマーカーについて陽性の事象を含むT-APCの二重ゲートを描きます。
- T細胞APCダブレットイベントのみ1 T細胞と1 APCを含んで、選択したイベントの中で。
- APCマーカーのための領域に対するアスペクト比をプロットすることによって単一のAPC( 図1D)を含む二重にゲーティングすることによってこれを行います。 T細胞のマークのための領域に対するアスペクト比をプロット単一のT細胞( 図1E)を含む二重にERおよびゲート。
注:唯一の2つのスポット( 図1F)のイベントに核染色蛍光およびゲーティングに適用されるようにさらなる改良がスポットカウント機能のヒストグラムをプロットすることによって達成することができます。
- APCマーカーのための領域に対するアスペクト比をプロットすることによって単一のAPC( 図1D)を含む二重にゲーティングすることによってこれを行います。 T細胞のマークのための領域に対するアスペクト比をプロット単一のT細胞( 図1E)を含む二重にERおよびゲート。
- いくつかの場合において、ダブレット内の二つのセルは接触することはないであろう。互いに接触した細胞を同定するために、APCおよびT細胞のオブジェクトマスクを定義します。
- マスクマネージャを開き、新しいマスクを定義するにはAnalysisメニューで「マスク」オプションを使用します。 など、名前を入力し、「T細胞オブジェクトマスク」。 「機能」ボタンをクリックすると、ダイアログボックスで、選択した「オブジェクトを。」
- T細胞マーカーが検出されたチャネル( 例えば、CH06)を選択します。 "OK" をクリックします。
注:「オブジェクト(M06、CH06、タイト)は、」関数のボックスに表示されます。このデフォルトのオブジェクトマスク通常WORうまくKSしかし、最適化が必要な場合があります。 - 適切なチャネルでのAPCのオブジェクトマスクを作成するには、このプロセスを繰り返します。
- APCおよびT細胞のマスクを識別した後、T細胞オブジェクトマスクにおけるAPCの蛍光強度に対するAPCのオブジェクトマスクのT細胞マーカーの蛍光強度をプロットすることにより膜接触を決定します。このプロットでは、互いに接触している細胞のみを含んでゲートを描きます。
注:典型的には、かなり明確な二重陽性および二重陰性集団( 図2A)があります。 正二重および二重陰性集団の間の境界は、接触している細胞は、ゲート内と接触している細胞ではないが除外されていることであることを保証するために、境界領域内の細胞の明視野画像を確認して設定することができます。 - この段階では、手動でシンプルな細胞 - 細胞接触から成熟した免疫シナプスを区別するために、このゲート内のイベントのファロイジンFITC画像を確認します。 Uこれらの画像をマークする「タグ画像」機能をSE。
注:このゲート内のタグ付けされたイベント(免疫シナプス)の割合は、研究されたT細胞集団で直接アロ反応性の指標として使用することができます。
結果
この方法は、異所心臓同種移植片の移植の前にドナー同種抗原に対して耐性マウスにおいてCD4 + T細胞の同種反応性を調べるために使用しました。 CBAマウス(H-2 k)は B6心臓移植を受ける前に、非消失性CD4抗体一月組み合わせるドナー特異的(B6、H-2 b)は、輸血からなる寛容化プロトコルを与えられました。 Foxp3 +制御性T細胞36,37に依存し、長期同種移植片生存におけるこのプロトコルの結果。七日後の移植は、このプロトコルに従って、脾臓CD4 + T細胞をB6、心臓同種移植片の寛容化および非寛容化レシピエントから入手し、B6骨髄由来DCと共培養しました。 図2は、この実験からの代表的データを示します。膜接触ゲートは、 図2に示されていますシナプス事象(左のパネル、1)上および非シナプス事象(右パネル)上に配置された緑色の十字線と、。 図2Bは 、このイベントのために明視野と蛍光チャネルを示しています。バイアスを低減するために、データは、治療割当23に盲検観察者によって分析しました。非寛容化の両方から、 図3のいくつかの例に示すように ( 図3A-B)及び寛容化( 図3C-D)B6心臓のCBAレシピエントは、シナプスは、T-APC界面における緻密FITC陽性リッジの存在によって非シナプス連絡先から容易に区別されます。これらの結果は、レシピエントT細胞によって作られた免疫シナプスの視覚的検出は、レシピエントにおける同種反応性の程度で追跡することを示します。
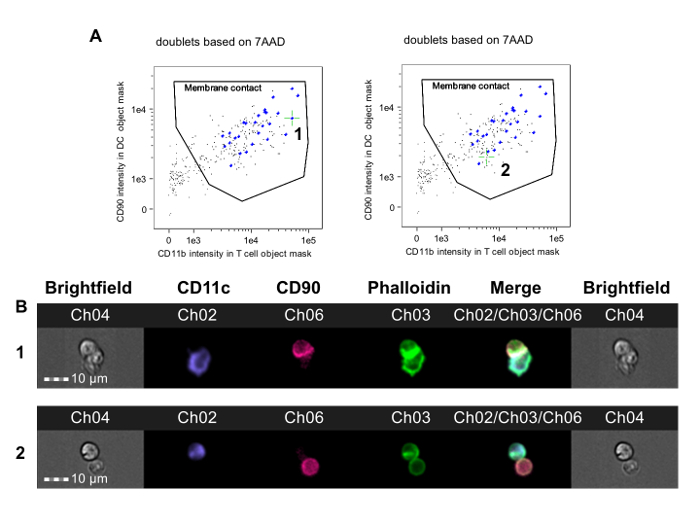
メンブレンT-APCダブレットの図2同定連絡先と免疫シナプス形成。最終の二重ゲート( 図1F)内のイベントが分析されます。 APCオブジェクトマスクのA. T細胞マーカーの蛍光は、DCオブジェクトマスクにおけるAPCマーカー蛍光に対してプロットされています。 いくつかの二重事象は、細胞 - 細胞接触なしAPCとT細胞を有しており、プロットの左下隅に表示される(画像が示されていません)。膜接触ゲートは、このようにT細胞及びAPCは接触しているだけダブレットを含むことを描くことができます。このゲート内の各イベントの画像は、ファロイジン-FITCチャネルにおけるアクチン細胞骨格再編成の証拠について検討されると解析ソフトウェアを使用してタグ付けすることができます。右のパネルは、免疫シナプスの形成(2標識と緑十字線で示される)ことなく、膜接触事象を示し、一方、左のパネルは、免疫シナプス事象(1標識と緑十字線で示す)を示しています。シナプス形成の決意は、これらの手動審査を要求します画像、B. B.に示す一番上の行は、免疫シナプスとダブレットのために明視野と蛍光チャネル画像を示す(Aのイベント1に相当します)。下の行は、膜接触とダブレットを示しているが、シナプス形成(Aにおけるイベント2に相当する)を欠きます。データは、処置割り当てに対して盲検で分析し、以前に公開された実験23からのものであるしました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
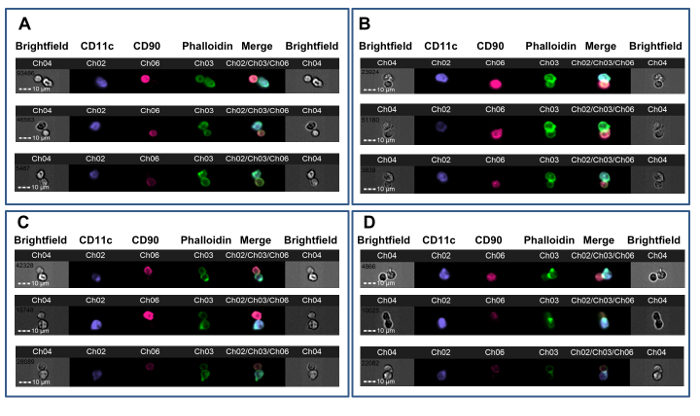
T-APCシナプス形成の3例を図。 CBAマウス(非消失性抗CD4抗体のカバーの下にない前処理(AB)のいずれかの後またはB6全血と寛容誘導後B6ドナーからの心臓同種移植片を受け栄> CD)。 7日後、脾臓CD4 + T細胞をB6 DCとシナプス形成について試験しました。 A.非寛容化動物からの膜接触と非シナプスダブレットの3例。 B.非寛容化動物から免疫シナプスの三つの例。 C.寛容化動物からの膜の接触と非シナプスダブレットの三つの例。 D.寛容化動物から免疫シナプスの三つの例。シナプス形成は、T-APC界面で明るい、FITC陽性リッジ(CH03)の存在によって示されます。データは、処置割り当てに対して盲検で分析し、以前に公開された実験23からのものであるしました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
表1抗体および本研究で用いた染料。蛍光標識抗体、染料、サプライヤ、および推奨濃度は表に示されています。各蛍光色素を検出するために使用されたチャネルサイトメータ撮像流れも表に示されています。
ディスカッション
イメージングフローサイトメトリー、モノクローナルT細胞およびAPCの間、またはスーパー抗原24、25、26、27、28の存在下における免疫シナプス形成を実証するために使用されてきました。この方法は、生産的T細胞APCの接触後、T細胞は、コンタクト21の部位に向かって偏光、そのアクチン細胞骨格を再配置するという事実を利用します。この再配置は、TCRシグナル伝達なしに発生せず、それゆえT細胞活性化19、20、21の初期の相関です。ここで提示された方法は、ポリクローナルT細胞集団におけるアロ反応性T細胞の頻度の測定にこのアプローチを適応させます。このように、将来的には、ドナーのためのアッセイの開発のための基礎として役立ち得るreactivi臨床移植におけるTY。
直接の比較はまだなされていないが、アロ反応性免疫シナプスの検出は、従来のMLRよりも優れた予測力を持っているように見えます。例えば、以前の研究は、上記の寛容化プロトコールにおいて、MLRの結果を確実に移植転帰2と相関しない、ことを示しています。
これらは、アロ抗原に反応してエフェクター細胞機能を測定しないがアッセイの数は、11、10、ヒト9に運用寛容状態のために開発されています。 対照的に、IFNγELISPOTは、IL-17 38のように、8小節エフェクターT細胞機能のアッセイが、急性および慢性同種移植片拒絶反応に関連し得るサイトカイン分泌の全スペクトルを捕捉することができません> 39。 労働集約的であり、限界希釈アッセイ4、およびマウスを必要とトランスビボアッセイ 6は 、臨床現場での適用を妨げる重大な実用上の制限があります。 MLRにおける応答T細胞のTCR配列解析を用いて細胞増殖の分析に関する最近の改良は価値があるかもしれませんが、ここで示したアッセイのように、臨床研究におけるさらなる検証18、40が必要になります。
免疫シナプス検出アッセイのさらなる開発は重要な質問の数が回答されている必要があります。まず、開発されたようアッセイは、唯一の直接同種反応性を測定します。直接経路は、ドナー由来のAPC上の同種MHC /ペプチド複合体のプレゼンテーションを伴います。後者は、一般に移植後速やかに除去し、さらに同種抗原提示はCARRIあるれますそのままのドナーMHC(半直接経路)または自己MHC(間接経路)に加工し、ドナー抗原を提示し、受信者のAPCによって編。間接的な経路は、慢性同種移植片拒絶反応33、41の重要なドライバです。
原理的には、このアッセイを用いた間接免疫シナプスを検出することが可能でなければなりませんが、間接的アロ反応性T細胞は、イベントのより多くの分析が必要とされることを意味し、直接的なもの42、43よりもはるかに低い周波数を有します。第二の考慮事項は、CD8 + T細胞はまた、抗ドナー応答の重要な構成要素であるのに対し、我々は唯一の、CD4 + T細胞を用いてこのアッセイを試験していることです。再び、この方法を用いてCD8 + T細胞APCシナプスを検出することが可能であるべきです。別の制限は、この方法は、最終MEMBにおける細胞画像のマニュアルレビューおよび分析を必要とすることですRANEコンタクトゲート、そして我々は現在、このステップの自動化に取り組んでいます。
最後に、この方法は、ヒト被験者でのテストと開発を必要とし、ヒトサンプルとの予備的研究が現在行われています。移植レシピエントにおける免疫シナプスの検出と組み合わせて、さらなる表現型のT細胞サブセットの分析( すなわち 、エフェクター、メモリ、調節など )アロ反応性T細胞レパートリーを特徴付けるための強力なアプローチを表すことになるとのための重要な焦点です。今後の課題。
開示事項
著者は、開示することは何もありません。
謝辞
SCJはFellowship.SM旅行国際心肺移植研究員と医師のロイヤル・カレッジ・オブ協会とカナダDetweilerの外科医によって支持された心と(SCJ)は肺移植キャリア開発賞のための国際協会によって部分的にサポートされていました。 SSは、ヘルスリサーチをOxford Biomedical研究Centre.JHの国立研究所によってサポートされていました腎臓リサーチUK上級非臨床フェローシップの受け手です。ウェルカムトラストプログラム・グラント(082519Z07Z)、英国心臓財団プログラム・グラント(PG / 10 / 62.28504)、およびEUフレームワーク計画7(; BioDRIM ONE研究):この作品は、ABとKWに以下の助成金によって賄われていました。著者は、のImageStreamマークXの機器とへのアクセスとサポートを提供するためのマイケル・パーソンズとフローサイトメトリーコア施設Lunenfeld-タネンバウム研究所で、シナイ医療システム、トロントに感謝したいです。
資料
| Name | Company | Catalog Number | Comments |
| Phosphate-buffered saline | Various | Varies | |
| Ethylenediamenetetraacetic acid, 0.5 M solution | Thermo Fisher Scientific | AM9260G | |
| Triton X-100 nonionic detergent | Sigma-Aldrich | X100 | |
| Beta-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D8418 | |
| Formaldehyde | Sigma-Aldrich | F1635 | Solution is 37% formaldehyde and so must be diluted 25 times for 1.5% solution |
| Cell strainers, 70 μm pore size | Fisher Scientific | 08-771-2 | |
| Phalloidin-fluorescein isothiocyanate | Sigma-Aldrich | P5282 | |
| 7-aminoactinomycin D | Thermo Fisher Scientific | A1310 | Reconstitute in DMSO |
| Allophycocyanin-conjugated anti-mouse CD90.2 | eBioscience | 17-0902 | |
| Pacific blue-conjugated anti-mouse CD11b | eBioscience | 48-0112 | Pacific blue has been replaced by eFluor 450 |
| Biotinylated anti-mouse CD3 | eBioscience | 13-0032 | |
| Biotinylated anti-mouse MHC class II | eBioscience | 13-5321 | |
| Biotinylated anti-mouse B220 | eBioscience | 13-0452 | |
| Biotinylated anti-mouse CD8 | eBioscience | 13-0081 | |
| Biotinylated anti-mouse CD19 | eBioscience | 13-0193 | |
| Anti-biotin microbeads | Miltenyi Biotec | 130-090-485 | |
| LS columns | Miltenyi Biotec | 130-042-401 | |
| MidiMACS magnetic cell separator | MIltenyi Biotec | 130-042-302 | |
| recombinant mouse GM-CSF | Peprotech | 315-03 | |
| recombinant human TGFβ1 | Peprotech | 100-21 | Human TGFβ1 has activity on mouse cells |
| Amnis ImageStream X Mark II | Amnis/EMD Millipore | N/A | Imaging flow cytometer; details available at http://www.emdmillipore.com/ |
| IDEAS Software | Amnis/EMD Millipore | N/A | Free download (registration required): https://www.amnis.com/index.php/page/Display/login%20%20 |
| Cell culture medium | Various | Varies | |
| Fetal bovine serum | Various | Varies | |
| Cell culture plates | Various | Varies |
参考文献
- Cravedi, P., Heeger, P. S. Immunologic monitoring in transplantation revisited. Curr Opin Organ Transplant. 17 (1), 26-32 (2012).
- Pearson, T. C., et al. The assessment of transplantation tolerance induced by anti-CD4 monoclonal antibody in the murine model. Transplantation. 55 (2), 361-367 (1993).
- Strober, S., Benike, C., Krishnaswamy, S., Engleman, E. G., Grumet, F. C. Clinical transplantation tolerance twelve years after prospective withdrawal of immunosuppressive drugs: studies of chimerism and anti-donor reactivity. Transplantation. 69 (8), 1549-1554 (2000).
- Fussell, S. T., Donnellan, M., Cooley, M. A., Farrell, C. Cytotoxic T lymphocyte precursor frequency does not correlate with either the incidence or severity of graft-versus-host disease after matched unrelated donor bone marrow transplantation. Transplantation. 57 (5), 673-676 (1994).
- Roelen, D. L., et al. Relevance of cytotoxic alloreactivity under different immunosuppressive regimens in clinical islet cell transplantation. Clin Exp Immunol. 156 (1), 141-148 (2009).
- VanBuskirk, A. M., et al. Human allograft acceptance is associated with immune regulation. J Clin Invest. 106 (1), 145-155 (2000).
- Poggio, E. D., Clemente, M., Hricik, D. E., Heeger, P. S. Panel of reactive T cells as a measurement of primed cellular alloimmunity in kidney transplant candidates. J Am Soc Nephrol. 17 (2), 564-572 (2006).
- Zitzner, J. R., Tambur, A. R. Role of ELISPOT Assays in Risk Assessment Pre- and Post-Kidney Transplantation. Cells. 1 (2), 100-110 (2012).
- Newell, K. A., et al. Identification of a B cell signature associated with renal transplant tolerance in humans. J Clin Invest. 120 (6), 1836-1847 (2010).
- Brouard, S., et al. Identification of a peripheral blood transcriptional biomarker panel associated with operational renal allograft tolerance. Proc Natl Acad Sci U S A. 104 (39), 15448-15453 (2007).
- Sagoo, P., et al. Development of a cross-platform biomarker signature to detect renal transplant tolerance in humans. J Clin Invest. 120 (6), 1848-1861 (2010).
- Halloran, P. F., Famulski, K. S., Reeve, J. Molecular assessment of disease states in kidney transplant biopsy samples. Nat Rev Nephrol. 12 (9), 534-548 (2016).
- Li, L., et al. Identification of common blood gene signatures for the diagnosis of renal and cardiac acute allograft rejection. PLoS One. 8 (12), e82153(2013).
- Khatri, P., et al. A common rejection module (CRM) for acute rejection across multiple organs identifies novel therapeutics for organ transplantation. J Exp Med. 210 (11), 2205-2221 (2013).
- Halloran, P. F., et al. Microarray diagnosis of antibody-mediated rejection in kidney transplant biopsies: an international prospective study (INTERCOM). Am J Transplant. 13 (11), 2865-2874 (2013).
- Mastoridis, S., Issa, F., Wood, K. J. Novel biomarkers and functional assays to monitor cell-therapy-induced tolerance in organ transplantation. Curr Opin Organ Transplant. 20 (1), 64-71 (2015).
- Miqueu, P., et al. Analysis of the peripheral T-cell repertoire in kidney transplant patients. Eur J Immunol. 40 (11), 3280-3290 (2010).
- Morris, H., et al. Tracking donor-reactive T cells: Evidence for clonal deletion in tolerant kidney transplant patients. Sci Transl Med. 7 (272), 272ra210(2015).
- Dustin, M. L., Bromley, S. K., Kan, Z., Peterson, D. A., Unanue, E. R. Antigen receptor engagement delivers a stop signal to migrating T lymphocytes. Proc Natl Acad Sci U S A. 94 (8), 3909-3913 (1997).
- Goldsmith, M. A., Weiss, A. Early signal transduction by the antigen receptor without commitment to T cell activation. Science. 240 (4855), 1029-1031 (1988).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Stoll, S., Delon, J., Brotz, T. M., Germain, R. N. Dynamic imaging of T cell-dendritic cell interactions in lymph nodes. Science. 296 (5574), 1873-1876 (2002).
- Juvet, S. C., Sanderson, S., Hester, J., Wood, K. J., Bushell, A. Quantification of CD4(+) T Cell Alloreactivity and Its Control by Regulatory T Cells Using Time-Lapse Microscopy and Immune Synapse Detection. Am J Transplant. 16 (5), 1394-1407 (2016).
- Ahmed, F., Friend, S., George, T. C., Barteneva, N., Lieberman, J. Numbers matter: quantitative and dynamic analysis of the formation of an immunological synapse using imaging flow cytometry. J Immunol Methods. 347 (1-2), 79-86 (2009).
- Burbach, B. J., et al. Distinct regulation of integrin-dependent T cell conjugate formation and NF-kappa B activation by the adapter protein ADAP. J Immunol. 181 (7), 4840-4851 (2008).
- Markey, K. A., et al. Cross-dressing by donor dendritic cells after allogeneic bone marrow transplantation contributes to formation of the immunological synapse and maximizes responses to indirectly presented antigen. J Immunol. 192 (11), 5426-5433 (2014).
- Moreau, H. D., et al. Dynamic in situ cytometry uncovers T cell receptor signaling during immunological synapses and kinapses in vivo. Immunity. 37 (2), 351-363 (2012).
- Wabnitz, G. H., Nessmann, A., Kirchgessner, H., Samstag, Y. InFlow microscopy of human leukocytes: A tool for quantitative analysis of actin rearrangements in the immune synapse. J Immunol Methods. , (2015).
- Ford, W. L., Simmonds, S. J., Atkins, R. C. Early cellular events in a systemic graft-vs.-host reaction. II. Autoradiographic estimates of the frequency of donor lymphocytes which respond to each Ag-B-determined antigenic complex. J Exp Med. 141 (3), 681-696 (1975).
- Macedo, C., et al. Contribution of naive and memory T-cell populations to the human alloimmune response. Am J Transplant. 9 (9), 2057-2066 (2009).
- Noorchashm, H., et al. A direct method for the calculation of alloreactive CD4+ T cell precursor frequency. Transplantation. 67 (9), 1281-1284 (1999).
- Suchin, E. J., et al. Quantifying the frequency of alloreactive T cells in vivo: new answers to an old question. J Immunol. 166 (2), 973-981 (2001).
- Lee, R. S., et al. Indirect recognition of allopeptides promotes the development of cardiac allograft vasculopathy. Proc Natl Acad Sci U S A. 98 (6), 3276-3281 (2001).
- Pickl, W. F., et al. Molecular and functional characteristics of dendritic cells generated from highly purified CD14+ peripheral blood monocytes. J Immunol. 157 (9), 3850-3859 (1996).
- Inaba, K., et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med. 176 (6), 1693-1702 (1992).
- Francis, R. S., et al. Induction of transplantation tolerance converts potential effector T cells into graft-protective regulatory T cells. Eur J Immunol. 41 (3), 726-738 (2011).
- Saitovitch, D., Bushell, A., Mabbs, D. W., Morris, P. J., Wood, K. J. Kinetics of induction of transplantation tolerance with a nondepleting anti-Cd4 monoclonal antibody and donor-specific transfusion before transplantation. A critical period of time is required for development of immunological unresponsiveness. Transplantation. 61 (11), 1642-1647 (1996).
- Faust, S. M., et al. Role of T cell TGFbeta signaling and IL-17 in allograft acceptance and fibrosis associated with chronic rejection. J Immunol. 183 (11), 7297-7306 (2009).
- Yuan, X., et al. A novel role of CD4 Th17 cells in mediating cardiac allograft rejection and vasculopathy. J Exp Med. 205 (13), 3133-3144 (2008).
- Emerson, R. O., Mathew, J. M., Konieczna, I. M., Robins, H. S., Leventhal, J. R. Defining the alloreactive T cell repertoire using high-throughput sequencing of mixed lymphocyte reaction culture. PLoS One. 9 (11), e111943(2014).
- Stanford, R. E., Ahmed, S., Hodson, M., Banner, N. R., Rose, M. L. A role for indirect allorecognition in lung transplant recipients with obliterative bronchiolitis. Am J Transplant. 3 (6), 736-742 (2003).
- Benichou, G., Valujskikh, A., Heeger, P. S. Contributions of direct and indirect T cell alloreactivity during allograft rejection in mice. J Immunol. 162 (1), 352-358 (1999).
- Liu, Z., et al. Contribution of direct and indirect recognition pathways to T cell alloreactivity. J Exp Med. 177 (6), 1643-1650 (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved