このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
相対力、抗 TNF モノクローナル抗体 (mAb) 中和体外生物分析法を用いた TNF によって測定
要約
中和機構を用いた WEHI 164 細胞抗 TNF モノクローナル抗体の相対的な抗アポトーシス活性測定のためのプロトコルを次に示します。このプロトコルは同じ生物学的機能を持つ異なる分子の中和力を比較するのに役立ちます。
要約
このプロトコルは、抗 tnf α モノクローナル抗体を用いたマウス線維芽細胞細胞モデル (WEHI 164) における tnf α のアポトーシス活性中和の測定を示しています。さらに、このプロトコルは、融合蛋白質などの他の抗 tnf α 分子を評価に使用できます。ここで採用されている携帯電話のモデルは、追加のストレス因子が細胞培養条件 (例えば、血清剥奪) に誘導される tnf α によるアポトーシスに敏感です。この手順に関する試料調製、セル希釈、アポトーシス誘導、吸光光度測定結果をお約束する重要なキー操作を強調表示、この分析法を実行する方法を例示しています。このプロトコルでは、アポトーシス誘導および記録、低い不確かさの値につながる効率的な信号に関するベスト パフォーマンス条件を明らかにします。
概要
生物学的効力量 (質量で表される) は蛋白質の物理化学的測定に対し関連する生物学的特性にリンクされている製品の試金される属性に基づいて生物学的活性の定量的な尺度であります。他の分析方法論とともに、効力テストは、製品の適合性、安定性、および比較研究の一部として実行されます。この意味で、効力の測定、製品バッチと市場承認後臨床試験のすべての段階において重要な品質属性 (CQAs) または承認基準を満たすことを実証する使用されます。
アポトーシスはプログラムされた細胞死、細胞は、ウイルスや環境によってセルを強調しているときに感染しているときに自然に発生する要因その妥協細胞生存率と機能1,2。とりわけ、アポトーシス抑制、または生物学的中和です免疫炎症性疾患などの慢性疾患の治療を中心に、Mab の主知られている治療上のメカニズムの一つ抗 TNF 分子は p55 と p75 細胞表面の受容器3、最後に細胞をアポトーシスに導く信号経路を防ぐと腫瘍壊死因子アルファ (tnf α) の相互作用をブロックすることによってその治療特性を発揮します。
Tnf α はいくつかの慢性的な病気の4の炎症を引き起こすことができます。Tnf α は自然免疫系と疾患5のこの種の主な俳優の歩哨であるマクロファージから分泌される細胞外の環境にも。共通パスとして tnf α の規制緩和は、これらの病気の病因に関連付けられます。制御なしと一定の誘導と細胞ストレスの下では、tnf α は関節リウマチ、クローン病、その他の病理組織学的プロファイル6に繋がる細胞死と組織の変性を誘導します。
TNF とその受容体の相互作用をブロックする TNF 拮抗薬は、症状を軽減し、これらの疾患の進行を妨げるの効果的な療法としてますます使用されています。今日では、抗 TNF 製剤、広く全身さらに関与する組織の変性を防ぐ、このサイトカイン濃度を制御する使用されます。この意味で、薬の生物学的効果を達成するために特定の能力を記述するため再現性と堅牢な生物検定法を提供することが不可欠です。
中和アッセイの開発中にステップで識別されるこの議定書、クリティカルで-生物学的効力の測定に成功は強調表示されます、バイオ分析メソッドを実行するために必要なスキルに重点。このバイオ分析法は、医薬品の臨床試験済みの標準物質と比較されたとき異なるバッチまたは抗 TNF の間有用な比較情報を提供します。
プロトコル
1 ですメディアとソリューションの準備
- 培養液の準備: 10% RPMI 1640 FBS、pH 7.4。 。
- 準備アッセイ培: RPMI 1640 フェノールレッドなく 1 %fbs、pH 7.4 。
- セル洗浄ソリューションを準備: 0.02 %edta、pH 7.4 DPBS Mg と Ca 無料ソリューションです 。
- 細胞剥離液の準備: 1 mm EDTA 0.125% トリプシン。
- 100 mL のトリプシン-EDTA と滅菌 500 mL フラスコへの転送の 0.25% 溶液を解凍 。 100 ml のセルの
- ミックスは、ソリューションを洗って 15 ml を 15 mL 滅菌チューブに分注します。使用するまで-80 ° C に-70 で店 。
- 0.22 μ m 膜を介してこれらのソリューションをフィルター処理し、使用前に少なくとも 30 分間、37 ° C の暖かい 。
- アポトーシス誘導原液 3.3 μ G/ml で tnf α ソリューションを準備します。
- プライマリ コンテナーで完全溶解までミックス フィルター滅菌水の 500 μ L で tnf α の解散 20 μ g.
- 15 mL 滅菌チューブに転送し、5.5 mL DPBS Mg と Ca 無料ソリューションをこのチューブに追加します。優しく渦のミキサーを使用してミックスします 。
- 因数 70 μ L 部分にソリューション。0.5 mL マイクロ チューブと-80 で店に各因数を調剤 ° C
- アポトーシス誘導ソリューションの準備: 40 ng/mL で tnf α ソリューション。
- アポトーシス誘導の在庫ソリューション、25 ° C で 10 分間で水浴の抱卵の因数を解凍
- 4.939 mL アッセイ培地 15 mL 滅菌チューブに 3.3 μ G/ml tnf α ソリューションの 61 μ L を追加することによって 40 ng/mL にアポトーシス誘導原液を希釈します 。
- 10 の渦のミキサーでミックス s; このソリューションは使用する前に新鮮な準備する必要があります 。
- Th eneutralization アッセイに使用前に、少なくとも 30 分の 37 ° C の解決策を暖かい 。
- 基板ソリューションを準備: カスパーゼ 3/7 グロ ソリューション 7 , 8。
- 雪解けの緩衝液のカスパーゼ (カスパーゼ 3/7 グロ バッファー) 使用前に 12 h 。
- カスパーゼ緩衝液および基板 (カスパーゼ 3/7 グロ基板) 座る別途 25 ± 5 ° C で混合する前に 30 分間みましょう 。
- インバージョンによる基板バイアルとミックスするカスパーゼ バッファー溶液 10 mL を転送します 。
- 維持 25 ± 5 ° C、使用までの光保護します
。 注: ソリューションは室温で 6 時間安定した 。
2。細胞培養とカウント
- 細胞融解と最初のサブカルチャー。
- -80 ° C で冷凍庫から WEHI 164 細胞 9 1 つのバイアルを外し、氷浴にそれらを転送します 。
- 凍結細胞を完全に解凍するまで上下に予め温めておいた培養液 1 ml ピペットします 。
- 15 mL 滅菌チューブに予め温めておいた培養液 9 mL を分注します 。
- 15 mL 滅菌チューブに細胞懸濁液を転送、逆転で 5 回を軽く混ぜる 。
- 清 125 x g で 3 分間破棄に細胞懸濁液を遠心し、細胞ペレットを非集計します 。
- は、チューブに培地 5 mL を追加します。完全に再停止されるセルになるまで混ぜる 。
- セルのカウント、500 μ L マイクロ チューブ、50 μ L 0.4% トリパン ブルーのミックスに細胞懸濁液を 50 μ l 添加を転送します。セルをカウントし、0.5 × 10 6 セル/mL に調整します。以下手順 2.2 を参照してください 。
- 75 mL 細胞培養用フラスコに予め温めておいた培地の 13 mL を追加します 。
- 0.5 × 10 6 セル/mL 細胞培養用フラスコを達成し、37 ° C および 5% の CO 2 を一晩インキュベート ステップ 2.1.6 から十分な細胞懸濁液容積を調剤します 。
- セルカウントします
。 注: を参照してください参照 10。- 2.1.6 のステップから診断に 0.05 mL を転送ソリューションを使用して、トリパン ブルー色素排除を使用して顕微鏡下で細胞密度を決定します 。
- 細胞および実行可能なセルの合計数を定量化します 。
- 0.5 × 10 6 セル/mL に細胞懸濁液を調整します
。 式 1
V 培 (mL) =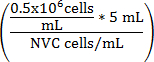
V 培 (mL) = (5 mL - V 細胞懸濁液)
V 培 (mL) = WEHI 164 の調整ボリューム細胞懸濁液
NVC 実行可能な WEHI 164 細胞/mL の数 =
V 培 (mL) = 0.5 6 セル/mL の 10 倍を達成するために細胞懸濁液に追加アッセイ培ボリューム
0.5 x 10 6 ターゲット細胞密度を =
- 細胞剥離と 2 番目と 3 番目のサブカルチャー
。 注: 真空システムは、フラスコからソリューションを削除する使用できます。使い捨てのまたはガラスの滅菌ピペットを使用ことができます。ピペットは、綿を詰まらせる場合上部で、使用する前に削除する必要があります。- T フラスコ 1 mL 滅菌ピペットと真空を使用して細胞培養から培養培地を削除します 。 文化 T フラスコに
- セル洗浄の調剤 5 mL ソリューションは優しく、ミックス、溶液を廃棄します。この手順を 2 回繰り返します
。 注: 培地の完全な除去は効率的な細胞の剥離にとって重要です 。
- T フラスコに細胞剥離溶液 15 mL を加え、37 ° C、5% CO 2 でインキュベーターで 3 分間放置します 。
- では、顕微鏡下でフラスコ内壁に取り付けられている細胞の有無を確認します。文化 T フラスコ 20 mL 滅菌ピペットを使用してからセルを削除し、50 mL の生殖不能の管にそれらを分配します 。
- 清 125 x g で 3 分間破棄に細胞懸濁液を遠心し、別の 5 mL の培養液でペレットを再懸濁します 。
- セルをカウントし、方程式 1 に従って目的のセルの濃度に到達する十分な培養液を追加します 。
- 72 cm 2 T フラスコにこの懸濁液を追加し、37 ° C、5% CO 2 で一晩インキュベートします 。
- サブカルチャーの少なくとも 2 倍、中和でそれらを使用する前にセルの試金します。次の 2 日の 2.3.1-2.3.8 の手順を繰り返します 。
- 細胞懸濁液をアッセイします。
少なくとも 3 つのパスを持つ
- 選択 WEHI 164 サブカルチャー。手順 2.1 を参照してください 。
- デタッチと 2.2 と 2.3 のこのプロトコルの手順に従ってセルをカウントします 。
- 式 1 によると 0.5 × 10 6 セル/mL に細胞懸濁液を希釈します 。
- は、中和の試金のためのこの細胞懸濁液を使用します。使用するミキサー前に渦によってすべての細胞懸濁液をミックスします 。
3。抗体作製および希薄
- mab 定量。
- 280 UV 吸収を通じて分析サンプル、コントロールのサンプル、参照物質の濃度を決定する nm の大量絶滅 (1.39) 係数 11 を使用しています
。 注: 元の濃度は、医薬品ラベルから取ることができます。ただし、これは UV 吸収によって確認する必要があります 。
- 280 UV 吸収を通じて分析サンプル、コントロールのサンプル、参照物質の濃度を決定する nm の大量絶滅 (1.39) 係数 11 を使用しています
- モノクローナル抗体希釈。
2 mL のマイクロ チューブ、2 mg/mL までの DPBS Mg と Ca 無料ソリューション千九百六十八で独立して
- Dilute すべてサンプル。3 通、空白として DPBS Mg と Ca 無料ソリューションを使用して紫外線吸収によるこの濃度を確認します 。
- 5 のストックのタンパク質溶液を混ぜて渦のミキサーを使用して s 。
- 0.9 mL アッセイ培地の mAb 各 2 mg/mL の溶液の希釈 100 μ L. ボルテックス ミキサー
- ミックス 5 s.
注: これらのソリューションは、200 μ G/ml の濃度を持っています。各 3 通の希釈液の調製を行う必要があります 。
- 希釈 10 ・ #181;アッセイ培地の 0.99 ml 各 200 μ G/ml mAb ソリューションの L。5 のミックス s 渦のミキサーを使用しています。これらのソリューションは、2 μ G/ml の濃度を持っています。中和法でそれらを使用する前に各 3 通のシリアル希薄を実行します 。
- は、3 つの独立したマイクロ プレートで抗 tnf α モノクローナル抗体希釈液を作る。それぞれ独立した 3 通から複製を作り、表 1 に示すように 1 つのマイクロ プレートで調剤。物質を参照 < テーブルの fo:keep-together.within-ページ =「1」fo:keep-と-next.within-ページ =「常に」fo:text-整列 =「センター」> プレート 1 皿 2 プレート 3 井戸 サンプル 井戸 サンプル 井戸 サンプル B2:B11 の標準物質 B2:B11 コントロールのサンプル B2:B11 分析サンプル C2:C11 C2:C11 C2:C11 D2:D11 分析試料 D2:D11 参照物質 D2:D11 コントロールのサンプル E2: e11 e2: e11 e2: e11 F2:F11 コントロールのサンプル F2:F11 分析試料 F2:F11 参照物質 G2:G11 G2:G11 G2:G11 テーブル 1: マイクロ プレート サンプル配列。中和を完全アッセイは、G11 に座標 B2 内の 3 つのマイクロ プレートで実行されなければなりません。調剤参照、分析、およびコントロールのサンプルのランダムなアッセイの偏りを確認する研究者を許可する 。
- 各参照の実行モノクローナル抗体希釈サンプル、または制御、表 2 に示すよう
。 注: この表に記載されている抗 TNF モノクローナル抗体濃度は中和試験で最終的な濃度ではありません。 < td> 250
Tできる 2: 抗 TNF モノクローナル抗体希釈液。 抗 TNF モノクローナル抗体のシリアル希薄がこの表に示されています。この表に記載されている最終濃度はありません、アッセイの濃度どこ抗 tnf α モノクローナル抗体 (mAb 希釈 + 培養培地、細胞懸濁液) の 3 倍希釈されました。行は太字で表す 3、5、7、9、および 10 のラインから来る希釈非うち太字の行は、3、4、および 6 行からの希釈を表しています。これらのシリアル希薄は、ちょうど中和試験を実行する前に行われます。希釈する前に上下に 3 回をピペッティングにより混合する注意する必要がありますプレート柱 アッセイ ボリューム培 (μ L) ボリュームの標準物質、分析試料またはコントロールサンプル (uL) アッセイ プレート (ng/mL) 中濃度 2 0 230 2000 3 150 150 2 行目から 1000 4 75 3 行目から 75 500 5 100 3 行目から 50 333 6 75 ライン 4 から 75 7 75 75 行 5 から 166 8 75 6 行目から 75 125 9 75 75 往復m ライン 7 83 10 75 9 行目から 75 41 11 150 行 10 から 75 13 。
- 25 ± 5 ° C で使用するまでプレートを維持します 。
4。中和 WEHI 164 細胞アッセイ
- ボルテックスこの議定書のいずれかの手順で調剤する前にすべてのセルの懸濁液 (0.5 × 10 6 セル/mL)
- ミックス
。 注: このセクションで 37 ° C、30 分前に使用する各ソリューションをウォームします 。
- 各列 2 に 11 および G に B 線から移動プレートの 60 の井戸に細胞懸濁液の転送 50 μ l
- MAb リファレンス、サンプル、およびコントロールの転送 50 μ L マイクロ プレートに希釈。 図 1 に示されたパターンに従います 。
- 各ウェルにアポトーシス誘導ソリューションの追加 50 μ L.
- WEHI 164 の 50 μ L の携帯電話コントロールを使用してセル、3 つの井戸で調剤。アッセイ培 150 μ L の最終巻に各ウェルをもたらすします 。
- は、WEHI 164 細胞の 50 μ L の混合物の毒性の制御とアポトーシス誘導溶液 50 μ L を使用します。アッセイ培 150 μ L の最終巻に各ウェルをもたらすします 。
- 、Tnf α の制御、アポトーシス誘導溶液 50 μ L を使用し、アッセイ培 150 μ L にそれをもたらします 。
- ブランク、アッセイ培養液だけで 150 μ L を使用します 。
- プレート蒸散効果を避けるために培地の 150 μ L で残りの井戸を埋める 。 他の 2 つのマイクロ プレートで 2 回繰り返し手順
- 4.1.1-4.1.9.
注: マイクロ プレートは: 0.666 mAb 最終濃度、および、0.083、0.042、0.014 0.028 0.056 0.111 0.167、0.333 の 0.004 μ g/mL 。
- のマイクロ プレート内のサンプルをロードは、 図 1 に示されるようにします
。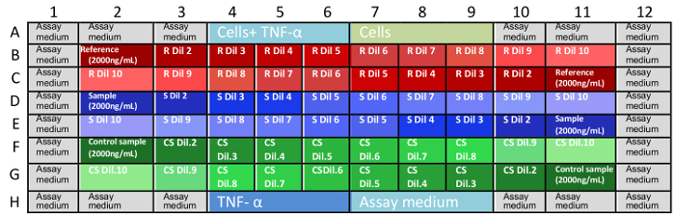
図 1: アッセイ プレートのサンプル処分。G11 に B1 はプレートでも座標であり、サンプル希釈液が配置される位置を記述します。行方不明の座標は、コントロールとアッセイ培 (A1 A12 と H1 H12) でいっぱいの井戸です。このサンプル (プレートの前方および逆の希釈) がランダムに分布は、媒体またはその他の変数の蒸発による結果にバイアスを排除するのに役立ちます。一度に 1 つのアナリストによって各マイクロ プレートされることをお勧めします。R: s: 参照サンプル、CS: コントロールのサンプル、Dil: 希釈。 この図の拡大版を表示するのにはここをクリックしてください 。
- 37 ° C、5% CO 2 16 ± で 3 版を孵化させなさい 2 h.
- 25 ± 5 ° C で使用する前に 30 分立つカスパーゼ 3/7 グロ試薬ができます 。
- 追加 100 μ L のサンプルやコントロールなどすべての井戸にこの試薬 。
- すぐに井戸に調剤後 25 ± 5 ° C で 3 分間のマイクロ プレート渦のミキサーを用いた板を振る 。
- 2.5 ± 0.5 h 25 ± 5 ° C、光から保護用の皿をインキュベートします 。
- マイクを挿入します。ルミノに roplates し、次のセクションを完了します 。
5。結果の分析
- 発光検出のソフトウェアを使用しての発光モードとエンドポイント関数を選択します 。
- 選択 96 ウェルの明確な底板と列 1 および 12 を除く 80 内部井戸 。
- 1,250 ms と 10 の積分時間を選択読む前にマイクロ プレートをミキシングのため s.
- 井戸の標準物質、分析物質およびコントロールのサンプルが配置され、対応する濃度を識別するを選択します 。
- 、ルミノとマイクロ プレートでのサンプルを読む 。
- は、結果の分析に第 4 パラメーターの式を使用します。用量反応曲線を 図 2 で示したグラフします
。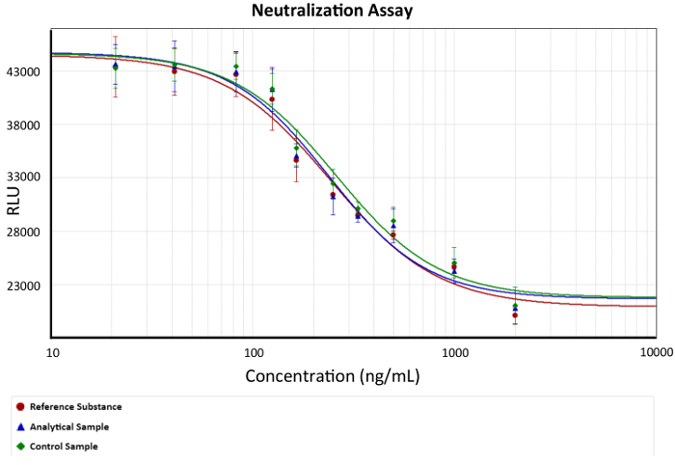
図 2: 用量反応曲線。発光 (細胞生存率) と抗 TNF モノクローナル抗体濃度が描かれています。モノクローナル抗体の抗 TNF 保護を記述する第 4 パラメーター式は、モデルとして使用されました。EC50 斜面の変化としてグラフに代表される各分析で 50% の細胞死を引き起こす tnf α の量を中和することができるモノクローナル抗体の濃度であります。バーは、各 mAb 濃度の発光の標準偏差をについて説明します。x 抗 TNF Ab 濃度を表し、y は、ng/ml、対数関数として描かれている 任意の発光ユニットの発光応答。 この図の拡大版を表示するのにはここをクリックしてください
。 注: 4 番目のパラメーター式 C 効果濃度 (EC50) 50 です。エフェクター機能によって、標準物質、分析サンプル、コントロールのサンプルを比較するこの値が使用されます 。
- 相対強度を計算すると、100% 参照物質を修正、サンプルのポーテンシーを算出し、それに応じて制御します
。 注: これらの値は、 図 3 に示したです
。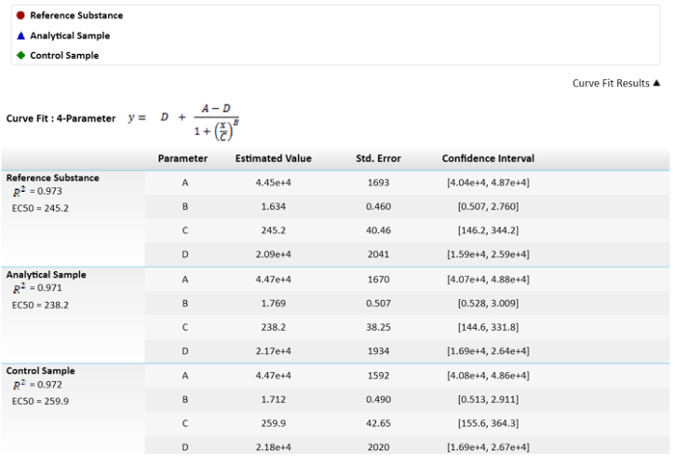
図 3: 、EC50s とその値を計算に使用される数式。EC50 値または C パラメーター標準エラーとして描かれている不確実性があります。EC50s の相対的な効力のサンプルとリファレンスの結果比較が描かれています。Α と信頼区間を計算 = 0.05。 この図の拡大版を表示するのにはここをクリックしてください 。
結果
(コントロール) と線量応答グラフ
図 1は、mAb 濃度対発光応答を表します。このシグモイド関数セル換散のためのアッセイ培地のカスパーゼ 3 および 7 のリリースを例示しています。細胞死は、血清飢餓に加えて、tnf α シグナル誘導によって強化されています。したがって、抗 tnf α 分子 (mAb) は (立体障害) によって細胞の TNF 受?...
ディスカッション
この特性は、高価な時間のかかる臨床試験を実施する前に事前開発中の分子の生物学的挙動を決定するのに役立ちます。また、バッチのリリースの承認薬製品のことをお勧めします。これらの試いる分子は、その作用メカニズムに関する適切な生物学的効果を持っている場合を判断するのに役立つことを言及する価値があります。このチュートリアルで提供されるバイオ分析法が異な?...
開示事項
著者がある何も開示するには
謝辞
この作品は国立科学評議会によって支えられたし、技術 (CONACYT)、メキシコ、研究のデザインに参加せずに PEI CONACYT 2015 220333 を付与します。
資料
| Name | Company | Catalog Number | Comments |
| WEHI 164 | ATCC | CRL-1751 | Fibrosarcoma cells from Mus musculus |
| RPMI-1640 Medium | ATCC | 30-2001 | Store medium at 2 °C to 8 °C |
| RPMI 1640 Medium, no phenol red | GIBCO | 11835-030 | Store medium at 2 °C to 8 °C |
| Trypsin-EDTA(0.25%),phenol red | GIBCO | 25200-056 | Store medium at -10 °C to -20 °C |
| DPBS, no calcium, no magnesium | GIBCO | 14190-136 | Store medium at 2 °C to 8 °C |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | Store at -20 °C to -70 °C |
| Fetal Bovine Serum (U.S), Super Low IgG | HyClone | SH3089803 | Store at -10 °C to -20 °C |
| Fetal Bovine Serum (U.S.), Characterized | HyClone | SH3007103 | Store at -10 °C to -20 °C |
| Caspase-Glo 3/7 Assay kit | Promega | G8093 | Store the Caspase-Glo. 3/7 Substrate and Caspase-Glo. 3/7 Buffer at –20 ºC protected fromLight |
| EDTA, Disodium Salt, Dihydrate, Crystal, A.C.S. Reagent | J.T.Baker | 8993-01 | -- |
| Sample mAb Adalimumab | Probiomed | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Reference and Control mAb Adalimumab | Abbvie | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Microplate Reader | Molecular Devices | 89429-536 | SpectraMax M3 Multi-Mode |
| Microplate reader Software | Molecular Devices | -- | SoftMax Pro 6.3 GxP |
| Incubator | Revco | 30482 | Revco RNW3000TABB Forced-Air CO2 |
| Laminar Flow Hood | The Baker Company | 200256 | Baker SG603A-HE | High Efficiency, Class II Type A2 |
参考文献
- Elmore, S. Apoptosis: A Review of programmed cell death. Toxicol Patho. 35 (4), 495-516 (2007).
- Darwish, R. S. Regulatory mechanisms of apoptosis in regularly dividing cells. Cell Health Cytoskelet. 2 (1), 59-68 (2010).
- Tracey, D., et al. Tumor necrosis factor antagonist mechanism of action: A comprehensive review. Pharmacol Ther. 117 (2), 244-279 (2008).
- Körner, H., Sedgwick, J. Tumour necrosis factor and lymphotoxin: Molecular aspects and role in tissue-specific autoimmunity. Immunol Cell Biol. 74 (5), 465-472 (1996).
- Wong, M., et al. TNFa blockade in human diseases: Mechanisms and future directions. Clin Immunol. 126 (2), 121-136 (2008).
- Furst, D. E., Wallis, R., Broder, M., Beenhouwer, D. O. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum. 36 (3), 159-167 (2006).
- Karvinen, J., et al. Homogeneous time-resolved fluorescence quenching assay (LANCE) for caspase-3. J Biomol Screen. 7 (3), 223-231 (2002).
- Ren, Y. G., et al. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 15 (11), 5064-5074 (2004).
- Sud, D., Bigbee, C., Flynn, J. L., Kirschner, D. E. Contribution of CD8+ T cells to control of Mycobacterium tuberculosis infection. J Immunol. 176 (7), 4296-4314 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. Apendix 3, 3 (2001).
- Ramasubramanyan, N., et al. . Low acidic species compositions and methods for producing and using the same. 1, (2014).
- Masters, J. R., Stacey, G. N. Changing medium and passaging cell lines. Nat Protoc. 2 (9), 2276-2284 (2007).
- Eskandari, M. K., Nguyen, D. T., Kunkel, S. L., Remick, D. G. WEHI 164 subclone 13 assay for TNF: sensitivity, specificity, and reliability. Immunol Invest. 19 (1), 69-79 (1990).
- Hora, M. S., Rana, R. K., Smith, F. W. Lyophilized formulations of recombinant tumor necrosis factor. Pharm Res. 9 (1), 33-36 (1992).
- Ponnappan, S., Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antiox Redox Signal. 14 (8), 1551-1585 (2011).
- Matsumaru, K., Ji, C., Kaplowitz, N. Mechanisms for sensitization to TNF-induced apoptosis by acute glutathione depletion in murine hepatocytes. Hepatology. 37 (6), 1425-1434 (2003).
- Camacho-Villegas, T., Mata-Gonzalez, T., Paniagua-Solis, J., Sanchez, E., Licea, A. Human TNF cytokine neutralization with a vNAR from Heterodontus francisci shark: a potential therapeutic use. mAbs. 5 (1), 80-85 (2013).
- Männel, D. N., Falk, W. Optimal induction of tumor necrosis factor production in human monocytes requires complete S-form lipopolysaccharide. Infect Immun. 57 (7), 1953-1958 (1989).
- Lis, K., Kuzawińska, O., Bałkowiec-Iskra, E. Tumor necrosis factor inhibitors-state of knowledge. Arch Med Sci. 10 (6), 1175-1185 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved