このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
96ウェルプレートに細胞遊走/創傷治癒を行う装置
要約
ここでは、96ウェル細胞培養プレートに半ハイスループット細胞遊走アッセイを実行するためのプロトコルを提示します。このプロトコルは、細胞単層上で一貫性のあるスクラッチ傷を作成するには、高速、シンプルかつ経済的な方法です。
要約
細胞遊走は/アッセイを負傷して細胞遊走および血管新生および腫瘍転移などの他の生物学的プロセスを研究するために一般的に用いられる方法です。このアッセイでは、細胞は、コンフルエントな単層を形成するために増殖させ、機械的な傷は、デバイスとのスクラッチによって作成されます。次いで、露出領域に向かって細胞の移動速度は、イメージングによってモニターすることができます。当社の8チャンネル機械wounderは、細胞遊走アッセイに関連する問題の多くに対処するように設計されています。まず、私たちのwounderは簡単にオートクレーブ処理によって、あるいは共通の消毒剤で滅菌することができます。第二に、個別の調整可能なピンでもシャープで再現性の創傷を作成することができるように、細胞培養プレートとの接触を可能にします。第三に、wounderの両側の案内バーは、各ウェル中に一貫性のある創傷の位置を確認してください。さらにwounderのより良いハンドリングを提供できるだけでなく、クロスcontaminatを最小限に抑えるために負傷のための使い捨てのプラスチック製ピペットチップの使用イオン。結論として、我々の細胞wounderは、標準的な96ウェル培養プレートを用いて細胞遊走アッセイを行うためのユーザーフレンドリーで再現可能なデバイスと研究者に提供することができます。
概要
細胞遊走は、胚発生、神経発生、血管新生、創傷治癒、粘膜修復、正常な発達と病気の状況1下上皮-間葉遷移などの細胞プロセスにおいて重要な役割を果たしています。これは、シグナル伝達分子間相互作用、細胞極性、細胞骨格の再編成、マトリックスリモデリング、膜の突起と動的細胞間接着の変調2を含む多数の間および細胞内のイベントの調整を必要とする複雑なプロセスです。細胞遊走を研究することによって、細胞運動およびその関連する生化学的経路をもたらす化学物質または生体分子の発見および検証を決定することができます。この基本的なプロセスは、このような疾患の治療および薬物標的化のような種々の用途のためのプロキシとして有利に使用することができます。
創傷アッセイは、細胞遊走アッセイ3の一つです。ここでは、細胞の個々のサンプルは、部分的に、細胞が領域をカバーするように移動する露出領域を生成するために機械的手段によって除去されます。特定の時点で回収率が監視されます。多数のサンプルを取り扱う場合、そのようなサンプル内の実験的なコストと交差汚染などの問題は、問題となる可能性があります。多くの商用ツールおよびアッセイは、細胞遊走4、5、6を研究するために利用可能であるが、それらの多くは、高価で精巧な装置を必要とし、改善が依然として必要とされています。これらの理由のために、8チャンネル機械細胞wounder( 図1)が開発されています。
我々の8チャンネル機械細胞wounderは、上記課題を解決するにいくつかのユニークな特徴を組み込んでいます。これは、96ウェル培養プレートフォーマットでの細胞遊走/創傷アッセイを実行するための柔軟性を提供します。調整可能な区idingバーのデザインは、スクラッチ領域は、各ウェルの中央の位置にあることを保証します。 wounder培養プレートの様々なブランドのために適用可能であるように、また、ガイドバーの高さを調整することができます。最後に、調整可能な創傷ピンの設計は、同時かつ再現性の創傷7、8を達成するために、培養皿の表面にピペットチップであっても接触を可能にします。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. Wounderのパーツの概要(図1)
- 等間隔に創傷のピンを固定することにより、ピンホルダーを準備します。ピペットチップを持ち、上下に調節可能な創傷ピンを移動させることにより、先端の高さを調整します。
- 96ウェル培養プレートの異なるブランドに調節可能なガイドバーを取り付け、創傷領域が固定位置にあることを確認してください。
- 六角ネジを締めて、調整可能な創傷固定してください。両端の六角キャップを締めて位置の案内棒を固定します。
2.ピンホルダーの幅を設定する(図2)
- M5六角レンチで六角キャップを緩めます。
- ガイドバーは、96ウェル培養プレートの幅に完全に収まるように、ピンホルダーの両側に調節リングの適切な数を挿入します。
注:コーニングといわきプレート大リングの1対の小さなリングの1組を必要とします。ファルコンとヌンクPLATEは、大きなリングの1ペアが必要。 - 六角を締め案内バーを固定するキャップ。
3.ガイディングバーを調整する(図3)
- 滅菌10-μLプラスチックピペットチップで負傷ピンを取り付けます。
- M5六角レンチで六角キャップを緩めます。
- wounderを保持し、96ウェル培養プレートの1列に創傷ピンを浸します。
- ヒントのすべてがかろうじてウェルの底に触れるまで案内するバーの高さを調整します。
- 六角キャップを締めます。 wounderは現在、完全に培養プレートに適合し、ピンをウェルの中央によく配置されていることをことを確認してください。
ピンの4キャリブレーション
- 平らな無菌面に垂直なwounder( すなわちシャーレ)を持ち、M3六角レンチですべての六角ネジを緩めます。
- ヒントのすべてが均等に平らな滅菌表面に接触するまでwounderをタップします。
- 位置にピンをロックするために、再び六角ネジを締めます。
- 平らな無菌の表面を軽くwounderをタップすることで、各チップの均一性を確認してください。
5.スクラッチ細胞単層(図4)
- 0.1%ゼラチンでコーティングした96ウェル細胞培養プレートにヒト臍帯血管内皮細胞を播種します。 20%熱不活化ウシ胎児血清、1%ペニシリン/ストレプトマイシン0.09グラム/ Lのヘパリンを添加した培地199中で培養細胞。一晩使用される前に、37ºCで5%二酸化炭素を含む加湿インキュベーター内で細胞を維持します。細胞が負傷する前に、100%の密集度に到達する必要があります。
- 一番左(または右端)ウェル培養プレートの同じ列内の各側の創傷のヒントを配置します。ウェルの反対側に渡ってwounderをスライドさせます。創傷先端がウェルの底に触れていることを確認してください。
- すべての列のスクラッチ(ステップ5.2)を繰り返します。
- 負傷後、トンを廃棄各ウェル中の培地彼と試験化合物を含む新鮮な培地と交換してください。
6.データ収集と画像解析
- 画像デジタルカメラ( 例えば 10倍の対物レンズ)を備えた低倍率の顕微鏡を用いて細胞単層上の機械的創傷と全体だけでなく、すぐに(T = 0時間)創傷後。
- 必要であれば、試験化合物を追加して、所望の時間インキュベートします。創傷領域と画像全体をよく再び希望のインキュベーション時間後(T =Δhを)。
- そのようなImageJのような画像解析ソフトウェアを(使用してhttps://imagej.nih.gov/ij/ )、フリーハンドツールを使用して、画像上の創傷領域を測定します。
- 創傷閉鎖の割合を計算します。
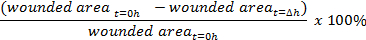
Access restricted. Please log in or start a trial to view this content.
結果
この8チャンネル機械wounderは、細胞遊走アッセイを実行するために、細胞単層を傷つけるように構成されています。それは、特別な訓練なし分未満で96ウェルプレート中の細胞引っ掻きアッセイを行うことができるユーザーフレンドリーなデバイスです。このwounderは600μm程度の均一な幅とし、シャープなエッジで細胞単層上の創傷領域を導入することができる(
Access restricted. Please log in or start a trial to view this content.
ディスカッション
私たちの細胞wounderは、従来の細胞遊走アッセイの問題を解決するにはいくつかのユニークな特徴を持っています。 8チャンネル機械細胞wounderは、オートクレーブにより滅菌することができる長寿命で高品位のステンレス鋼(スチール304)で構成されています。市販の96ウェル培養プレートのほとんど全ての商業ブランドがあるため、調整可能なガイドバーのこの機械的な細胞wounderと共に使用...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、彼らが競合する金融利害関係を持たないことを宣言します。
謝辞
著者は、このwounderのプロトタイプを製造する際に氏タムポー・レオン氏ウォンチー金武とその技術的なスキルのための科学学部ワークショップの技術スタッフ、香港バプティスト大学、アドバイスに感謝したいと思います。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plate | Nunc | 167008 | Other brands of 96-well cell culture plate can also be used |
| P10 pipette tips | Axygen | 301-03-051 | Short P10 pipette tip is more easy to create a clear wound |
| Wounder | R&P Technology Limited | ||
| Medium 199 | Sigma | M2520-1L | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Fetal bovine serum | Gibco | 26140079 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Penicillin/Streptomycin | Gibco | 15140122 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Heparin sodium salt from porcine intestinal mucosa | Sigma | H3393 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Gelatin from bovine skin | Sigma | G9391 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
参考文献
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat Rev Cancer. 3 (5), 362-374 (2003).
- Friedl, P. Prespecification and plasticity: shifting mechanisms of cell migration. Curr Opin Cell Biol. 16 (1), 14-23 (2004).
- Lampugnani, M. G. Cell migration into a wounded area in vitro. Methods Mol Biol. 96, 177-182 (1999).
- Sholley, M. M., Gimbrone, M. A. Jr, Cotran, R. S. Cellular migration and replication in endothelial regeneration: a study using irradiated endothelial cultures. Lab Invest. 36 (1), 18-25 (1977).
- Gotlieb, A. I., Spector, W. Migration into an in vitro experimental wound: a comparison of porcine aortic endothelial and smooth muscle cells and the effect of culture irradiation. Am J Pathol. 103 (2), 271-282 (1981).
- Chen, Y. C., et al. Single-cell migration chip for chemotaxis-based microfluidic selection of heterogeneous cell populations. Sci Rep. 18 (5), 9980(2015).
- Yarrow, J. C., Periman, Z. E., Westwood, N. J., Mitchison, T. J. A high-throughput cell migration assay using scratch wound healing, a comparsion of image-based readout methods. BMC Biotechnol. 4, 21(2004).
- Lauder, H., Frost, E. E., Hiley, C. R., Fan, T. P. Quantification of the repair process involved in the repair of a cell monolayer using an in vitro model of mechanical injury. Angiogenesis. 2 (1), 67-80 (1998).
- Yue, P. Y. K., Leung, E. P. Y., Mak, N. K., Wong, R. N. S. A simplified method for quantifying cell migration/ wound healing in 96-well plates. J. Biomol Screen. 15 (4), 427-433 (2010).
- Yue, P. Y., et al. Elucidation of the mechanisms underlying the angiogenic effects of ginsenoside Rg(1) in vivo and in vitro. Angiogenesis. 8 (3), 205-216 (2005).
- Kwok, H. H., Chan, L. S., Poon, P. Y., Yue, P. Y., Wong, R. N. Ginsenoside-Rg1 induces angiogenesis by the inverse regulation of MET tyrosine kinase receptor expression through miR-23a. Toxicol Appl Pharmacol. 287 (3), 276-283 (2015).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved