Method Article
ネッタイシマカジカのベクトルで脂肪ボディ臓器培養システム
要約
脂肪体は昆虫の中央代謝臓器です。様々 な刺激に対する分離脂肪体組織の反応を研究することができます本物のオルガン文化システムを提案します。
要約
昆虫の体脂肪は、虫の代謝と栄養貯蔵、肝臓と脊椎動物の脂肪質のティッシュの機能をミラーリングで中心的な役割を果たしています。昆虫の体の脂肪組織は通常昆虫の体全体に分散されます。ただし、しばしば腹部に集中して、腹部の体壁に接続されています。
蚊脂肪体は、卵の生産のために重大である卵黄タンパク質の唯一のソースです。したがって、蚊脂肪体組織の体外培養は蚊生理学研究のための重要なシステムを表す新陳代謝および、最終的に、卵の生産。脂肪体文化プロセス ソリューションおよび試薬、アミノ酸原液、ヒトスジシマカ生理食塩水塩原液 (AP)、カルシウム原液、脂肪体の培養培地などの準備から始まります。脂肪体解剖、実験的治療の順に処理が進みます。治療後、RNA シーケンス (Seq RNA)、qPCR、西部のしみ、プロテオミクス、メタボロミクスなど、さまざまな異なる分析を実行できます。
例実験、黄熱の蚊、ネッタイシマカ、アルボ ウイルス デング熱、チクングニア、ジカなどの主なベクトルから切除と脂肪体の文化を通じてプロトコルを示す.リポタンパクリパーゼ卵黄タンパク質と対照する知られている生理学的条件下で培養した脂肪体からの RNA は、遺伝子発現の調査のこのプロシージャの潜在的な有用性を示す RNA シーケンス分析の対象となった。
概要
蚊は、マラリア、デング熱、チクングニア、ジカ1,2,3などの壊滅的な人間の病気のベクトルであります。これらの疾患を抑制するためと病気送信蚊の個体数を制御する強烈な国際努力にもかかわらず蚊媒介疾患の流行の発生がまだ一般的、とりわけ途上国における。多くのこれらの病気に対する効果的なワクチンが利用できなくまたは限られた有効性4、5の。感染を防ぐ最も効果的な方法は、殺虫剤トリートメントを使用して主に、蚊の個体数を制御することです。ただし、殺虫剤抵抗性蚊個体群の多くで開発し、世界6,7,8のまわりの共通の問題になります。蚊の生理学の研究は、新規ツールおよび病気を制御するための戦略の開発に不可欠です。
蚊の脂肪体は、栄養貯蔵、代謝恒常性、複製、および異物の異化9,10、11,12で中心的な役割を果たしています。それはトリグリセリド、グリコーゲン貯蔵タンパク質の中のアミノ酸の主なストレージ臓器です。それはまたほとんどの体液蛋白質および代謝産物の合成の場所として機能します。蚊の脂肪体は女性で彼らは血食事13,14を取る後に発生卵黄蛋白質の生産の唯一のソースです。
脂肪体の主たる細胞型、大型、倍数体の trophocyte または脂肪3,9,10,12です。脂肪体組織は葉や葉鞘に編成し、脂肪体の大きな葉が腹部の体壁に接続されている、腹部に位置する最大の部分と、蚊のすべての体の部分で見つけることができます。
ここで示した蚊脂肪体文化システムを 70 年代に開発し、脂肪体生理学10、特に現在の解析技術との組み合わせを研究するための強力なツールのまま。この手法の基礎は、腹部の体壁と関連付けられた脂肪体組織の分離に基づいています。腹部のキューティクルの疎水性と、没頭して腹部の脂肪体の添付の葉と培養液の表面に浮くされます。培養組織の酸素化の確保、気門および tracheolar 構造が保持されます。今後、我々 がこれらの準備を「脂肪体」として参照してください。分離脂肪体 (未発表結果) 適切な培地で培養したときに 12 時間以上実行可能に残る。脂肪体の文化はさまざまな脂肪体内分泌生理学9,10,12,15,16、に関する質問を対処している貴重なツール 17。
培養脂肪体は様々 な実験的に受けることができ、治療のタイミングは、決定は、捜査官を制御します。脂肪体の収集し、qPCR16,17,18,19, ウエスタンブロット18 を含む下流の解析処理潜伏期間の終わりに、、20、プロテオミクス21、またはメタボロミクス22。実験は、一緒に培養することができます何百ものグループに個々 の脂肪体から、さまざまなスケールで実行できます。
ここに含まれる代表的な結果は、アミノ酸および濾胞16,17、血液の食事活性化をシミュレートするためにステロイド ホルモン 20-ヒドロキシ脱皮ホルモンの存在下で培養した脂肪体から派生しました。 23,24。私たちは分析し、次世代シーケンス解析を介して活性化脂肪体対ないアクティブの差動遺伝子発現を比較しました。
プロトコル
1 ですソリューションと試薬の準備
- アミノ酸原液
- 準備 4 X アミノ酸原液 23 , 24 の重さによって、。表 1 の濃度によると三角フラスコに 20 種類のアミノ酸を追加します
。 注: いくつかのケースで amino acid(s) ソリューションから除外でき等しい浸透圧物質濃度を維持するためにマンニトールのモル同量に置き換えられます 。
- DdH 2 O ソリューションの適切なボリュームを生成するための適切な量を追加します 。 アミノ酸が完全に溶解していることは、確実に
- 熱液体が完全にクリアされるまで継続的に攪拌しながら優しく; わずかな黄色の色合いにかかります
。 注: 解散するより疎水性アミノ酸のいくつかを許可するように塩酸を追加することによって pH を 6 に削減が必要になる場合があります 。
- ソリューションの約数と滅菌フィルター シリンジ フィルターを用いた 0.2 μ m 孔サイズ 。
- -20 ° C まで 6 ヶ月間で密封された容器でストア 。
- 準備 4 X アミノ酸原液 23 , 24 の重さによって、。表 1 の濃度によると三角フラスコに 20 種類のアミノ酸を追加します
- AP
注: 25 を参照してください。- 20 X の原液を塩、水 50 mL で 表 2 に示す塩を組み合わせます。完全に溶解するまで攪拌します
。 注: 少し熱塩を完全に解消するソリューションが必要になる場合があります 。
- 無菌フィルター シリンジ フィルターを用いた 0.2 μ m 孔サイズと-20 で 50 mL のチューブで、ソリューションを格納 ° C
- 20 X の原液を塩、水 50 mL で 表 2 に示す塩を組み合わせます。完全に溶解するまで攪拌します
- カルシウム原液
- カルシウム原液 X 50、100 mL の水 (表 3) に塩化カルシウムの 0.90 g を追加; 完全に溶解するまで攪拌します 。
- 注射器を用いた無菌フィルター 50 mL チューブに分注 0.2 μ m の細孔径を持つソリューションをフィルターや-20 デパート ° C
- Tris バッファー (pH 7.4)
- 、トリス バッファー、塩と 表 4 のソリューションを組み合わせて、ddH 2 O を追加 100 mL.
- 注射器を用いた無菌フィルター フィルター 0.2 μ m の気孔のサイズそして因数のソリューション 50 mL チューブに; 常温で保存します 。
- 脂肪体培
- 脂肪体の培養培地を準備する上記のすべてのソリューションを準備します 。
- 表 5 脂肪体培地 200 mL にボリュームに従ってそれらを結合します 。
- 7.2 水酸化ナトリウムや塩酸を使用して pH を調整します 。
- 無菌フィルター シリンジ フィルターを用いた 0.2 μ m 孔サイズ ソリューションです 。
- 15 ml にソリューションを分割し、-20 ° C で 6 ヶ月保存します 。
2。郭清の準備
- 照明顕微鏡 (10-20 倍の倍率) を準備し、2 つの極細ピンセットと顕微解剖はさみのペアを置く 。
- は、実験に必要なすべてのソリューションを準備します。部屋の温度に脂肪体培養液を解凍
。 注: 沈殿は優しくない 30 以上にソリューションを加熱することによって解散することができます ° C - ヒメアリ、雌成虫蚊 (出現後 3-7 日) を収集し、それらの麻酔二酸化炭素または氷を使用して
注: 一度麻酔、蚊べき CO 2 の下で最短の時間で可能であれば、代わりに 20 分を超えない、蚊が氷の上に麻酔され約 30 分の - 3 ml の APS の井戸あたり 6 ウェル プレートを準備します 。
3。脂肪体解剖
- 解剖顕微鏡の焦点を当てるし、快適な高さに椅子を合わせる 。
- 顕微鏡表面に凹顕微鏡スライドを配置し、中心に AP の 2 滴を追加します 。
- 、鉗子を使用して足を蚊をピックアップし、顕微鏡スライドの APS の表面にそれを転送します 。
- 慎重に左の手でピンセットで胸郭によって蚊をグリップし、腹側、上向きに蚊を回転します 。
- 胸郭によって安定した体を保持している間、右手の鉗子で最後の 2 つの腹部のセグメントをつかみ、注意深く引き出します
。 注: 最後の 2 つの腹部のセグメント腹部からと添付の卵巣、キイロショウジョウバエマルピギー細管、後腸、中腸; 分離されます。時々、作物は、腹部からスライドされます。彼らが削除されていない場合作成された小さな穴に鉗子の閉鎖のヒントを挿入し、残りの組織を削除します 。
- は、右の鉗子を脇、春はさみを拾います。胸部下のセグメントまでの腹部の穴に 1 つのブレードをスライドさせます。優しくかつ腹部に縦にカットします
。 注: カットがなされたら、腹部だすべき外側に展開、これはすぐに発生可能性があります 。
- 横カットは、胸郭の下や最初のカットが終了した位置より少し下になります 2 番目のカットをすることを続行します
。 注: 腹部必要があります開くし、キューティクルと AP 内側浸漬脂肪体、胸部から切り離して考えます。、この腹部の体壁は 生体外で 文化のための脂肪体準備します 。
- は組の鉗子の先端を使用して、APS ソリューションから脂肪体を持ち上げ、ソリューションから室温で AP を含む 6 ウェル プレートに転送。脂肪体文化に進む前に約 0.5 時間の残りの部分にティッシュを許可します 。
4。脂肪体文化
- それらを平衡に少なくとも 0.5 h の室温での AP の脂肪体をインキュベートします 。
- は、鉗子の先端を使用して脂肪体を転送し、優しくそれらを APS ソリューション持ち上げます。脂肪体培地に先端を下げる
。 注: 脂肪体に媒体の表面上を開き、自由に浮かぶ。脂肪体の文化は、通常、各ウェル中の 150-200 μ L での 96 ウェル プレートで行います。1 つも、3 つまでの個々 の脂肪体を合うことができるし、彼らが 12 時間以上 (未発表の個人的な結果) の実行が可能です 。
- 潜伏期間後脂肪体を培地からダウン ストリーム処理のための適切な試薬を含む 1.5 mL 遠心チューブに転送します
。 注: 典型的な分析を含む qPCR 16 , 17 , 18 , 19, ウエスタンブロット 18 ,メタボロミクス 22 21、プロテオミクスやトランスクリプトミクス 26 20 。
結果
例として脂肪体培養実験を行いすべて 20 自然発生するアミノ酸と 6 h の昆虫ステロイド ホルモン 20-ヒドロキシ エクジソン (10 μ M) の釣り合った混合物が含まれているソリューションにそれらをインキュベートし分離脂肪体を刺激.コントロールとして時間の同量のための AP の脂肪体が孵化します。
インキュベーション後、総 RNA は、製造元の指示に従って三試薬27を使用して分離された.抽出した RNA サンプルの量と質は、分光光度計、蛍光定量と agarose のゲルの電気泳動を使用して評価されました。RNA シーケンス ライブラリの総 RNA の 4 μ g を使用して生成された、2 つの異なる手法を使用して定量を行った。その後、ライブラリは、ペアの終了シーケンスの商用プロバイダーに送られました。
この実験の結果は、表 6のとおりです。アミノ酸と 20-ヒドロキシエクジソン最強の転写応答を示す遺伝子は、主に卵黄のタンパク質の遺伝子、前の結果11に一致していた。
図 1は、差動 1,256 の遺伝子発現レベルを示すヒートマップ 2 つの異なる治療後の培養脂肪体からの遺伝子の表現を示しています。
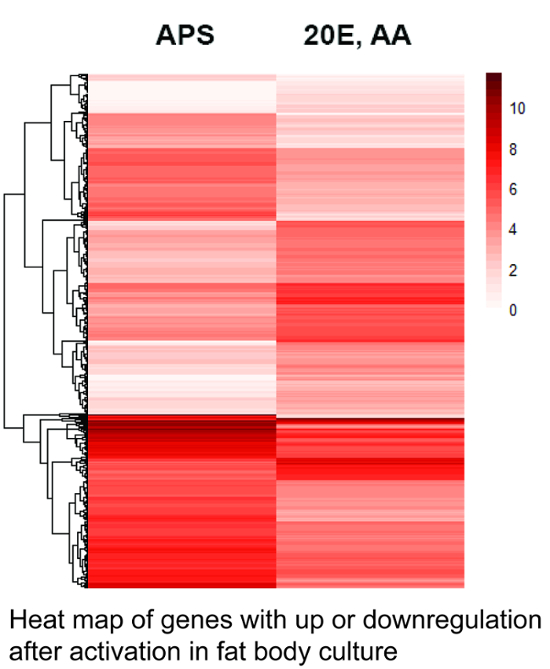
図 1.脂肪体培養で発現する遺伝子のヒートマップ。ヒート マップは各遺伝子 R ソフトウェア環境の一部であるヒートマップ パッケージ28を使用して異なるライブラリ内の特定のコピーの数に基づいて計算されます。暗い影は、高い発現を表します。式の統計的に有意な変動を持つ 1,256 遺伝子 (Q 値 < 0.05) が表示されます。遺伝子は (彼らの系統関係) に従っていない左側の樹形図で示されている彼らの平均発現量に基づいて並べられています。高アミノ酸 (AA) と 20-ヒドロキシエクジソン (20 e) 刺激後のアップまたはダウン調整式と遺伝子数に注意してください。AP =ヒトスジシマカ生理食塩水。遺伝子との相対発現量のリストについて補足のファイル 1を参照してください。この図の拡大版を表示するのにはここをクリックしてください。
| アミノ酸 | 分子の重量 g/mol | mM 濃度 | 1 リットル当たりの mg | 300 mL ボリュームの mg |
| アラニン | 89.1 | 26.68 | 2377.19 | 713.16 |
| アルギニン | 174.2 | 26.68 | 4647.66 | 1394.3 |
| アスパラギン | 150.1 | 26.68 | 4004.67 | 1201.4 |
| アスパラギン酸 | 133 | 26.68 | 3548.44 | 1064.53 |
| システイン | 121.16 | 10.68 | 1293.99 | 388.2 |
| グルタミン酸 | 147.1 | 26.68 | 3924.63 | 1177.39 |
| グルタミン | 146 | 26.68 | 3895.28 | 1168.58 |
| グリシン | 75 | 53.32 | 3999 | 1199.7 |
| ヒスチジン | 155.16 | 80 | 12412.8 | 3723.84 |
| イソロイシン | 131 | 10.68 | 1399.08 | 419.72 |
| リシン | 183 | 26.68 | 4882.44 | 1464.73 |
| ロイシン | 131 | 26.68 | 3495.08 | 1048.52 |
| フェニルアラニン | 165 | 10.68 | 1762.2 | 528.66 |
| プロリン | 115 | 26.68 | 3068.2 | 920.46 |
| セリン | 105 | 53.32 | 5598.6 | 1679.58 |
| スレオニン | 119 | 10.68 | 1270.92 | 381.28 |
| トリプトファン | 204 | 10.68 | 2178.72 | 653.62 |
| チロシン | 181 | 5.32 | 962.92 | 288.88 |
| バリン | 117 | 10.68 | 1249.56 | 374.87 |
| メチオニン | 149 | 10.68 | 1591.32 | 477.4 |
表 1。アミノ酸原液 x 4。
| コンポーネント | 50 ml ddH2O に追加グラムの重量します。 |
| 塩化ナトリウム | 8.0 g |
| KCl | 0.074 g |
| MgCl2-6 H2O | 0.120 g |
| NaHCO3 | 0.0250 g |
表 2.20 X 塩原液。
| コンポーネント | 100 ml ddH2O に追加グラムを重量します。 |
| CaCl2-2 H2O | 0.90 g |
g > テーブル 3。カルシウム原液 x 50 。
| コンポーネント | 原液濃度 | 100 ml のバッファーのボリューム株式 |
| トリス pH8.0 | 1 M | 5 mL |
| EDTA | 0.25 M | 2 mL |
| 塩化ナトリウム | NA | 0.3 g |
| ddH2O | NA | 100 ml (~ 93 mL) |
表 4.トリスバッファー 。
| コンポーネント | ボリューム在庫 200 ml |
| アミノ酸原液 | 150 mL |
| 塩原液 | 10 mL |
| カルシウム原液 | 4 mL |
| TES バッファー | 10 mL |
| ddH2O | 26 mL |
表 5 。脂肪体培。
| 注釈 | 遺伝子の記述 | フォールドの変更 | P 値 |
| AAEL006138 | ビテロジェニン B | 3443 | 2.52E-112 |
| AAEL006126 | ビテロジェニン C | 2795 | 8.64E-91 |
| AAEL006563 | 水子カルボキシペプチダーゼ | 1002 | 2.17E-119 |
| AAEL010434 | ビテロジェニン A | 220 | 1.14E-27 |
| AAEL006542 | 水子カルボキシペプチダーゼ | 185 | 2.14E-65 |
| AAEL012678 | AAEL003006-PA [ヤブカ属 aegypti](65%) | 96 | 4.00E-70 |
| AAEL000080 | タンパク質 | 82 | 6.69E-188 |
| AAEL015312 | 水子カテプシン B | 77 | 1.27E-15 |
| AAEL009588 | 核内受容体 3 | 75 | 4.58E-56 |
| AAEL010529 | タンパク質 | 66 | 1.32E-29 |
表 6.実験結果。
補足ファイル 1.このファイルをダウンロードするここをクリックしてください。
ディスカッション
昆虫の器官培養は昆虫内分泌学、開発、および特定の臓器や細菌共生29,30,31、間の相互作用を調査するためにも代謝を研究に多用されました。 32,33,34。脂肪体器官培養体外アミノ酸輸送法規の蚊と他の双翅目16,17,35卵黄タンパク質の生産の研究に使用されました。,36. 琪プロセス中に蚊脂肪体は卵黄蛋白質12 の大量に合成する体液からの血液の食事由来のアミノ酸をインポートする特異性の高いアミノ酸トランスポーターの配列を使用します。、19,35,36。脂肪体の文化は、このコンテキスト18脂肪体の栄養条件の描写に尽力しました。
メスの蚊は、原料の品質は、これらの実験の成功にとって重要です。蚊幼虫の下で混雑した条件で育ち、通常高栄養飼料で飼育は、最高の結果を生みます。実験デザインの観点から研究室で蚊脂肪体培養条件を確立する際に考慮するいくつかの重要な変数があります。我々 は、脂肪体の遺伝子発現は個々 の生活史と蚊11,22の栄養状態によって大きく変わる前の研究で示した。蚊培養条件は均一サイズの可変性を抑えるべきであるし、実験の蚊の栄養を有します。また、担当者が、解剖は、一貫性のある結果を迅速かつ正確な解剖、十分にトレーニングする必要があります。分離脂肪体の細胞生存率は、異なる染色法37,38を使用して確認できます。
脂肪体培養実験の実験的なデザイン考慮すべき解剖数一定期間で可能。大量の脂肪体が必要な場合、複数の解離セッションまたは複数 dissectors は必要かもしれません。蚊や他の虫の脂肪体文化の in vitroの将来のアプリケーションの広い範囲があります。それは昆虫防除のため潜在的な薬剤の候補者をテストするときに便利になります。脂肪体 trophocytes で特定のレポーター蛋白質を表現する昆虫の遺伝子組み換え技術の使用は、新しい手法を用いて、脂肪体の生理学の研究のための強力な生物検定を開くでしょう。
開示事項
何を開示する必要があります。
謝辞
この研究は、2014 年 NMSU HHMI グラント #52008103、NSF PGR 付与 #1238731 NIH グラント #SC1AI109055、によって支えられました。我々 は脂肪体培養実験とテクニカル サポートのため Lavesh Bhatia NMSU 春 2015 BIOL302 分子 Methods クラスの参加者に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Scissors | Fiskars | 83872 | |
| Fly pad | Genesee Scientific | 789060 | |
| Battery-powered aspirator w/ collection vial | Hausherrs Machine Works, Inc. | 3740-01-210-2368 | |
| Fine tip forceps | World Precision Instruments, Inc. | 500085 | |
| Light microscope | Leica Microsystems | ||
| 96 well plate | Sigma | CL S3383 | |
| Sucrose | Sigma | S9378 | |
| Alanine | Sigma | A7627 | |
| Arginine | Sigma | A5006 | |
| Asparagine | Sigma | A0884 | |
| Aspartic Acid | Sigma | A9256 | |
| Cysteine | Sigma | W326305 | |
| Glutamic Acid | Sigma | G1251 | |
| Glutamine | Sigma | G3126 | |
| Glycine | Sigma | G2879 | |
| Histidine | Sigma | H6034 | |
| Isoleucine | Sigma | I2752 | |
| Lysine | Sigma | L5501 | |
| Leucine | Sigma | L8000 | |
| Phenylalanine | Sigma | P2126 | |
| Proline | Sigma | P0380 | |
| Serine | Sigma | S4500 | |
| Threonine | Sigma | T8625 | |
| Tryptophan | Sigma | T0254 | |
| Tyrosine | Sigma | T3754 | |
| Valine | Sigma | V0500 | |
| Methionine | Sigma | M9625 | |
| NaCl | Sigma | S7653 | |
| KCl | Sigma | P9333 | |
| MgCl2-6H2O | Sigma | M2670 | |
| NaHCO3 | Sigma | S5761 | |
| CaCl2-2H2O | Sigma | C8106 | |
| Tris pH8.0 | Sigma | T1503 | |
| EDTA | Sigma | E6758 | |
| ddH2O | Sigma | W4502 |
参考文献
- Benelli, G., Mehlhorn, H. Declining malaria, rising of dengue and Zika virus: insights for mosquito vector control. Parasitol Res. 115 (5), 1747-1754 (2016).
- Newby, G., et al. The path to eradication: a progress report on the malaria-eliminating countries. Lancet. 387 (10029), 1775-1784 (2016).
- Clements, A. N. . The Biology of Mosquitoes. 2, (1992).
- Long, C. A., Zavala, F. Malaria vaccines and human immune responses. Curr Opin Microbiol. 32, 96-102 (2016).
- Mendis, K. N., David, P. H., Carter, R. Human immune responses against sexual stages of malaria parasites: considerations for malaria vaccines. Int J Parasitol. 20 (4), 497-502 (1990).
- Frings, S., Lindemann, B. Odorant response of isolated olfactory receptor cells is blocked by amiloride. J Membr Biol. 105 (3), 233-243 (1988).
- Froese, A., Szyszka, P., Menzel, R. Effect of GABAergic inhibition on odorant concentration coding in mushroom body intrinsic neurons of the honeybee. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 200 (3), 183-195 (2014).
- Yewhalaw, D., et al. Multiple insecticide resistance: an impediment to insecticide-based malaria vector control program. PLoS One. 6 (1), e16066 (2011).
- Arrese, E. L., Soulages, J. L. Insect fat body: energy, metabolism, and regulation. Annu Rev Entomol. 55, 207-225 (2010).
- Raikhel, A. S., Deitsch, K. W., Sappington, T. W., Crampton, J. M., Beard, C. B., Louis, C. . The Molecular Biology of Insect Disease Vectors: A Methods Manual. , 507-522 (1997).
- Price, D. P., et al. The fat body transcriptomes of the yellow fever mosquito Aedes aegypti, pre- and post- blood meal. PLoS One. 6 (7), e22573 (2011).
- Hansen, I. A., Attardo, G. M., Rodriguez, S. D., Drake, L. L. Four-way regulation of mosquito yolk protein precursor genes by juvenile hormone-, ecdysone-, nutrient-, and insulin-like peptide signaling pathways. Front Physiol. 5, 103 (2014).
- Raikhel, A. S., Dhadialla, T. S. Accumulation of yolk proteins in insect oocytes. Annu Rev Entomol. 37, 217-251 (1992).
- Raikhel, A. S., et al. Molecular biology of mosquito vitellogenesis: from basic studies to genetic engineering of antipathogen immunity. Insect Biochem Mol Biol. 32 (10), 1275-1286 (2002).
- Hansen, I. A., Attardo, G. M., Chandrasekar, R. Ch. 6. Short Views on Insect Molecular Biology. , (2009).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proc Natl Acad Sci USA. 101 (29), 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. J Biol Chem. 280 (21), 20565-20572 (2005).
- Attardo, G. M., Hansen, I. A., Shiao, S. H., Raikhel, A. S. Identification of two cationic amino acid transporters required for nutritional signaling during mosquito reproduction. J Exp Biol. 209 (Pt 16), 3071-3078 (2006).
- Carpenter, V. K., et al. SLC7 amino acid transporters of the yellow fever mosquito Aedes aegypti and their role in fat body TOR signaling and reproduction. J Insect Physiol. 58 (4), 513-522 (2012).
- Attardo, G. M., Higgs, S., Klingler, K. A., Vanlandingham, D. L., Raikhel, A. S. RNA interference-mediated knockdown of a GATA factor reveals a link to anautogeny in the mosquito Aedes aegypti. Proc Natl Acad Sci USA. 100 (23), 13374-13379 (2003).
- Hugo, L. E., et al. Proteomic biomarkers for ageing the mosquito Aedes aegypti to determine risk of pathogen transmission. PLoS One. 8 (3), e58656 (2013).
- Price, D. P., Schilkey, F. D., Ulanov, A., Hansen, I. A. Small mosquitoes, large implications: crowding and starvation affects gene expression and nutrient accumulation in Aedes aegypti. Parasit Vectors. 8, 252 (2015).
- Uchida, K., et al. Induction of oogenesis in mosquitoes (Diptera: Culicidae) by infusion of the hemocoel with amino acids. J Med Entomol. 38 (4), 572-575 (2001).
- Uchida, K., Ohmori, D., Yamakura, F., Suzuki, K. Changes in free amino acid concentration in the hemolymph of the female Culex pipiens pallens (Diptera: Culicidae), after a blood meal. J Med Entomol. 27 (3), 302-308 (1990).
- Hayes, E. Determination of a physiological saline solution for Aedes aegypti .(L). J Econ Entomol. 46 (4), 624-627 (1953).
- Price, D. P., et al. The Fat Body Transcriptomes of the Yellow Fever Mosquito Aedes aegypti, Pre- and Post Blood Meal. Plos One. 6 (7), e22573 (2011).
- Chomczynski, P., Mackey, K. Short technical reports. Modification of the TRI reagent procedure for isolation of RNA from polysaccharide-and proteoglycan-rich sources. Biotechniques. 19 (6), 942-945 (1995).
- Fujiwara, T., Kazawa, T., Haupt, S. S., Kanzaki, R. Postsynaptic odorant concentration dependent inhibition controls temporal properties of spike responses of projection neurons in the moth antennal lobe. PLoS One. 9 (2), e89132 (2014).
- Larsen, W. P. Growth in an insect organ culture. J Insect Physiol. 13 (4), 613-619 (1967).
- Judy, K. J., et al. Isolation, Structure, and Absolute Configuration of a New Natural Insect Juvenile Hormone from Manduca sexta. Proc Natl Acad Sci USA. 70 (5), 1509-1513 (1973).
- Marks, E. P. The action of hormones in insect cell and organ cultures. Gen Comp Endocrinol. 15 (2), 289-302 (1970).
- Hughes, G. L., Pike, A. D., Xue, P., Rasgon, J. L. Invasion of Wolbachia into Anopheles and Other Insect Germlines in an Ex vivo Organ Culture System. PLoS One. 7 (4), e36277 (2012).
- Postlethwait, J. H., Handler, A. M. Roles of Juvenile-Hormone and 20-Hydroxy-Ecdysone during Vitellogenesis in Isolated Abdomens of Drosophila melanogaster. J Insect Physiol. 25 (5), 455-460 (1979).
- Spielman, A., Gwadz, R. W., Anderson, W. A. Ecdysone-initiated ovarian development in mosquitoes. J Insect Physiol. 17 (10), 1807-1814 (1971).
- Boudko, D. Y., et al. Substrate specificity and transport mechanism of amino-acid transceptor Slimfast from Aedes aegypti. Nat Commun. 6, 8546 (2015).
- Fleischer, J., Bumbalo, R., Bautze, V., Strotmann, J., Breer, H. Expression of odorant receptor Olfr78 in enteroendocrine cells of the colon. Cell Tissue Res. 361 (3), 697-710 (2015).
- Jones, K. H., Senft, J. A. An improved method to determine cell viability by simultaneous staining with fluorescein diacetate-propidium iodide. J Histochem Cytochem. 33 (1), 77-79 (1985).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. A3B, (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved