Method Article
多層皮質Ca
要約
ここでは、自由に動くマウスの複数の皮質層にわたる細胞 - 解像度で大規模なCa 2+イメージングを行うための手順を提示する。移植されたプリズムプローブと結合された小型頭部装着型顕微鏡を使用して、数百の活性細胞を同時に観察することができる。
要約
インビボでの回路および細胞レベルの機能イメージングは、脳を実際に理解するための重要なツールです。 2光子顕微鏡法を用いたマウス大脳皮質ニューロンの高解像度イメージングは、皮質構造、機能および可塑性についてのユニークな洞察を提供している。しかし、これらの研究は頭部固定動物に限られており、研究に利用可能な行動の複雑さを大幅に低減する。この論文では、自由に行動するマウスの複数の皮質層にわたる細胞解像度で慢性蛍光顕微鏡検査を行うための手順を説明する。本発明者らは、移植されたプリズムプローブと組合わされた小型の蛍光顕微鏡を使用して、数日間に亘って新しい物体探査課題に関与するマウスとして、体性感覚皮質の複数の層にわたって数百のニューロンのカルシウム動態を同時に視覚化し記録した。この技術は、異なる動物種の他の脳領域に、他の行動paradigms。
概要
皮質は、注意、知覚、トップダウンの認知制御1,2,3から動機づけ、報酬、中毒経路まで、多くの複雑な精神的および行動的機能における必須の要素である 4,5 。その機能の基礎となる計算プロセスを理解することは、多くの精神的および行動的障害のより良い臨床的理解を促進する重要な目標である。
皮質神経回路の機能不全または不調和が、精神分裂病6 、自閉症7または強迫性障害8のような状態の特徴である認知および行動異常の基礎をなす可能性があるという考えのまわりの精神医学的疾患センターの多くの現在の理論が中心である。したがって、共同体からの集団レベルの神経活動データを得ること同時行動情報の適切な文脈内の回路は非常に重要であり、理想的には、より細かい神経回路解剖のための特定の細胞型を標的とすることができる。
埋め込み型勾配屈折率(GRIN)マイクロレンズと組み合わせた小型化された顕微鏡は、皮質14,15,16を含む多様な可能な脳領域9,10,11,12,13から自由に動く条件下でニューロンアンサンブルへの光学的アクセスを可能にする。遺伝的にコード化されたカルシウムインジケータと結合した移動式顕微鏡検査システムを使用することにより、多くの脳領域9において数日から数週間にわたる何百ものニューロンを包含する同じ細胞集団の一貫したイメージングが可能になり、ウイルスベクターまたはトランスジェニック技術を用いて特定の細胞型に遺伝的に標的化される。
皮質が異なる機能をサポートし、皮質薄層17,18,19内の細胞の位置に依存して異なる脳領域に接続することが知られているので、我々は目覚める行動する被験者において同時多層神経活動を得ることに興味がある。ここでは、小型蛍光顕微鏡20を皮質の多層ビュー( 図1 )を提供する移植されたプリズムプローブと組み合わせて使用して、自由に行動するマウスにおいて何百もの蛍光標識されたニューロンを画像化する方法を示す 。
ここで使用されているプリズムプローブは、2つの別々のGRINレンズで構成されています:プリズムとシリンドリカルリレーレンズ( 図1 )。顕微鏡からの光は、蛍光標識されたプローブのプリズム部分の斜辺から反射された後に、プリズムプローブの撮像面に沿って配置される。細胞から放出された光は、プリズムの斜辺から反射し、顕微鏡の対物レンズを通して集められ、顕微鏡内のセンサーに到達する。この手順で使用されるプリズムプローブは、標準の定位固定装置で簡単に使用できるようになっています。
小型蛍光顕微鏡20は、Ca 2+感受性遺伝的にコードされた蛍光インジケータで特異的に標識された後、単一細胞分解能を有するニューロン集団における活動電位誘発性のCa 2+トランジェントを検出する。このプロトコールでは、ウイルスベクター(AAV1.CaMKII.GCaMP6f.WPRE.SV40)にコードされたCa 2+インジケーターを注入し、プリズムプローブを移植し、顕微鏡を設置し、次に体性感覚(S1後肢)神経活動データ動物からの暴露dを自由探査中の新規物体表面に適用する( 図2 )。
プロトコル
動物被験者に関する手順は、カリフォルニア州NASAエイムズリサーチセンターのLifeSource Biomedical Servicesで機関動物管理および使用委員会(IACUC)によって承認されています。
1.手術前の準備
- ホットビーズ滅菌器で外科的処置に使用する器具を滅菌し、70%エタノールで手術部位を拭く。定位固定ステージ上に置かれた加熱パッドをオンにし、37℃で維持する。
- イソフルラン(誘導の場合は5%、維持の場合は1〜2%、O 2の場合は0.6〜0.8L)を使用して動物を麻酔する。麻酔深度を評価するためにつま先のつまみがないことを確認します。
- 耳と歯のバーが取り付けられた定位フレームに動物を乗せる。
- 動物の眼に眼科用軟膏を塗布し、暗い紙で覆い、乾燥や激しい外科手術の灯りから保護します。
- ケトプロフェンを動物に皮下注射する(2.5mg / kg)またはカルプロフェン(2.5mg / kg)
2.ウイルス注射手術
- 目と耳の間の頭皮をトリミングして削り、70%エタノールとベタジンの3つの交互スワブで皮膚を消毒する。
- 頭皮に切開を入れ、目の間を開始し、滅菌外科用ブレードで1.5cmの吻側吻合部まで伸ばして、頭蓋骨を露出させる。頭蓋骨を露出させるために皮膚を開き、綿棒とメスを使用して、所望の注射部位の周りの骨膜を除去する。滅菌PBSで頭蓋をすすいでください。頭皮を清潔にし、綿棒で磨く。
- 頭蓋骨を水平にし、マーカーでウイルス注射の定位座標をマークします。高速マイクロドリル(約7,000〜10,000rpmに設定)に0.5mmバリを使用して、頭蓋骨に小さな穴を作ります。穿孔中にわずかな圧力を加え、断続的に骨の埃をきれいにし、滅菌したPBSでその領域を湿らせて、脳組織が過熱するのを防ぐ痛い穴が掘られたところで脳を湿らせてください。
- マイクロシリンジでウイルス( 例: AAV1.CaMKII.GCaMP6f.WPRE.SV40)を拾うためには26Gの針を使用し、注射用には35Gの針で置き換えます。ウィルスが付着したマイクロシリンジを定位固定装置のマニピュレータアームに取り付ける。
- シリンジを注射部位の穴に近づけ、針の角度を調節して脳の表面に対して90°の角度で入るようにします。硬膜に触れるまで針を下げ、硬膜を貫通させます。針が所望の深さ(z)に達するまで、10μm/ sの増分で針を下降させ始める。定位腕を使用して針の位置を固定する。
- 25 nL /分でウイルスの250 nLを注入するようにマイクロシリンジポンプを設定します。
- 重要なステップ:注射するウイルスの量はタイターと希釈に依存するので、予め希釈実験を行い、細胞を画像化するための最適な容量と濃度の基準を確立する実験では
- いくつかのウイルスが注射部位から出て見える場合は、注射を一時停止し、脳組織がウイルス液滴を吸収するまで待つ。全容量を注入してから5〜7分間待ってから、針を引っ込める。ウイルスが脳表面から出て見える場合に、注射速度を制御するのを助けるために、ファストグリーンのような色素をウイルス溶液に添加することもできる。
- 皮質の複数の層にラベルを付けるには、必要に応じて複数回の注入を行います。最初に腹側の部位で開始し、注射後5〜7分待ってから、注射のために次の最も背側の点に針を引き上げる( 例えば 、-1.0mm AP、1.5mm±MLおよび400および600μmで注射する) DV)。最終注射から10分待ってから、針を抜き取り、定位固定から取り除いてください。
- 少量のin vivo生体適合性透明エラストマー接着剤を二重バレルシリンジから混合する(例えばKwik-Sil)、それと頭蓋骨の穴を覆う。エラストマー接着剤の層の上にシアノアクリレート接着剤を塗布し、硬化させます。
- 頭皮を縫合し、歩行するまで暖かい回復ケージで動物を麻酔から回復させる。動物をケージに戻す前に、ケトプロフェン(2.5mg / kg)またはカルプロフェン(2.5mg / kg)を皮下投与する。単独で術後の被験者を収容し、手術部位を保護し、24時間後に用量を反復する。
- マイクロシリンジを取り外した後、26 Gと35 Gのニードルを蒸留水で7〜10回洗い流して保存してください。
3.プリズムプローブインプラント手術
- 1-2週間のウイルス注入後、プリズムプローブ移植手術の準備をします。プリズムプローブを70%エタノールで消毒し、レンズペーパーで拭いてください。プリズムプローブをレンズホルダーツールに挿入し、ドライバーで六角ネジを締めます。ベースホルダーに顕微鏡を載せます(磁石がその場所に保持されます)。
- 術前準備セクションに記載されているように動物を準備する。
- 目と耳の間で動物の頭をトリミングして剃り、70%エタノールとベタジンの交互スワブで皮膚を消毒する。
- 滅菌はさみで皮膚を切開し、皮膚のフラップと根底にある骨膜を除去して頭蓋骨を露出させる。綿棒で頭蓋骨を乾かし磨きます。周囲の筋肉組織を十分に除去して、清潔で乾燥した広範囲の骨基盤を作り、次のステップに備える。
- 反対側の半球の頭蓋骨のネジをインプラントを安定して固定するためにインプラントします。これらは、セクション5の実験的画像撮影セッションのために動物を準備するために目覚め頭部固定のためのヘッドバーを植え込むことを選択する場合にも有用であり得る。
- 頭蓋骨を水平にし、レンズ挿入のためのAPおよびML座標をマーカマークで示します。マイクロドリル上に0.5mmのバリを使用して、円形の開頭術を行い、e craniotomyの直径は、プリズムの直径、この場合は1.0 mmよりもちょうど大きいです。断続的に中断しながら穏やかに穿孔し、滅菌PBSで頭蓋骨を洗い流し、綿棒で吸い取ります。生成された骨の埃を取り除く。
- 重要なステップ:プリズムが皮質に挿入されたときに、その平坦な端部(イメージング表面)がウイルス注入部位に面し、150〜200μmの半径内にあるように、開頭術を行う。
- 頭蓋骨が完全に薄くなる前に掘削を停止してください。血管は、間引かれた骨を通して見ることができます。細かい45°の鉗子で穏やかに骨のプラグを取り外します。
- #5鉗子で硬膜を削除します。
- クリティカルステップ:脳組織が露出したら、常に組織を湿らせてください。 craniotomy上の滅菌生理食塩水に浸した綿棒を置きます。これにより、組織への圧力も維持されます。
- 脳組織duの圧力を軽減するためにプリズムプローブのリングを挿入すると、事前に挿入領域が作成されます。定位装置の電極ホルダーアームに直線状の解剖ナイフを取り付け、ナイフブレードが頭蓋骨の湾曲に対して垂直である角度(この場合、10°の角度)で、定位装置の電極ホルダアームにウイルス注入カラムに平行な面である。
- 刃先を腹側に向けて( 図1 )、ウイルスの注射部位の側方〜200μmの側方に、その内側前縁に沿って開頭術の上にナイフを注意深く配置する。ナイフ先端がピーアに触れてZ軸をゼロにし、プリズムプローブが挿入される深さまで徐々に(10μm/ s単位で)下げます。その後、ナイフを1mm後方に動かして、プリズムの前縁のための経路を作ります。滅菌前の生理食塩水で切開している間に起こる可能性のある出血を一時停止し、制御する。
- ナイフがこの位置に来たら、滅菌生理食塩水でその部位を洗い流し、出血が治まるまで待つ。その後、定位腕のマイクロマニピュレーターを用いて10μm/ s単位で徐々にナイフを引っ込め、切開部の滅菌生理食塩水に浸したゲルフォームスポンジを置く。
- レンズホルダー(プリズムプローブと顕微鏡付き)を前のステップでナイフと同じ角度で定位マニピュレーターアームに取り付けます。プリズムの平坦な側面が切開部の上にあり、ウイルス注入カラムに平行になるように、プリズムを整列させる。このステップでは、定位腕の位置を微調整する必要があります。より速い結果を得るために、頭蓋骨の近くに留まることによって調整を調整してください。
- プリズムが正しい角度になったら、脳表面から開始して、このプローブの最終zが1.1mmになるように、脳内で10μmずつ徐々に低下させる。脳組織はプリズムの周りに広がり、作成される圧力は視覚の背後にあります視野に影響を与えません。顕微鏡をUSB3ポートを介してインストールされた取得ソフトウェアを備えたコンピュータに接続し、LEDを点灯させて蛍光を視覚化します。
- 25Gの針を使用して、エラストマー接着剤の非常に薄い保護層で、開頭術のプリズム周辺の露出した組織を覆います。
- エラストマー接着剤を硬化させた後(通常約3〜5分)、25G針を使用してシアノアクリレート接着剤を塗布してプリズムレンズのガラスを隣接する頭蓋骨にエラストマー接着剤の層上に取り付け、開腹手術。より良い接着のためにプリズムプローブカフの端を含めてください。埋め込まれたプリズムプローブの上面に接着剤をつかないでください。シアノアクリレート接着剤が硬化したら、レンズホルダーのネジを緩め、顕微鏡を慎重に取り外します。次に、定位固定マニピュレータアームをゆっくりと後退させ、プリズムプローブをしっかりと埋め込んだままにします。
- 歯科用アクリルまたは周囲の収縮した筋肉組織に接触するまで、全ての露出した頭蓋骨表面を覆うために、インプラント周囲のシアノアクリレート接着剤を除去する。この頭蓋骨キャップで頭蓋骨の広い領域をカバーすると、後にベースプレートの取り付けに役立ちます。インプラント部位周辺の皮膚は、頭蓋骨のまわりでそれ自身で治癒するはずである。
- クリティカルステップ:接着剤を周囲の皮膚や筋肉組織に触れさせたり、頭蓋骨の皮膚に浸透させたりしないでください。そうすると皮膚が刺激され、過剰な傷やインプラントへの損傷の原因となります。
- オプション:目を覚ました頭部固定のセットアップを使用して、動物を簡単に麻酔またはスクラッビングするのではなく実験的な撮影セッションで動物のベースプレートに取り付けたり取り外したりしたい場合は、選択肢の固定設定(このプロトコルでは実証されていません)。
- 触媒と塩基をシリコンから混合する。e接着シリンジを使用し、エラストマーの液滴をプリズムプローブカフの内側に入れて、プローブレンズの上部を覆い、損傷や埃の沈降を防ぎます。
- 定位フレームから動物を取り出し、暖かいチャンバーで麻酔から回復させる。皮下にケトプロフェン(2.5mg / kg)またはカルプロフェン(2.5mg / kg)を投与し、移動したらきれいなホームケージに戻します。インプラントを保護するためにすべての被験者を単独で収容し、24時間後にその投与量を繰り返す。
4.ミニチュア顕微鏡設置用ベースプレートアタッチメント
- プリズムプローブを移植してから1〜10日後に、移植されたプリズムプローブを介して組織内のウイルス発現をチェックし、調製物が細胞活性を示す場合、ベースプレートを頭蓋骨に取り付ける。顕微鏡は、ライブイメージング中にベースプレート上にドッキングします。
- ベースプレートの取り付けのために動物を準備するための術前手順に記載されている手順に従ってください。
- 移植されたプリズムプローブレンズ上部の表面上にシリコーン接着剤キャップを取り除きます。レンズプローブの表面を調べ、レンズペーパーと70%エタノールで埃を清潔に除去し、イメージング表面がきれいであることを確認します。
- 顕微鏡をDAQボックスに接続し、USB3ポートを介してPCに接続します。
- コンピュータ上の取得ソフトウェアを開き、顕微鏡をUSB3ポート経由で接続します。神経活動をチェックするため、およびこの被験者の将来の記録の視野設定を測定および文書化するために、収集ソフトウェアを使用する。
- 顕微鏡にベースプレートを取り付け、ベースプレートセットスクリューを固定してベースプレートを所定の位置に保持し、顕微鏡の本体によって定位マイクロマニピュレーターアーム上の顕微鏡グリッパーに顕微鏡を固定する。定位置マイクロマニピュレーターアームに取り付けることができるニューポートロッドにグリッパーを取り付けます。
- sを使用してプリズムプローブレンズの上に顕微鏡を置きますtereotaxicマイクロマニピュレーターアーム。視覚的には、動物のステージの側面と背面からプリズムレンズを見て向きを点検します。顕微鏡用対物レンズとプリズムプローブレンズの両方の光軸は一致させなければなりません。
- ソフトウェアを通して顕微鏡LEDを点灯させます。取得ソフトウェアの移植されたプリズムプローブレンズの上面に焦点を合わせることによって、顕微鏡の位置合わせの品質を評価します。適切に位置合わせされたとき、プリズムプローブレンズの上面のエッジは鋭くすべきである。
- stereotaxicマニピュレータアームを使用して、移植されたプリズムプローブの上の顕微鏡の物理的距離を調整し、組織内の所望の焦点面を得る。顕微鏡対物レンズと移植されたGRINレンズとの間の光学的に最適化された距離は約500μmである。
- 所望のイメージング平面が捕捉されると、参照蛍光イメージを保存する。
重要な点:顕微鏡の位置を調整しないでください。顕微鏡の位置が変わるため、顕微鏡の位置を調整しないでください。組織内の結像面のオンとなる。
注:次のステップで接着剤を塗布して、ベースプレートの位置を頭蓋に固定します。接着剤は、次の1日または2日にいくらかの体積収縮を経験する可能性があり、これは組織内の焦点面を変える可能性がある。接着剤塗布工程に進む前に、接着剤混合物および生体外距離の収縮量を測定し、顕微鏡+ベースプレートの最終Z位置をその量だけバックアップすることによって、これを事前に考慮する。 - 歯科アクリルまたはシアノアクリレートを使用して、動物の頭蓋骨を覆っているアクリルキャップにベースプレートを恒久的に取り付け、アクリルまたは接着剤との隙間を橋渡しします。歯科用アクリル/シアノアクリレートを徐々に塗布し、多段階で硬化させることにより、前述の収縮が顕微鏡の画像面の最終位置に及ぼす影響を最小限に抑えることができる。
- クリティカルステップ:歯科治療中に注意してくださいアクリル/シアノアクリレートを使用して、顕微鏡の対物レンズ、セットスクリュー、または顕微鏡本体に物質が接触するのを防ぎます。これにより、後で計測器が正しく動作しなくなります。
- クリティカルステップ:接着剤を塗布しながら、顕微鏡を押す必要はありません。顕微鏡またはベースプレートに対する圧力は、プリズムプローブレンズに対する顕微鏡対物レンズの動きを引き起こし、その結果、ミスアライメントまたは迅速な再調整を必要とする組織内の焦点面の変化が生じる可能性がある。
- 歯科用アクリル/シアノアクリレートが、一対の鉗子またはシリンジ先端でアクリルを叩くことによって硬化し、硬化したことを確認する。取得ソフトウェアで最終参照蛍光画像を取得する。
- グリッパから顕微鏡を離し、グリッパを顕微鏡から引き抜きます。シアノアクリレートなどの透明接着剤を使用した場合は、黒いマニキュアまたは黒色の歯科用セメントの層で覆い、実験中に得られた将来の画像を汚染する可能性のあるヘッドキャップ内への軽い光漏れ。
- この時点で、必要に応じて顕微鏡を取り外します。顕微鏡をベースプレートから分離するには、セットスクリューを反時計回りに約1/2回転させてベースプレートセットスクリューを外します。もう一方の手でベースプレートとアクリルキャップを支えながら顕微鏡本体を挟み、顕微鏡をまっすぐ引き上げます。保管容器に入れ替えます。
- 移植されたプリズムプローブをベースプレートカバーで保護します。これによりレンズ表面に塵埃が付着するのを防ぎます。ベースプレートを取り付けた後はきれいにすることができます。
- ベースプレートカバーをベースプレートに取り付け、セットスクリューを時計回りに約1/2回転させるか、またはセットスクリューがベースプレートカバーと同じ高さになるまで進めます。過度にしないでください。
- 動物を麻酔から取り除き、歩行するまで暖かい回復チャンバーでモニターする。戻るその家の檻へインプラントを保護するために、移植されたベースプレートですべての動物を単独で収容します。
自由に動くマウスに複数の皮質層を画像化する
- 行動装置( 例えば、 Phenotyper、Noldus)を洗浄して消毒し、10%漂白剤溶液で拭いて準備する。
- 顕微鏡をDAQボックスに差し込み、コンピュータに接続し、収集ソフトウェアを起動します。
- 収集コンピュータ上の十分なファイルストレージスペースを確認し、カルシウムイメージングムービー用のスペースを確保します。顕微鏡とコンピュータの間の高いデータ転送速度に対応し、記録中にデータが失われないように、外付けハードドライブに書き込むのではなく、ソフトウェアからローカルハードディスクに直接保存します。
- 顕微鏡を取り付けるために誘導チャンバー内でイソフルラン(酸素中5%)で動物を麻酔する。あるいは、動物を静かにこすったり、目を覚まされた頭に固定された設定麻酔が選択された行動パラダイムを妨害することがわかっている場合には、頭部を持ってください。
- ベースプレートの止めねじを反時計回りに回し、ベースプレートのカバーを持ち上げて、ベースプレートのカバーを取り外します。
- 顕微鏡のベースプレートを動物の上に置きます。顕微鏡はベースプレート上の磁石の助けを借りて所定の位置にはめ込まれるべきです。わずかな抵抗が感じられるまでベースプレートセットスクリューを前進させます。
- 重要なステップ:ベースプレートの固定ネジを締めすぎないようにして、顕微鏡ハウジングが損傷しないようにします。
- ソフトウェアで蛍光スナップショットを取得し、必要に応じて顕微鏡のタレットセットのネジを緩めて顕微鏡のタレットを回転させて細かい焦点を調整し、次にタレットを締め直して組織内の焦点面を調整して組織内のイメージング面を確認しますハウジングセットスクリュー。
- クリティカルステップ:最初にセットスクリューを緩めることなくタレットを回転させないでください。タレットセットネジを締めすぎないでください。
- 縦方向の調査を行う場合は、物理的なタレット位置に戻り、同じ視野をキャプチャします。ハードウェアでは、同じ視野に素早く戻るために同じ顕微鏡で撮影された各動物について、タレットの回転数またはタレットの物理的位置を記録します。
- 顕微鏡を携行している動物をホームケージまたは行動室に放出して適応させ、適用可能であれば麻酔の消耗を待つ。
- クリティカルステップ:実験セッションを開始する前に、顕微鏡を身に着けて正常動作を妨げないようにするまで、ダミー顕微鏡を使用して、いくつかのセッションのために顕微鏡の重量を運ぶように動物を訓練する。目まぐるしい拘束のための通常の取り扱いと訓練は動物に過度のストレスを与えないようにする。
- データ収集に使用する取得設定を選択します。これには、私はデータをキャプチャするためのレート( たとえば、 20 fps、ゲイン1、LEDパワー50%)。良好なSNRを保証するために設定を選択するときは、画像ヒストグラムを確認してください。
注:蛍光収集の開口数は、1mmのプリズムプローブでは0.35であり、1mmの直線プローブでは0.5であるのに対して、0.35である。 - ビヘイビアソフトウェアを起動し、所望のイメージング記録サイクル( 例えば 、4×5分ON 2分OFF)で顕微鏡をトリガーするようプログラムする。 Noldus IOボックスのTTLポートをRJ45-BNCケーブルを介してDAQボックスのTRIGポートに接続します。
- まだそこにいなければ、動物を行動場に置き、実験を始める。
- 所望のデータを取得した後、誘導チャンバ内でイソフルラン(酸素中5%)で動物を再麻酔するか、または動物を静かに覚醒させる。
- ベースプレートセットのネジを緩め、顕微鏡を静かに引き上げてベースプレートから顕微鏡を取り外します。ベースプレートカバーを取り付け、ベースプレートを静かに締めますセットスクリュー。
- 次回の記録まで動物をホームケージに戻してください。後続の画像化セッションを同じ視野に戻すための基準として、参照蛍光画像を使用する。
6.大規模なCa 2+イメージングデータの評価
- 視野内の細胞位置およびCa 2+動態をデータから抽出するために、異なるデータ解析プラットフォームを使用することができる。大規模なCa 2+イメージングムービーを処理するために特別に設計されたデータ解析プラットフォームであるMosaicは、ここでこの研究に使用されています。
- 不良ピクセルを修正し、前処理ステップで生のムービー内にドロップされた個々のフレームを補間します。スペース1,440 x 1,080ピクセルの視野から720 x 540ピクセルまで画像をビンして、データフットプリントを削減します。
- 顕微鏡のイメージセンサーに関する脳のモーションアーチファクトを補正するには、厳密なImageJベースのイメージを使用してムービーを登録しますgistrationアルゴリズム(TurboReg)。
- 個々のニューロンを同定するために、蛍光の相対的変化として画像を再表現する。ΔF/ F 0 = FF 0 / F 0ここで、F 0は映画全体を平均して得られる平均画像である。
- 確立されたセルソートアルゴリズムを使用して、個々のセルに対応する空間フィルタを識別します。ここでは、個々のニューロンを識別するためにプリンシパルおよび個別コンポーネント分析21を使用しました。
注記:トレース中のイベントのピーク振幅が、データセットのトレースのベースラインから8標準偏差を超えており、細胞位置およびCa 2+動態データをさらなる分析のためにエクスポートした場合、イベントが指定されました。
結果
ここに概説されたプロトコルは、プリズムプローブ( 図1 )を用いて自由に行動するマウスにおいて、何百もの皮質ニューロンから縦多層のCa 2+イメージングを行う効果的かつ効率的な方法を説明している。多層皮質画像化への以前のアプローチは、主に固定動物22,23,24,25,26,27に限定されていた。自由に行動する状況でこのレベルのデータを取得するために、小型化された顕微鏡プラットフォームを行動の柔軟性のために使用した。遺伝的にコードされたカルシウム指示薬(GCaMP6f)を用いて特定の細胞集団(CAMKII +細胞の皮質)を標的化した。慢性の多層視野を提供するためにプリズムプローブを選択した。
イメージングのために動物を準備するためのワークフローを実演しました。適切なカルシウムインジケータをコードするウイルスベクターを、標識細胞への光学的アクセスを可能にするプリズムプローブを慢性的に移植する前に、皮質に注入した( 図2 、ステップ1)。イメージングセッション中に顕微鏡を配置するための安全な一時的ドックとして機能するベースプレートを動物頭部に設置し( 図2 、ステップ3)、覚醒している実験的実験で複数の細胞層にわたる皮質活動の可視化を可能にしたセットアップ( 図2 、ステップ4)。
所望の細胞集団を確実に標的とするために、代表的なマウス由来の死後の冠状脳切片を図3に示し、プリズムプローブ領域および視野をGCaMP6fラボに関連してマークした身体感覚皮質の2/3および5層における神経細胞の脱出。
Open Field(1日目)、Object Familiarization(2日目〜4日目)、およびNovel Object(5日目)の3つの異なる環境にマウスを曝露したとき、体感感覚皮質ニューロンの活動が記録された。 図4 )。 1日目に、マウスは何の物体も欠いている行動アリーナに置かれた。 2〜4日目に、同じ2つのテクスチャ的に異なるオブジェクト(ゲルパッドと木ブロック)を用いてマウスをアリーナに配置した。 5日目に、オブジェクトの1つが新しいオブジェクトに置き換えられました。動物を毎日20分間5日間にわたって撮像した。
Ca 2+画像データ分析ソフトウェアを用いた細胞抽出後、細胞位置に対応する空間フィルタを、顕微鏡記録データの平均蛍光強度投影上に重ねた( 図5) 。白い破線は、層2/3および5のセルを分離する。各層からの5つの細胞からの対応するCa 2+トレースは、2つの異なる行動状況、すなわち、オブジェクトのファミリアリゼーションおよび新規のオブジェクト曝露における細胞の発火パターンを示す。層2/3細胞は、マウスを新規対象に曝露した日に層5細胞と比較してより活性であった。これは、1日目、4日目および5日目に撮像されたすべての細胞の閾値化された発火活性を示すラスタプロットからも明らかである。
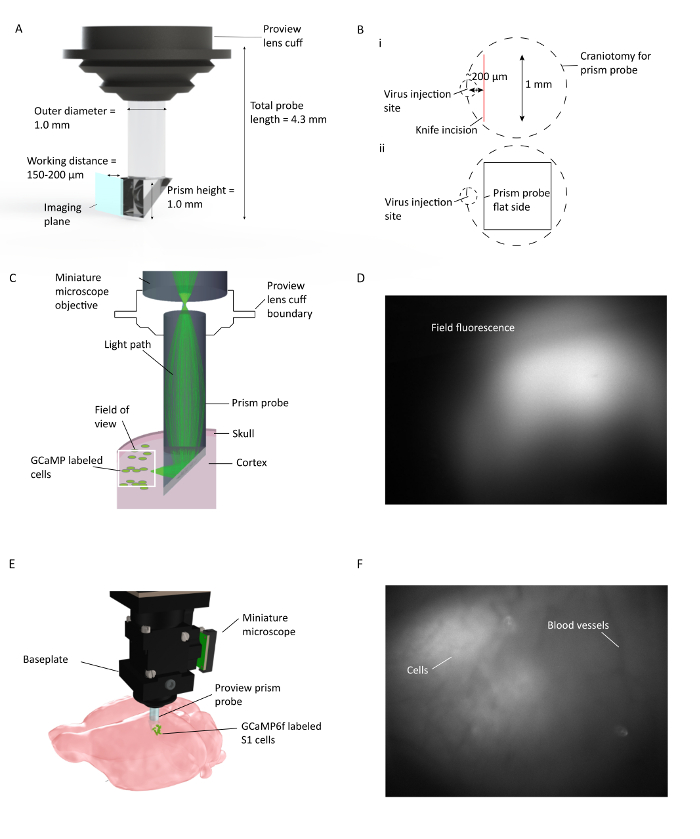
図1:自由に動くマウスにおける複数の皮質層にわたるインビボ Ca 2+イメージング。 ( A )プリズムプローブの仕様とイメージング面の描写。斜辺の内側の反射コーティングは、プリズムプローブの挿入面から90°の結像を可能にする。レンズcuffはレンズホルダーと一体化し、移植手順を合理化し、移植中の周辺組織の蛍光を潜在的に見ることができる( B )(i)。 (ii)ナイフ切開およびウイルス注射部位に対するプリズムプローブの平らな側面の位置の図解である。 ( C )マウス大脳皮質に移植されたプリズムプローブを介して全視野内の小さな領域の光路を示すインビボ Ca 2+イメージング設定の図。 ( D )プリズムプローブ設置中の視野の例。ミニチュア顕微鏡はプリズムプローブを保持するレンズホルダーに取り付けられており、プリズムプローブの設置中にウイルスの発現を確認することができます。 ( E )GCaMP6f標識S1細胞の多層皮質画像化のためのプリズムプローブと顕微鏡の統合。 F視野の例ベースプレートの取り付け時。生の画像にいくつかの細胞を入れたベースプレートの設置時に、明確な血管パターンが見えます。取得ソフトウェアウィンドウでDF / Fをオンにすると、より多くのセルがはっきりと見えます。 この図の拡大版を見るには、ここをクリックしてください。
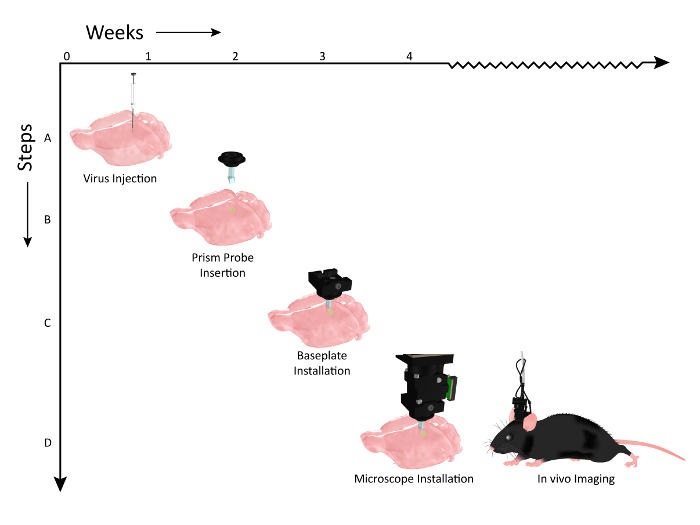
図2:Prism Probe ImplantationとMicroscope Installationのワークフローイベントのタイムラインを示す図。週数は、Y軸に沿ったプロシージャのX軸とワークフローのステップで表されます。 ( A )マウス体性感覚皮質の複数の層を標識するために、同じ背側腹軸に沿ったウイルス注射(AAV1.CaMKII.GCaMP6f.WPRE.SV40)を示す図。 ( B )ウイルス注射の2週間後、プリズム・プローブeは、ウイルス注入部位に平行な軸に移植される。 ( C )プリズムプローブ移植のおよそ1週間後、動物の顕微鏡での発現をチェックし、細胞集団が見える場合には、ベースプレートを頭部に装着する。 ( D )その後、動物は、関連する行動課題(マウスクリップアートは、UW-Madison Biochemistry MediaLabから許可を得て変更された)の間、慢性画像化の準備が整う。 この図の拡大版を見るには、ここをクリックしてください。
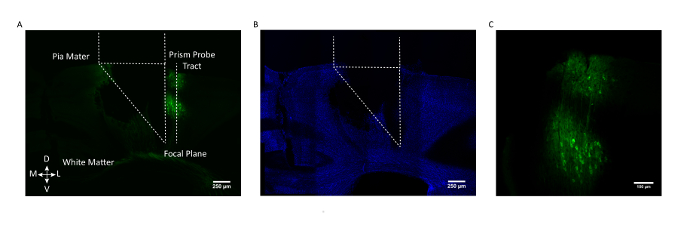
図3:プリズムプローブの位置およびGCaMP発現の死後の組織学的検証。 ( A )プリズムプローブ領域を示し、そのイメージング側が向いている代表的なマウスの脳からの冠状切片GCaMP6f発現細胞(AAV1.CaMKII.GCaMP6fは、層2/3および5のニューロンにおいて発現される)。 ( B )DAPIに対する染色後の同じ冠状脳切片。スケールバー=250μm( C )体性感覚皮質におけるGCaMP6f発現細胞の視野を拡大。スケールバー=100μm。 この図の拡大版を見るには、ここをクリックしてください。
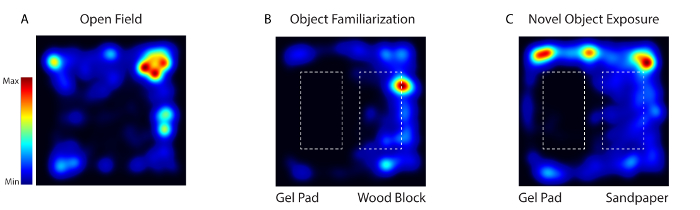
図4:慣れている間のマウスの活動、ファミリアリゼーション、および新規オブジェクトの露出テストはビデオソフトウェアを使用してビデオトラッキングされました。 ( A )1日目に、動物は何の物体も欠いている行動場に置かれた(オープンフィールド)。 ( B )2〜4日目に、同じ2つのテクスチャ的に異なるオブジェクト(ゲルパッドと木ブロック)をアリーナに置いた(Object Fami嘘つき)。 ( C )5日目に、物体の1つを新しい物体(砂の木を有する木ブロック)(新規物体曝露)に置き換えた。 この図の拡大版を見るには、ここをクリックしてください。
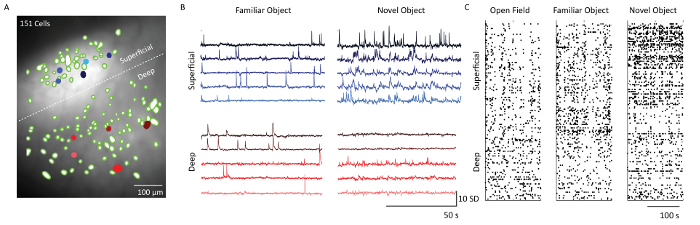
図5:顕微鏡で撮影された代表的なマウスの体性感覚皮質の表層および深層からのカルシウム動態。 ( A )ニューロンの空間フィルタ(緑色の斑点)と、プリズムプローブ視野を通した顕微鏡記録の平均蛍光強度投影の合成画像。白い破線で示される顆粒層と顆粒層の間の境界。スケールバー=100μm。 ( B )5つの例示的な表層細胞および深層細胞からのカルシウムトレース(青色および赤色のcパネルAのells)、主成分分析および独立成分分析後の蛍光の標準偏差の単位を示す。水平スケールバー50sおよび垂直スケールバー10SD( C )オープンフィールド、オブジェクトファミリアリゼーションおよびノベルオブジェクトの探索で示された表面(レイヤ2/3)および深層(レイヤ5)からのセルのラスタプロット。スケールバー= 100秒。 この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
覚醒行動中の神経回路活動を理解することは、健康および疾患における脳機能を効果的に解剖するために必要な神経科学的調査の極めて重要なレベルである。皮質は、多くの重要な感覚、認知および執行機能において重要な役割を果たすので、目覚め行動の文脈において研究するために特に重要な領域である 28,29 。
皮質柱は皮質の基本機能単位であると考えられ、皮質細胞の集団レベルの活動は柱内の物理的位置に基づいて異なることが知られている。例えば、体性感覚皮質の層2/3の興奮性ニューロンは、主に他の新皮質領域に投射し、他の皮質網30を変調するが、深層の細胞は主に視床31のような皮質下領域に投射する。百の活動を記録する自由行動する被験者の異なる薄層を経て、時間と共に同時に予め指定された皮質細胞の塊状構造が、皮質情報フローの我々の理解を大きく促進し、リアルタイムの行動情報およびタスク関連の時間依存性の情報によって知らされる皮質柱の、スケール。
このレベルの神経回路データを収集することは、自由に行動する被験者(または頭に固定された被験者)における大規模なCa 2+イメージングを行うための、効率的かつ合理化された小型化された顕微鏡プラットホームの使用によって可能となる。このプロトコルは、細胞型特異的標的化を可能にする遺伝的にコード化されたカルシウムインジケータとともに使用され、慢性的に移植されたプリズムプローブによって提供される多層視野を画像化する、このプロトコルは、多くの可能な用途の1つのケースを探究した:マウスの体性感覚皮質処理物理的に新しい物体と噛み合っていた( 図5 )。これは、起きて自由に行動する動物において複数の皮質層を研究するためのこの種の細胞型特異的インビボアプローチの最初の手順図であり、能動的な脳の層状構造を理解するのに利用可能な実験方法のスペクトルを広げる。
関心領域に直接背側の組織の保存が望まれる場合、この技術におけるプリズムプローブによって有効にされる展望視野は、他の脳構造に適用可能である。例えば、CA3画像化は、海馬の機能を中断させることなく達成することができた。
Ca 2+活性をイメージングするためのプリズムプローブベースのアプローチは、皮質へのマイクロプリズムの物理的挿入および永久移植を必要とし、これはレンズプローブが挿入される皮質病変の生成に相当する。これは、頂端の樹状突起およびプロセスの切断を含む、局所的な神経回路への混乱をもたらす可能性がある。 T彼の手順はまた、領域内のグリア細胞の初期活性化を引き起こすが、これは、プリズム表面から約150μmの組織に局在し、脳が治癒した後に鎮静すると予想される。実験を計画するとき、この技法が動物の正常な回路解剖学および/または行動に影響するかどうかを検討することは非常に重要である。行動対照群は、交絡実験結果を生み出すベースライン行動に重大な変化がないことを確実にするために常に実施すべきである。
神経薬理学的操作、様々な認知的、社会的、運動的または内的行動学的パラダイムを用いたこの小型化された移動性Ca 2+イメージング技術を使用し、それを他の生理学的測定基準と組み合わせることにより、行動および信号における神経回路の機能的役割処理32 。抑制または活動薬物によって調節される特定の経路の作用は、この技術を用いて容易に研究することができる関連する行動に影響し得る33 。カルシウムインジケータのターゲッティングを変更することによって異なる細胞型に分岐することは、他の強力かつ有用な応用であり、様々な神経回路の問題に対処するための実験ツールの多くの独創的な組み合わせを可能にする。
開示事項
著者はジャーナルの方針を読み、以下の競合する利益を持っています:SG、SO、VCはInscopixの従業員です。
謝辞
著者らは、AAV1-GCaMP6fの寛大な寄贈について、Howard Hughes Medical InstituteのJanelia Research CampusのGenetically-Encoded Neuronal Indicator and Effector(GENIE)プロジェクトのV. Jayaraman、DS Kim、LL LoogerおよびK. Svobodaに感謝したい。ペンシルバニア大学のVector Coreに彼らはまた、共焦点顕微鏡検査サービスのためのNIH NS069375助成金によって支えられているスタンフォード大学のA.オルソンと神経科学顕微鏡コアに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Neurostar Motorized Ultra Precise Small Animal Stereotaxic Instrument | Kopf | Model 963SD | Surgery |
| Stereoscope | Labomed | Prima DNT | Surgery and Imaging |
| Mini Rectal Thermistor Probe (.062"/1.6 mm diameter) - 1/4" Jack | FHC | 40-90-5D-02 | Surgery |
| Heating Pad 5 X 12.5 cm | FHC | 40-90-2-07 | Surgery |
| DC Temperature Controller | FHC | 40-90-8D | Surgery |
| Microsyringe Pump | World Precision Instruments | UMP3 model; serial 155788 F110 | Surgery |
| NanoFil 10 μL Syringe | World Precision Instruments | NANOFIL | Surgery |
| 35 G Beveled Tip Nanofil NDL 2PK | World Precision Instruments | NF35BV-2 | Surgery |
| Omnidrill35, 115 - 230 V | World Precision Instruments | 503598 | Surgery |
| Burrs for Micro Drill | Fine Science Tools | 19007-05 | Surgery |
| nVista | Inscopix | 100-001048 | Imaging |
| AAV1.CaMKII.GCaMP6f.WPRE.SV40 | Penn Vector Core | AV-1-PV3435 | Surgery |
| Ketoprofen | Victor Medical | 5487 | Surgery |
| Carprofen | Victor Medical | 1699008 | Surgery |
| Isoflurane | Victor Medical | 1001054 | Surgery |
| Gelfoam (Patterson Veterinary Supply Inc Gelfoam Sponge 12 cm x 7 mm) | Pfizer (Fisher Scientific) | NC9841478 | Surgery |
| Dumont #5/45 forceps | Fine Science Tools | 11251-35 | Surgery |
| Dumont #5 forceps | Fine Science Tools | 11251-30 | Surgery |
| Dissecting knives | Fine Science Tools | 10055-12 | Surgery |
| ProView Implant Kit | Inscopix | 100-000756 | Surgery and Imaging |
| ProView Prism Probe 1.0 mm-Dia. ~4.3 mm Length | Inscopix | 100-000592 | Surgery and Imaging |
| Kwik-Sil adhesive pack of 2 | World Precision Instruments | KWIK-SIL | Surgery |
| Kwik-Cast Sealant | World Precision Instruments | KWIK-CAST | Surgery and Imaging |
| Miniature Optical Mounting Post | Newport | M-TSP-3 | Imaging |
| Microscope Baseplate | Inscopix | BPL-2 | Imaging |
| Microscope Baseplate Cover | Inscopix | BPC-2 | Imaging |
参考文献
- McConnell, S. K. Development and decision-making in the mammalian cerebral cortex. Brain Res. 472 (1), 1-23 (1988).
- Kwon, S. E., Yang, H., Minamisawa, G., O'Connor, D. H. Sensory and decision-related activity propagate in a cortical feedback loop during touch perception. Nat. Neurosci. 19 (9), 1243-1249 (2016).
- Miller, E. K., Cohen, J. D. An integrative theory of prefrontal cortex function. Annu. Rev. Neurosci. 24, 167-202 (2001).
- Bailey, M. R., Simpson, E. H., Balsam, P. D. Neural substrates underlying effort, time, and risk-based decision making in motivated behavior. Neurobiol. Learn. Mem. 133, 233-256 (2016).
- Dehaene, S., Changeux, J. P. Reward-dependent learning in neuronal networks for planning and decision making. Prog. Brain Res. 126, 217-229 (2000).
- Ferenczi, E. A., et al. Prefrontal cortical regulation of brainwide circuit dynamics and reward-related behavior. Science. 351 (6268), aac9698 (2016).
- Anomal, R. F., et al. Impaired Processing in the Primary Auditory Cortex of an Animal Model of Autism. Front. Sys. Neurosci. 9, 158 (2015).
- Pauls, D. L., Abramovitch, A., Rauch, S. L., Geller, D. A. Obsessive-compulsive disorder: an integrative genetic and neurobiological perspective. Nat. Rev. Neurosci. 15 (6), 410-424 (2014).
- Ziv, Y., et al. Long-term dynamics of CA1 hippocampal place codes. Nat. Neurosci. 16 (3), 264-266 (2013).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Sun, C., et al. Distinct speed dependence of entorhinal island and ocean cells, including respective grid cells. Proc. Natl. Acad. Sci. 112 (30), 9466-9471 (2015).
- Kitamura, T., et al. Entorhinal Cortical Ocean Cells Encode Specific Contexts and Drive Context-Specific Fear Memory. Neuron. 87 (6), 1317-1331 (2015).
- Pinto, L., Dan, Y. Cell-Type-Specific Activity in Prefrontal Cortex during Goal-Directed Behavior. Neuron. 87 (2), 437-450 (2015).
- Cox, J., Pinto, L., Dan, Y. Calcium imaging of sleep-wake related neuronal activity in the dorsal pons. Nat. Comm. 7, 10763 (2016).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nat. Protoc. 11 (3), 566-597 (2016).
- Hooks, B. M., et al. Organization of cortical and thalamic input to pyramidal neurons in mouse motor cortex. The J. Neurosci. 33 (2), 748-760 (2013).
- Masamizu, Y., et al. Two distinct layer-specific dynamics of cortical ensembles during learning of a motor task. Nat. Neurosci. 17 (7), 987-994 (2014).
- Rowland, D. C., Moser, M. -. B. From cortical modules to memories. Curr. Opin. Neurobiol. 24 (1), 22-27 (2014).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nat. Methods. 8 (10), 871-878 (2011).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Andermann, M. L., et al. Chronic cellular imaging of entire cortical columns in awake mice using microprisms. Neuron. 80 (4), 900-913 (2013).
- Goldey, G. J., et al. Removable cranial windows for long-term imaging in awake mice. Nat. Protoc. 9 (11), 2515-2538 (2014).
- Chia, T. H., Levene, M. J. In vivo imaging of deep cortical layers using a microprism. J. Vis. Exp. (30), (2009).
- Chia, T. H., Levene, M. J. Microprisms for in vivo multilayer cortical imaging. J. Neurophysiol. 102 (2), 1310-1314 (2009).
- Chia, T. H., Levene, M. J. Multi-layer in vivo imaging of neocortex using a microprism. Cold Spring Harb. Protoc. 2010 (8), (2010).
- Low, R. J., Gu, Y., Tank, D. W. Cellular resolution optical access to brain regions in fissures: imaging medial prefrontal cortex and grid cells in entorhinal cortex. Proc. Natl. Acad. Sci. 111 (52), 18739-18744 (2014).
- Zeisel, A., et al. Brain structure. Cell types in the mouse cortex and hippocampus revealed by single-cell RNA-seq. Science. 347 (6226), 1138-1142 (2015).
- Hawrylycz, M., et al. Inferring cortical function in the mouse visual system through large-scale systems neuroscience. Proc. Natl. Acad. Sci. 113 (27), 7337-7344 (2016).
- Petrof, I., Viaene, A. N., Sherman, S. M. Properties of the primary somatosensory cortex projection to the primary motor cortex in the mouse. J. Neurophysiol. 113 (7), 2400-2407 (2015).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Euro. J. Neurosci. 31 (12), 2221-2233 (2010).
- Rogan, S. C., Roth, B. L. Remote control of neuronal signaling. Pharma. Rev. 63 (2), 291-315 (2011).
- Berdyyeva, T., et al. Zolpidem reduces hippocampal neuronal activity in freely behaving mice: a large scale calcium imaging study with miniaturized fluorescence microscope. PloS One. 9 (11), e112068 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved