Method Article
スライス パッチ ・ クランプの技術学習によって誘発される可塑性を分析するため
要約
スライス パッチ ・ クランプの技術は、組み込みのプロパティと興奮性、抑制性のシナプスの可塑性の学習による変化を分析するための効果的な方法です。
要約
スライス パッチ ・ クランプの技術は、特定の脳領域の学習による神経可塑性を調査するための強力なツールです。運動学習による可塑性を分析するには、回転ロッド タスクを使用してラットを訓練されます。ラットは、30 の間隔で 10 回 1 または 2 日間のタスクを実行します。最初の試験と比較してトレーニング日にパフォーマンス向上を。我々 は、訓練を受け、訓練を受けたラットにおける一次運動野 (M1) 急性脳スライスを準備しました。電流クランプ分析は、層 II/III 錐体細胞の膜抵抗、環形動物、スパイクしきい値膜電位を安静時のダイナミックな変化を示した。電流注入による未熟なコントロールよりも 2 日間訓練を受けたラットの多くより多くスパイクです。
文脈ラーニング誘起塑性を分析するには、抑制性回避 (IA) タスクを用いたラットを訓練されます。ボックスのダークサイドのフット ショックを経験した後、ラット ライト側での滞在は、それを避けることを学んだ。私たちは、未熟な対になっていない、IA 訓練から急性海馬スライスとウォークスルー ラットを用意しました。クランプ電圧解析は、ミニチュア興奮性および抑制性シナプス後電流 (mEPSCs および mIPSCs) 同じの CA1 ニューロンからを連続的に記録していました。各ニューロンがその興奮性および抑制性シナプスで別のシナプス強みを持っていたことを示唆している各 CA1 細胞に別の平均の mEPSC と mIPSC の振幅を見つけた。また、未熟なコントロールと比較して、IA の訓練を受けたラットは幅広い多様性より高い mEPSC と mIPSC 振幅を持っていた。文脈ラーニングが各 CA1 ニューロンに興奮性と抑制性シナプスのシナプスの多様性を作成することが示唆されました。
CNQX で温浴以来シナプス電流を仲介するように見えた AMPA または GABAAの受容体やビククリンによりブロックそれぞれ mEPSC または mIPSC イベント。この手法は、さまざまな種類の感覚野と扁桃体などの他の地域での学習を研究する使用できます。
概要
Neher とザックマン, によって開発された、パッチ ・ クランプの技術は、電気生理学的実験1のため広く使用されています。全細胞パッチ クランプ法2は、細胞内電流や細胞膜の gigaohm シールを使用して電圧を記録する使用できます。電流クランプの技術ポテンシャル、抵抗と容量3を休んでなど膜特性の違いを分析することが出来ます。電圧クランプ技術は、私たちは興奮性と抑制性シナプスで学習によるシナプス可塑性を分析することができます。
一次運動野 (M1) は、熟練した自発的な動きの重要な中心地です。以前の電気生理学的研究を示した長期増強 (LTP) の開発-第 II/III 興奮性シナプス後熟練運動トレーニング4層の可塑性が好き。さら生体内イメージング研究はさらに、熟練の到達タスク5,6後 M1 樹状突起スパインの改造を示した。ただし、学習によるシナプスと本質的な可塑性は、M1 ニューロンで示されていません。
我々 は最近、ローター棒作業促進グルタミン酸作動性のダイナミックな変化と gaba 作動性シナプスし M1 層 II/III ニューロン7の組み込みの可塑性を変更を報告しました。ここで我々 は学習によって誘発される可塑性を調査するのにスライス パッチ ・ クランプの技術を使用しました。この手法は、他の頭脳領域における経験依存的可塑性の他のタイプを調査するも使用できます。たとえば、バレル皮質に感覚入力は、層 II/III ニューロン8に AMPA 受容体を介した興奮性入力を強化することが、工夫の恐怖条件付け強化外側扁桃体ニューロンに興奮性の入力が求められるためメモリ9を恐れてください。また、文脈ラーニングは、海馬 CA1 ニューロン10,11に興奮性および抑制性シナプス入力の面で多様性を作成します。
プロトコル
動物実験の山口大学医学部のガイドラインに従っていたし、制度的動物のケアと使用山口委員会によって承認されたすべての動物飼育および外科的処置大学
。1 です動物
- 4-5 週齢雄 Sprague-dawley ラット (生後 28 ~ 31 日年齢) を使用します。 。
- 家の 12 時間の明暗サイクルの下で個々 のプラスチック製ケージ (40 cm × 25 cm × 25 cm) でラットを (23 ° C ± 1 ° C) の温度を一定に維持します。水や食料をラット 自由 アクセスを提供します 。
2。ローター ロッド テスト
- 学習、ローター棒テスト 各ラットを対象 の運動能力を調査する
- (ロッド径 7 cm; 車線幅 8.9 cm; 落下高さ 26.7 cm) 1 または 2 日連続 ( 図 1 a の木田ら、2016 < supクラス ="xref"> 7)。静かで温度制御ルーム (23 ± 1 ° C) でタスクを実行します。邪魔したり、テスト前にラットを扱うしないでください
- 5 分で 40 回転/分 (80 π/分 8 π/分) に 4 回転/分からなる加速度モードにローター ロッドを設定
- は、安静時の回転棒にラットを置きます。すべての手足がロッドにことを確認します 。
- 運動パフォーマンスを評価する回転棒から落下する待機時間を測定します 。
- 各ラットに 30 の間隔で 10 回試行 (トライアル) を許可します 。
- ラットは、回転棒から落ちる場合は、10-20 の間隔後に再度ロッドにそれを設定します 。
- は、最後の審判の後 30 分ペントバルビ タール (400 mg/kg) の過剰摂取によるラットを犠牲します。同じ線量ホーム檻の中で麻酔の未熟な対照群を挿入します 。
3。抑制性回避テスト
調査文脈ラーニング対象ラット抑制性回避 (IA) テスト ( 図 1 で満島 et al., 2011, 2013年 10 ,- 11) 避けるためケージの変更や洗浄など任意のエピソードの経験など、実験の日に連絡します。静かで、温度管理された部屋 (23 ± 1 ° C) のタスクを実行します
。 注: IA トレーニング装置は二腔心のアクリル ボックス (長さ 33 cm × 横 58 cm; 高さ 33 cm)。それは明るい安全側とトラップドア ( 図 1) によって分離されている暗いショック側 。
- は、照らされた箱の安全 (点灯) 側にラットを配置します。ストレスなく優しくラットを処理します 。
- しばらく (10 に 20 s) 環境にラットに慣れる 。
- ラットで暗いボックスを入力するを許可するように引き戸を開く 。
- は、ラット ボックスの新規の暗い側に入る前に、待機時間 (秒) を測定します。最初の試験の待機時間を表します、ラット ' トレーニングの前に s パフォーマンス 。
- ダークサイドに入った後、ドアを閉めるし、スクランブルの電気フット ショックを適用 (2 秒、1.6 mA) ボックスの床に電気の鋼棒を介して。1 分でなくてショックを受けて実習装置を探索するウォークスルー ラットを許可します。いくつかの照らされた衝撃ケージで家の対になっていないラット数日、突然、エピソード経験せずショックを与えます。グループでストレスなくやさしく処理します 。
- 10 の暗いボックスで各ラットを保つ家のケージに戻る前に s 。
- で 30 分フット ショック後は再びボックスのライト側にラットを配置します。ダークサイドを入力する待機時間を測定します 。
- ホーム ケージにラットを返します 。 ペントバルビ タール (400 mg/kg) の過剰摂取によるラットを犠牲にショックを経て、
- で 60 分。ラットを優しく処理し、腹腔内麻酔を注入します。訓練を受けていない対照群ラット、上記経験のないホーム檻の中で麻酔を注入します 。
4。郭清バッファー
- 12.579 g 純水 (950 mL、900 mL) 塩化コリン、1.423 g MgCl 2-6 H 2 O、0.074 g CaCl 2 0.188 g KCl 0.195 g NaH 2 PO 4-2 H 2 O の結晶を溶解.表 1 を参照してください 。
- 2.340 g アスコルビン酸、0.342 g ピルビン酸ナトリウム塩、2.100 g NaHCO 3、および 4.500 グラムのブドウ糖の結晶を溶解します 。
- 追加の水 1000 mL。浸透圧の範囲になります 290 mOsm/L と 300 mOsm/L. 調整浸透超純水水を追加することによって範囲を超える場合は 。
- 5% CO 2 ソリューションをバブル/95% O 2 は使用する前に 5 分間の冷たい温度で混合物をガスします 。
5。人工髄液 (アプライド)
- 0.186 g 6.700 g NaCl、KCl と 0.156 g NaH 2 PO のディゾルブ結晶 4-2 H 2 O 純水 (950 mL、900 mL)。表 2 を参照してください 。
- 5 分間混合ガス気泡
- 1.800 g グルコースと 2.184 g NaHCO 3 の結晶を溶解し、4 mL MgCl 2 と 1 M から 4 mL CaCl 2 在庫ソリューションを追加します 。
- 追加の水 1000 mL。浸透圧の範囲になります 290 mOsm/L と 295 mOsm/L. 調整浸透超純水水を追加することによって範囲を超える場合は 。
- ガス混合物前に使用するとバブルします 。
6。細胞内ソリューション
- 6.089 g K グルコン酸、HEPES 0.476 g、0.0456 g グリコールエーテルジアミン四酢酸、および 1 M から 500 μ L MgCl 2 貯蔵 180 mL 純水液で電流クランプ録音 (表 3)、溶解 0.0746 g KCl の (島の 7.2 pH 調整)。
- 0.4408 g ナ 2 - ATP、0.0418 g ナ 3 - GTP と 0.510 g ナ クレアチンリン酸を追加。200 mL に水を加えて、島の 735万に pH を調整します 。
- 超高純度水を加えて約 290 mOsm/L に浸透圧を調整します 。
- 冷凍庫 (-30 ° C) に 1 mL 因数としてストア 。
- の電圧クランプ録音 (表 4) 溶解 5.244 g CsMeSO 3, 0.672 g CsCl、HEPES 0.476 g、0.0456 g グリコールエーテルジアミン四酢酸、および 1 M から 500 μ L MgCl 2 在庫 180 mL 純水ソリューション。CsOH と 7.2 に pH を調整します。MEPSP および mIPSP の録音、GABA A の受容体応答 11 の逆転の可能性を調整するのに 5.814 g CsMeSO 3 と 0.252 g CsCl の変更された濃度を使用します。
- 0.4408 g ナ 2 - ATP、0.0418 g ナ 3 - GTP と 0.510 g ナ クレアチンリン酸を追加。200 mL に水を加えて、CsOH と 7.35 に pH を調整します 。
- 超高純度水を加えて約 290 mOsm/L に浸透圧を調整します 。
- 冷凍庫 (-30 ° C) に 1 mL 因数としてストア 。
7。準備をスライス
- 前を犠牲に、クールダウン、ロックアイス ( 図 2 a) すべての解剖ツール。接触面積の増加に砕いた氷の容器に約 500 mL の冷たい水を追加します。この手順を示した以前 10 、 11 , 12
。 注: ここでのツールは、: 大鋏、アイリスはさみ、ヘラ、マイクロ ヘラ、鉗子、ピンセット、ステンレス鋼 200 mL ビーカー、トリミング、満ちているガスの混合物と扱われる解離バッファー 120 mL 心筋灌流シリンジの脳のための刃、シリコン チューブ (20 cm) フラットな 18 g 針、ステンレス脳解剖ステージに接続 (厚さ 3 mm、φ = = 12 cm)、および、vibratome の取り付け段階 (φ = 5 cm). - は、ペントバルビ タール (400 mg/kg 体重) の過剰摂取と麻酔による行動パラダイムを完了した後 30 分のラットを犠牲します。スライスが可能な 10 、 11 , 12 ほど健康ではように急速にスライスの準備を実行します。脳の扉を開きアクション プロトコルは、私たちの大学すべての獣医の基準を満たしています 。
- 冷たい解剖バッファー (表 1) と 120 mL の注射器が 5% CO 2 とバブルの塗りつぶし/95% O 2 ガス混合物。灌流の前に空気の泡を削除します 。
- 心を公開した後、左心室の後部に針を挿入します 。
- 実行 transcardial 手動で注射器を用いた脳血流。大きいラット灌流のより多くの郭清のバッファーが必要です。水没中に継続的に 5 分泡バッファーのバッファーを冷たい解剖で脳が水没します 。
- は、ブレードを使用してターゲットの皮質領域の樹状突起の向きに角度の平行で脳の後方をトリミングします。以来、脳は、切り口下部郭清ステージに立つが、初期角度はすべてのそれに続く脳スライスの角度を決定します。この手順は 非常に重要である ( 図 2 b) です。不正確な角度がターゲット錐体ニューロンをカットがあります
。 注: ここでのツールは、: 脳トリミング用ブレード、フィルター紙 (φ = 10 cm)、ステンレス脳解剖ステージ (厚さ 3 mm、φ = = 12 cm)、ヘラ、瞬間接着剤や、スポイト、vibratome の取付台 (φ = 5 cm). - は、vibratome を使用して厚いコロナ脳スライス 350 μ m をカットしました。解離チャンバー内に冷えたバッファーが 5% CO 2 とバブルの塗りつぶし/95% O 2 ガス混合物 ( 図 2)。脳スライスの中に継続的にバッファーをバブルします 。
- アイリスのはさみを使用してターゲット地域の周囲をトリミングします 。
- 室温アプライドで優しくトリミング スライス バブル 5% CO 2/95% 洗浄 O 2 (表 2). インターフェイスの部屋にまで記録は、
- 維持トリムされたスライスは、( 図 2 D および E) に実行されます。商工会議所で 1 時間培養、細胞の状態を改善がスライスは 10 時間以上培養した表現型が変わる。ガスを囲むチャンバーの蓋を閉めるし、アプライドの小型液面します 。
8。全細胞パッチク ランプ
注: 全体セルの録音アンプと 5 kHz のカットオフ周波数に設定されているローパス フィルターを必要とします。信号はデジタル化され、PC に保存されています。保存されたデータを分析したオフライン ( 図 3 a).
- 作成ガラス電極水平の引き手を使用しています。適切なソリューション (表 3 と 4) に電極を埋める細かいガラス管と 0.22 μ m のフィルターに接続されている通常ポリエチレン 1 mL 注射器を使用します 。
- セルとの接触、前に正圧を維持し、ゼロに現在のピペットを調整します 。
- Gigaohm シールを形成した後 ( 図 3 f で全細胞構成) 細胞膜を破裂する否定的な圧力を適用します 。
9。電流クランプ分析
細胞膜- プロパティ入力電流クランプ録音 (表 3) の細胞内の溶液でピペットを録画パッチ。ピペットの抵抗は 4 MΩ と、アプライドで 7 MΩ の間が 。
- 膜の破裂後保持膜電圧-60 V クランプ モードで mV。切り替えてから " バス " モード " 細胞 " 膜を膜キャパシタンス、抵抗、時定数などの固有セル プロパティを測定するソフトウェアを使用してテスト モード 。
- 現在注射に関する研究
- 固有セル プロパティを記録した後トラックに V クランプからモードを切り替える (私 = 0) 電流注入用/I-CLAMP 標準。液間電位の修正 10 ではないことに注意してください 。
- 300 ミリ秒の現在のセルに挿入から段階的な電流の強度を変更 − 50 pA 増加 + 550 pa 100 pA。現在の注射によってスパイク (活動電位) の数をカウントします 。
- (これは、しきい値電圧は) 活動電位を誘発するために必要な最小の電圧を測定します 。
- スパイク開始時の電圧と環形動物 7 の間に達成する最低の電圧間の差として環形動物振幅を計算します 。
10。クランプ電圧解析
- 、AMPA/NMDA 比
注:、AMPA/NMDA 比率はグルタミン酸作動性興奮性シナプス 7 、 8 にシナプス可塑性を評価する従来の方法, 9, 10, 11 します。 ただし、両方のコンポーネントの付随の増加が比 13 を変更可能性があります。- Perfuse 生理学的ソリューションと録音室ガス混合物で、25 ° C 追加 0.1 mM ピクロトキシン GABA A - 反応を媒介し、4 μ M 2 を追加 - ブロックするソリューションに 22 の ° C の温度を維持誘発神経応答 14 を安定させるためにクロルアデノシン 。
- 入力電圧クランプの細胞内の溶液でピペットを録画パッチ録音 (表 4)。アプライドで記録ピペットの抵抗を確認してください。抵抗は 4 MΩ ~ 7 MΩ.
- 、M1 の層 II/III 錐体ニューロンにおける記録のため配置バイポーラ タングステン電極 200 μ m から 300 μ m 外側前肢表現部軟膜表面の下に記録される細胞を刺激 (2 mm の外側、正中線) 15 , 16 , 17.
- 、CA1 錐体細胞で記録のため刺激電極 200 μ m 300 μ m 横 (シャファー担保繊維) からまたはがあるセルの内側 (temporoammonic 経路) を記録した ( 図 3 b).
- シナプス応答まで刺激強度を高める > 10 ペンシルバニア州
- AMPA/NMDA 比率を計算は、ピーク電流の比を基準として − 60 +40 mV、電流測定は 150 mV 刺激発症後のミリ秒。50 に 100 のトレースを比率を計算する平均べきであることに注意してください 。
- ミニチュア シナプス後現在録音
注: ミニチュア興奮性シナプス電流 (mEPSCs) は単一の小胞のグルタミン酸塩のシナプス前のリリースにより誘発に対応すると考えられている 18.対照的に、ミニチュア抑制性シナプス電流 (mIPSCs) は、GABA 18 の単一の小胞のシナプス前のリリースにより誘発に対応するいると考えられます。MEPSCs と mIPSCs の振幅の増加を反映してシナプス伝達の強化、増加中周波数機能シナプスや神経終末放出確率の数の増加を反映してイベントで 11 .- -60 に変更された細胞内ソリューション GABA A の受容体を介する電流の反転可能性を調整する (表 4) でパッチ記録ピペットを埋める mV 。
- 自発性活動電位をブロックするお風呂に追加 0.5 μ M テトロドトキシン 。 R
- ホールド電圧-60 mV開始 5 分の mEPSC イベント 5 分のレコードの mIPSC イベントに
- 0 に潜在的な保有の変更 mV。+15 で M1 細胞の mIPSCs を記録しているので、M1 ニューロンのわずかに高い逆転 AMPA 受容体を介した電流の可能性を示し、0.1 mm APV mV 。
- 電流を安定させるために数分待ちます 。
- 5 分の mIPSC イベントを記録
- は、ソフトウェアを使用してミニチュア イベントを検出し、10 pA 上記のイベントを使用して、分析のため。頻度を決定する 5 分の mEPSCs または mIPSCs のイベントの数をカウントします。平均の平均振幅を取得するイベントの振幅します 。
- 温浴 CNQX 10 μ M、10 μ M のビクークリンメチオダイドが mEPSCs、mIPSCs のイベントをそれぞれブロックかどうかを確認します 。
- 対パルス解析
注: 対パルスを用いたシナプス可塑性を分析できます。ペアになって脈拍数の増加を示唆しているシナプス前のグルタミン酸の減少や GABA 確率 7 , 10 , 11。- 興奮性シナプスを分析し、0.1 mM ピクロトキシンを追加し-60 で応答を記録
- mV。お風呂に 4 μ M 2-クロルアデノシンを追加したので、シナプス前リリース確率 14 薬に影響を与えることを念頭に私たち必要があります 。 抑制性のシナプスを分析する
- 0.1 mM APV、4 μ M 2-クロルアデノシンをお風呂に追加し、0 で応答を記録 mV。M1 ニューロン記録 +15 で応答 mV 。
- ペア刺激間間隔 100 ms、200 ms のパルスを適用
- 潜在的なを保持している各 50 100 シーケンシャル トレースを記録し、平均値 。
- シナプス電流の最初のピークに 2 番目のピークの比として対パルス比を計算します 。
結果
最近述べたように7ローター棒トレーニング (図 1 a) は M1 層 II/III の錐体細胞の本質的な可塑性変化を誘発しました。ラットに回転棒から落ちるまでの遅延を測定、ラットの熟練した学習性能を推定することができます。長い待ち時間は、運動パフォーマンスの向上を示します。トレーニングの日 1、ラットは、裁判が終了するまでそのローター ロッド性能を改善しました。平均セッションで達成のラット 2 日目ほぼ漸近レベル (図 1 b) の評価です。第一審での待機時間と比較して、事後分析トレーニング日 (図 1) に最終試験で有意な改善を示した。
図 4 aは、大脳皮質が運動スキル学習後変更された電流クランプ分析の例を示します。それぞれ未熟なグループで、1 日の訓練を受けたラットの活動電位を誘発する 400 pA と 500 pA の電流の注射が必要でした。対照的に、現在 150 pA のみの注入で 2 日間の訓練を受けたラットにおける活動電位を引き出すために十分でした。電流の強さと活動電位の数の関係は、図 4 bに示されます。現在としてはほとんど 50 pA だった 2 日間訓練を受けたラットのスパイクを引き出すために十分です対照的に、1 日の訓練を受けたラットは 350 の pA と高い電流に未熟なラットより少ない活動電位と答えた。さらに、図 4に示します 1 日訓練を受けたラット示したこと低い休んでいる潜在的な 2 日間の訓練を受けたラット示した (図 4) 高い静止電位と膜抵抗 (しきい値、および深い環形動物を高いスパイク図 4)。
11を前述のよう、IA トレーニング (図 1) は海馬の CA1 ニューロンの興奮性と抑制性シナプスのシナプス可塑性を誘導しました。ライト ボックスで遅延を測定することによってラットの文脈ラーニング性能予測を行うことができます。図 1Eは、IA のタスクの結果を示しています。対電気ショック後ラット ボックスのダークサイドを避けるために、明るい側では、通常彼らは希望しないに滞在することを学ぶ。ダークサイドを回避する傾向は、したがって、文脈依存記憶の取得を示します。
図 5は、文脈ラーニング後どのミニチュア シナプス電流に変更された劇的にクランプ電圧解析の例を示します。学習によって誘発される可塑性、自発的な AMPA を介した mEPSCs および GABAAを調査する-仲介された mIPSCs は 0.5 μ M のテトロドトキシン (図 5 aとB) の存在下で順番に記録されました。二次元プロット (図 5) に示すように、各 CA1 ニューロンは mEPSCs と mIPSCs のための別の平均振幅を持っていた。振幅が低かったし、の分布範囲を示したが未熟な対になっていない、ウォークスルー ラット IA 訓練ラット (表 5) 多様なでした。分散分析の事後解析に続いては、IA トレーニングラット CA1 ニューロンの学習によるシナプス可塑性を示唆している (図 5 e) で mEPSC の平均振幅が大幅に増加し、mIPSC を示した。
また、各 CA1 細胞 mEPSC mIPSC の異なる周波数 (図 5) を出展しました。周波数が低いとの分布範囲を示したが未熟な対になっていない、ウォークスルー ラット IA 訓練ラット (表 6) の多様であった。分散分析の事後解析に続いては、IA の訓練を受けたラット (図 5 階) で mEPSC、mIPSC のイベントの頻度の重要な増加を示した。これらの結果の 2 つの可能な解釈があります。最初の文脈ラーニングがニューロンの機能的なシナプスの数を増加したことです。他の文脈ラーニングにグルタミン酸や GABA の神経終末放出確率が増加したことです。
シナプス可塑性をさらに調べると、また行ったペアパルス刺激,10,11を既に報告されています。
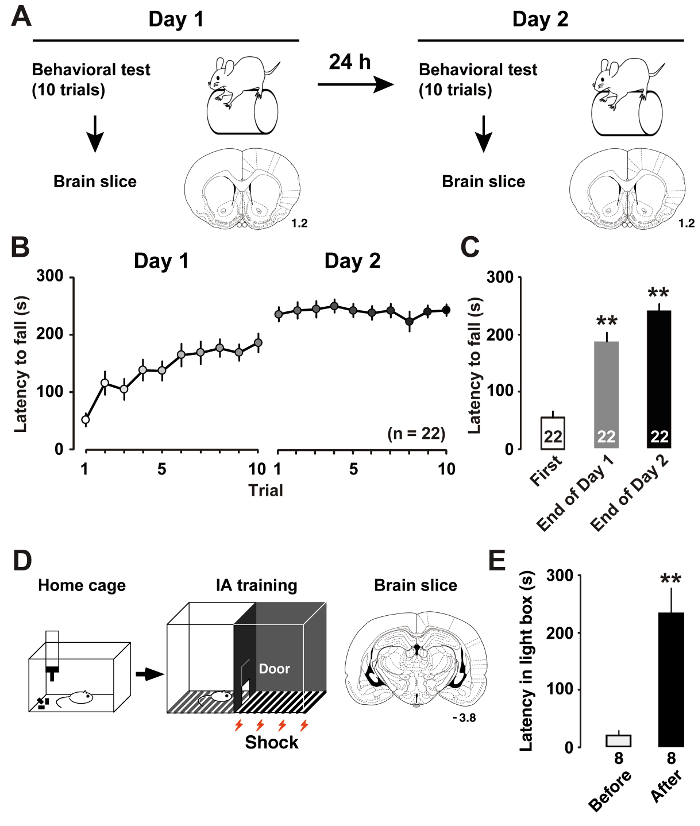
図 1: トレーニング後を学習します。
A: ローター棒トレーニングとコロナ脳スライス実験的なデザインを示しています。B: 加速のローター棒バレルから秋に平均待ち時間。C: 最初とトレーニング 1、2 日7の最後の試験にロッドが落下する平均待機時間。P< 0.01対初公判。D: 抑制性回避 (IA) タスクと歯冠の脳スライスのスキーマ。E: IA トレーニング11前後に暗いボックスを入力に平均待ち時間。P< 0.01対IA トレーニングの前に。コロナ セクションによって数値は mm で前の前方距離を示します。動物の数は、バーの下部に表示されます。誤差範囲を示す SEM.この図の拡大版を表示するのにはここをクリックしてください。
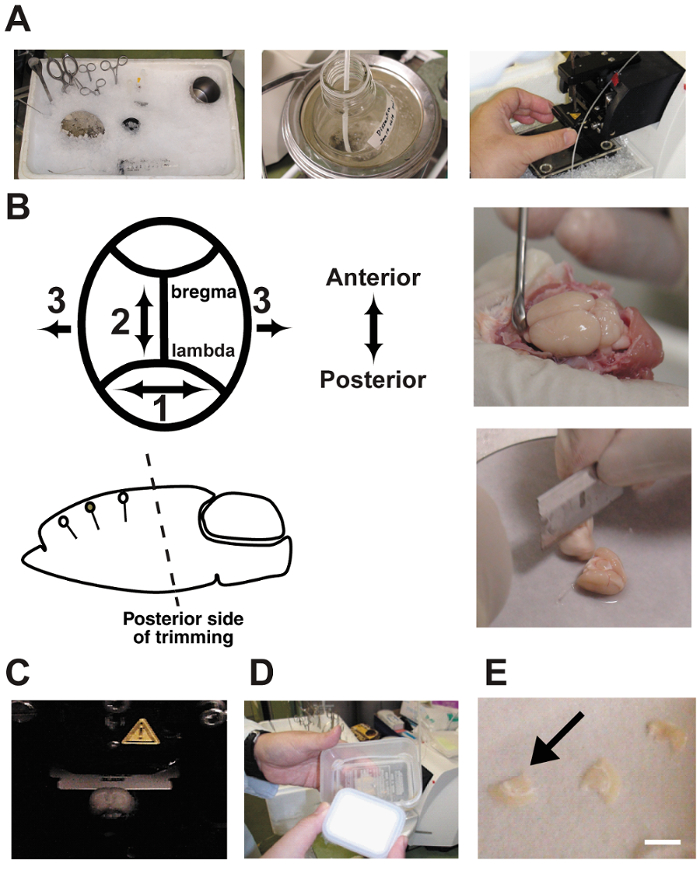
図 2: プロシージャをスライスします。
A: 写真を示す急性脳スライスの準備。郭清ツールを使用する前に砕いた氷で冷却。B: 脳の解剖とトリミング。トリミングの後部側の角度が樹状突起の方向と平行に向いていなければならないことに注意してください。C: vibratome 室に脳をスライスします。脳は郭清バッファーを浴びて、5% CO295% O2ガス混合物で継続的にバブルします。D: 2 つのプラスチック製の食品容器とシリコン チューブで作られたインターフェイス室。商工会議所は、人工脳脊髄液で満たされ、混合ガスを継続的にバブルします。E: 脳スライスが商工会議所でろ紙上に配置されました。バー = 5 mm.この図の拡大版を表示するのにはここをクリックしてください。
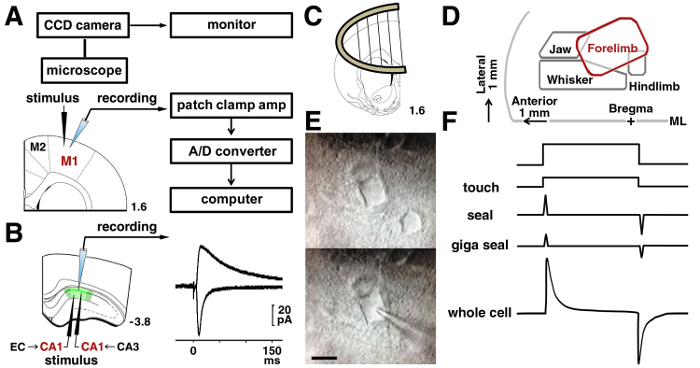
図 3: パッチ クランプ プロシージャ。
A: パッチ ・ クランプ システムのニューロンからの電気信号を記録するために使用します。ラット皮質運動野刺激および層 II/III 神経電極の場所のとおりです。B: 地層結腸寄生虫に置かれた刺激電極、CA1 錐体細胞のシャファー シナプスを分析します。Temporoammonic シナプスを分析するには、刺激的な電極は地層 moleculare に配置されました。誘発 AMPA の痕跡を代表と同じの CA1 ニューロンの NMDA 受容体を介する興奮性シナプス電流が表示されます。C: スライスのアンカーは、記録室でスライスを安定させるために使用されました。D: 論文15,16,17に基づく運動皮質の表現マップ。ML 正中線を =。E:前に II/III ニューロン層の M1 の IR DIC 顕微鏡(上部) と (下) の録音中。バー = 10 μ m. F: タッチ (トップ) の前に現在の膜破裂 (下) のピペットに変更。この図の拡大版を表示するのにはここをクリックしてください。
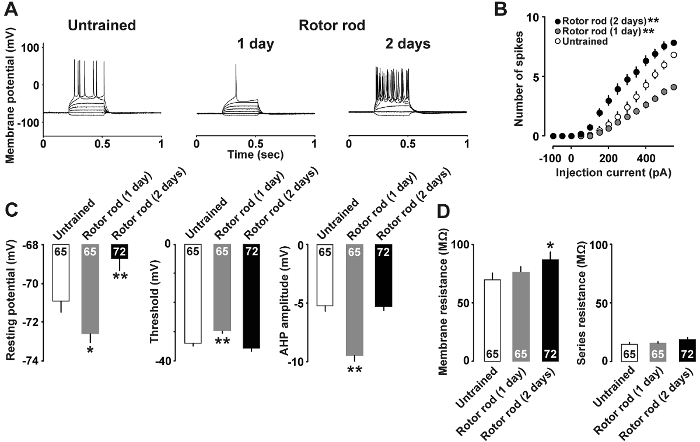
図 4: 電流クランプ分析7の代表の結果.
A: 現在注射で誘導後電位の代表的な痕跡を記録しました。B: 平均電流入力 (pA) 脳スライスにおける活動電位出力 (スパイクの数) と未熟な (開いているバー)、1 日訓練を受けた (灰色)、2 日間の訓練を受けたラット (充填バー) からの関係。C: 潜在的なしきい値、および層 II/III ニューロンの環形動物を休んでします。D: ニューロンのシリーズ抵抗と膜抵抗。各グループの 9-10 ラットを使用しました。細胞の数は、各バーに表示されます。誤差範囲を示す SEM *P< 0.05 * *P< 0.01対未熟な。この図の拡大版を表示するのにはここをクリックしてください。
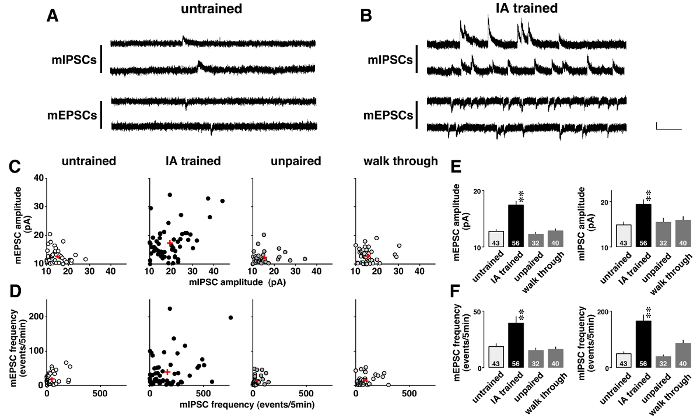
図 5: クランプ電圧解析11の代表の結果.
ミニチュア興奮性と抑制性シナプス後電流 (mEPSCs と mIPSCs) 未熟な (A) と抑制性回避 (IA) の代表的な痕跡-ラット (B) を訓練を受けた。-60 mV、0 mV を順番に同じテトロドトキシン (0.5 μ M) の存在下で CA1 錐体細胞で測定した時の mIPSCs で mEPSCs。垂直バー 20 pA、水平方向のナビゲーションバーを = = 200 msec。 C: 平均の二次元プロット (I) PSC 私で振幅未熟な、IA に訓練された、対になっていない、とウォークスルー ラット。D: 私 (I) PSC の二次元プロット 4 グループの周波数。PSC の振幅と周波数、各 CA1 ニューロン展示別注は私 (I) を意味します。IA トレーニング強化だけでなく平均振幅(E) も PSC イベント (I) 私の周波数を増加した(F)。各グループの 4-6 のラットを使用しました。細胞の数は、バーの下部に表示されます。赤のプラス記号 (C, D) と (E, F) の垂直線を示す平均 ± SEM. * *P< 0.01対未熟ラット。この図の拡大版を表示するのにはここをクリックしてください。
| 郭清バッファー (合計 1 L) | ||
| NaH2PO4 • 2 H2O | 0.195 g | 1.25 ミリ モル/L |
| KCl | 0.188 g | 2.5 ミリ モル/L |
| CaCl2 | 0.074 g | 0.5 モル/L |
| MgCl2 • 6 H2O | 1.423 g | 7.0 mmol/L |
| 塩化コリン | 12.579 g | 90 ミリ モル/L |
| アスコルビン酸 | 2.340 g | 11.6 ミリ モル/L |
| ピルビン酸 | 0.342 g | 3.1 ミリ モル/L |
| NaHCO3 | 2.100 g | 25 ミリ モル/L |
| グルコース | 4.500 g | 25 ミリ モル/L |
表 1:郭清のバッファーのためのレシピ
| 人工髄液 (1 L の合計) | ||
| KCl | 0.186 g | 2.5 ミリ モル/L |
| 塩化ナトリウム | 6.700 g | 114.6 モル/L |
| NaH2PO4 •2H2O | 0.156 g | 1 モル/L |
| グルコース | 1.800 g | 10 ミリ モル/L |
| NaHCO3 | 2.184 g | 26 モル/L |
| 1 M MgCl2 | 4 mL | 4 モル/L |
| 1 M CaCl2 | 4 mL | 4 モル/L |
表 2:人工脳脊髄液 (CSF) のためのレシピ
| 現在のクランプ (合計 200 mL) の細胞内のソリューション | ||
| KCl | 0.0746 g | 5 ミリ モル/L |
| K グルコン酸 | 6.089 g | 130 ミリ モル/L |
| HEPES | 0.476 g | 10 ミリ モル/L |
| グリコールエーテルジアミン四酢酸 | 0.0456 g | 0.6 ミリ モル/L |
| 1 M MgCl2 | 500 Μ L | 2.5 ミリ モル/L |
| ナ2 ATP | 0.4408 g | 4 モル/L |
| Na3 GTP | 0.0418 g | 0.4 ミリ モル/L |
| クレアチンリン酸 Na | 0.510 g | 10 ミリ モル/L |
テーブル 3:現在のクランプの細胞内のソリューションのためのレシピを記録
| 電圧クランプ (合計 200 mL) の細胞内のソリューション | ||||
| CsMeSO3 | 5 | |||
表 4:電圧クランプ用細胞内のソリューションのためのレシピを記録
| パラメーター | 未熟です | IA の訓練 | 対になっていません。 | を歩く | |
| mEPSC 振幅 | 分散 | 5.8 | 32.1 | 4.7 | 5.9 |
| 標準偏差 | 2.4 | 5.7 | 2.2 | 2.4 | |
| 変動係数 | 0.189 | 0.326 | 0.177 | 0.190 | |
| mIPSC 振幅 | 分散 | 17.1 | 56.7 | 31.8 | 20.7 |
| 標準偏差 | 4.1 | 7.5 | 5.6 | 4.5 | |
| 変動係数 | 0.279 | 0.387 | 0.367 | 0.286 |
表 5: ミニチュア興奮性および抑制性シナプス後電流 (mEPSC および mIPSC) 振幅抑制性回避 (IA) での多様性-ラットを訓練
| パラメーター | 未熟です | IA の訓練 | 対になっていません。 | を歩く | |
| mEPSC 周波数 | 分散 | 278 | 2195 | 188 | 195 |
| 標準偏差 | 17 | 47 | 14 | 14 | |
| 変動係数 | 0.902 | 1.198 | 0.893 | 0.874 | |
| mIPSC 周波数 | 分散 | 3282 | 27212 | 1385 | 5135 |
| 標準偏差 | 57 | 165 | 37 | 72 | |
| 変動係数 | 1.195 | 1.006 | 0.955 | 0.836 |
表 6: ミニチュア興奮性および抑制性シナプス後現在 (mEPSC と mIPSC) の周波数の抑制性回避 (IA) 多様性-ラットを訓練
ディスカッション
スライス パッチ ・ クランプの技術の主要な制限は何が起こるかの生体を表さない場合がありますスライスの準備、記録です。生体内電流クランプ分析はより信頼性の高いは意識した動物から十分なデータを得るため技術的に困難な。それぞれの錐体細胞は異なる細胞特性があるので正しくトレーニング後ニューロンの違いを分析する十分な細胞数が必要です。また、電圧クランプ分析 CNQX、APV、またはビククリンによりシナプス応答の性質を決定するために連続的な薬物治療が必要です。グルタミン酸や GABA の単一の小胞によるミニチュア応答を解析、自発的な活動電位をブロックするテトロドトキシンによる継続的な治療が必要です。最近開発された多光子イメージングは興奮性シナプス19に形態学的変化を分析するための強力な生体内でシナプスの機能を分析する、結合されたパッチ ・ クランプの技術が必要です。現在、最も抑制性シナプスは棘を形成しないので、抑制性シナプスの形態学的変化を分析する非常に困難です。この時、スライス パッチ クランプはセルのプロパティや訓練された動物における興奮性/抑制性シナプスの機能を分析する最も適切な技術でしょう。
電流クランプ分析 (図 4) を使用して、我々 は最近レイヤー II/III ニューロンの学習による組み込みのモーターのシナプス可塑性を報告しました。具体的には、1 日の訓練を受けたラットはスパイクのしきい値で膜電位と増加を安静時の重要な減少を示した。2 日間の訓練を受けたラット静止膜電位増加興奮を引き起こした重要な増加を示した。これらの結果は示唆が訓練を受けたラットの M1 層 II/III 神経細胞の本質的な可塑性変化をしました。追加クランプ電圧解析では、シナプス前の GABA リリース確率7の一時的な減少があったことを示唆している 1 日訓練を受けたラットにおけるペアパルス比の増加を明らかにしました。したがって、第 II/III シナプス層で GABA からその脱は M1 の結果学習-によって誘発される可塑性を引き起こす可能性があります。これをサポートするため、M1 のスライス標本 LTP20を誘発する GABAAの受容体拮抗薬浴治療が必要です。
ミニチュアのシナプス後電位の解析は、IA に訓練された動物のシナプス可塑性を検出する強力な方法です。連続録画が mEPSCs と 1 つの mIPSCs の CA1 ニューロンは、それぞれ個々 のニューロンの興奮性/抑制性シナプスの結合強度の解析をことができます。1 つ以来私 (I) PSC 応答はグルタミン酸や GABA、増加の単一の小胞に起因する私 (I) PSC の振幅をシナプス強化示唆しています。(I) 私は PSC を分析して、各 CA1 細胞 (図 5) に興奮性/抑制性入力の強さの個人差を発見しました。IA トレーニングは明らかにシナプス強度の多様性を推進、これは他のグループ (表 5) で観察されなかった。
学習によるシナプスの多様性を数学的に解析することができます。各ポイントの出現確率を計算することにより各ニューロンからのデータは、自己エントロピー21クロード ・ e ・ シャノンの情報理論を用いた (ビット) に変換できます。(平均程度) 高出現確率の点は、非常にまれな確率 (逸脱点) でポイントが高い自己エントロピーを示し低自己エントロピーを示します。未熟なラットと比較して、ニューロンあたり自己エントロピーは IA の訓練を受けたラットで明らかに増加しますが、ペアではなくまたはウォークスルー ラット22。この分析では、コンテキストの学習後内 CA1 情報の増加があったことを示唆しています。
スライス パッチ ・ クランプの技術は、エアコン扁桃体外側9研究工夫の恐怖のバレル皮質8感覚的経験に関する研究にも使用できます。さらに、さらに調査のため、様々 な技術でこの手法を使用できます。たとえば、ウイルス媒介緑色蛍光タンパク質 (GFP)-タグ遺伝子配達方法特定の分子の機能を分析するパッチ ・ クランプの技術と組み合わせて使用できます。さらに、特定の領域に、プロジェクトの特定のニューロンを視覚化する逆行性トレーサーの焦点のインジェクションを使用できます。その後、電流クランプの技術を使用して、セルに固有のプロパティで分析できます可視化ニューロン23。さらに、2 光子励起グルタミン酸の調査と結合二光子励起レーザ走査顕微鏡は背骨特異的な増殖と EPSC 応答マウス大脳皮質の層 II/III 錐体細胞19を示すために使用されています。したがって、新規化学物質、遺伝子送達、写真操作の手法と組み合わせることによってスライス パッチ ・ クランプの技術を改良中です。
開示事項
著者は利益相反を宣言しません。我々 は、我々 はに関する倫理的な出版にたずさわるジャーナルの位置を読んでいるし、我々 は、この報告書はそれらのガイドラインと一致して確認することを確認します。資金提供者には、研究デザイン、データ収集または分析を発行し、決定または原稿の準備の役割はなかった。
謝辞
その技術支援のため博士足-分-テイン-オブジェクト指向、韓 Thiri 迅博士と夫人の秀親に感謝したいと思います。このプロジェクトの若手 (香港とある)、科学的研究 B (D.M.)、科学的研究 C (D.M.) および科学研究で革新的な地域 (D.M.)、教育省、文化、スポーツ、科学、科研費に支えられ、日本の技術。
資料
| Name | Company | Catalog Number | Comments |
| Rota-Rod Treadmills | Med Associates Inc. | ENV577 | |
| inhibitory avoidance box | Shinano Seisakusho | ||
| Pentobarbital | Kyoritsu Seiyaku | ||
| Blade | Nisshin EM Co., Ltd | LC05Z | |
| Cardiac perfusion syringe | JMS Co., Ltd | JS-S00S | |
| Vibratome | Leica Microsystems | VT-1200 | |
| Horizontal puller | Sutter Instrument | Model P97 | |
| Microfilm 34 gauge | World Precision Instruments, Inc | MF34G-5 | |
| 0.22 µm filter | Millipore | SLGVR04NL | |
| Axopatch–1D amplifier | Axon Instruments | ||
| Digidata 1440 AD board | Axon Instruments | ||
| pCLAMP 10 software | Axon Instruments | ||
| Upright Microscope | Olympus | BX51WI | |
| CCD camera | Olympus | U-CMAD3 | |
| Camera controller | Hamamatsu Photonics K.K. | C2741 | |
| Stimulator | Nihon Kohden | SEN-3301 | |
| Isolator | Nihon Kohden | SS-104J | |
| Motorized manipulator | Sutter Instrument | MP-285 | |
| Micromanipulator | Narishige | NMN-21 | |
| Peristaltic Pump | Gilson, Inc | MINIPULS® 3 | |
| Glass capillary | Narishige | GD-1.5 | |
| Ag/AgCl electrode | World Precision Instruments, Inc | EP4 | |
| Slice Anchor | Warner instruments | 64-0252 | |
| Stimulus electrode | Unique Medical Co., Ltd | KU201-025B | |
| Materials | Company | Catalog Number | Comments |
| Dissection buffer/ artificial CSF | |||
| NaH2PO4 • 2H2O | Sigma-Aldrich Co. | C1426 | |
| KCl | Wako Pure Chemical Industries | 163-03545 | |
| CaCl2 | Wako Pure Chemical Industries | 039-00475 | |
| MgCl2 • 6H2O | Wako Pure Chemical Industries | 135-00165 | |
| Choline chloride | Sigma-Aldrich Co. | C7527 | |
| Ascorbic acid | Wako Pure Chemical Industries | 190-01255 | |
| Pyruvic acid Na | Wako Pure Chemical Industries | 199-03062 | |
| NaHCO3 | Sigma-Aldrich Co. | 28-1850-5 | |
| Glucose | Sigma-Aldrich Co. | 07-0680-5 | |
| Materials | Company | Catalog Number | Comments |
| Intracellular solution | |||
| K-Gluconate | Sigma-Aldrich Co. | G4500 | |
| HEPES | Wako Pure Chemical Industries | 346-01373 | |
| EGTA | Wako Pure Chemical Industries | 348-01311 | |
| Na2 ATP | Nacalai Tesque | 01072-24 | |
| Na3 GTP | Sigma-Aldrich Co. | G-8877 | |
| Na phosphocreatine | Sigma-Aldrich Co. | P-7936 | |
| CsMeSO3 | Sigma-Aldrich Co. | C1426 | |
| CsCl | Wako Pure Chemical Industries | 033-01953 | |
| Materials | Company | Catalog Number | Comments |
| Drugs in aCSF | |||
| 2-Chloroadenosine | Sigma-Aldrich Co. | C5134 | |
| Picrotoxin | Sigma-Aldrich Co. | P-1675 | |
| Tetrodotoxin | Wako Pure Chemical Industries | 207-15901 | |
| CNQX | Sigma-Aldrich Co. | C239 | |
| APV | Sigma-Aldrich Co. | A5282 |
参考文献
- Neher, E., Sakmann, B. Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature. 260 (5554), 799-802 (1976).
- Hamill, O. P., Marty, A., Neher, E., Sakmann, B., Sigworth, F. J. Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 391 (2), 85-100 (1981).
- Edwards, F. A., Konnerth, A., Sakmann, B., Takahashi, T. A thin slice preparation for patch clamp recordings from neurones of the mammalian central nervous system. Pflugers Arch. 414 (5), 600-612 (1989).
- Rioult-Pedotti, M. S., Friedman, D., Donoghue, J. P. . Learning-induced LTP in neocortex. Science. 290 (5491), 533-536 (2000).
- Yang, G., Pan, F., Gan, W. B. Stably maintained dendritic spines are associated with lifelong memories. Nature. 462 (7275), 920-924 (2009).
- Xu, T., et al. Rapid formation and selective stabilization of synapses for enduring motor memories. Nature. 462 (7275), 915-919 (2009).
- Kida, H., et al. Motor Training Promotes Both Synaptic and Intrinsic Plasticity of Layer II/III. Pyramidal Neurons in the Primary Motor Cortex. Cereb Cortex. 26 (8), 3494-3507 (2016).
- Takahashi, T., Svoboda, K., Malinow, R. Experience strengthening transmission by driving AMPA receptors into synapses. Science. 299 (5612), 1585-1588 (2003).
- Rumpel, S., LeDoux, J., Zador, A., Malinow, R. Postsynaptic receptor trafficking underlying a form of associative learning. Science. 308 (5718), 83-88 (2005).
- Mitsushima, D., Ishihara, K., Sano, A., Kessels, H. W., Takahashi, T. Contextual learning requires synaptic AMPA receptor delivery in the hippocampus. Proc Natl Acad Sci U S A. 108 (30), 12503-12508 (2011).
- Mitsushima, D., Sano, A., Takahashi, T. A cholinergic trigger drives learning-induced plasticity at hippocampal synapses. Nat Commun. 4, 2760 (2013).
- Kida, H., Mitsushima, D. Patch Clamp Technique in Brain Slices: Recording of Neuronal Activity in the Rat Primary Motor Cortex. Yamaguchi Medical Journal. 63, (2014).
- Watt, A. J., van Rossum, M. C., MacLeod, K. M., Nelson, S. B., Turrigiano, G. G. Activity coregulates quantal AMPA and NMDA currents at neocortical synapses. Neuron. 26 (3), 659-670 (2000).
- Baidan, L. V., Zholos, A. V., Wood, J. D. Modulation of calcium currents by G-proteins and adenosine receptors in myenteric neurones cultured from adult guinea-pig small intestine. Br J Pharmacol. 116 (2), 1882-1886 (1995).
- Tandon, S., Kambi, N., Jain, N. Overlapping representations of the neck and whiskers in the rat motor cortex revealed by mapping at different anaesthetic depths. Eur J Neurosci. 27 (1), 228-237 (2008).
- Adachi, K., Murray, G. M., Lee, J. C., Sessle, B. J. Noxious lingual stimulation influences the excitability of the face primary motor cerebral cortex (face MI) in the rat. J Neurophysiol. 100 (3), 1234-1244 (2008).
- Tennant, K. A., et al. The organization of the forelimb representation of the C57BL/6 mouse motor cortex as defined by intracortical microstimulation and cytoarchitecture. Cereb Cortex. 21 (4), 865-876 (2011).
- Pinheiro, P. S., Mulle, C. Presynaptic glutamate receptors: physiological functions and mechanisms of action. Nat Rev Neurosci. 9 (6), 423-436 (2008).
- Kwon, H. B., Sabatini, B. L. Glutamate induces de novo growth of functional spines in developing cortex. Nature. 474 (7349), 100-104 (2011).
- Hess, G., Donoghue, J. P. Long-term potentiation of horizontal connections provides a mechanism to reorganize cortical motor maps. J Neurophysiol. 71 (6), 2543-2547 (1994).
- Shannon, C. E. A mathematical theory of communication. Bell Sys Tech J. 27, (1948).
- Ono, K. M., D, Learning creates diversity of excitatory and inhibitory synapses in the hippocampal CA1: a possible amount of information at a single synapse. J Physiol Sci. 67, (2017).
- Wang, L., Conner, J. M., Rickert, J., Tuszynski, M. H. Structural plasticity within highly specific neuronal populations identifies a unique parcellation of motor learning in the adult brain. Proc Natl Acad Sci U S A. 108 (6), 2545-2550 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved