Method Article
プロシージャおよび自動キャピラリー電気泳動を用いた免疫測定法のためのキーの最適化戦略
要約
総蛋白製剤からの薬物の標的タンパク質を測定する商用プラットフォームを用いたキャピラリーを用いた免疫測定法が示されています。さらに、露光時間、タンパク質濃度と抗体希釈アッセイ パラメーターは、細胞培養モデル系に最適です。
要約
キャピラリーを用いたイムノアッセイを活用する新しい技術は、伝統的なイムノアッセイと比較してより速くより定量的なタンパク質評価をお約束します。他の抗体を用いた蛋白質の試金と同様に、タンパク質濃度、抗体希釈露光時間などの毛細血管に基づく免疫パラメーターの最適化は、意味のある、信頼性の高いの世代に重要な前提条件データ。測定は、信号の変化、溶解濃度の変化に直接比例アッセイの線形の範囲内でなければなりません。ひと気管支上皮細胞ライン、ベアス-2B の適切な溶解液濃度、抗体希釈液と露光時間の選択のプロセスは、ここに示されています。アッセイの直線性は、p53 および α-チューブリン抗体と全細胞抽出タンパク濃度の範囲で表示されます。信号燃え尽き症候群の例が長い露光時間で最高濃度に見え、彩度を示す α-チューブリン抗体希釈曲線が表示されます。さらに、実験結果の例は、ドキソルビシン治療細胞最適化されたパラメーターを使用して報告されます。
概要
キャピラリー電気泳動イムノアッセイ サイズまたは電荷分離システムを使用してセル lysates の蛋白質の表現を測定し、従来免疫上のいくつかの利点を提供します。たとえば、ゲル、転送デバイス、必要西部のしみと比較して、自動キャピラリー ベースのプロシージャがなくなり、マニュアルを洗います。さらに、必要なタンパク質の絶対量が約 10 倍小さくなりますので毛細血管系稀または限られたサンプル1,2での使用に最適。結果は自動システムを使用して 3 時間ほどで得られるし、以前より定量的で従来の西部よりも再現性が示されている手順3,4、5のしみ。サイズに基づく試金のためのプロセスはドデシル硫酸ナトリウム (SDS) ジチオトレイトール (DTT) のサンプルをロードで構成され、分子量マーカーをスタッキングと分離行列を含むキャピラリーカラムに蛍光ラベルします。毛細血管への電圧はサイズにより試料中のタンパク質を分離し、UV 光が毛細血管壁に分けられた蛋白質を固定化します。毛細血管は、ターゲット固有一次抗体と西洋わさびペルオキシダーゼ (HRP) に免疫をプローブ-共役二次抗体。ルミノール及び過酸化物触媒化学発光の光生成電荷結合素子 (CCD) カメラによる測定は、蛋白質を量的に分析をします。
相対的な容易さ、自動キャピラリーを用いた電気泳動イムノアッセイ プラットフォームの速度にもかかわらず、蛋白濃度、抗体の希釈、露光時間など測定条件の最適化は、正確で再現性を得るため重要結果。一般に、これらのシステムの分析を最適化するために次の手順を実行する必要があります。
1) 画面を実行して、評価し信号の蛋白質ターゲットに特異的抗体を選択ください。の特異性を評価する場合は、浄化された蛋白質またはターゲット エピトープを使用できますただし、総蛋白質モデル システムから供給の潜在的な非固有の信号を評価することが重要です。
2) 次に、測定のダイナミック レンジを決定する必要があります。理想的な状況で、サンプル濃度を倍増; として観察は信号倍増 (ピーク領域を使用して測定される)ただし、実習では、予測可能な方法を (例えば、線形フィット) で入力信号に比例して変化はプロテインの定量のために十分。さらに、この最適化はタンパク質濃度高信号ですがまだ実験的モデルの線形の範囲内を定義します。
3) 固定タンパク質濃度の最適化手順 2 で選択したを使用して最適な抗体濃度を決定します。抗体の濃度が増えると、それは彩度で高原まで信号が増加します。この飽和レベルに近い抗体濃度のタンパク質濃度の正確な測定に必要です。
ベアス-2B、気管支変形 SV 40 人間から分離された全細胞抽出物を用いたタンパク質濃度、抗体希釈液、自動キャピラリーによるサイズ測定6露出時間を最適化するために使用するプロセスを示す上皮細胞線。細胞や組織の抽出物からの蛋白質の隔離公開プロトコル7,8,9の数を使用して実行することができます、ここでは説明しません。最適化された条件を使用して実験の結果は合計の報告、リン酸化 1.2 にドキソルビシン (10細胞アポトーシスを誘導する一般的な化学療法剤) に公開される文化 (セリン 15、セリン 20) p53、1.8 と収穫前に h 4 の 2.4 μ g/mL メディア。P53 のピーク面積は、ɑ-チューブリン、ローディング コントロールとして使用する正規化されます。
プロトコル
注: 製造業者に従ってすべての試薬とサンプルが準備されていることを確認 ' s プロトコルは、以下の通り。この手順、ニトリル手袋、白衣、閉鎖つま先の靴、安全ゴーグルなどの中に適切な個人用保護具を着用してください。特定の材料、試薬や必要な機器のテーブルが個別に提供しています。あらかじめブラッドフォード法 11 のように溶解バッファーを使用すると互換性がある確立された方法論を使用してサンプルの総蛋白濃度を決定する必要があります
。1 ですサンプルと試薬製造元によって提供された標準的なパックからの準備
- ジチオトレイトール (DTT) の 400 mM の作業ソリューションを準備、透明なチューブを含むに 40 μ l の脱イオン水を追加する
- 、。メーカーから在庫を供給しました。ゆっくりと穏やかなピペットで溶液の混合によってソリューションに気泡を導入することを避けることが重要です 。
- 追加 20 μ L 10 X サンプルバッファーと 20 μ L 蛍光 5 X を含むピンクのチューブに準備された 400 mM DTT ソリューションのマスター ミックス (材料の表 を参照してください).
注: マスター ミックス (MM) ホイル カバーの製造元によって密封される、ピペット チップでピアスする必要があります。ピペットの DTT を水しぶきを避けるために低速ピペッティングで優しくミックス 。
2 μ L のサンプル バッファー、および製造元によって提供白ビオチンはしご管準備の 400 mM DTT ソリューションの 2 μ L × 10 を指定、 - は次に、16 μ L の脱イオン水を追加します。穏やかに混合し、変性剤濃度を 0.6 mL チューブに移す 。
- X サンプルバッファー水とソリューションを 1: 100 X 付属の 10 を希釈して 0.1 準備。十分な 0.1 x すべてのサンプルを希釈するサンプル バッファーを準備します 。
- は、最終的な目的総蛋白濃度に依存するサンプルに追加される 0.1 x サンプルバッファーの量を計算します。ミックス 1 パート 5 蛍光 MM x 4 つの部分では、目的最終的な蛋白質の集中を達成するためにサンプルを希釈しました。
- 計算通りボリューム: (i) 蛍光 MM x 5 巻 (希望最終的なタンパク質濃度) = 5;/(ii) 蛋白質在庫量 = (必要な容量 x 希望最終的なタンパク質濃度)/蛋白質素材濃度;(iii) ボリューム 0.1 x サンプルバッファー合計ボリューム - 5 MM ボリューム x - 蛋白質の在庫数量を = します 。
2。サンプルとはしごの変性
- に用意された場所のサンプルと、95 ° C の熱ブロック、孵化直後後 5 分ボルテックス チューブをビオチン化はしご実行 〜 5 のスピン卓上遠心と氷の場所で s
注: いくつかの蛋白質は蛋白質の集合を防ぐために、キャピラリーのマトリックスに移行を向上させる穏やかな変化の条件 (例えば、70 o C で 10 分間) を必要があります。(たとえばビデオを見なさい) より高い分子量の重いスミアがある場合このオプションを検討してください 。
3。抗体の調製
- 最適化によって決定される (代表結果 と ビデオ を参照)、指定された抗体一次抗体 (例えば、1:50、1: 100) の目的の dilution(s) を準備希釈 2.
注: 抗体より高い濃度ではより伝統的な西部のしみのためのキャピラリー ベース イムノアッセイの通常使用されます。指定された二次抗体は希釈せずに使用する準備ができています 。
4。ルミノール-S と過酸化物の準備
- ルミノール S と過酸化水素の 1:1 の混合物を準備します 。
- ミックス、氷に格納して渦
注: この混合物を各実験の試金のために新鮮な用意があることが重要です。250ul 合計ミックスは完全な板を実行に必要な 。
5。アッセイ プレートの作製
- 図 1 で示すように、読み込むサンプルと試薬アッセイ プレートに上記準備します。行ごとに以下の詳細な手順を参照してください。井戸からの蒸発を抑えるようにプレート蓋が試薬の追加と置き換えられます 。
- も A1 に A、ビオチン化はしごのピペット 5 μ L の行で。残りの行のピペットは A2 A25 の井戸にサンプル (各 5 μ L) を準備します
。 注: それはカートリッジ最初の毛細血管は、この標準を実行するため最適化されているので A1 がよく、常にはしごを含まれていること不可欠です 。
- B (B1-B25) を各ウェルに抗体希釈 2 ピペット 10 μ L の行にします 。
- も C1 に行 C 抗体希釈 2 ピペット 10 μ L で。残りの行の C 井戸、一次抗体 (ウェルズ C2 C25) のピペット 10 μ L.
- も D1 に行 D、ストレプトアビジン-HRP のピペット 10 μ L で。残りの行で D 井戸、二次抗体 (ウェルズ D2 D25) のピペット 10 μ L.
- E (E1 E25) を各ウェルに作りたてのルミノール過酸化ミックスのピペット 10 μ L の行にします 。
- は、最後に、各バッファーの井戸の上部 3 行に当たりコンパートメント 500 μ L 洗浄バッファーを追加します
。 注意: 軽くピペッティングし、泡が毛細血管の読み込みを妨げるし、実行しない先端から最終巻を追放して気泡を最小限に抑えることが重要です 。
- すべての井戸を読み込んだら、泡を削除し、井戸の底に液体が確実に部屋の温度で 5 分間 ~ 1000 × g でプレートを遠心分離機します。小ピペット チップまたは清潔な針で任意の目に見える気泡をポップ (例えば、25 ゲージ滅菌 " 担当者トップ " 針).

図 1 。アッセイ プレート ピペッティング テンプレート。色分け適切な試薬、アッセイ プレートに追加のサンプル (最大 24 合計) を表します。A25 まで井戸 A2 からサンプルを準備も A1 (オレンジ) にビオチン化はしごを追加 (水色)、B25 B1 と C1 の井戸に抗体希釈 2 (ライト グリーン)、井戸 C2 C25 (青)、ストレプトアビジン-HRP も D1 にまでに一次抗体 (濃いピンク) に二次抗体D25 まで D2 の井戸 (ダーク グリーン) と E25 (紫) まで E1 の井戸にルミノール過酸化ミックス。洗浄バッファーが大きい中間プレートの最初の 3 つの行に追加されます (紺) の井戸。 この図の拡大版を表示するのにはここをクリックしてください
6。 キャピラリーのイムノアッセイ装置の開始
- 楽器とそれに伴うコンピューターの電源がオンになっていることを確認します。ウォーム アップ時間は必要ありません 。
- は、コンピューターで計測ソフトウェアを開きます。最初に、選択、" アッセイ " ウィンドウの右側にあるタブと " 新しいアッセイ " の下で、" ファイル メニュー " 左側。サイズ、サイズの範囲 (例えば、12 230 kDa)、およびカートリッジ選択特定のアッセイに使用された型 (例えば、25 キャピラリー).
注: 1 つ 5 月も入力アッセイ パラメーター希望場合蛋白質の集中、抗体の種類、希釈を含むがこれらは測定を開始する必要はありません 。
- オレンジのパネルの上にボタンを押すことにより計測器のドアを開きます 。
- は、パッケージからキャピラリー カートリッジを慎重に取り外します。ガラス管に触れることがなく、自分自身はカートリッジ ホルダーにカートリッジを配置します。インテリア光のオレンジ色から青色に変化を観察することによってカートリッジの座席を確認してください 。
- は、プレートをベンチにしっかりし、プレートの下の部分から蒸発シールを慎重にはがします。Sm とこれらの分離行列の井戸に見られる任意の気泡をポップします。すべてのピペット先端部やきれいな針 (例えば、25 ゲージ滅菌 " 担当者トップ " 針).
- がしっかり確保するプレート ホルダーにアッセイ プレートを置き、計測器のドアを閉じます 。
- をクリックして、" 開始 " ソフトウェアでボタンします
。 注: [スタート] ボタンが表示されない場合、計測器との接続が失われました。トップ左側のメニューから計測器を選択し、接続します。機器のシリアル番号; とポップアップが表示されます。これは、[接続] をクリックします。[スタート] ボタンが表示されます 。
- の実行が完了したときは、プレートを破棄します。カートリッジを取り外し、気泡をポップして使用された針と一緒に処分のため鋭利な容器に入れます。楽器が定期的に使用されている場合、接続の問題を避けるために力を残す (例えば、少なくとも毎週) です 。
7。実験解析
- 分析前に、確認次の品質チェックが行われます。
- ことを確認を選択して蛍光標準、" 表示基準 " アイコン。基準がで正しく認識されていることを確認、" グラフ ビュー "] タブ。彼らは間違っている場合に行く、" 単一のビュー " 正しいピークを右クリックし、アイコン、" 力標準 "、または不適切なピークを右クリックし、選択 " ない標準 "。各新しい毛細血管にこのチェックを実行します 。 クリックして
- を確認ビオチンはしご、" サンプル " と " 単一のビュー " アイコン。[実験] タブではしごを選択します。ピークが正しく識別されていない、もし右クリックで " グラフ ビュー " を選択、" 削除ピーク ".
注: たとえば、12 230 kDa キット用ビオチンはしごする必要があります表示 12、40、66、116、180、および 230 の kDa のサイズのピーク。この手順を実行しない場合サンプルのピークのサイズが正しく計算されない、誤った結果を生成します 。
- ビューおよびサンプル ピークを分析します。実験的計算に必要な信号対雑音 (S/N)、ピークの高さやピーク面積分子量を含むピーク テーブルからデータを取得します 。
結果
露光時間-決定信号バーンアウト
信号燃え尽き症候群は、ルミノール及び過酸化基質がなくなるとすぐに発生します。これは、異なる化学発光の露光時間でデータを調べることによって決定できます。解析ソフトウェアで「編集->-> 画像解析」に行きます。露光範囲は 480 に 5 s。レーザービームの y 軸は、それぞれの露出からのデータと同様の信号/時間係数を持つ必要がありますので信号/時間を報告します。この係数が小さくなる順に長い露光でルミノールを使い尽くすと場合、p53 は 1 抗体 (図 2) で見る。基質の枯渇のためこのアッセイを 5-30 の露出でのみ 0.2 μ g/μ L の濃度まで測定可能で検討できます。したがって、この例では、15 で s は p53 の最適なデータ解析露光時間を決定しました。
ライセートの滴定-線形動的な範囲を決定します。
測定はピーク面積で測定された信号の変化がサンプルの蛋白質の量の変化に比例して各アッセイの線形ダイナミック レンジ内で撮影することが重要です。15 s の選択の最適な露出時間を使用して前のセクションで p53 と ɑ チューブリンのアッセイの直線性を実演上濃度 (図 3) の 15-fold の範囲を超える。我々 の経験の R2値で >、線形回帰の 0.9 と見なされます許容既知量 (場合の試金は絶対定量) またはサンプルの精製タンパク質の希釈範囲の不明なターゲット蛋白ライセート (場合アッセイ相対定量測定は、)。
抗体希釈の最適化
飽和濃度で抗体を使用する測定信号の変化が蛋白量の変化だけによるものであることを確認できます。例として 2 つと 2 b セルライン全細胞抽出 (アッセイに読み込まれる 0.2 μ g/μ L 総蛋白) は希釈した ɑ チューブリン抗体濃度が 1:25 - 1:800 (図 4) に至るプローブされました。化学発光信号 (ここでは、ピーク面積として測定) 抗体希釈に対してプロットしました。彩度は、1:50 近く観察された希釈曲線が顕著な高原を開始します。
実験的試み - ベアス 2 b 細胞におけるドキソルビシンの治療
ベアス 2 b 細胞培養はドキソルビシンの 3 つの異なる濃度の扱われた最適化されたアッセイ条件を使用して、(1.2、1.8 と 2.4 μ g/mL) 4 時間 (図 5、表 1)。翻訳後修飾による p53 の活性化は、細胞周期の停止、老化、アポトーシス12など、いくつかの細胞応答を仲介します。具体的には、15 のセリンのリン酸化は、ドキソルビシン治療13後アポトーシスの結果、p53 の転写活性化に起因しています。このデモでは、ɑ チューブリンはピーク領域は、コントロールの倍として表示を正規化します。興味深いことに、3.5 p53 リン酸化セリンで 4 倍増にドキソルビシンに 4 時間暴露後 20 セリンのリン酸化 p53 のレベル 15 と 2 倍増加がみ。これらの結果を示す p53 の活性化しかし、用量-反応は見られなかった選択濃度 (逆に、低用量のテストでは、最高の応答が誘発される)。総 p53 このモデル システムでは、明確な治療に対する反応を示さなかった。我々 は以前14亜鉛処理と 2 b の細胞で p53 がない場合は同様の条件で総 p53 の増加レベルのリン酸化の活性化を観察しました。

図 2.露出画像比較信号バーンアウトを検出します。レーン表示 1: 500 希釈で p53 は 1 抗体プローブ ベアス 2 b 溶解液のタンパク質濃度を減少します。化学発光信号係数、計測器ソフトウェアのピーク高さとして報告を重畳しています。ピーク高さとは異なりビジュアル バンド強度が自動的に生成され、バンドとは別に 1 つのパネルから匹敵するの表示を支援する装置によって調整します。信号と消失しつつある (スプリット ピーク) 基質の枯渇を示す 2 つの長い露出で露出時間が増加し、化学発光シグナルの低下を注意してください。この図の拡大版を表示するのにはここをクリックしてください。

図 3.ライセートの滴定がレーンのビューを表示します。車線を示す溶解液の滴定は、ベアス-2 b 1: 500 p53 は 1 または 1:50 ɑ-チューブリン プローブされるときライセートの(A)を表示します。ピーク面積の値とは異なりビジュアル バンド強度が自動的に生成され、バンドとは別に 1 つのパネルから匹敵するの表示を支援する装置によって調整します。線形回帰分析 (B) は、アッセイは、テスト、0.20 μ g/μ L と 0.025 から 0.40 μ g/μ L, R2値 0.999 の 0.985、0.01 からそれぞれ全範囲にわたって線形を確認します。線形範囲の真ん中に総蛋白濃度は、どちらの方向 (例えばα-チューブリンの 0.2 μ g/μ L) の潜在的なターゲット蛋白質バリエーションに合わせて選ばれました。この図の拡大版を表示するのにはここをクリックしてください。

図 4.2 lysates の別ベアス 2 b タンパク質とベースライン正規化なしの α-チューブリン抗体希釈曲線します。明確な発車直線性からトゥーレは、1:50 (0.02) で見られて希釈、彩度を示します。1:50 したがって、この抗体の希釈として選ばれました。この図の拡大版を表示するのにはここをクリックしてください。
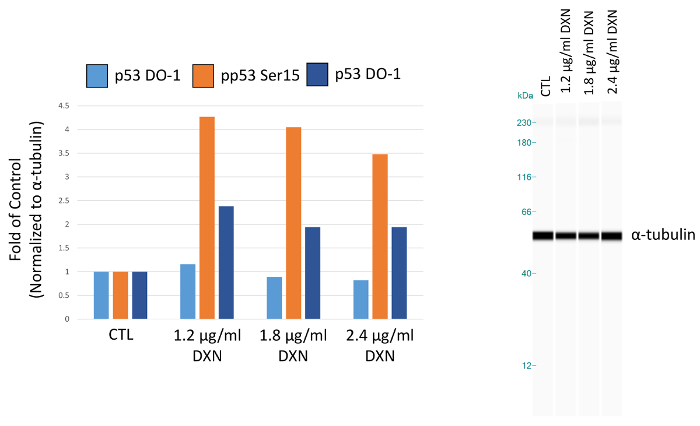
図 5。セリンに 4 h ドキソルビシン (DXN) 治療の効果は、ベアス 2 b 細胞の p53 蛋白発現をリン酸化します。ピーク面積は α-チューブリンに正規化され、コントロール (CTL) の倍としてプロットします。この図の拡大版を表示するのにはここをクリックしてください。
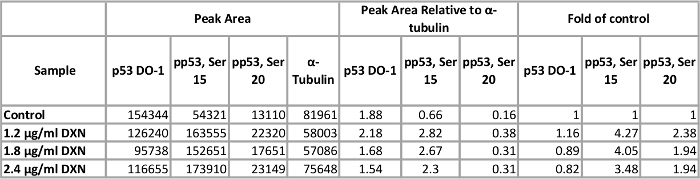
テーブル 1。セリンに 4 h ドキソルビシン (DXN) 治療の効果は、ベアス 2 b 細胞の p53 蛋白発現をリン酸化します。この表の拡大版を表示するのにはここをクリックしてください。
ディスカッション
何十年もがずっとあるキャピラリー電気泳動を用いた免疫測定法の開発で持続的な関心低いサンプルと試薬の支出のため、減少処理従来の方法と比較して時間と高い互換性手順4,15を自動化します。毛細血管、ふるい分けの電気泳動、動電、ポリマーと (それぞれ異なるプロパティによってタンパク質を分離、等電点方法などを利用して蛋白質の分離のための異なるプロトコルの数があります。静電気、分配平衡、ふるい分け分離マトリックス、および pH のプロパティ)16。ここでは、自動化されている分離をふるい高分子を用いた抗体ベース (または免疫測定法) のキャピラリー電気泳動法と商業的に採用された3について述べる。このシステムの利点は、使用の操作、標準化された市販試薬と少ない試薬と西部のしみなど伝統的な蛋白質の試金と比較してサンプルを必要とする信頼性の高い、高感度測定の容易さ酵素免疫測定法、その他は、3,4,5を書式設定します。それは、利用可能な分離行列4、しかし最近の製品は 440 kda17 2 から測定可能な範囲を拡大しているによって評価することができます蛋白質のサイズの範囲が制限されており、この技術の以前の評価で指摘されています.さらに、いくつかの溶解バッファーは、18のアッセイに対応する知られている、したがって使用実験試薬の選択考慮されなければならない事前。
市販のコンポーネントを持つ自動化されたプロシージャの主な利点は、標準化された方法と試薬を使用して結果の一貫性です。これはプロシージャ内で重要なステップを自動化してアッセイの失敗のチャンスを最小化します。しかし、キャピラリー電気泳動を用いたイムノアッセイに関する問題を最小限に抑えるためのプロトコル間に特定の慣行が守られなければならないことに注意する重要です。まず、平板載荷の前に新鮮なすぐをルミノール-S/過酸化水素混合物準備は重要です。一貫したタイミングは、一貫性のある発光アッセイ後特定の抗体アッセイの一貫性のある測定値になります、酸化剤を追加した後で発生します。さらに、酸化剤の効力に影響を与える主に試薬の期限切れでないが使用されることが重要です。また、その他の試薬、抗体、サンプルの読み込み順序が (図 1参照) を従うこと厳密に重要です。場違い戻どの試薬は、アッセイの失敗と無駄な実行になります。
これらの重要な手順に加え手法で発生した主な問題は一般的に、最適化によって克服します。確かに、これらの条件はモデル システム/抗体の組み合わせごとに固有であり、したがって各の新しいアッセイの経験的決定する必要があります。この記事で私たちは 3 つの一般的な最適化の手順に焦点を当てる: 露光時間、ライセート滴定および一次抗体希釈。測定可能な結果を生成する能力は、いつルミノール基板はない急速に減らされて、信号の損失で基板の枯渇の結果として露光時間の解析に依存します。ライセートの滴定は、同じ蛋白質ターゲットのための異なった抗体と同様に、別のモデル システムと異なることがそれぞれのアッセイの線形ダイナミック レンジを決定します。抗体希釈濃度を飽和状態に近い選択は無料抗体の不足によって、利用できる蛋白質ターゲット エピトープの異なる量によってのみ、信号の変化は影響しないを確認します。抗体培養時間とスタッキング/サンプル読み込み時間最適化プロセス中にその他の考慮事項があります。ほとんどの場合は、楽器の既定の設定は、解像度と感度の最適なバランスを提供しています。ただし、いくつかの場合、貧しい人々 の解像度や感度を改善できますこれらのパラメーターを調整することによって。
キャピラリー電気泳動を用いた免疫測定法は、高速で効率的、かつ再現性のある蛋白質測定を提供します。一方、これらのメソッドは、研究・開発の設定で主に利用されている、これらの技術の一貫性は、規制と臨床アプリケーションの潜在的なユーティリティと。たとえば、病気の進行と環境毒性や患者に影響を受けやすい集団の同定は、血液、尿、唾液などのアクセス可能な行列の測定蛋白質バイオ マーカーに基づくことが。試薬と操作コスト ドロップ数のサンプルと同時に評価の増加をすることができますターゲットと多分キャピラリー電気泳動を用いたイムノアッセイ法アプリケーションのこれらの種類の使用を見る。
開示事項
著者は、彼らは競合する金銭的な利益があることを宣言します。この原稿が国立健康環境影響研究所によってレビューおよび承認します。コンテンツは、米国 EPA の見解を必ずしも反映しないも支持または推奨される使用法を構成する商号や商品の言及は。
謝辞
著者は、研究と開発研究の三角形公園 (ORD RTP) グラフィックとメディア チーム開発のための米国環境保護庁テーピングし、教育のビデオの編集のキース tarpley 氏に感謝したいと思います。またデータ.の最適化に関する役に立つ会話の ProteinSimple からデボラ ・ プリチェットを感謝したいと思いますJM Guynn は、科学教育研究/参加プログラム米国の環境保護庁のオークリッジ国立研究所によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Wes instrument | ProteinSimple (Santa Clara, CA) | 004-600 | |
| P53 DO-1 primary antibody | Santa Cruz Biotechnology, Inc. | sc-126 | |
| phosphorylated p53 (ser 15) primary antibody | Cell Signaling Technology | 9286 | |
| phosphorylated p53 (ser 20) primary antibody | Cell Signaling Technology | 9287 | |
| alpha-tubulin primary antibody | Cell Signaling Technology | 3873 | used as a loading control |
| Compass Software | ProteinSimple (Santa Clara, CA) | provided with the Wes | |
| 12-230 kDa Master kit | ProteinSimple (Santa Clara, CA) | PS MK02 (since replaced by a new kit #) | |
| www.proteinsimple.com/consumables_sw_wes.html | INCLUDES PART NO: Wash Buffer (60 mL) 042-202 10X Sample Buffer (440 μL) 042-195 Pre-Filled Microplates (8) PS-PP01 Capillary Cartridges (8) PS-CC01 Antibody Diluent II (20 mL) 042-203 Luminol-S (1.5 mL) 042-233 Peroxide (1.5 mL) 042-234 Streptavidin-HRP (132 μL) 042-414 Standard Pack (8): Biotinylated ladder, fluorescent 5X master mix, DTT, and empty 0.6 mL tube PS-ST01 Anti-Rabbit Secondary Antibody 042-206 or Anti-Mouse Secondary Antibody 042-205 | ||
| Name | Company | Catalog Number | Comments |
| Cell culture, treatment, and harvest (using vendor recommended protocols; protocols not included in manuscript) | |||
| BEAS-2B cells | American Type Culture Collection (ATCC, Manassas, VA) | CRL-9609 | |
| keratinocyte growth medium, KGM Gold | Lonza Ltd (Basel, Switzerland) | 192152 | for cell culture |
| keratinocyte basal medium, KBM Gold | Lonza Ltd (Basel, Switzerland) | 192151 | serum free medium for chemical dosing |
| doxorubicin | Sigma-Aldrich (St. Louis, MO) | D1515 | |
| Coomassie Blue Bradford Assays | ThermoFisher Scientific (Waltham, MA) | 23200 | for protein quantification |
| Nuclear Extract kit | Active Motif (Carlsbad, CA) | D1515 | used to prepare whole cell lysates |
| INCLUDES: | |||
| Lysis Buffer AM1 | |||
| 1M dithiothreitol (DTT) | |||
| Protease Inhibitor Cocktail | |||
| 10X PBS | |||
| Phosphatase Inhibitors |
参考文献
- Bradley, H. L., Sabnis, H., Pritchett, D., Bunting, K. D. . Hematopoietic stem cell protocols. 1185, (2014).
- Guo, L., Eldridge, S., Furniss, M., Mussio, J., Davis, M. Use of Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes (hiPSC-CMs) to Monitor Compound Effects on Cardiac Myocyte Signaling Pathways. Curr Protoc Chem Biol. 7 (3), 141-185 (2015).
- Chen, J. Q., et al. Absolute quantitation of endogenous proteins with precision and accuracy using a capillary Western system. Anal Biochem. 442 (1), 97-103 (2013).
- Chen, J. Q., Wakefield, L. M., Goldstein, D. J. Capillary nano-immunoassays: advancing quantitative proteomics analysis, biomarker assessment, and molecular diagnostics. J Transl Med. 13, 182 (2015).
- Liu, S., et al. The Application of a Novel Nanovolume Capillary Electrophoresis- Based Protein Analysis System in Personalized & Translational Medicine Research. J Bioanal Biomed. S3 (004), (2013).
- ProteinSimple Western. . Size Assay Development Guide, Revision 1. , (2014).
- Eaton, S. L., et al. A guide to modern quantitative fluorescent western blotting with troubleshooting strategies. J Vis Exp. (93), (2014).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Silva, J. M., McMahon, M. The fastest Western in town: a contemporary twist on the classic Western blot analysis. J Vis Exp. (84), e51149 (2014).
- Thorn, C. F., et al. Doxorubicin pathways: pharmacodynamics and adverse effects. Pharmacogenet Genomics. 21 (7), 440-446 (2011).
- Ernst, O., Zor, T. Linearization of the bradford protein assay. J Vis Exp. (38), (2010).
- Taira, N., Yoshida, K. Post-translational modifications of p53 tumor suppressor: determinants of its functional targets. Histol Histopathol. 27 (4), 437-443 (2012).
- Thompson, T., et al. Phosphorylation of p53 on key serines is dispensable for transcriptional activation and apoptosis. J Biol Chem. 279 (51), 53015-53022 (2004).
- Currier, J. M., Cheng, W. Y., Menendez, D., Conolly, R., Chorley, B. N. Developing a Gene Biomarker at the Tipping Point of Adaptive and Adverse Responses in Human Bronchial Epithelial Cells. PLoS One. 11 (5), e0155875 (2016).
- Moser, A. C., Hage, D. S. Capillary electrophoresis-based immunoassays: principles and quantitative applications. Electrophoresis. 29 (16), 3279-3295 (2008).
- Shintani, H. . Handbook of Capillary Electrophoresis Applications. , (1997).
- . Wes reagents and consumables :: ProteinSimple Available from: https://www.proteinsimple.com/consumables_sw_wes.html (2017)
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved