このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ラット舌の機械的および粘弾性的特性のインビボ評価
要約
我々は、舌の筋緊張および粘弾性を決定するための麻酔したラットモデルにおける外科的処置を記載する。この手順は、舌下神経の特異的刺激、および受動的リサージュ力/変形曲線の筋肉への適用を含む。
要約
舌は、ほとんどの脊椎動物の口の床に高度に神経支配され、血管新生された筋肉静止画である。主な機能には、咀嚼と嚥下のサポート、味覚と音韻のサポートが含まれます。したがって、舌の強度および体積は、脊椎動物が摂食、伝達および呼吸などの基本的な活動を達成する能力に影響を及ぼす可能性がある。睡眠時無呼吸のヒト患者は、舌を大きくし、筋緊張の低下および筋内脂肪の増加を特徴とし、磁気共鳴映像法(MRI)によって視覚化および定量化することができる。舌の力発生および粘弾性を測定する能力は、画像化データと相関する機能的情報を得るための重要なツールを構成する。ここでは、麻酔下のZuckerラットにおける舌下神経の電気刺激による舌力産生の測定技術および粘弾性特性の決定技術を紹介するf受動的なリサージュ力/変形曲線を適用して舌を形成する。
概要
舌は、咀嚼、嚥下、味覚センシング、および発言に不可欠なサポートを提供します。明確な神経支配および解剖学的/機能を有する外因性および内因性の筋肉の存在は、この筋肉質のハイドロスタットの特異性を説明する。最近の画像技術の進歩により、その複雑な解剖学的構造1のより詳細な図が提供されている1 。舌機能の低下、舌の萎縮、嚥下障害および言語障害は、パーキンソン2 、筋萎縮性側索硬化症(ALS) 3 、筋緊張性ジストロフィー(MD) 4および他のミオパチーのような筋障害状態の共通症状でもある。
一般的な疾患状態に関連する筋肉組成の変化は、舌の機械的特性および粘弾性特性に影響を及ぼす。例えば、舌力の機能解析は、老化に伴う収縮特性の変化を明らかにしているss = "xref"> 5,6 、低酸素症7,8および肥満9,10 。筋ジストロフィーの場合、線維化の増加はより高い筋肉の剛性をもたらし、リサジューの変形プロトコルが適用されたときの変形に対する適合性が低下する。逆に、肥満患者に記載されているような筋肉脂肪含量の変化は、骨格筋13,14の代謝および機械的特性の両方を変化させ、変形に対する筋肉コンプライアンスを増加させると予測される。舌脂肪の増加はまた、部分上気道閉塞(無呼吸)の点まで舌体積を増加させることによって、ヒト17における閉塞性睡眠時無呼吸(OSA)の発症と相関する15,16 。シムヒトと同様に、舌脂肪の浸潤は肥満のZuckerラット10に記録されており、このモデルは脂肪の浸潤が舌の生理作用に及ぼす影響を研究する貴重なツールであることを示唆している。
舌の力を測定するには、舌下神経17,18を分離して両側に刺激するために繊細な外科的技術が必要である。このような技術は、ラット5,17,19,20、ウサギ21およびヒト22,23 において以前に記載されているが、研究者に視覚補助は限られている。その高度な技術的性質のために、詳細なプロトコルの利用可能性は、この技術のアクセス可能性および再現性を著しく改善する。実験的なパラダイムの目標は、病気ラットモデルの舌の強度と粘弾性を測定するための有効で信頼性の高い技術を習得します。これを達成するために、ラットを麻酔し、舌下神経を露出させ、気管にカニューレを挿入して動物の舌に自由に接近させる。次いで、縫合ループは、舌の先端を、力と長さの両方を制御することができる力トランスデューサに接続し、一方、2つの双極フック電極は、舌下神経を刺激して舌の収縮を誘発する。力測定が完了した後、一定の振幅(リサージュ曲線)、持続時間および周波数を有する正弦波プロトコルに従って、力変換器の長さ制御能力を用いて舌の長さを迅速に変化させ、その粘弾性11,24。このプロトコールは、解剖ステップ、実験動物の位置付けrm、電極の配置、および最後に力および粘弾性データの取得および分析に至る。
プロトコル
動物被験者を含むすべての手順は、ペンシルバニア大学の機関動物管理および使用委員会(IACUC)(議定書番号805822)によって承認されている。記載された手順は終末であり、無菌状態または医薬グレードの製品の利用を必要としない。
1.外科的処置
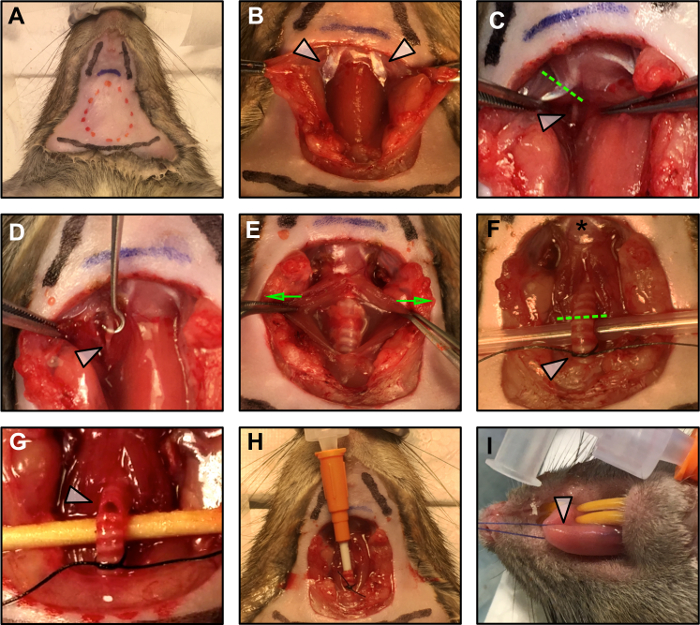
図1:手術手順。
(A)手術計画の境界。赤い破線は、切開の面積を示す。 2本の黒い線は顎の位置を示し、下の黒い線は胸郭の位置を示す。青い線は舌骨を示しています。 (B)脂肪組織、舌下およびサブマックスの鈍的切開後の胃の腹部(矢印)の曝露アリー腺。 (C)舌下神経を露出させるために胃の腹部の腹部の切除(破線の緑色の線)(白い矢印)。 (D)舌下神経(白矢印)は、周囲の筋膜から除去される。 (E)気管は周囲の平滑筋を静かに引き離して(緑色の矢印は力の方向を示す)、挿管準備のために持ち上げ(F)して気管を露出させる。星は、舌骨が舌骨に挿入されたことを示します。緑色の破線は、挿管のための切開部を示す。白い矢印は、挿入されたカニューレを所定の位置に固定するために準備されたゆるい結び目を示す。 (G)カニューレ挿入のための気管切開。 (H)気管カニューレを挿入し、正方形の結び目で所定の位置に固定する。 (I)舌への縫合糸の適用。target = "_ blank">この図の拡大版を見るには、ここをクリックしてください。
- 麻酔と手術準備
- 4%イソフルラン麻酔で誘導チャンバーにラットを置きます。
- 動物の仰臥位を熱源に置き、1〜3%のイソフルランで麻酔を維持し、毎分70回以上の呼吸を確保する。
- エアークリッパーと脱毛クリームで頸部を剃る。脱毛クリームを使用するときは、毛皮が取り除かれるまで、コットンチップアプリケータでクリームを広げます。長時間の脱毛クリームへの暴露は、皮膚の刺激を引き起こす可能性があります。
- 手術野を70%アルコールで洗浄する( 図1A )。
- 最初の切開を続行する前に、動物の呼吸パターンと反射(つま先のピンチ反射がない)を確認してください。継続的な麻酔深度のモニタリングと評価は不可欠です脊髄呼吸数および10分ごとの反射の欠如);手術中に麻酔の深い外科手術面の下に動物を置く必要があります。
- 下肢神経識別
- 図1Aの赤い点線で示すように、皮膚を切除して取り外すことにより、手術用はさみで手術野を開きます 。
- 脂肪組織、舌下および顎下腺、ならびに気管を取り囲む筋層を通って鈍化させる。
注:解剖中に慎重にしてください。可能な限り鈍的な切開を使用し、首の血管を傷つけないように注意してください。 - 気管の側方の胃の腹部(PD)を特定する( 図 1B-白い矢印)。舌下神経はこの筋肉の下を走る( 図1C-白い矢印)。電気焼灼器を用いて、PDプロキシを切除する( 図 1C-破線)。
注:周囲の神経や組織が乾燥しないようにしてください。それを保護するために神経に鉱物油の滴を加えなさい。電極からの刺激の電界伝播による筋収縮を避けるために、神経周囲の可能性のある接触部位の筋肉組織を慎重に焼灼する。 - 微細な鉗子のペアを使用して、周囲の筋膜から舌下神経を切開する。フックの助けを借りて、双極電極( 図1D )の接続のために少なくとも3mmの神経が利用可能であることを確認する。
- マイクロ止血鉗子を使用して、刺激の逆行伝搬を避けるために、可能な限り舌骨( 図1D-白い矢印)から遠位に舌下神経を圧潰する。マイクロ止血鉗子で5秒間圧迫して神経を粉砕します。止血鉗子が神経をつかむと、簡単なt舌の底にある魔女が目に見えるはずです。
- もう一方の手順を繰り返します。
- 気管挿管
- 周囲の平滑筋を鈍い切開によって静かに分離して気管を露出させる( 図1E-緑色の矢印で示す)。
注意:控えめで、鈍的な切開を優先的に使用してください。カニューレの直径と気管の直径を比較する。カニューレは気管内に正確に収まるはずであり、ステップ1.3.2から1.3.5で説明されているように縫合された後、安定して挿入されたままでなければならない。 - 静かに縫合糸鉗子のペアを使用して気管を持ち上げ、胸郭の近くに、その下に4から0の縫合を渡す。喉頭から6番目と7番目のリングの間に最初の緩い結び目を結ぶ( 図1F-白い矢印)。この結び目はカニューレが挿入されると閉鎖され、カニューレは所定の位置に保持される。
- 茎のスライド気管の下に移送ピペット(鉱油でピペットを潤滑して挿入を容易にする)を行い、カニューレ(IV 14 gx 3.25 "カニューレ)の挿入を容易にする。
- 喉頭から4番目と5番目のリングの間に小さな切開を切る( 図1G-白い矢印)。最初の切開後、開口部は広がる傾向があるので、気管の完全切除を避けるために最初の切開を行う際には控えめである。
注:気管切開を行う前に、カニューレの準備が整っており、麻酔が行われていることを確認してください。 - カニューレを通して麻酔投与を開始し、約5リングの長さの気管内を穏やかに前進させて切開部に静かに挿入する。気密シールを作成するために、カニューレを縫合糸で固定します( 図1H )。
注:痛みを避けるために、ニックの入った気管に液体が入っていないことを確認してください。気管が切開されると、動物は室内の空気を呼吸します。したがって、麻酔の送達が維持されるようにカニューレを迅速に挿入することが重要である。動物を動かす場合は、気管内のカニューレの正確な位置を監視します。 - 動物をノーズコーンから静かに取り出します。
注:イソフルランの代わりに注射可能な麻酔薬を使用すると、気管挿管の必要性を排除し、過剰な管から実験的作業空間を取り除くことによって手順を単純化することができる。
- 周囲の平滑筋を鈍い切開によって静かに分離して気管を露出させる( 図1E-緑色の矢印で示す)。
- 舌の縫合
- 20cmの長さの5/0縫合糸を浸す(我々は、シルク、黒の編組をPBSで推奨する)。
- ラットの口を開けたまま、舌の先端を縫合糸鉗子で静かに保持する。
- 潜在的な組織を避けるために舌を生理食塩水で湿らせておくために注意を払って、舌の先端を通して縫合糸を内側に通す( 図1I-白い矢印)損傷。
- 約4cm幅のループを結ぶ(直径は、動物と力トランスデューサとの間の距離に基づいて変化し得る)。
注:挿入を容易にし、組織の不要な病変を避けるために、縫合糸と舌が濡れていることを確認してください。
2.実験的セットアップ
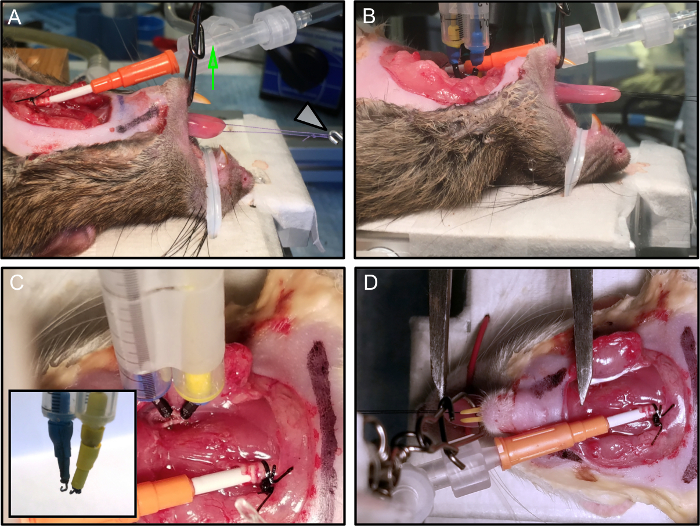
図2:動物の配置と保護。
(A)マウスを実験プラットフォーム上に置く。顎は固定され、垂直の張力(緑の矢印)の適用によって口が開いたままに維持される。縫合ループは、力トランスデューサ(白い矢印)に接続されています。 (B)電極が接続されている。 (C)マイクロマニピュレータに取り付けられた各電極は、安定して神経に接続されている。インレイは、tの終了を示す彼はフック電極。 (D)舌の最適な長さは、舌骨のレベルまでの挿入から舌の先端までのバーニアキャリパーで測定される。この画像では、明確にするために電極を除去した。 この図の拡大版を見るには、ここをクリックしてください。
注:実験中の動きを避けるために、以下の固定手段を使用して、動物の仰臥位を装置の加熱トレイに置く。
- 加熱されたプラットフォーム( 図2A 、 2B )に直接接続されたプラスチックでコーティングされた金属のツイストタイを使用して、ラットの鼻をトレイに固定します。
- 垂直張力をかけることによって開けられたラットの口を維持する(9kgの試験モノフィラメントラインに結合された3ウェイスイベルを使用し、カメラスティックで所定の位置に保持する)( 図2A-緑色の矢印)。
注:ラットを安定化させるための別のアプローチは、齧歯類の口渇きまたはそのカスタム修正を使用することです。測定の質に影響を与える可能性のある首の動きを避けるために、口が開いて安定して維持されることが不可欠です。 - 縫合ループを力トランスデューサに接続します( 図2A - 白い矢印)。
- 外科用テープを使用して、ラットの四肢および腹部を固定し、刺激中の動きを制限する。
- 2つの刺激フック双極電極を解剖された舌下神経に、クラッシュ部位の近位に適用する( 図2C )。
- プラスチック製のサポート(ここでは、2本の1mLの血清学的ピペットを一緒に使用しています)を使用して、互いに2mmの距離で一緒に保持された、外科用グレードの鋼製29ゲージ針電極の対から作られた刺激性の双極電極を使用してください。
- ニードル電極の先端をフック状に曲げる神経との安定した接触を形成するのに十分小さい( 〜1mm直径)( 図2C-インレイ)。
- 各電極の2本のワイヤーをバナナジャック×BNCジャック付きの積み重ね可能なダブルバインディングポストに接続し、BNCスプリッターを使用してインサイチューマッスルテストシステム(表3)の刺激モジュールに接続します。
注記:動物が安定していること、および首と舌が力変換器のレバーに揃っていることを確認してください。呼吸数のモニタリングを続け、拘束具が呼吸を妨げないようにします。
3.最適長(L 0 )および最大等配力決定
- 舌の長さを徐々に調整し、最大の力が得られるまで等尺性の痙攣刺激を適用する。
- 等尺性収縮力( 表1 )が最大となる長さとしてL 0を定義し、その後の正規化について記録する力の測定は、すべての動物のために変わる。バーニアキャリパーを使用して、舌骨の高さ( 図2D )から舌の先端までの舌の長さを測定します。
注:電極の正しい位置は、神経との最適な接触を確保するために不可欠です。最適なポジショニングは、2つの神経の一方または両方を刺激するときに、同様の相加的な力を発揮すべきである。
- 等尺性収縮力( 表1 )が最大となる長さとしてL 0を定義し、その後の正規化について記録する力の測定は、すべての動物のために変わる。バーニアキャリパーを使用して、舌骨の高さ( 図2D )から舌の先端までの舌の長さを測定します。
- 実験を開始する前に、両方の電極を刺激装置に接続し、試験用破傷風刺激を投与する( 表1 )。この収縮の間に、動物が位置が安定していることを確認し、首筋の望ましくない目に見える収縮をチェックする。
- 痙攣を20秒後に続いて破傷風を適用することによって等尺性力を測定する。刺激サイクルの間に4分間の回復を可能にするように刺激を3回反復する(サイクルは1つのツイッチを含み、e破傷風刺激)、最大の攣縮と破傷風力を記録する。
- 収縮の間に数滴のPBSを塗布することにより、常に舌を濡らしてください。
注:頚部の筋肉が収縮する場合は、周囲の筋肉組織に触れないように慎重に電極の位置を変更し、必要に応じて電極と接触している組織を焼灼します。
粘弾性測定(リサージュ曲線)
- 等尺性力測定後、舌を3〜5分間休ませる。リサージュ曲線をL 0から開始して実行します 。したがって、動物と力トランスデューサの位置は決して変更しないでください。
- 舌下神経を刺激することなく、L 0の 5,10,15,20,25,30,35,40,50%の増加する変位(d)を有する受動的伸長( 表2 )のサイクルを適用する(振幅が高い場合、 higheとモードコントローラr逸脱値は305C-LRよりも大きい)。例えば、40%L 0の振幅は、舌の変形を+ 20%L 0から-20%L 0にもたらす。
- サイクルごとに10回の繰り返しで固定2Hzのサイン周波数を使用し、サイクルごとに合計5秒間使用します。正弦周波数の変化は、過去にダイアフラム24のような組織で使用されており、実験プロトコルを変更するために採用することができた。
- 各サイクルの間に30秒間おき、全工程中に舌が濡れるようにします。
注:手順中に舌を濡らし、PBSを数滴加えてください。伸びの間、特に変位が40%以上に達したときに、顎を保持する拘束具が安定して定位置に留まるようにしてください。
- 実験が終了した直後に、動物がまだ麻酔の深い手術面の下にある間に、認可されたIACUC動物プロットに従って動物を安楽死させるocol。さらなる処理( すなわち、凍結切片または生化学分析のための保存)のために舌を解剖する。
結果
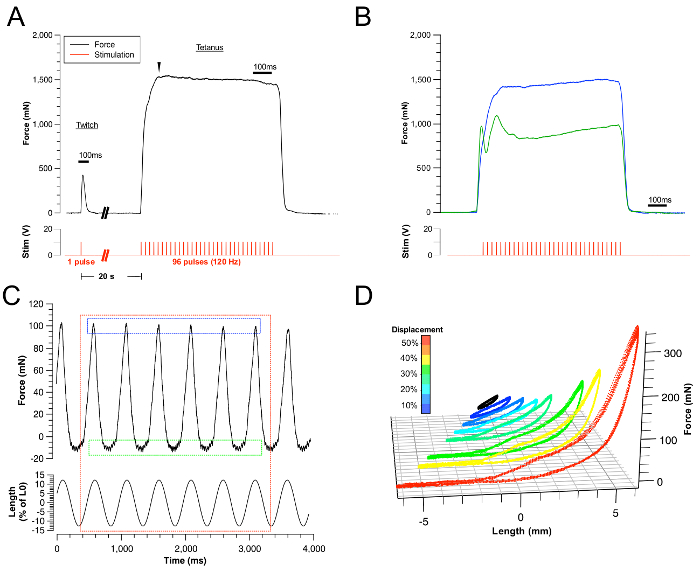
図3:代表的な結果。
(A)成功した攣縮と破傷風の跡の例。対応する刺激は、赤い痕跡によって表される。 (B)極大収縮(青色痕跡)および頚部筋肉の間接刺激による舌の破裂収縮の失敗の例。両方の状態は、刺激電極の位置を変えることによって、または電...
ディスカッション
舌代謝および/または組成、 例えば肥満の結果としての舌脂肪浸潤の変化は、本発明者らのプロトコルによって評価されるパラメータの定量化可能な変化を引き起こすと予測される。舌の力の定量化は大きな関心事である。何故ならば、突き出る活動と後退する活動との間の不均衡または全体的な舌の弱化は、上気道15の閉塞をもたらし得るからである。ラット
開示事項
著者は何も開示することはない。
謝辞
この調査は、2つの国立衛生研究所(HL089447)(「肥満およびOSA:舌脂肪および代謝機能の重要性の理解」)およびHL094307(「肥満および舌脂肪の関係の理解」)によって支持された
資料
| Name | Company | Catalog Number | Comments |
| SurgiSuite (heated Surgical tray) | Kent Scientific | SurgiSuite-LG | Includes heated platform |
| LED Lighting and Magnification Kit | Kent Scientific | SURGI- 5003 | |
| RC2 Rodent Circuit Controller | VetEquip | 922100 | |
| Isoflurane | Butler Schein Animal Health Supply | 29405 | |
| Alcohol Prep | Webcol | 6818 | |
| Cotton-tipped applicators | MediChoice | WOD1002 | |
| Hair clipper | Conair | ||
| Hair remover lotion | Nair | ||
| Medical tape | Transpore | 3M | |
| D-PBS | Corning | 21-030-CM | |
| Operating Scissors | World Precision Instruments | 503717-12 | |
| Hemostatic Forceps | Merit | 97-458 | Any tissue forceps can be used instead |
| Microdissecting Forceps, Angled, Serrated, 10.2 cm, SS | World Precision Instruments | 504479 | |
| Suture Tying Forceps | Fine Science Tools | 18025-10 | |
| Blunt Micro Hook | Fine Science Tools | 10062-12 | |
| Microhemostat | Fine Science Tools | 12075-14 | |
| Thermal cautery | WPI | 501292 | Disposable cauteries are available at lower cost |
| IV 14g x 3.25" cannula | BD | B-D382268H | For tracheal cannulation |
| Braided silk non-absorbable suture size 4-0 | Harvard Apparatus | SP104 | For stabilization of the tracheal cannula |
| Braided non-absorbable silk 5/0 suture | Surgik LC, USA | ESILRC15387550 | For suturing the tongue |
| Plastic-coated metal twist-tie (or electrical wire) | For securing the rat's nose to the platform | ||
| Camera stick | |||
| 3 way-swivel and Trilene 9 Kg test monofilament line | Berkley | For securing the jaw and maintaining the mouth open | |
| Camera stick with adjustable angle | For supporting the 3 way-swivel and maintaining the mouth open. | ||
| in situ Muscle Test System | Aurora Scientific | 809C | This system is designed for mice and was modified by extending the platform. Alternatively the rat-specific 806D system can be used. |
| Dual-Mode Muscle lever (force transducer) | Aurora Scientific | 305C-LR | 309C offers higher excursion capabilities than 305C-LR. Link for more information and specifications: http://aurorascientific.com/products/muscle-physiology/dual-mode-muscle-levers/ |
| Needle Electrodes (surgical steel, 29 gauge) | AD Instruments | MLA1204 | 300C is recommended for use in mice. |
| Magnetic Stands | World Precision Instruments | M10 | Used for making the bipolar stimulating hook electrodes |
| Kite Manual Micromanipulator | World Precision Instruments | KITE-R and KITE-L | Require a steel plate |
| Stackable Double Binding Post with Banana Jack x BNC Jack | McMaster Carr | 6704K13 | |
| Carbon fiber composites digital caliper | VWR | 36934-152 |
参考文献
- Sanders, I., Mu, L. A three-dimensional atlas of human tongue muscles. Anat Rec (Hoboken). 296 (7), 1102-1114 (2013).
- Ciucci, M. R., et al. Tongue force and timing deficits in a rat model of Parkinson disease. Behav Brain Res. 222 (2), 315-320 (2011).
- Easterling, C., Antinoja, J., Cashin, S., Barkhaus, P. E. Changes in tongue pressure, pulmonary function, and salivary flow in patients with amyotrophic lateral sclerosis. Dysphagia. 28 (2), 217-225 (2013).
- Wang, Z. J., Huang, X. S. Images in clinical medicine. Myotonia of the tongue. N Engl J Med. 365 (15), e32 (2011).
- Ota, F., Connor, N. P., Konopacki, R. Alterations in contractile properties of tongue muscles in old rats. Ann Otol Rhinol Laryngol. 114 (10), 799-803 (2005).
- Schwarz, E. C., Thompson, J. M., Connor, N. P., Behan, M. The Effects of Aging on Hypoglossal Motoneurons in Rats. Dysphagia. 24 (1), 40 (2008).
- Pae, E. -. K., Wu, J., Nguyen, D., Monti, R., Harper, R. M. Geniohyoid muscle properties and myosin heavy chain composition are altered after short-term intermittent hypoxic exposure. J Appl Physiol. 98 (3), 889-894 (2005).
- Fuller, D. D., Fregosi, R. F. Fatiguing contractions of tongue protrudor and retractor muscles: influence of systemic hypoxia. J Appl Physiol. 88 (6), 2123-2130 (2000).
- Ray, A. D., Farkas, G. A., Pendergast, D. R. In-situ mechanical characteristics of the tongue are not altered in the obese Zucker rat. Sleep. 32 (7), 957 (2009).
- Brennick, M. J., et al. Tongue fat infiltration in obese versus lean Zucker rats. Sleep. 37 (6), 1095-1102 (2014).
- Stedman, H. H., Sweeney, H. L., Shrager, J. B., Maguire, H. C., Panettieri, R. A., Petrof, B., Narusawa, M., Leferovich, J. M., Sladky, J. T., Kelly, A. M. The mdx mouse diaphragm reproduces the degenerative changes of Duchenne muscular dystrophy. Nature. 352 (6335), 536-539 (1991).
- Goodpaster, B. H., Wolf, D. Skeletal muscle lipid accumulation in obesity, insulin resistance, and type 2 diabetes. Pediatr Diabetes. 5 (4), 219-226 (2004).
- Loro, E., et al. IL-15Rα is a determinant of muscle fuel utilization, and its loss protects against obesity. Am J Physiol Regul Integr Comp Physiol. 309 (8), R835-R844 (2015).
- Rahemi, H., Nigam, N., Wakeling, J. M. The effect of intramuscular fat on skeletal muscle mechanics: implications for the elderly and obese. J R Soc Interface. 12 (109), 20150365 (2015).
- Kim, A. M., et al. Tongue fat and its relationship to obstructive sleep apnea. Sleep. 37 (10), 1639-1648 (2014).
- Kim, A. M., et al. Metabolic activity of the tongue in obstructive sleep apnea. A novel application of FDG positron emission tomography imaging. Am J Respir Crit Care Med. 189 (11), 1416-1425 (2014).
- Gilliam, E. E., Goldberg, S. J. Contractile properties of the tongue muscles: effects of hypoglossal nerve and extracellular motoneuron stimulation in rat. J Neurophysiol. 74 (2), 547-555 (1995).
- Sokoloff, A. J. Localization and contractile properties of intrinsic longitudinal motor units of the rat tongue. J Neurophysiol. 84 (2), 827-835 (2000).
- Becker, B. J., Russell, J. A., Connor, N. P. Effects of aging on evoked retrusive tongue actions. Arch Oral Biol. 60 (6), 966-971 (2015).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle Nerve. 47 (2), 230-240 (2013).
- Seo, J., et al. Nerve cuff electrode using embedded magnets and its application to hypoglossal nerve stimulation. J Neural Eng. 13 (6), 066014 (2016).
- Friedman, M., et al. Targeted hypoglossal nerve stimulation for the treatment of obstructive sleep apnea: Six-month results. Laryngoscope. 126 (11), 2618-2623 (2016).
- Heiser, C., Maurer, J. T., Steffen, A. Functional outcome of tongue motions with selective hypoglossal nerve stimulation in patients with obstructive sleep apnea. Sleep Breath. 20 (2), 553-560 (2016).
- Syme, D. A. Passive viscoelastic work of isolated rat, Rattus norvegicus, diaphragm muscle. J Physiol. 424, 301-315 (1990).
- Connor, N. P., et al. Effect of tongue exercise on protrusive force and muscle fiber area in aging rats. J Speech Lang Hear Res. 52 (3), 732-744 (2009).
- Schaser, A. J., Stang, K., Connor, N. P., Behan, M. The effect of age and tongue exercise on BDNF and TrkB in the hypoglossal nucleus of rats. Behav Brain Res. 226 (1), 235-241 (2012).
- Puhan, M. A., et al. Didgeridoo playing as alternative treatment for obstructive sleep apnea syndrome: randomised controlled trial. BMJ. 332 (7536), 266-270 (2006).
- Guimarães, K. C., Drager, L. F., Genta, P. R., Marcondes, B. F., Lorenzi-Filho, G. Effects of oropharyngeal exercises on patients with moderate obstructive sleep apnea syndrome. Am J Respir Crit Care Med. 179 (10), 962-966 (2009).
- Ueda, H., Almeida, F. R., Chen, H., Lowe, A. A. Effect of 2 jaw exercises on occlusal function in patients with obstructive sleep apnea during oral appliance therapy: a randomized controlled trial. Am J Orthod Dentofacial Orthop. 135 (4), 430 (2009).
- Strollo, P. J., et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 370 (2), 139-149 (2014).
- Perrier, P., Payan, Y., Zandipour, M., Perkell, J. Influences of tongue biomechanics on speech movements during the production of velar stop consonants: A modeling study. J Acoust Soc Am. 114 (3), 1582-1599 (2003).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle & nerve. 47 (2), 230-240 (2013).
- Brady, J. P., et al. AlphaB-crystallin in lens development and muscle integrity: a gene knockout approach. Invest Ophthalmol Vis Sci. 42 (12), 2924-2934 (2001).
- Spassov, A., et al. Differential expression of myosin heavy chain isoforms in the masticatory muscles of dystrophin-deficient mice. Eur J Orthod. , ciq113 (2010).
- Lever, T. E., et al. Videofluoroscopic Validation of a Translational Murine Model of Presbyphagia. Dysphagia. 30 (3), 328-342 (2015).
- Gantois, I., et al. Ablation of D1 dopamine receptor-expressing cells generates mice with seizures, dystonia, hyperactivity, and impaired oral behavior. Proc Natl Acad Sci. 104 (10), 4182-4187 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved