Method Article
蛍光顕微鏡による監視対称および非対称のソリューションの条件下での荷電ベシクルの相挙動
要約
相分離巨大リポソーム (Guv) 実験は頻繁生理的水条件を無視します。この作品は、膜ソリューションの非対称性と温度の関数として多成分荷電の膜の液-液相分離の高塩分濃度の緩衝効果を研究するアプローチを提示します。
要約
相分離巨大リポソーム (Guv) と共存する出展液注文し、液体不規則ドメインが脂質ラフト仮説を調査する一般的な生物物理学的ツール。多くの研究は、しかし、生理学的なソリューションの条件の影響を無視します。そのアカウントの現在の仕事は dioleylphosphatidylglycerol、卵スフィンゴミエリンやコレステロールから成長して荷電膜の液-液相分離に及ぼす高塩分濃度のバッファーと膜ソリューションの非対称性を示します。等温およびさまざまな温度条件下での効果を調べた。
装置および対称および非対称の高塩濃度条件下での荷電ベシクル共存液体ドメインの安定性を監視するため該当する実験的戦略について述べる。これは、高温高塩分濃度バッファーで荷電成分 Guv の準備へのアプローチが含まれています。プロトコルは、小胞の希釈を最小限に抑えながら単純な希釈段階で外部のソリューションの部分的な交換を実行するオプションを必要があります。代替的アプローチは、完全な外部ソリューション exchange では、マイクロ流体デバイスを利用した提示されます。温度変動下における相分離ソリューションの効果を検討した.このため、基本設計と、社内の内蔵温度試験槽のユーティリティを提案します。それとそれらを回避する方法に落とし穴が関連付けられているはさらに、我々 GUV 位相状態の評価に反映します。
概要
液-液相分離巨大リポソーム (Guv) 蛍光顕微鏡による微小ドメインの観測以来膜は脂質ラフト仮説1,2を調査するモデル システムとして使用されています。,3. 彼らの自立膜の細胞からの範囲にある、仮説のいかだを備えた細胞膜の適切な模倣です。このような膜に関する数多くの研究は、純粋な水、ショ糖や低塩分ソリューション4,5,6,7、8に分散した小胞で行われています。これらの条件も反映されません高塩分環境と膜ソリューション非対称性生体膜の生理学的に関連する暴露細胞のための条件は。
この仕事と私たちのグループ9から前の文書では、膜荷電成分 Guv の相状態を塩とソリューションの非対称性の存在の関数として調べた。Dioleoylphosphatidylglycerol (DOPG)、卵スフィンゴミエリン (eSM)、及びコレステロール (哲) (浸透圧 210 mOsm/kg) とショ糖液や高塩分濃度バッファー (100 mM の NaCl、10 mM トリス、pH 7.5、210 の比が異なる混合膜の調製mOsm/kg)。脂質の選択は、すでにこの混合6,8の相図で得られたデータによって正当化されました。
Guv の準備のためのメソッドの数は文献10、11,12で利用できる (ここで注意、水性相油ベースから脂質の転送を含むそれらを考慮13,14膜相挙動に影響を与えるかもしれない残りの石油留分の固有の危険のために)。高塩分濃度バッファーで膜の準備は、具体的な課題に関連付けられます。低いイオン強さの解決策は、については、electroformation 法15,16は、小さな欠陥10,17高収率で膜を準備する簡単な方法を示します。メソッドは、導電性表面 (電極) 脂質の層を堆積、それらを乾燥、交流電界の適用中に水溶液で潤いに基づいています。ただし、このメソッドは、調整塩は水溶液18,19にある必要があります。Electroformation による小胞の成長の原動力である高い伝導率20で妨げられる浸透16と見なされます。したがって、高塩分溶液中膜の electroswelling は、それは異なる塩濃度には腫れのソリューションの最適化を必要と簡単な方法ではありません。21,22を膨潤ゲルによる小胞は形成時間がさらに高速の electroformation の潜在的な代替です。(アガロースまたはポリビニル アルコール (PVA)) ゲルを基板として使用する場合、このアプローチは強化された脂質膜の水和に基づいています。これらのアプローチでは、ただし、場合 agarose ベース腫れ23および/または温度制限の PVA 系の腫れの場合と同様に膜の汚染のリスクが付いています。同様に、セルロース紙基板に膜を成長するプロトコル最近確立された24となっています。このメソッドの一般的な問題は、基板の純度を制御の欠如だけでなく、脂質の大量の使用。この作品の紹介、GUV の準備、すなわち、自発的な膨潤法25,26の最も伝統的な方法の利点を提示します。水蒸気雰囲気でその後腫れ腫れ解決する潤い疎油基基板上の脂質層を乾燥ので構成されます (図 1とプロトコルのセクションで詳細を参照してください)。このメソッドは小胞のサイズ分布の制御を提供していません、高分子基板またはマイクロ流体を意味する電界印加による生産を支援する、手法と比較して全体的に小さい小胞の結果します。しかし、小胞の品質とサイズはここで探検として膜の相状態の確認のために適切にあります。
同様に特定の課題に関連付けられて小胞膜ソリューション間の非対称性を作成します。一般的に使用される方法の 1 つは、目的の外部ソリューション27,28小胞懸濁液の直接希釈です。ただし、これも小胞の分布密度は低くなります。別の戦略は、ゆっくり Guv のソリューションは、フローセルの下部に決済周りの外部ソリューションを交換することで、送受信。不安も流れに小胞を失ったりしないように、低流量、応用8、このアプローチの時間非効率的なレンダリングです。さらに、これらのアプローチのどちらもは完全な外部ソリューション exchange を保証します。明白な解決策は、外部ソリューション交換中にそれらを失うことを避けるために小胞を固定化することです。例えば、ビオチン化膜は、ストレプトアビジン コーティングの表面の29につながれることができます。しかし、このアプローチは、付着の組成の変化につながる可能性があります、したがって非付着膜セグメント30,31。小胞の膜を課す結果をトラップする磁気のアプリケーションまたは電界は緊張32です。ハンドルを持つ必要があります小嚢をトラップする光ピンセットを用いた光担架の使用は局所加熱33を含む可能性があります (すなわちビーズ)、接続されています。膜のトラップは、最終剥離34なし白金線にそれらを成長することにより実現できます。これはただし、薄い脂質管 (テザー) によって分離され、通常ワイヤに接続されている小胞または他の小胞を得られます。
提示された作品は、前述の制限を克服するための戦略を強調表示します。最初自発の膨潤法適応、高塩分濃度バッファーで膜の生産用に最適化の詳細な説明を提案します。その後、単純な希釈やマイクロ流体デバイスの使用率によって非対称ソリューション条件を効率的に作成する 2 つのアプローチを紹介します。私たちの目標は、別のソリューションの条件で膜の膜相状態の解析は、後続のセクションは、統計解析に成功の条件と偽の分類を避けるため現在のヒントについて説明します。
温度変動下におけると同様、等温条件下で解析が行われました。温度 c 中管理を用い、実験的温度制御チャンバーの詳細については、ほとんど説明。ここでは、さまざまな温度条件で膜を観察する社内構築されたセットアップが表示されます。
プロトコル
1 です。 自発膜の膨潤
注: クロロホルムは揮発性の高いである有害な物質。ヒューム フードの下でクロロホルムを含むすべての操作を実行します。転送やクロロホルム ソリューションのストレージ用ピペット チップやプラスチック容器などのプラスチック製実験器具を使用しないでください。クロロホルムは、ソリューションを汚染、プラスチックを分解します。ガラス注射器を使用し、ガラス容器の代わりに。また、膜と対話することが不純物の導入を避けるためにできるだけきれいに動作します。GUV の最終準備で一般的な脂質濃度は、マイクロモルの範囲、従って不純物濃度範囲内膜挙動に強い影響があることに注意してください
。- 基本的な機器から離れて準備ができて次の項目があります。
- 準備ポリテトラフルオ エチレン (PTFE、テフロンとしてよく知られている) サイズ ~1.5 cm × 1.5 cm と適切な厚さの脂質沈着量のプレート。細かいサンドペーパーで一側のプレートを粗きます
。 注: PTFE は、疎油基滑らかな場合にクロロホルム ソリューションによって湿ったないです。PTFE 板の両側は、脂質沈着の正しい側面について混乱を避けるために荒くことができます。例えば それがあまりにも柔軟ではないと、水和ソリューションによって容易に覆うことができる簡単な処理のため板厚を選択必要があります ( 図 1 を参照)。ここで 〜 2 mm 厚のプレートを使用しました。荒く、一度 PTFE 板に再利用できる新しい実験後適切なクリーニング (手順 1.3). - 最終的な脂質膜の水和と小胞の成長の適切なボリューム (〜 15 mL) のヒートシール可能なガラス瓶を準備します 。
- を 〜 15 mL バイアル適合; 脂質膜前腫れの水飽和雰囲気を作成し、 図 1 を参照してくださいに使用されますの密閉ガラス容器を準備します 。
- 準備ポリテトラフルオ エチレン (PTFE、テフロンとしてよく知られている) サイズ ~1.5 cm × 1.5 cm と適切な厚さの脂質沈着量のプレート。細かいサンドペーパーで一側のプレートを粗きます
- 準備 4 ミリメートル 1, 2 の任意の比率で脂質株式 - dioleoyl - sn - グリセロホスファチジン - 3 - リン-(1 ' - rac - グリセロール) (ナトリウム塩) (DOPG) 追加 0.1 mol %1, 1 卵スフィンゴミエリン (eSM) とコレステロール (哲)、′ - dioctadecyl - 3、3, 3 ′ 3、′-tetramethylindocarbocyanine 過塩素酸塩 (DiIC 18) 4 mM の総脂質濃度に。クロロホルムを溶媒として使用します。材料の表 を参照してください 。
- 徹底的にその順序で PTFE 板と市販の食器用洗剤、エタノール、クロロホルムとガラス容器を洗い、最後に乾かします 。
- ガラス製の注射器を使用して、預金し、均一な脂質膜を作成する PTFE 板の粗面に脂質株式の 10-15 μ L を均等に分散します。必要な場合は、ソリューションを広めるため注射針を使用します 。
- は、きれいな表面に PTFE プレートを置き、一緒に、クロロホルムを削除する 60 ° C で 2 時間沈殿させた脂質膜脱水します。便宜上、プレートを洗浄し封印されていない 15 mL ガラス容器に乾燥中に預金します
。 注意: 高温により、脂質膜がこれとすべてのそれに続くステップで均一な単一液体状態である 。
- 、乾燥後 〜 15 mL バイアル (~ 1 cm) を倒して、 図 1 を参照してくださいに浮力を許可しないレベルまでの脱イオン水であらかじめ腫れのガラス容器を埋める 。
- 〜 15 mL ガラス容器に PTFE 板付きバイアルし、水飽和雰囲気が生じるために、それをカバーに入れては、 図 1 b を参照してください
。 注: 内部容器の壁で凝縮水を与える成功した水蒸気飽和状態のよい適応です 。
- Let 堆積脂質膜は、60 ° C 4 h で閉じたガラス容器内事前うねり。この期間内で希望の腫れソリューションを準備します
。 注: 低温で行なうことができる小胞の準備のこの時間非常に短縮できる - - 数分に前の腫れに暖かい水飽和窒素またはアルゴンを使用する場合代わりに。- HCl と 60 ° c の熱膨張のソリューションを作成する準備 200 mM ショ糖や 100 mM の NaCl、10 mM トリス、pH 7.5 調整します 。
- 前膨張後 〜 15 mL ガラス容器から PTFE 板を取る。0.45 μ m のフィルターに接続されている注射器で脂質膜の水和物への 15 mL のバイアルに腫れのソリューションの ~ 5 mL を追加します
。 注: フィルターに針を固定腫れソリューションの挿入が容易になります。注射器とフィルターを事前に温暖化は腫れのソリューションを追加する脂質膜の単一液相状態を確保することをお勧めかもしれません。(に-) 細菌や塩析出物 等 の有機汚染を最小限に抑えるソリューションをフィルタ リング - PTFE 板蒸発を最小限に抑えるために水和した脂質膜を保持 〜 15 mL バイアルをシールします。必要な場合は、パラフィン フィルムを使用してシールを強化します。腫れ最終的な旦那の 60 ° C で水和の脂質膜を一晩おきます 。
2。収穫 Guv
注: 腫れ、目で見える小さな (~ 1 mm) 雲のような塊で PTFE 基板結果から切り離される Guv の集計。蛍光染料を使用しないとき、それは白っぽい表示されます。それ以外の場合、蛍光体の吸収スペクトルによると色は。DiIC 18 レンダリング雲ピンク ( 図 2 参照) の追加。小胞は、骨材の集中と小胞収率を最大限にそれを収穫します
。- 室温 ~ 1 h. カット内に小胞をクールな
- ~1/10 クラスターのピストン ピペット プラスチック先端のとがった端のオリフィスを通過に合わせて小胞の集合体
。 注: 冷却速度は、それが固体ドメインのサイズを変えると、固液相分離が予想される場合特に重要です。ここでは、冷却を遅く、我々 はサイズ 5 × 9.5 cm 7.5 の金属ブロックと接触してサンプルを配置 cm (H L x W x) 1 h. 内で部屋の温度に冷却する - ピペットを腫れソリューションの適切なボリュームとクラスター ( 図 2 参照)。対称解の条件を作成する腫れのソリューションで再集計を停止または任意の非対称ソリューションの条件を作成する iso 浸透ソリューションです
。 注: ボリュームの下限は、完全に収穫される集計のサイズによって制限されます。外部ソリューションを希釈し、正確な濃度を評価するためにベシクル溶液の量は考慮する必要があります 。
3。蛍光顕微鏡を用いた位相状態評価のための膜の観察
注: の膜を DiIC 18 蛍光マーカーとして添加しました。この蛍光体は、液体無秩序 (Ld) 相に優先的にパーティション分割します。これにより、膜の相分離によるドメインの蛍光顕微鏡観察できます。エピ蛍光顕微鏡による位相状態評価を行った。原則として、これらの観察は共焦点レーザー走査顕微鏡 (CLSM) 信号の定量化 (例えば 膜 unilamellarity を決定する) のもことができますを使用しています。ただし、CLSM がより洗練された機器を必要とし、(通常) スキャンする前にエピ蛍光観察は、いずれの場合も役に立つ
。- は、膜を観察し、一貫してそれを使用すると、異なるソリューションで同じ組成の相状態を比較するときに目的 (例えば 40 倍の倍率 0.6 開口数 (NA) で使われたこことして) の決定n の条件。適切な刺激および放出波長フィルターを使用して使用される蛍光体 (例えば 560 ± 40 nm と DiIC 18 の使用の間にスプリッター ビーム 585 nm と 630 ± 75 nm で励起) と蛍光観察を有効にします
。 注: 相図内の相状態の境界、目的達成を検出するマイクロ ドメインの最小サイズを定義して、解像度によって異なります 。
- 分析のみを選択次の品質基準を満たす Guv。
最低の蛍光発光強度と小胞は、最も可能性の高いリポソーム;
- 別の小胞の目視による GUV 膜の unilamellarity を確保し、その強度を比較します
。 注: 自発的な腫れは、ジャイアント ・ ベシクルの大部分が単層ベシクル バッチをもたらす可能性があります 。
- はたぶん巨大なベシクルの蛍光発光強度を定量化することで追加チェックを実行して、集団内での散乱の対応する信号を確認します。異なる膜間の整数の差は認められなかった場合、それらのすべてがリポソームをする可能性があります
。 注: 小胞が自発的な腫れ、上記で説明した方法など確立されたメソッドを使用して従来の脂質から調製したベシクルの検出十分です。新しい旦那の準備のプロトコルを確立するか、型破りな脂質を使用より詳細な研究は unilamellarity を確認する必要がかどうか。例えば、新しいプロトコルによってラベル付けされた小胞の膜の蛍光信号は; 確立された手法により作製した膜のものと比較することまたは、小胞膜 24 に膜細孔タンパク質 α 溶血を挿入できます。追加色素膜小胞の外にだろう、彼らの内部かどうか、ユニや、多重層膜ベシクルの存在によってそれぞれ入力します 。
- 旦那がまだ認識するドメインの合理的な最小の直径を持っていることを確認します 。
- 旦那に突出または付着部分や内部構造などの欠陥が (ほとんど) ないことを確認します 。
- 別の小胞の目視による GUV 膜の unilamellarity を確保し、その強度を比較します
- 顕微鏡スライド上に旦那を懸濁液の因数を転送し、正しくそれを封印します。観察室を準備します 。
- は、顕微鏡のスライドにサンプルを入金します。中央の円形切り欠きを持つシリコーン スペーサーで囲みます。汚染を避けるためには、スペーサーがサンプルとの接触がないことを確認します。カバー スリップ シリコーン スペーサーの上に配置することによって内部のシールです
。 注: シリコーンの代わりにスペーサー 1 つことができますシリコーング リースや自家製 polydimethysiloxane (PDMS) スペーサーを使用してください。商工会議所のシールにより、サンプルの最小の蒸発と iso 浸透条件を維持します 。
- が可能なドメインの再平衡 ~ 5 分のサンプルを残しています
。 注: ピペッティングから機械的ストレスが膜ドメインは、改革に時間が必要をミックスがあります 。
- は、顕微鏡ステージ上にサンプルを顕微鏡スライドを置き、統計的アプローチの GUV バッチの相状態を分析します。バッチごとの以上 30 の膜を観察し、GUV 相状態評価 DiIC 18 ( 図 3) に次の基準によると、位相の状態を決定します
。 注意: その成長後小胞は (例えば) ドメインを出芽やカーボンナノ チューブを介して膜材料の交換のための個々 の構成を変更できます。膜は、したがって同じバッチ 35 内の組成変化を展示します。 いずれか液体注文 (Lo) されている- 単一液相または液障害 (Ld): GUV の全体の形状が球形で滑らかな、DiIC 18 均一膜で配布することを確認 (最初の画像の上部と下部のパネルで <強いクラス ="xfig"> 図 3).
- Lo + Ld の気液二相共存状態: 小胞が滑らかな境界を持つ円形に表示されるドメインを示すことを確認; DiIC 18 分配挙動によるとドメインは、(Ld) 明るい赤や暗い赤/黒 (Lo) (2 番目の上の画像と底面 図 3、偽色)。ドメイン無料小胞の表面に拡散させると合体できることを確認します 。
- 二相固体 (S) + 液体 (S + Lo または S + Ld) の共存状態: 指のようなまたは丸みを帯びた、角の境界にドメインが表示されることを確認 ( 図 3 の上部と下部のパネルの第 3 イメージ)。拡散は表示されません (黒) 一色 (赤) 液体ドメインを観察します。逆に、固体 (ブラック) ドメイン無料になります液体背景 (赤) に拡散する 。
- 三相 S + Lo + Ld 共存: 表示されるドメインの 3 つのタイプを観察: 赤ドメイン (Lo) (ii) と (iii) 明るい (Ld) に埋め込まれた (i) 角黒ドメイン (S) です 。
- Guv の人口のランダム サンプルでは、次の例のようにの間で支配的であることが判明位相状態せい:
- 場合 20 単一液体膜と 15 Lo + Ld Guv, 考慮するバッチを単一液相 。
- 場合 10 S + L Guv、30 Lo + Ld Guv、および 25 の単一液体膜が観察 Lo + レーザにバッチを考えてみます
4。マイクロ流体デバイスにおける GUV 観測
注: 最初マイクロ流体デバイスを作製; マイクロ流体デバイスの設計とアセンブリの詳細を与えられている他の場所で 36 , 37;概要については、 図 4 を参照してください
。- (塩または 1.8.1 のステップにしたがってスクロース) ソリューションを腫れ新鮮な旦那を準備し、0.45 μ m のフィルターをフィルター処理します
。 注: 流れるソリューションで、不純物はマイクロ流体デバイスで詰まることがあります 。
- カット 200 μ L ピストンはピペットのチップとデバイスの PDMS の部分で穴にそれらを置きます。100 μ L と新鮮でフィルターされた貯水池への解決策を膨潤の 5 μ L を追加 (参照してください 図 5 a) と各カットのヒントをそれぞれピペットします。デバイスを事前入力して空気を除去する振動ローター遠心で 10 分間 900 x g で全体のデバイスを遠心します 。
- 1 mL ガラス製注射器を事前入力して腫れのソリューションとチューブを接続し、プランジャーの位置 0 mL に移動します 。
- デバイスの流体のコンセントにチューブを配置し、シリンジ ポンプに注射器を配置します
。 注記: 注射器と注射器のポンプのブランドの選択は重要ではありません。ただし、ガラス注射器はより正確なポンプは μ L/分の流量範囲で動作できる必要があります 。
- 接続マイクロ流体制御の 8 の入り江にカスタム水圧制御ユニット層 ( 図 5A 参照)。(空気、窒素またはアルゴン) バー 3 水圧制御ユニットに圧力がバルブを閉位置にマイクロ流体デバイスに設定されています 。
- 今倒立顕微鏡ステージ上シリンジ ポンプと圧力のコントロール ユニットに接続されているマイクロ流体デバイスを置きます。
- 使用と同じ目的の倍率と一括連続観測にナ。3.7 の手順で説明したように、相国家統計は異なる解像度に基づく観測成果物を避けるために別の目的を使用する場合残っている場合を制御します 。
- 、膜をデバイスにロードします。
- 最初、ピペット離れて貯留層にとどまっているソリューションの 25 に 50 μ L を除くすべて。GUV ソリューションの 150 μ L を追加 (スクロースまたはステップ 1.8.1 によると塩、しかし、マッチング、 プレフィル 4.1 のステップでデバイスに使用されるソリューション) 貯水池と穏やかなピペッティングでミックスします。注射器で 10 μ L/分の流量を約 20 分間モードを撤回またはトラップの 90% を占められるまで以上に設定します
。 注: 貯水池は、乾燥を実行するない許可する必要があります。この場合、空気の泡はマイクロ チャンネルを入力します。多くの GUV ソリューション、reservoi を追加します。読み込み中に r がデバイスにピペッティング時に気泡を導入すること注意してください 。
- 最初、ピペット離れて貯留層にとどまっているソリューションの 25 に 50 μ L を除くすべて。GUV ソリューションの 150 μ L を追加 (スクロースまたはステップ 1.8.1 によると塩、しかし、マッチング、 プレフィル 4.1 のステップでデバイスに使用されるソリューション) 貯水池と穏やかなピペッティングでミックスします。注射器で 10 μ L/分の流量を約 20 分間モードを撤回またはトラップの 90% を占められるまで以上に設定します
- トラップ/膜周りマイクロ リング バルブを閉じるに圧力コントロール ユニット バルブをすべて開きます。・ シリンジ ポンプを 0 μ L/分に設定します。1 時間後膜およびレコードの共焦点画像を観察します。エキサイト、fluorophore の使用 (例: 561 nm で検出 DiIC 18 は 580 620 nm の間励起) によると膜を検出します。ステップ 3.6 , から同じ選択条件を使用し、それぞれの旦那 (すなわち 列と行の数は、 図 4 を参照) の位置に注意してください注意してください
- 交換ソリューション 、膜を取り巻く.
- は、シリンジ ポンプを 0 μ L/分に設定し、貯水池から GUV ソリューションの距離すべてが 25 に 50 μ L をピペットします。穏やかなピペッティングによる貯水池とミックス (ショ糖か、膜外目的のソリューションに応じて、1.8.1 の手順に従って塩) で第 2 ソリューションの 150 μ L を追加します。緩衝液の貯留層からの距離すべてが 25 に 50 μ L をピペットします
。 注: この解決策は、0.45 μ m のフィルターを使用してもフィルター処理するが 。
- は、シリンジ ポンプを 0 μ L/分に設定し、貯水池から GUV ソリューションの距離すべてが 25 に 50 μ L をピペットします。穏やかなピペッティングによる貯水池とミックス (ショ糖か、膜外目的のソリューションに応じて、1.8.1 の手順に従って塩) で第 2 ソリューションの 150 μ L を追加します。緩衝液の貯留層からの距離すべてが 25 に 50 μ L をピペットします
- 徹底的に貯水池でソリューションを置き換えるに少なくとも 5 回前の手順を繰り返します。シリンジを 10 μ L/分の流量に設定で撤回するマイクロ流路内ソリューションを置き換えるに 〜 10 分のモード 。
- 削減へ 1 μ L/分の流量 8 圧力コントロール ユニット バルブ 2 s、閉じるをもう一度 (マイクロ リング バルブの開閉時に生じる) を開きます。もう一度、流量を 0 μ L/分に設定します 。
- 後 1 h を観察 Guv と共焦点画像を記録します。再度、列および外部バッファー交換の前後に同じ GUV の比較を許可する各 GUV のあるマイクロ チャンバーの行に注意してください注意してください 。
5。デザイン及び温度制御チャンバー
注: 温度制御に適した商工会議所か市販されたり家造られました。温度制御は水浴するペルチェ素子 GUV サンプル室の熱的結合によって通常達成されます。ここでは、デザインと外部の水サーモスタット搭載自作温度制御チャンバーの特性について述べる。このようなサーモスタットは多くの実験室で利用または古い機器レーザー、分光器などから回収することができます
。- 組み立て熱流室、ここでは、として作られた水のお風呂にコネクタ付きのアルミ ブロックの 図 6 に示します。上部と下部の開口部をシールし、ブロックにカバーガラスをつくことによってサンプルの明視野観察を有効にします 。
- は、サンプルが配置され、ピペットの 1.8.1 のステップにしたがって実験で使用されるソリューションの約 100 μ L の液滴側の流れ区域を反転します。ファイバー光ファイバー温度プローブ (例えば FISO FTI 10) を挿入または適切な濃度、例えば 500 μ M ローダミン b. の温度感受性色素を追加する必要に応じて、
- は、リング形状またはいくつか他のスペーサー (PTFE またはゴム製) で作製したシリコン グリスを使用して旦那観察室を組み立てるし、0.17 μ m カバーガラスでそれを封印します。ドロップは、不純物の導入を避けるためにシール剤やスペーサーとの接触ではないことを確認します 。
- ゆっくりアセンブリを裏返し、それを適切なチューブと外部の水のサーモスタットを接続します。任意の水漏れに特別な注意を払うです 。
- の平衡化に必要な時間はシステムの最小限の応答時間の見積もりを与える最低セット外部の水のサーモスタットで温度を希望し、平衡温度センサーの読み取りが安定するまでシステム; 。
- チャンバーを使用する前に、少なくとも一度制御実験を実行します。
- 溶液温度 (例えば ガラス繊維プローブ) を測定し、サーモスタットの読書興味の温度範囲にわたって比較しています 。
- サーモスタット読書と測定温度の直線性から最小限のオフセットを確認します 。
- は温度の敏感な染料を使用して観測チャンバー内の温度勾配をチェックします。蛍光強度や蛍光寿命イメージング (FLIM) 下部カバー スリップ 40 から異なる距離の液温を測定します。さらにチェック、GUV 観察地域に任意の温度勾配があるかどうか 図 7 に示すよう 。
6。さまざまな温 GUV 観測
注: Guv の通常、その膜潜在的相分離観測温度 T obs で均一に表示される、相分離になりますT obs 下誘導 (温度範囲観察されるかどうか決まる)。逆に、相を分離小胞は T obs より高い温度で均質になるべきであります。これは特定の (複雑な) 脂質組成の場合する必要はありませんし、常に全体にアクセス可能の温度範囲 38 をスキャンする興味深いものになる可能性があります。相転移温度の観察と評価のためのプロトコルは温度制御に使用する特定のメソッドに依存しません
。- によると セクション 5、ファイバー光ファイバー温度プローブや温度に敏感な蛍光を省略する温度観測室を組み立てるです 。
- 室温 (23 ° C) に外部の水槽をセットし 10 ~ 15 分の平衡システム
- カウント手順 3.6 から条件を使用してフェーズで区切られた小胞の数; GUV の人口の状態はシステムの転移温度の領域についてのヒントを与える全体的な段階。小胞の人口間での位相状態はむしろ異質場合手順 6.5 に直接進みます 。
- (小胞の大半が相分離) 場合を増減させる (小胞の大半が均質な) 場合、粗い間隔 (例えば 1-2 ° C) の温度とシステム平衡の約 2 分の相状態を再評価ランダム サンプルし、小胞の人口を示す異種相状態まで温度は異なる手段 GUV 別人 。
- の相転移点近傍の人口が (すなわち 個々 の膜間で位相の状態ではなく異種が)、解像度を高く (例えば 0.5 の ° C) の温度間隔を短きます。〜 2 分の平衡し、ランダムなサンプルによる GUV 人口の位相状態を再評価システムします 。
- 相転移のポイントが渡されると、一度維持やまで、すべて Guv 今均一な相分離してそれぞれに温度が変化します 。
- 平衡度が十分かどうかを評価するヒステリシスをチェックします。
- 温度の方向の変更のスキャン、私。e. スキャンが温度の上昇の行われていた場合は、温度を減少させることによってスキャンを実行します 。
- 旦那の人口相州の比率 (例えば 80% が相分離) を評価するために温度の少なくともサブセットを選択します 。
- 温度ステップ サイズを減らすか、または手順 6.4 と 6.5 で平衡化時間が長く両方の方向で相州の比率の間で相当な偏差、ヒステリシスがある場合 。
- 等しい比で示される履歴がない場合は、ステップ サイズおよび/または平衡時間を増やすことを検討します 。
- 温度に対する位相状態の比をプロットします。定量化, 適切なモデル ( 図 8) にデータに適合します
。 注: 位相遷移曲線の一般的機能の s 字軌道と s 字状のボルツマン モデル フィッティングの適切なセットを提供します:
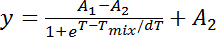
y:制服/相分離膜の一部
1: 初期の分数値
2: 最終的な分数値
T: 温度
T ミックス: 半最大 y 温
Y は、均質な膜の一部は、A 1 と A 2 を 0、1、それぞれ修正される必要があります。混和性として移行する s 字、分数値は測定温度範囲以下のすべての分数値は 0 と見なされます特定の温度で 0 にすると見なされます。逆に、分数値が特定の温度で 1 と、上記の温度範囲のすべての分数の値と見なされます 1 。
結果
旦那の腫れ
ここで説明した自発的な腫れアプローチ、膜から成る DOPG、eSM と哲は 210 mM ショ糖や 100 mM の NaCl、10 mM トリス、pH 7.5 表示集計を形成で一晩育った。集計を収穫高の小胞の利回りを保証します。腫れのソリューションで再懸濁が対称膜ソリューションの条件で起因しました。非対称の条件を作成する集計されたそれぞれ iso 浸透蔗糖あるいは高塩濃度で再停止される (図 2)。結果として得られる希釈は膜の数の希薄化を最小限に抑えながら準外部ソリューション exchange に対応します。
蛍光顕微鏡を用いた膜の相図のマッピング
ワイド フィールド蛍光顕微鏡による位相状態の観察のため、Guv のフェーズに固有 DiIC18 0.1 mol % の存在を認めた63 x で S + L 相分離を示す小胞がみ/細かく解決できるように 1.2NA、指のようなドメインを構成します。すべての残りの場合、x/0.6 40 NA 目的が使用されました。膜の外観検査の中にアーティファクトを避けるために、再現性を最大化する、特定の条件がセットに相の状態分析 (プロトコル手順 3.6)、どの小胞を決定します。
蔗糖あるいは高塩濃度で腫れて、室温で観測された比率の広い範囲の混合物 DOPG/eSM/哲三元から作製した膜展示同種の S + L、Lo + Ld、フェーズまたは Ld Lo 相分離、図 3を参照してください。 図 9データ解析に含めないで exemplarily 欠陥小胞を示しています、また多重層膜ベシクルを識別する方法を示します。
不明な経緯から、膜はバッチ内の組成変化の35を展示する可能性があります。したがって、特定の組成物の全体的な位相状態は、統計的手法で決定されました。特定の脂質組成の GUV 集団は、ランダムなサンプル (プロトコル手順 3.6) では支配的であることが観察された位相状態に帰されました。まだ、Lo + Ld 共存領域に近い組成はしばしば支配的な位相状態が狭い大半成ってバッチをもたらした。このような漠然とした場合は、少なくとも 3 つの独立したサンプルの目視検査を繰り返した。同一位相状態 (例えば出展 Lo + Ld 相分離) ランダム サンプル内で小胞の一部とみなされた最終的な結果 (図 10) 試行回数平均だった。
記述されていたプロトコルは、哲、eSM、DOPG の高塩分と蔗糖溶液の比が異なる幅広い範囲にわたって十分な旦那の成長で起因しました。元系状態図内の広範な領域は、対称と非対称の高塩濃度条件 (図 11) マップでした。別のソリューションの条件下で観察された小胞の相挙動の違いは、詳細9で他の場所で議論されました。
マイクロ流路を用いた完全なバッファー交換相挙動の観察
外腫れ溶液の希釈が残基により非対称ソリューション条件を作成します。私たちマイクロ アプローチは完全な外部ソリューションを交換するためことができます。図 5 aは、流体出口圧力制御入口と共焦点顕微鏡ステージ上完全に組み立てられたマイクロ流体デバイスを示しています。管は 90 ° 上から光イメージングを転送のためにスペースを許可する金属パイプを介して接続されます。
マイクロ流体デバイス内での観察、63 x と共焦点顕微鏡/1.2NA 水浸対物レンズを実装しました。一括で前の所見と同様 DiIC18は膜を染色に使用されました。デバイスの膜の状態に閉じ込め相の観察を行うとき、データを誤解しないように注意が必要があります。記事に、Guv の近くのため、ドメイン (図 12) の偽の出現につながる PDMS による励起と放射光パスを部分的にブロック可能性があります。ここでは、透過光検出は記事で膜の位置を調べるに便利です。この不要な効果は、直径 10 μ m 以下の小さな膜のために特に顕著です。これらのケースでは、データが拒否されました。図 13Aのコンフォーカル画像は GUV 小胞に Lo ドメインが存在を横切る平面小胞セクションを示しています。この場合、均一相状態にあると見なされます GUV、なぜそれは見逃されて、小胞であるのと比較するとサイズが小さいためドメインにない平面断面スキャンさらに上または下のセクションに示しただろうが。したがって、共焦点 z は GUV 表面全体を調べるに使用ください。広視野顕微鏡、これできない場合があります問題全体の小胞を一度にイメージングすることができますので。
最後に、あげられている膜外側のソリューションの交換の前後に、膜の状態に (図 14) は、どのような段階はクリア。各デバイスには (単一 GUV をトラップする記事のペアで、それぞれ)、60 室万デバイスごとの実験を許可する (図 4を参照)。ただし、いくつかの膜外部ソリューション交換中に迷子になることがあります。これは、次の手順によって最小化できる: 1) GUV 接着/破裂; 投稿を防ぐためにウシ血清アルブミン (BSA) コーティングを使用コーティングは、60 分、その後洗浄作業バッファーの BSA の 20 mg/mL に壁面を公開することによって行われます。使用できる別の接着分子は poly(L-lysine) 移植 poly(ethylene glycol)39です。弛緩の Guv、記事の中心を通過する可能性を避けるために内側と外側のソリューションの 2) 注意浸透一致または膜の破裂します。3) 小胞の記事のセンター通過を防ぐために 〜 8 μ m よりも大きいを取得する旦那の準備の手順を最適化します。
GUV の観測用温度制御チャンバーの設計と評価相州
外部の水のサーモスタット (図 6) への接続がある単純なフロー チャンバーを考案しました。用いて、アルミ ブロックの粉砕による商工会議所。一般に、商工会議所材料は、熱伝導性、サンプルは図 6 b 、 6 Cに示すように下部カバー ガラスで風呂の水と結合する必要はありません。
正確なデザインとは関係なく商工会議所のパフォーマンスが評価されなければなりません。具体的には外部から設定温度、体系的な温度オフセット、チャンバー内の温度勾配と試料温度の直線性をチェックしました。最初の 2 つのポイントが (例えばFISO FTI 10) ファイバー光ファイバー温度プローブによる直接温度測定チャンバー内で当たった。GUV サスペンション内の温度勾配も調べた。このようなグラデーションは商工会議所の外側に熱の流れから生じる。空間分解温度測定温度敏感な fluorophore40によって得ることができる、図 7を参照してください。
データのプロットとT相分離膜のミックスを取得する調整を行う
Sigmoidally 形データ ポイント軌道観測温度範囲にわたって均一な膜の一部をプロット結果。そこから推測される(図 8があることができるミックス Tボルツマン モデル (プロトコル セクション 6.8) にデータが収まるよう我々)。
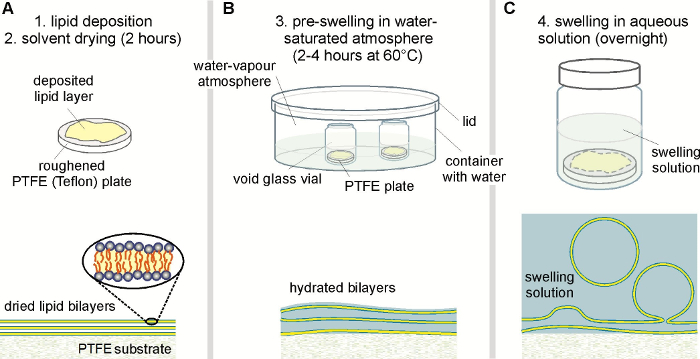
図 1: 小胞の成長 (下段) の対応するステージで自発的な腫れプロトコル (上部パネル) 中に実験の手順を実行します。(A) A 同種脂質膜は荒く PTFE 板に拡散および溶剤から乾燥します。(B) 乾燥した脂質膜が膜の水和を促進する水を閉じた容器内の水飽和雰囲気の中で事前腫れているし。Void バイアル PTFE 板が含まれています、この水和ステップ中に開いたままになります。(C) あらかじめ腫れ脂質膜は最終的に完全に脂質コーティング PTFE 板硝子小瓶の中に目的の腫れ液の添加による水和になります。蒸発を避けるためには、ガラスの瓶は夜通しの孵化中に正しく密封されます。バッチ内の組成の変化を最小限に抑えるため、すべての手順が脂質混合物は完全に混和性温度で行う必要があります。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 収穫 GUV 。20/60/20 0.1 mol % DiIC18高塩分濃度バッファーで腫れていたとのモル比で DOPG/eSM/哲から成る堆積 A (A) 脂質膜から成る 100 mM の NaCl、10 mM トリス、pH 7.5。ガラス容器の蓋は、パラフィンの膜でさらに密封されました。関心領域拡大にはには、結果の GUV 集計が含まれています。その赤い外観 DiIC18の存在の結果であります。(B) の膜は、切り捨てられたピペット チップで収穫されました。この画像で集計された戻を一緒に 50 μ L、ソリューションを膨潤の新鮮なバイアルに移ったが。(C) ソリューションの条件、非対称膜を作成する集計は別の等張性外部ソリューションで希釈しました。ここでは、一緒に、50 μ L のソリューションを腫れは 950 μ L ショ糖溶液を得、腫れのソリューションの 20 倍希釈で再停止されます。この図の拡大版を表示するのにはここをクリックしてください。
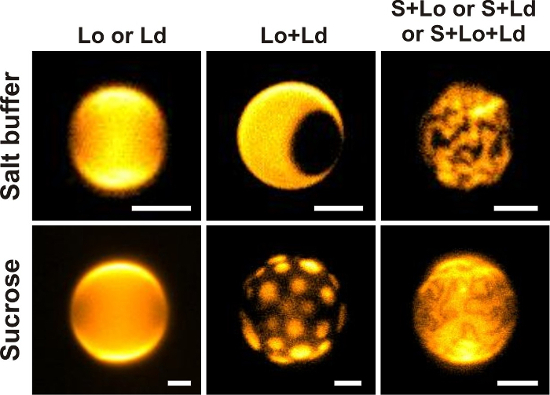
図 3: イメージング GUV 。0.1 mol % DiIC18準備し、対称塩またはショ糖ソリューション哲、eSM、DOPG の比が異なるから成る観察をドープした膜の蛍光画像を広いフィールド (左から右に、salt のバッファーで: 30/60/10; 50/20/30 40/20/40 でショ糖は、左から右へ: 30/30/40;20/60/20;40/50/10)。画像は異なる (共存) 相州プロトコル手順 3.6 の条件に従って評価で膜を描きます。ここでは、小胞を X/0.6 40 をイメージしましたナ目的。スケール バー = 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 4: マイクロ チャネル設計のレイアウト。膜は、貯水池下入口経由流体下層 (アウトライン チャンネル) を入力します。デバイスから不要なゴミをフィルターにブロックします。入力 60 室 (8 行、15 列) の配列含む各記事の単一 GUV キャプチャ (を参照してください挿入)。各商工会議所は、流体層の上の制御レイヤー (塗りつぶされた黒チャンネル) を押せばリング バルブ内に分離することができます。この図の拡大版を表示するのにはここをクリックしてください。

図 5: マイクロ流体デバイス。(A) 単一 Guv をトラップし、完全に外部のソリューションを交換するために使用するマイクロ流体デバイスの写真。ラベルは、ソリューション (1) 圧力入口 x 8 を追加する貯水池、圧力コントロール ユニット (2)、流体の出口は注射器とポンプ (3) に接続を示します。パネル (B) では、それぞれ 1 管を調整するマイクロ流体デバイスに接続された 8 バルブを備えた圧力コントロール ユニットを示しています。ここで、#1 と 2 バルブは開いており、それ故に対応するリング バルブが閉じています。この図の拡大版を表示するのにはここをクリックしてください。

図 6: 温度制御チャンバー 。(A) 商工会議所前にアセンブリ。(B) 組み立て室 (上向き) 2 mm カバー ガラス上部と下部に接着します。オレンジ色のゴムのスペーサーは高さ 0.5 mm を測定し、同封の GUV の懸濁液の観察のための 0.17 mm カバー スリップで密封します。この画像で校正用 (右の商工会議所を出て茶色繊維) 温度プローブが挿入されます。(C) 温度プローブなし倒立顕微鏡のステージ上の最終的なアセンブリ。オレンジ色のゴムのスペーサーは下方直面しています。ゴムは、十分な場所でサンプルを保持する接着剤です。エピ蛍光と明視野観察の両方を有効にするサンプル透過光することができます注意してください。この図の拡大版を表示するのにはここをクリックしてください。
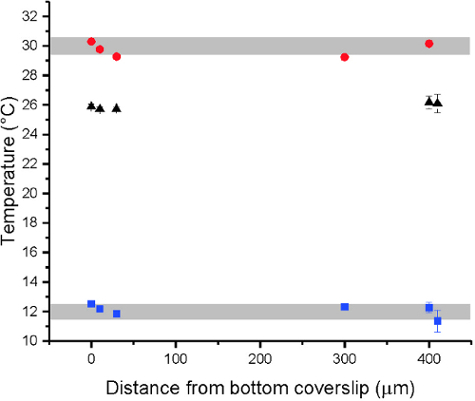
図 7: 温度の敏感な染料の FLIM 測定によって得られる観測室内空間分解温度データ(ここで: 500 μ M ローダミン B)40。 0、10、30、300、400 μ m 下部カバー スリップ上でデータ ポイントが得られます。赤と青のデータ ポイントは、それぞれ 30 ° C と 12 ° C に設定風呂の水の温度を測定しました。黒のデータ点は、部屋の温度平衡に水お風呂左を示します。商工会議所を通して小さな温度変化は観察が、0.5 の ° C (灰色のバー) の下に滞在します。総室高さはスペーサーの厚さ (上記参照) によると約 500 μ m です。誤差範囲は、標準偏差を示します。この図の拡大版を表示するのにはここをクリックしてください。
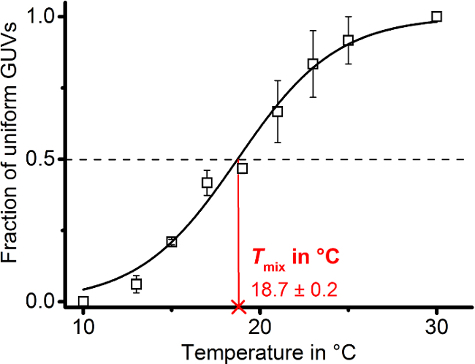
図 8: 混和性温度を検索します。0.1 mol %3 つの独立したランダム サンプルから DiIC18添加率 30/40/30 DOPG/eSM/哲から作製した膜の一部均一 (単一液体状態) の個々 のデータ ポイントを示します (N = 20-40)。誤差範囲は、平均の標準誤差を表しています。データ ポイントがボルツマン モデル手順 6.8 (黒実線) から推論された、ドメイン混合温度Tミックス(横座標に従う赤連続線)、s 字の半分の最大値に基づいてに搭載されました。曲線座標 (黒の破線)。最初と最後の値 (1および2) をそれぞれ 0 と 1 に修正しました。この図の拡大版を表示するのにはここをクリックしてください。
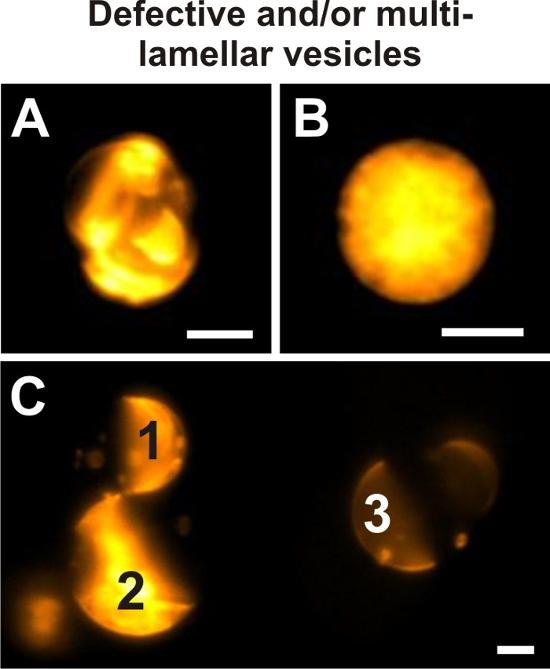
図 9: 欠陥小胞。ジャイアント ・ ベシクルの例は 20/60/20 DOPG/eSM/哲から準備し、手順 4.2 ワイド フィールド蛍光顕微鏡によるイメージングで設定条件を満たしていない DiIC18場合 0.1 mol % 添加します。個々 のイメージの強度表示範囲をたびに描かれた小胞の蛍光強度を最適化しました。追加膜材料およびカプセル化された小さい小胞の存在のためには、(A) で小胞の位相状態を明確に定義できません。このジャイアントベシクルの外観は lamellarity の任意の信頼性の高い検査を許可しません。パネル (B) では、内部が賑わっている膜材料である小胞を示しています。結果として、外装小胞膜の蛍光信号、その内部の信号は、lamellarity と潜在的なドメインの可視化は不可能レンダリングと重ね合わせられます。(C) 直接比較で同じ表示輝度範囲 3 つ異なるジャイアント ・ ベシクルの蛍光強度が表示されます。この画像は、巨大な多重層膜ベシクル (1, 2) を旦那 (3) と比較して、増加の蛍光信号が識別できることを示します。リポソーム膜小胞展示 Lo + Ld 相分離と同様、ここでは、多重。すべての画像で小胞を x/0.6 40 をイメージしましたナ目的。スケール バー = 5 μ m.この図の拡大版を表示するのにはここをクリックしてください。
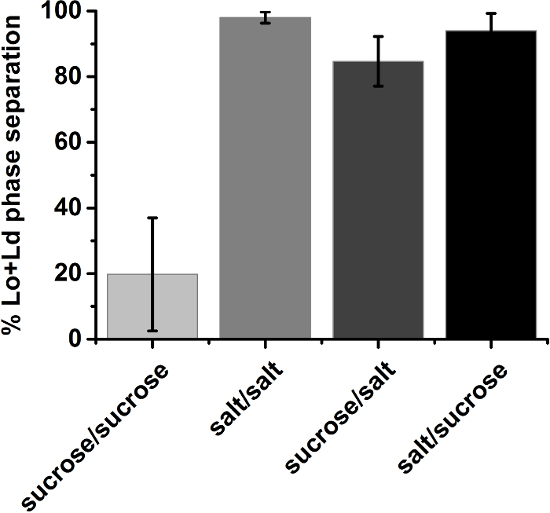
図 10: Lo + Ld 相率分離膜、少なくとも 3 つの独立標本平均します。30/40/30 DOPG eSM/Lo + Ld 共存領域の国境に近い哲小胞で構成されていました。対称ショ糖条件の誤差範囲は、バッチ間の散乱を示しています。縦軸のラベルが説明ソリューション内部/外部の小胞;スクロース: 210 mM ショ糖;塩: 100 mM の NaCl、10 mM トリス、pH 7.5;エラーバーは標準偏差を示します。この図の拡大版を表示するのにはここをクリックしてください。

図 11: eSM、DOPG から作製した膜と哲 210 mM ショ糖 (スクロース) と 100 mM の NaCl、10 mM トリス、pH 7.5 (塩) を使用して別のソリューションの条件下でマップの相図。旦那相状態はショ糖・ スクロース (A; 上部のセクション) で検討したショ糖/塩 (入力/出力) (A; 低多角形断面) 塩/塩 (B; 上部) と塩/スクロース (B; 低多角形断面)。漫画では、強調表示されたセクションと対応するソリューション条件内にあるドメインの支配的なパターンを示しています。多角形の下部で表される小胞フェーズ状態は 20 x GUV 希釈した時に非対称ソリューション条件下で観察されました。参照9から適応。この図の拡大版を表示するのにはここをクリックしてください。
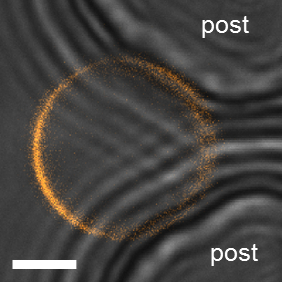
図 12: 閉じ込められた膜内のアイテム。近くのポストのため偽のドメインを見ることができる小さな GUV の例 (DOPG/eSM/哲 60/20/20)。明るいフィールド転送投稿 (gr を示す光の画像ey) 旦那 (オレンジ) の共焦点の蛍光画像が重なって表示されます。明視野像で干渉縞を作成する記事が見られます。蛍光信号すぐ相分離の外観を与える (右) の投稿が減少します。スケール バー 5 μ m を =。
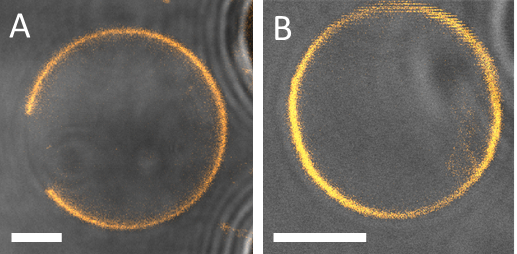
図 13: 位相状態がはっきり見える PDMS 投稿によってキャプチャされた 2 つの異なる膜の例。(A) Lo + Ld 相 DOPG/eSM/哲 60 の区切られた小胞/20/20。(B) A 小胞は 40/30/30 出展 Ld または Lo 単相から成っています。(アウト フォーカス) ドメインが存在しないことを確認するため全体の小胞の共焦点 z スタックを調べた。記事の端 (グレー) の画像の右側に見られています。スケール バー 5 μ m を =。
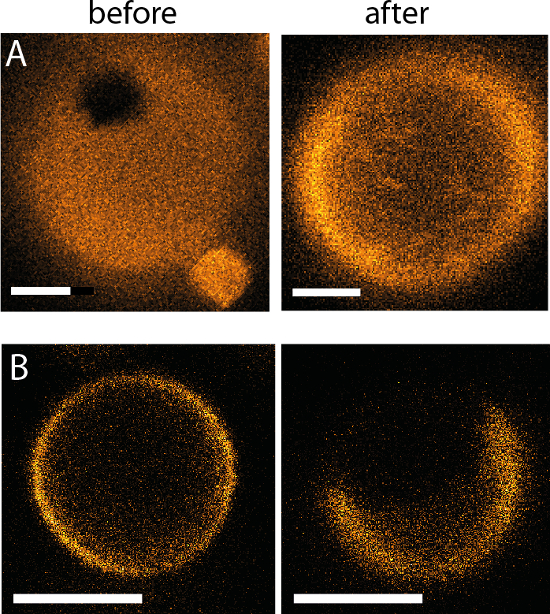
図 14: マイクロ流体デバイスを使用して完全な流体交換後の結果の相挙動します。同じ旦那が表示されます (A) 対称塩/塩 (入力/出力) のソリューション exchange の前後両方に塩/ショ糖 (入力/出力) (DOPG/eSM/哲 60/20/20、スケール バーは 2 μ m) と (B) 対称ショ糖・ スクロース (入力/出力) スクロース/塩 (入力/出力) (DOPG哲 30/40/30 スケール eSM/バー = 3 μ m)。参照9から適応。
ディスカッション
対称および非対称の高塩分濃度の条件下での位相状態観察の Guv の成功の生産
ここで紹介するプロトコルは、高塩分濃度のバッファーとソリューションの非対称性の組成物の広い範囲にわたって荷電膜の膜の相状態に及ぼす影響を評価するための戦略を紹介します。この目標の達成に向けた主要な課題の 1 つは、高塩分濃度バッファーで荷電膜の生産です。
ショ糖液とで塩分の高いバッファーで膜を生成される正常に堆積した脂質膜の前水和ステップおよび小胞の成長のための一晩の最終的な水分補給手順を含んだ単純な自発的な腫れアプローチで。ベシクルの収量にも脂質が広がっているように荒く PTFE 板に脂質沈着が行われることに注意してくださいすることが重要です。さらに、脂質膜が同種と流体の相州は温小胞準備中にすべてのステップを行うために不可欠です。他、小胞の人口構成の多と最終的な人口相の状態分析をバイアスします。一方で再取得する小さなボリュームで中断する可能性を提供する小胞塊 Guv 利回りの自発の腫れの特定のプロトコル高濃度分散液胞と非対称のソリューションを提供する一方、膜小胞8,28の希薄化を最小限に抑えながら条件。小胞希釈または外部のソリューション中に交換、内部と浸透圧の不一致による形態変化が誘発または Lo + Ld 相分離41を防ぐため、または低張の場合外 osmolarities まま一致するが肝要です。条件は、小胞が破裂する可能性があります。
PVA による腫れをもたらした多重層膜ベシクル中、高塩濃度の electroformation プロトコルを最適化しよう結果ない膜の生産に。にもかかわらず、自発的に準備時間が長くなると低品質10,17の小胞バッチの結果、荷電ベシクルの巧妙な生産が必要です腫れは付加的な利点が付属します。統計バッチ分析のための十分な収穫で、その結果、最小限の労力を要求し、electroformation とは異なり高度な機器や最適化は必要ありませんでした。さらに、脂質の酸化による汚染が観察されていない42,43。文献によると小胞の脂質組成とそれらが7,17が栽培された対応する株の違いはございません。さらに、PTFE 基板上小胞形成は外国の分子を基板23によって導入されるゲルによる腫れメソッドとは対照的に任意の汚染を含めることを要求されません。Electroformation は、非対称ソリューションの条件を作成するとき過剰な小胞の希釈に関連するそれ以上の欠点が付属します。Electroformation によって生成される膜 (自発的な腫れの中に形成される塊の形で高濃度小胞サスペンション) と対照をなして均一分散として通常存在しています。外部ソリューションの任意の希釈は実質的に同様の小胞数を希釈します。さらに、観察されたこの作品のコース上に高塩分濃度バッファーで希釈した場合不安定な DOPG/eSM/哲膜がショ糖の electroformation によって生成されることなった。蛍光顕微鏡スライドの脂質パッチからの目視検査が可能だった前に、小胞が破裂する示されています。このような不安定と思われる自発的な腫れ10によって得られるものと比較して electroformation により作製したベシクルの上昇した膜緊張します。
高率に部分的な外部ソリューション exchange それだけに実現している小胞希釈非対称 GUV ソリューションの条件を作成する簡単かつ迅速な方法ですが、(ここで: 95%、図 2) の痕跡を希釈時に、ソリューションを腫れが残ります。外部ソリューション exchange の程度の選択は、(セクション 2) の腫れのソリューションと共に小胞塊をピペッティングし、ないあまり希釈間のトレードオフです。したがって、迅速かつ完全な外部ソリューション exchange GUV 相状態観測中に希釈した位相状態の観察を確認することができます詳細37で他の所で説明した代替マイクロ アプローチを紹介小胞。対称非対称ソリューションの条件に変更する場合の位相状態変化の観察はことに同意確かに観察されました。両方の方法、非対称ソリューション条件表示ここでは、比較的簡単な (比較参考文献8) を生み出し、いいえ、知られているリスクの局所組成変化 (比較参照30,31) とさらに、膜張力 (比較参考32)、増加額又は局所加熱 (比較参照33)、別の方法としては、導入で説明されています。マイクロ トラップ中に小胞の内部と外部の浸透圧のバランスではない前述の相状態の成果物だけでなく、高張液条件によるデフレを避けるために唯一のエッセンシャルはスリップに閉じ込められた膜を引き起こす可能性があります。外部ソリューション交換後の記事。
ダイレクトオン/eSM/哲システムでは、その他の場合は、料金の不在からの小胞が GUV 個々 膜44 間の反発の結果の欠如による膨潤を損なう可能性がありますにもかかわらず、自発的な腫れは、非荷電成長に正常に適用されています。.あらかじめ腫れの期間延長またはかさばる脂質 headgroups を導入することは、この問題45をカウンター可能性があります。さらに、腫れに使用したものと異なるソリューションで、希釈後小胞の安定性は、異なる脂質組成と希釈のメディアは、我々 はここで検討していないため異なる場合があります。我々 はまた、紹介調製法と旦那の平均粒径を調整の可能性を検討していません。発泡組成やソリューションを膨潤などのパラメーターが結果に影響を与える可能性があります。代替方法46のアプリケーションは脂質およびここで使用されるソリューションの大きい小胞をもたらす可能性があります、しかし、彼らは、メソッドに関連付けられている他の欠点と来るかもしれない。対称および非対称の高塩分濃度条件で膜を生成する上記のアプローチは、異なる脂質組成から成り、別のメディアに分散した小胞のさらなる研究のため潜在的なツールを提供します。我々 はこれらの可能性を検討していないと、未来の試験は GUV 準備と希釈方法を適用可能性がありますどのように一般的に表示されます。
さまざまな温度で相分離を観察すること
さまざまな温度で膜を研究に適した異なった実験組み立ては存在します。これらの設定は、一般的、文献内で詳細に記載されていない、現在の仕事研究の適用の基本的なアセンブリを示します。
コントロール測定表示これ社内の設計および構築室の温度はサーモスタットによりきめ細かい制御が、チャンバー内の温度勾配は実験温度分解能内。それは実験熱条件がサーモスタットの読書の間の一貫性が保証されています。
広い温度範囲にわたって GUV 位相状態の評価、時に温度が変更された後は、観察された小胞は平衡も重要です。これを実現する方法の 1 つは、履歴を確認することです。ヒステリシスがある場合温度ステップを下げる必要がありますおよび/または平衡時間は増加します。この作品で制御は動作温度の範囲は 0 - 100 ° C に理想的に限定して確立水ベースのサーモスタットによってその温度としてこの範囲を展開する石油など他の温度制御の液体を使用するかなど、その他の設定を採用することによりペルチェ素子。実習では、動作温度は、可能な限り凝縮または蒸発によっても制限されます。さらに、温度室温から遠く離れて、観察室の間で定常状態温度勾配の発生に可能性が高くなります。また、撮像装置は、極端な温度で被害かもしれない。典型的な温度範囲脂質ベシクル研究 (~ 10-50 ° C7,9) 適切な観測装置の損傷考慮すべきが期待されていません通常。
小胞のドメイン観察成果物
ワイド フィールド蛍光顕微鏡を用いた観察成果物のソース数があります。まず、1 つは小胞段階状態の外観検査の適用されるオブジェクトの最大解像度rが脂質ドメインの検出限界を決定することに注意してくださいする必要があります。
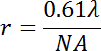
λは、波長、NA は対物レンズの数値の絞り。X 倍率と緑色発光を検出する 0.6 NA 40 の典型的な目的光約 560 nm に達する光学解像度で ~0.6 μ m. したがって、フェーズ状態間で異なる特定の脂質の混合物から作られた小胞の比較研究条件は、同じ目的を同じ脂質混合物の使用にしてください。
他のアイテムは、励起光41への延長露出のため脂質光酸化の結果として脂質ドメインの出来事です。写真の損傷は、脂質の不飽和炭化水素鎖で優先的に発生します。実際には、いくつかの脂質組成の最初均質な小胞のようなドメイン形成後に観察されたここで励起光照射の長期間 (~ 30 s)。その問題に対抗するため励起光保たれた焦点を 1 つのビューのフィールドで相状態評価の数秒。したがって、DiIC18は、我々 の目的に適していた。他の染料は、ただし、可能性がありますはるかに敏感、励起光照射時間の短縮と低い励起強度で処理する必要があります。
小胞のピペット転送から機械的せん断応力は潜在的ドメインを一時的に、それにより歪曲明白な小胞の相挙動をミックスします。いくつかのバッチの異なる小胞は異なる相挙動を示した 0 分後と 5 分後ピペット顕微鏡 coverslip に転送します。また47の混合ドメインで発生するマイクロ流体デバイスにおける流体の流れによるせん断応力を示されています。小胞は、観察する前に平衡のための時間の十分な量の妨げられていない残っているべき。この研究内小胞マイクロ流体デバイスに閉じ込められて後の残された 1 h の妨げられていない小胞の読み込みと観察する前にソリューション交流。
核磁気共鳴分光法48や超解像顕微鏡技術49など代替方法、光の回折限界によって課された制限と同様に、上記の問題のいくつかを避けるために採用される可能性があります。
結論と展望
提示された作品は、高塩分の対称および非対称のソリューションの条件が膜相分離に及ぼす影響の解析は、一連のメソッドを示します。すべての提示されたメソッドは、他のアプリケーションに適しています。マイクロ流体デバイスは、たとえばドメイン形成と解決策の非対称性の誘導の時に消失の動力学を調査するためのプラットフォームを提供します。また、そのように塩分濃度の関数としてドメインの外観を検査できます。すべてのメソッドは、見て興味の他のソリューションを使用して相挙動に及ぼす影響にも使えます。
開示事項
著者が明らかに何もありません。
謝辞
この作品は、連邦教育省、ドイツ研究、マックス ・ プランク協会によって共同で資金が供給される MaxSynBio コンソーシアムの一部です。
資料
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phospho-(1'-rac-glycerol), sodium salt | Avanti Polar Lipids | 840475C | abbreviated as DOPG in the text |
| chicken egg sphingomyelin | Avanti Polar Lipids | 860061 | abbreviated as eSM |
| cholesterol (ovine wool, > 98 %) | Avanti Polar Lipids | 700000 | abbreviated as Chol |
| 1,1'-dioctadecyl-3,3,3',3'-tetramethylindocarbocyanine perchlorate | Molecular Probes | D-282 | abbreviated as DiIC18 |
| Chloroform, HPLC grade (≥ 99.8 %) | Merck | ||
| NaCl (> 99.8 %) | Roth | ||
| HCl (37 %) | Roth | ||
| Tris (≥ 99.9 %) | Roth | ||
| Sucrose (≥ 99.5 %) | Sigma Aldrich | ||
| Parafilm | |||
| Threaded vial 45x27 mm, 15 mL | Kimble | Soda flat bottom, white screw cap | |
| pH meter | Mettler Toledo | MP220 | |
| Osmometer | Gonotec | Osmomat030 | |
| Epi-fluorescence microscope | Zeiss | Axio Observer D1 | |
| Confocal laser scanning microscope | Leica | TCS SP5 | |
| Objective 40x, 0.6 NA | Zeiss | LD Achroplan | |
| Objective 40x, 0.75 NA | Leica | 506174 | |
| Objective 63x, 0.9 NA | Leica | 506148 | |
| Microscope slide, 56x26 mm, 0.17 ± 0.01 mm | Menzel-Gläser | ||
| Cover slip, 22x22 mm, 0.17 ± 0.01 mm | Menzel-Gläaser | ||
| Parafilm "M" | Bremix Flexible Packaging | ||
| Syringes, 5 mL, 10 mL | Braun | ||
| 0.45 µm syringe filter | GVS North America | Cameo 25AS, 1213723 | Acetate, sterile |
参考文献
- Dietrich, C., et al. Lipid rafts reconstituted in model membranes. Biophys J. 80 (3), 1417-1428 (2001).
- Bagatolli, L. A. To see or not to see: lateral organization of biological membranes and fluorescence microscopy. Biochim Biophys Acta. 1758 (10), 1541-1556 (2006).
- Carquin, M., D'Auria, L., Pollet, H., Bongarzone, E. R., Tyteca, D. Recent progress on lipid lateral heterogeneity in plasma membranes: From rafts to submicrometric domains. Prog Lipid Res. 62, 1-24 (2016).
- Baumgart, T., Hess, S. T., Webb, W. W. Imaging coexisting fluid domains in biomembrane models coupling curvature and line tension. Nature. 425 (6960), 821-824 (2003).
- Bacia, K., Schwille, P., Kurzchalia, T. Sterol structure determines the separation of phases and the curvature of the liquid-ordered phase in model membranes. Proc Natl Acad Sci U S A. 102 (9), 3272-3277 (2005).
- Vequi-Suplicy, C. C., Riske, K. A., Knorr, R. L., Dimova, R. Vesicles with charged domains. Biochim Biophys Acta. 1798 (7), 1338-1347 (2010).
- Blosser, M. C., Starr, J. B., Turtle, C. W., Ashcraft, J., Keller, S. L. Minimal effect of lipid charge on membrane miscibility phase behavior in three ternary systems. Biophys J. 104 (12), 2629-2638 (2013).
- Pataraia, S., Liu, Y., Lipowsky, R., Dimova, R. Effect of cytochrome c on the phase behavior of charged multicomponent lipid membranes. Biochim Biophys Acta. 1838 (8), 2036-2045 (2014).
- Kubsch, B., Robinson, T., Lipowsky, R., Dimova, R. Solution Asymmetry and Salt Expand Fluid-Fluid Coexistence Regions of Charged Membranes. Biophys J. 110 (12), 2581-2584 (2016).
- Dimova, R., et al. A practical guide to giant vesicles. Probing the membrane nanoregime via optical microscopy. J Phys Condens Matter. 18 (28), S1151-S1176 (2006).
- Liu, A. P., Fletcher, D. A. Biology under construction: in vitro reconstitution of cellular function. Nat Rev Mol Cell Biol. 10 (9), 644-650 (2009).
- Walde, P., Cosentino, K., Engel, H., Stano, P. Giant Vesicles: Preparations and Applications. Chembiochem. 11 (7), 848-865 (2010).
- van Swaay, D., deMello, A. Microfluidic methods for forming liposomes. Lab Chip. 13 (5), 752-767 (2013).
- Stein, H., Spindler, S., Bonakdar, N., Wang, C., Sandoghdar, V. Production of Isolated Giant Unilamellar Vesicles under High Salt Concentrations. Front Physiol. 8, 63(2017).
- Angelova, M. I., Dimitrov, D. S. Liposome Electroformation. Faraday Discuss. 81, 303-311 (1986).
- Dimitrov, D. S., Angelova, M. I. Lipid swelling and liposome formation mediated by electric fields. Bioelectrochemistry and Bioenergetics. 19, 323-336 (1988).
- Rodriguez, N., Pincet, F., Cribier, S. Giant vesicles formed by gentle hydration and electroformation: a comparison by fluorescence microscopy. Colloids Surf B Biointerfaces. 42 (2), 125-130 (2005).
- Montes, L. R., Alonso, A., Goni, F. M., Bagatolli, L. A. Giant unilamellar vesicles electroformed from native membranes and organic lipid mixtures under physiological conditions. Biophys J. 93 (10), 3548-3554 (2007).
- Pott, T., Bouvrais, H., Meleard, P. Giant unilamellar vesicle formation under physiologically relevant conditions. Chem Phys Lipids. 154 (2), 115-119 (2008).
- Green, N. G., Ramos, A., Gonzalez, A., Morgan, H., Castellanos, A. Fluid flow induced by nonuniform ac electric fields in electrolytes on microelectrodes. I. Experimental measurements. Phys Rev E Stat Phys Plasmas Fluids Relat Interdiscip Topics. 61 (4 Pt B), 4011-4018 (2000).
- Horger, K. S., Estes, D. J., Capone, R., Mayer, M. Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength. J Am Chem Soc. 131 (5), 1810-1819 (2009).
- Weinberger, A., et al. Gel-Assisted Formation of Giant Unilamellar Vesicles. Biophys J. 105 (1), 154-164 (2013).
- Lira, R. B., Dimova, R., Riske, K. A. Giant Unilamellar Vesicles Formed by Hybrid Films of Agarose and Lipids Display Altered Mechanical Properties. Biophys J. 107 (7), 1609-1619 (2014).
- Kresse, K. M., Xu, M., Pazzi, J., Garcia-Ojeda, M., Subramaniam, A. B. Novel Application of Cellulose Paper As a Platform for the Macromolecular Self-Assembly of Biomimetic Giant Liposomes. ACS Appl Mater Interfaces. 8 (47), 32102-32107 (2016).
- Reeves, J. P., Dowben, R. M. Formation and properties of thin-walled phospholipid vesicles. J Cell Physiol. 73 (1), 49-60 (1969).
- Needham, D., Evans, E. Structure and Mechanical-Properties of Giant Lipid (DMPC) Vesicle Bilayers from 20-Degrees-C Below to 10-Degrees-C above the Liquid-Crystal Crystalline Phase-Transition at 24-Degrees-C. Biochemistry. 27 (21), 8261-8269 (1988).
- Manneville, J. B., et al. COPI coat assembly occurs on liquid-disordered domains and the associated membrane deformations are limited by membrane tension. Proc Natl Acad Sci U S A. 105 (44), 16946-16951 (2008).
- Wollert, T., Wunder, C., Lippincott-Schwartz, J., Hurley, J. H. Membrane scission by the ESCRT-III complex. Nature. 458 (7235), 172(2009).
- Kuhn, P., et al. A facile protocol for the immobilisation of vesicles, virus particles, bacteria, and yeast cells. Integr Biol (Camb). 4 (12), 1550-1555 (2012).
- Sarmento, M. J., Prieto, M., Fernandes, F. Reorganization of lipid domain distribution in giant unilamellar vesicles upon immobilization with different membrane tethers. Biochim Biophys Acta. 1818 (11), 2605-2615 (2012).
- Lipowsky, R., Rouhiparkouhi, T., Discher, D. E., Weikl, T. R. Domain formation in cholesterol-phospholipid membranes exposed to adhesive surfaces or environments. Soft Matter. 9 (35), 8438(2013).
- Korlach, J., Reichle, C., Muller, T., Schnelle, T., Webb, W. W. Trapping, deformation, and rotation of giant unilamellar vesicles in octode dielectrophoretic field cages. Biophys J. 89 (1), 554-562 (2005).
- Delabre, U., et al. Deformation of phospholipid vesicles in an optical stretcher. Soft Matter. 11 (30), 6075-6088 (2015).
- Fidorra, M., Garcia, A., Ipsen, J. H., Hartel, S., Bagatolli, L. A. Lipid domains in giant unilamellar vesicles and their correspondence with equilibrium thermodynamic phases: a quantitative fluorescence microscopy imaging approach. Biochim Biophys Acta. 1788 (10), 2142-2149 (2009).
- Bezlyepkina, N., Gracia, R. S., Shchelokovskyy, P., Lipowsky, R., Dimova, R. Phase diagram and tie-line determination for the ternary mixture DOPC/eSM/cholesterol. Biophys J. 104 (7), 1456-1464 (2013).
- Eyer, K., Kuhn, P., Stratz, S., Dittrich, P. S. A microfluidic chip for the versatile chemical analysis of single cells. J Vis Exp. (80), e50618(2013).
- Robinson, T., Kuhn, P., Eyer, K., Dittrich, P. S. Microfluidic trapping of giant unilamellar vesicles to study transport through a membrane pore. Biomicrofluidics. 7 (4), 44105(2013).
- Veatch, S. L., Gawrisch, K., Keller, S. L. Closed-loop miscibility gap and quantitative tie-lines in ternary membranes containing diphytanoyl PC. Biophys J. 90 (12), 4428-4436 (2006).
- Kolesinska, B., et al. Interaction of beta(3) /beta(2) -peptides, consisting of Val-Ala-Leu segments, with POPC giant unilamellar vesicles (GUVs) and white blood cancer cells (U937)--a new type of cell-penetrating peptides, and a surprising chain-length dependence of their vesicle- and cell-lysing activity. Chem Biodivers. 12 (5), 697-732 (2015).
- Robinson, T., et al. Removal of background signals from fluorescence thermometry measurements in PDMS microchannels using fluorescence lifetime imaging. Lab Chip. 9 (23), 3437-3441 (2009).
- Morales-Penningston, N. F., et al. GUV preparation and imaging: minimizing artifacts. Biochim Biophys Acta. 1798 (7), 1324-1332 (2010).
- Zhou, Y., Berry, C. K., Storer, P. A., Raphael, R. M. Peroxidation of polyunsaturated phosphatidyl-choline lipids during electroformation. Biomaterials. 28 (6), 1298-1306 (2007).
- Breton, M., Amirkavei, M., Mir, L. M. Optimization of the Electroformation of Giant Unilamellar Vesicles (GUVs) with Unsaturated Phospholipids. J Membr Biol. 248 (5), 827-835 (2015).
- Lasic, D. D., Needham, D. The "stealth" liposome: a prototypical biomaterial. Chemical Reviews. 95, 2601-2628 (1995).
- Needham, D., McIntosh, T. J., Lasic, D. D. Repulsive interactions and mechanical stability of polymer-grafted lipid membranes. Biochim Biophys Acta. 1108 (1), 40-48 (1992).
- Akashi, K., Miyata, H., Itoh, H., Kinosita, K. Jr Preparation of giant liposomes in physiological conditions and their characterization under an optical microscope. Biophys J. 71 (6), 3242-3250 (1996).
- Sturzenegger, F., Robinson, T., Hess, D., Dittrich, P. S. Membranes under shear stress: visualization of non-equilibrium domain patterns and domain fusion in a microfluidic device. Soft Matter. 12 (23), 5072-5076 (2016).
- Veatch, S. L., Polozov, I. V., Gawrisch, K., Keller, S. L. Liquid domains in vesicles investigated by NMR and fluorescence microscopy. Biophys J. 86 (5), 2910-2922 (2004).
- Owen, D. M., Magenau, A., Williamson, D., Gaus, K. The lipid raft hypothesis revisited--new insights on raft composition and function from super-resolution fluorescence microscopy. Bioessays. 34 (9), 739-747 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved