Method Article
高分解能断層顕微鏡(HREM) - 有機材料の処理および可視化のための簡単で堅牢なプロトコル
要約
我々は、高解像度腺鏡検査法を用いたデジタルボリュームデータの生成を可能にするために、様々な種の生検材料、生物医学モデル生物の胚および他の有機組織の試料を処理するための簡単で堅牢なプロトコルを提供する。
要約
我々は、高分解能肛門鏡検査(HREM)法を用いてデジタルボリュームデータを生成するための簡単なプロトコルを提供する。 HREMは、1 x 1 x 1と5 x 5 x 5μm3の間の典型的な数値分解能で最大5 x 5 x 7 mm 3までの体積の有機材料を画像化することができます。標本はメタクリレート樹脂に包埋され、ミクロトーム上で切片化される。各セクションの後に、ブロック表面の画像が複合型顕微鏡ヘッドに接続された光電管上に置かれたデジタルビデオカメラで取り込まれる。光軸は、緑色蛍光タンパク質(GFP)フィルターキューブを通過し、各セクション後にボックホルダーアームが静止する位置に位置合わせされる。このようにして、後続のブロック表面を表示する一連の固有に整列されたデジタル画像が生成される。このような画像シリーズを3次元(3D)視覚化ソフトウェアにロードすることにより、デジタルボリュームデータへの即座の変換が容易になり、仮想データさまざまな直交平面および斜めの平面での動作、およびボリュームおよび表面レンダリングされたコンピュータモデルの作成。我々は、マウス、ニワトリ、ウズラ、カエルおよびゼブラフィッシュの胚、ヒト生検材料、コーティングされていない紙および皮膚代替材料を含む様々な有機体標本を処理するための3つの簡単で組織特異的なプロトコルを提示する。
概要
有機および無機材料の構造解析は、その物理的性質および機能を理解するための第一歩である。そのような分析の基礎は、組織構造、細胞形態およびトポロジー、分子組成および生体力学的特性の詳細を抽出する、様々な単純で洗練された画像化方法を用いて、組織学的セクションを注意深く観察することによって得られる二次元(2D) 2,3 。しかしながら、2D情報は、空間的に複雑な配置を研究するのには適していない。したがって、デジタルボリュームデータの生成を可能にする生体 内および生体外の方法の数が過去数十年に確立され、さらに多くが開発中である。
大部分のボリュームデータ生成方法の原理的な原理は、仮想スタックの生成であるオブジェクトの仮想または物理的な区切りによって得られたセクションを表示するデジタル画像のことである。セクションイメージが適切に整列されている場合は、仮想断面平面で再分割するか、3Dサーフェスおよびボリュームレンダリングモデルを作成するためにボリュームを作成します。人間とより大きな生物学的試料を可視化するための一般的な技術は、磁気共鳴断層撮影(MRT)、コンピュータ断層撮影(CT)、陽電子放射断層撮影(PET)および単一光子放出コンピュータ断層撮影(SPECT)である。小さな検体は、通常、マイクロ磁気共鳴イメージング(μMRI)、光学投影トモグラフィー(OPT)、光干渉断層撮影(OCT)、光音響トモグラフィー(PAT)、組織学的断面化法、共焦点顕微鏡法、および電子断層撮影法を用いて視覚化される。 、 7,8,9,10 、 11,12,13,14,15,16,17 。
小標本および組織学的組織サンプルのデジタルデータを生成する比較的新しいボリュームデータ生成技術は、Tim Mohun 18,19と密接に協力して開発されたHREM法です。これは、ミクロトーム上で切片化された樹脂埋め込み材料からデジタルボリュームデータを生成する、単純な顕微鏡ベースの技術である。このデータは、組織構造および細胞分布の詳細な分析ならびに中間の光学顕微鏡レベルでの小さな特徴のメトリック分析を容易にする。
HREMは、eからキャプチャしたように見える、本質的に整列したデジタル画像のスタックを生成しますosinで染色された組織切片。視野に関する組織コントラストおよびデータ解像度は、μCT、μMRI、およびOPTで生成されるデータのそれを上回るが、共焦点、光シートおよび電子顕微鏡で得られるデータよりも低い20 。しかし、後者とは対照的に、HREMは、5×5×7mm 3までの比較的大きな体積の組織標本を組織学的品質で視覚化することができる。最近のいくつかの研究では、単一イメージング技術の長所と短所の詳細な特徴付けと比較が行われており、客観性のために、それらの限界と応用分野4,21,22,23,24,26,27,28,29,27,28,29 、 24 。
本研究では、HREMイメージング法に焦点を当て、広いスペクトルの有機材料のHREMデータを生成するための非常に簡単なプロトコルと、その応用の例。 HREMデータを作成するワークフローは簡単で、メタクリレート樹脂に埋め込むことができるすべての材料に適用されます( 図1 )。しかし、試料調製には組織特異的な違いがあり、考慮する必要があります。したがって、我々は様々な試料を調製するための3つの標準的なプロトコルを提供する。埋め込みとデータ生成プロトコルの手順は、すべて同じです。
プロトコル
すべての手順は、ウィーン医科大学の倫理ガイドラインに従って実施した。
サンプル調製
- 胚と胚の組織を準備する(最大5 x 5 x 5 mm 3 )
- 4℃で4%PFA / PBSまたはBouin固定液中の胚または胚の一部を固定し、少なくとも16〜24時間一定ロッキング下で固定する。
注:48時間のゼブラフィッシュ、19時間のニワトリおよびウズラ、および出生前のマウス胚など、いくつかの種および様々な発達段階の胚を使用することができます( 代表結果を参照)。検体を採取し、固定液に入れる前に、ステージングのために室温でPBSに移した。必要に応じて、埋め込み型にフィットするように固定する前に、マイクロハサミまたはメスで標本をトリムします。 - 固定液を除去し、4℃でPBS中の胚組織を洗浄する。一定のロッキング下でgで24時間(2-3回の変化)。
- 70%、80%、90%、96%エタノール中のサンプルを4℃で2〜3時間脱水する。試料が入っているチューブを回転装置に置きます。
注:小さなサンプル(<2 x 2 x 2 mm 3 )では、サンプルが各エタノールに入っている時間を60分に短縮することができます。大きなサンプル(> 5 x 5 x 5 mm 3 )では、4時間まで延長することができます。 - 防護手袋を着用している煙霧ボンネットの下で以下の浸透ステップを実行します。
- 1.25gの過酸化ベンゾイル(可塑化触媒)と0.4gのエオシンを100mLの溶液Aに添加することにより浸潤溶液を調製する(詳細については、 表の表を参照)。エオシンと触媒が完全に溶解するまで(2-3時間)、磁気攪拌プレート上のビーカーで4℃で撹拌する。
- 浸潤溶液に試料を12〜24時間置く。連続的な揺れや回転のもとで4℃に保つ。 3と12の後に浸透溶液を新鮮な溶液に交換するh。
注:大型胚(> 1cmクラウン/臀部の長さ)では、浸潤時間を48時間に延長する。
- 4℃で4%PFA / PBSまたはBouin固定液中の胚または胚の一部を固定し、少なくとも16〜24時間一定ロッキング下で固定する。
- 成体組織サンプルを調製する(最大5×5×7mm 3 )
- 少なくとも3日間4℃で4%のコール酸を含む2%PFA / PBSで組織を固定する。
注:このソリューションでは、皮膚、肝臓、膵臓、腎臓、甲状腺、心臓、線条筋肉、脳、神経およびいくつかの新生児および成人、げっ歯類、ブタ、ミバエおよびゼブラフィッシュの腫瘍モデルに由来する組織サンプルを固定することができますHREMイメージングのために処理されます(サンプルの修正を示します; 代表結果を参照)。メス、はさみまたは生検パンチで組織サンプルを切り出し、固定剤に直接移す。神経組織を固定するには、4%PFA / PBSを使用する。 - 固定剤を除去し、実行中の水道水の下で組織を3〜6時間洗う。
- 続いてプラックでサンプルを脱水する70%、80%、90%、96%エタノール中でそれらを100mL当たり0.4gのエオシン(各2-3時間)と混合する。サンプルを4°Cで一定のロッキングまたはローテーター下に保ちます。
注:小さなサンプル(<2 x 2 x 2 mm 3 )では、サンプルが各エタノールに入っている時間を60分に短縮することができます。大きなサンプル(> 5 x 5 x 5 mm 3 )では、4〜8時間に延長することができます。 - 防護手袋を着用したヒュームフードの下で以下の浸透ステップをすべて実行してください。
- 1.25gの過酸化ベンゾイル(可塑化触媒)と0.4gのエオシンを100mLのSolution Aに加えて浸透溶液を調製する(詳細は表の表を参照)。エオシンと触媒が完全に溶解するまで(2-3時間)、磁気攪拌プレート上のビーカーに4℃でかき混ぜる。
- 試料を24〜36時間浸透溶液に入れる。連続的な揺れや回転のもとで4℃に保つ。 3の後、浸透溶液を新鮮な溶液に交換する。12時間。
注:大きなサンプル(> 5 x 5 x 5 mm 3 )の場合、浸透時間を48時間に延長します。
- 少なくとも3日間4℃で4%のコール酸を含む2%PFA / PBSで組織を固定する。
- 他の有機材料の準備
注:通常のはさみで、皮膚の代用品と用紙を所望のサイズにトリムします。固定は必要ありません。- 固定、脱水、脱水の手順を省略します。
- 防護手袋を着用したヒュームフードの下で以下の浸透ステップをすべて実行してください。
- 1.25gの過酸化ベンゾイル(可塑化触媒)と0.4gのエオシンを100mLのSolution Aに加えて浸透溶液を調製する(詳細は表の表を参照)。エオシンと触媒が完全に溶解するまで(2〜3時間)、磁気攪拌プレート上で4℃でビーカー中で撹拌する。
- 浸透溶液にサンプルを3〜12時間置く。連続的な揺れや回転のもとで4℃に保つ。浸透溶液を1〜2時間後に新しい溶液に交換する。
埋め込み
注記:保護手袋を着用しているフュームフードの下ですべての手順を実行します。
- 上記のように新鮮な浸潤溶液を調製する(ステップ1.1.4.1)。浸透溶液100mLに溶液B(詳細は表を参照)4mLを加えて包埋溶液を調製する。
注記:包埋モールド内の試料の正確な向きが必要であり、いくつかのサンプルを平行に埋め込むことができるようにするには、ビーカーを氷浴に入れてストック溶液の重合を遅くします。 - 6 x 8 x 5 mm 3または13 x 19 x 5 mm 3の定型容積の金型または最大8 x 10 x 15 mmのボリュームを持つカスタマイズされた金型を使用して、成形カップトレイ(詳細は表を参照)を使用してください3 ( 図2 )。
- 金型に包埋溶液を充填し、金型に試料を移す。スプーン。移送中は、空気トラップを避けるためにサンプルが包埋溶液で完全に覆われていることを確認してください。
注:これは、試料および冷蔵庫からの包埋溶液を収集した直後に開始する場合、室温で行うことができる。- ニードルまたは鉗子を使用して型の内側にサンプルを向ける。
- 埋め込み溶液が粘性になるとすぐに、金型の上にブロックホルダー( 材料の表を参照)を置き、ブロックホルダーの底面が1〜2で覆われるまでブロックホルダーの中心穴に埋め込み溶液を加えますmmである。
- モールドカップトレイを液体パラフィンワックスで覆いシールし、硬化するまで待ちます。あるいは、サンプル付きのモールドカップトレイに第2のモールドカップトレイを上下逆に置き、粘着テープで密封して防塵します。
- 密封された成形カップのトレイを1〜室温で2日間。
- 重合後処理のためには、標準的な実験室オーブンに重合ブロックを入れた成形カップトレイを置き、暗赤色になるまで最低1〜2日間70〜80℃で焼きます。オーブンからトレイを収集し、金型からブロックを取り出します。
注:ベーキングは通常の環境条件で行うことができます。埋め込み後の第1段階の気密シールを確実にする被覆成形カップトレイは、10時間後に樹脂の色をチェックできるように取り除くことができる。ベーキングの直後、樹脂は柔らかく、ブロックは成形カップトレイから容易に取り外すことができる。 2〜3時間以内に、それらは硬く、数ヶ月間室温で保存することができます。
3.データ生成
注:ここで使用されているHREMプロトタイプ18,25は、以下の項目で構成されています。(i)ブロックホルダー付きロータリーミクロトーム各切断の後にその上方転向点で停止する。 (ii)標準の使い捨てではないミクロトームナイフ、硬質金属、プロファイルD(詳細は表を参照)。 (iii)対物レボルバーおよびGFP-フィルター立方体(励起470/40;発光フィルター525/50)をその光軸に有する蛍光化合物顕微鏡のヘッド。光軸は、ミクロトームに取り付けられたブロックの新たに切断された表面に対して垂直に配置され、上下運動を可能にする装置によって保持される。 (iv)ミクロトームを担持する電動クロステーブル。テーブルは、光軸の方向および横方向にシフトすることができる。 (v)蛍光化合物顕微鏡に取り付けられたデジタルビデオカメラ。 (vi)モノクローム光源(470nm)。 (vii)カメラに接続されたコンピュータ、データ生成ソフトウェア(詳細は表を参照)。
- 手順
- 関心のある領域を示します。
- 標準的な実験室のリ白色光をブロック面に斜めに照射するための光源( 表の表を参照)。
- 埋め込みマテリアルの輪郭をブロックサーフェスに投影する際にその輪郭を特定します。ペンまたはカミソリの刃を使用して、関心領域および後の視野をブロック表面上に示す。
注:この手順は、セクション化する前に視野の範囲を定義するために必須です。
- 視野を定義します。
- ミクロトーム上にサンプルを含む樹脂ブロックをマウントします。
- ブロックホルダーを停止位置に移動します(ブロックホルダーエクスカーションの上部転回点)。
- デジタルカメラとデータ生成ソフトウェアを起動し、ライブイメージを取得します。
- ブロック面に表示された関心領域をカバーするために適切な倍率で対物レンズを選択します。
注:倍率が2.5倍、5倍、10倍、20倍、開口数が0.07〜0.40のものがよく使用されます。 - 関心領域がコンピュータ画面上に表示される視野と一致するまで、電動クロステーブルを使用して、視神経を上下左右に動かします。
- フォーカス。
- サンプルの最初の構造が目に見えるようになるまで手動でセクションを段階的に実行します。
- ミクロトームを光軸の方向に動かすことによって、光学系の焦点面内にブロック面を配置する。
- セクションの厚さを選択します。セクションの厚さは0.5〜5μmが推奨されます。
- 関心のある領域を示します。
- データの生成と処理
- セクションとイメージのキャプチャを調整するソフトウェアルーチンを起動します。画像キャプチャソフトウェアの文書化された指示に従ってください。
- ソフトウェアルーチンを停止し、サンプルが完全に分割されるとすぐにブロックサーフェスの前面にスケーリングスライドを配置します。
- 後のキャリブレーションのために画像をインタラクティブにキャプチャする。
注:これは、新たに設定された設定で目的が使用されるたびに実行されなければなりません。 - 画像シリーズを8ビットグレースケール画像in.jpg形式に変換します。
- 画像シリーズを3Dビジュアライゼーションソフトウェアにロードし、コントラストを調整します。
注:イメージ変換と3Dビジュアライゼーションは、それぞれのソフトウェアの指示に従って、さまざまな商用または自由に利用可能な標準ソフトウェアパッケージで行うことができます。
結果
HREMは、ヘマトキシリン/エオジン染色組織切片の画像と同様のコントラストを有する一連の本来的に整列したデジタル画像を生成する。 2D断面画像とは対照的に、HREM画像のスタックは、3Dにおける幅広い種類の有機材料の組織構造、形態およびトポロジーの可視化および分析を可能にする。高いコントラストは、表面レンダリングされたモデルの生成のために、体積レンダリングされたコンピュータモデルおよび半自動等高線所見の迅速かつ簡単な3D視覚化を容易にする。
HREMデータのサイズは、カメラターゲットのサイズ、画像キャプチャモード(8,12,16ビット、グレースケール、カラー)、およびシングルブロック顔画像の数によって異なります。 2,048ピクセル×2,048ピクセルの1,000個の8ビット.jpgグレースケール画像のより小さいデータセットは、約900 MBのサイズを有する。 4,096 pの3,000 8ビット.jpgグレースケール画像のより大きいデータセットixel x 4,096ピクセルの容量は約20 GBです。
提供されるプロトコルはシンプルで堅牢であり、過去10年間に多くの異なる標本のHREMデータを生成するために使用されました。プロトコールセクション1.1は、最大1cmの長さを有する生物医学モデル生物の全胚および5x5x5mm 3までの胚組織サンプルを処理するために最適化された。マウス( Mus musculus) 、ニワトリ( Gallus gallus )、ゼブラフィッシュ( Danio rerio )、ウズラ( Coturnix coturnix) 、アフリカツメガエル( Xenopus laevis )、ウマ( Hepidae)の胚のHREMデータを作成するためにこの方法を使用した。 イクサツメガエル )、ミルクウィードバグ( Oncopeltus fasciatus )、ワニ( Crocodylia )、タコ( Octopus vulgaris )すべての種のデータは優れた品質であった( 図3 )
3までの大きさの若年性および成人組織サンプルを処理するために最適化され、かつ、組織サンプルを視覚化するために使用された。 ( ホモ・サピエンス )、マウス( Mus musculus )、ラット( Rattus norvegicus )、ブタ( Sus scrofa domestica )フェレット( Mustela )から採取した皮膚、肝臓、膵臓、腎臓、甲状腺、心臓、 ( Drosophila melanogaster )、およびゼブラフィッシュ( Danio rerio )のような魚類が含まれる。結果はほとんどの標本( 図4 アニメーション1など )では優れていましたが、3 x 3 x 3 mm 3より大きい皮膚の中央部分(表皮付き)および脳標本は、エオシンの不十分な浸透のためにしばしば染色されずに残っていましたこれらの組織。
プロトコル1.3は、繊維状有機材料を処理するために最適化され、コート紙、コーティングされていない紙、天然の真皮代替材料および幹細胞播種された真皮代替材料の繊維構造を視覚化するために用いられた。これらのサンプルは簡単かつ迅速に処理できました。コーティングされていない紙およびほとんどの皮膚代替物のデータは良好な品質であった( 図5 、 アニメーション2 )。無機材料がエオシンの浸透を妨げると、コート紙の処理に問題が生じた。別の問題は、浸透溶液によって部分的に消化されたため、寒天を基礎にして皮膚を代用するときに発生しました。
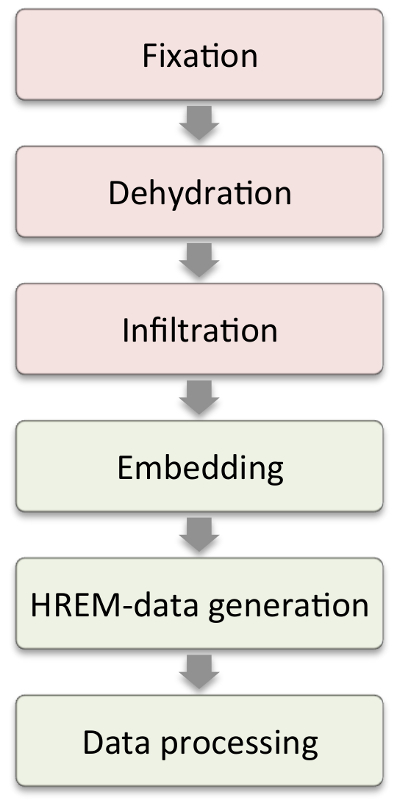
図1:ワークフロー。赤いボックスに示されているステップは、サンプルの特性に応じて変更する必要があります。緑色のボックスの手順は、すべてのサンプルにおいて同様である。 この図の拡大版を見るには、ここをクリックしてください。

図2:カスタマイズされた金型。金型は、元の金型に穴を切って、パスツールピペットの球を挿入し、モデリング材料でそれを密封することによって適合させることができる。 この図の拡大版を見るには、ここをクリックしてください。
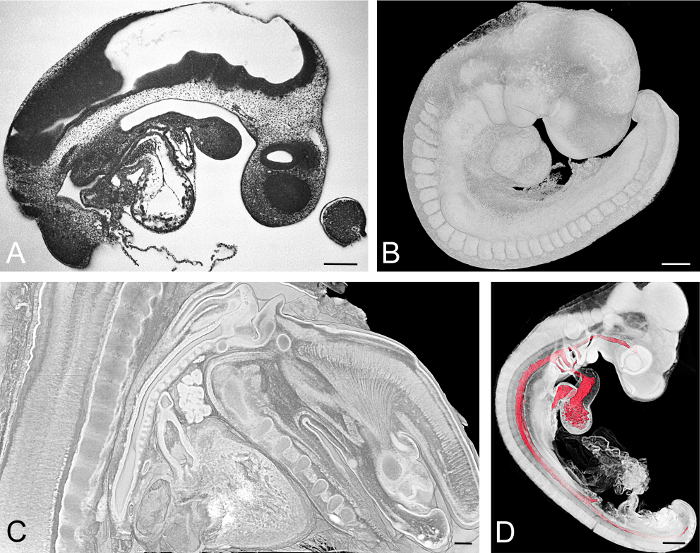
図3:例示的に視覚化された胚。 (A、B)胚の日に採取したマウス胚、E = 9.5。 HREM断面画像を(A)に、 。表面を示す体積レンダリングされた3Dモデルが(B)に示されている。 (C) E15.5マウス胚の頸部のボリュームレンダリングモデルによる仮想矢状断面。 (D)発生Hamburger Hamilton(HH)段階でのニワトリ胚18.すべての胚組織のボリュームレンダリングと組み合わせた心血管コンポーネントの管腔の表面モデル。スケールバー=200μm。 この図の拡大版を見るには、ここをクリックしてください。
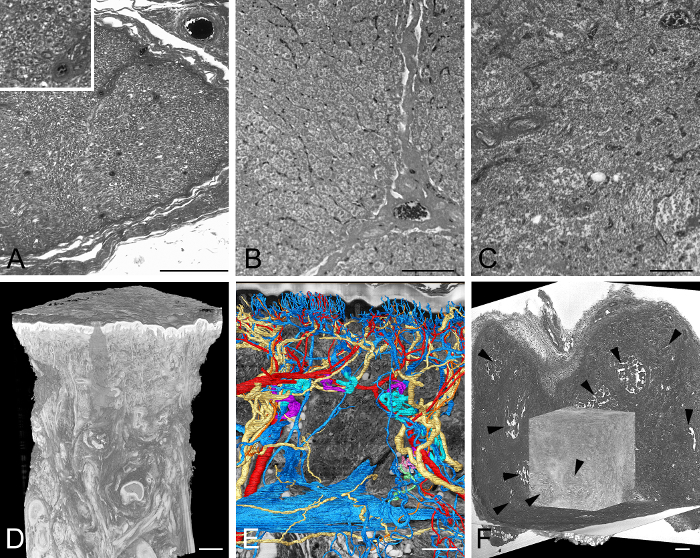
図4:典型的に視覚化された成人組織サンプル。 (A)人間の神経を通したHREM切片像の一部。インレイは、イメージのセクションをより詳細に示します。 (B)ブタ肝臓を通したHREM切片画像の一部。 nに注意してくださいuclei。 (C)ヒトリンパ組織のHREM切片画像の一部。 (D、E)人間の親指パッドの厚い肌。全体の生検のボリュームレンダリングされた3Dモデル。 (D) HREMデータ(E)による仮想切除の前の動脈、静脈、および神経の表面レンダリングされたモデル。 (F)成体マウス組織における実験的腫瘍。ボリュームレンダリングされた3Dモデルは、HREMデータを介して3つの仮想セクションの前にレンダリングされます。壊死部分(矢頭)に注意してください。スケールバー=200μm。 この図の拡大版を見るには、ここをクリックしてください。

図5:例示的に視覚化された繊維材料。 (A、B) HREMセクションのコートされていない、茶色の用紙の画像。 (B) は(A)のセクションを示しています。繊維とその内腔に注意してください。 (C)コート紙のHREMセクション。繊維は染色されないままであることに留意されたい。 (D)天然の代用材料の体積表示モデル。ファイバーの異なる口径と形状に注意してください。スケールバー=100μm。 この図の拡大版を見るには、ここをクリックしてください。
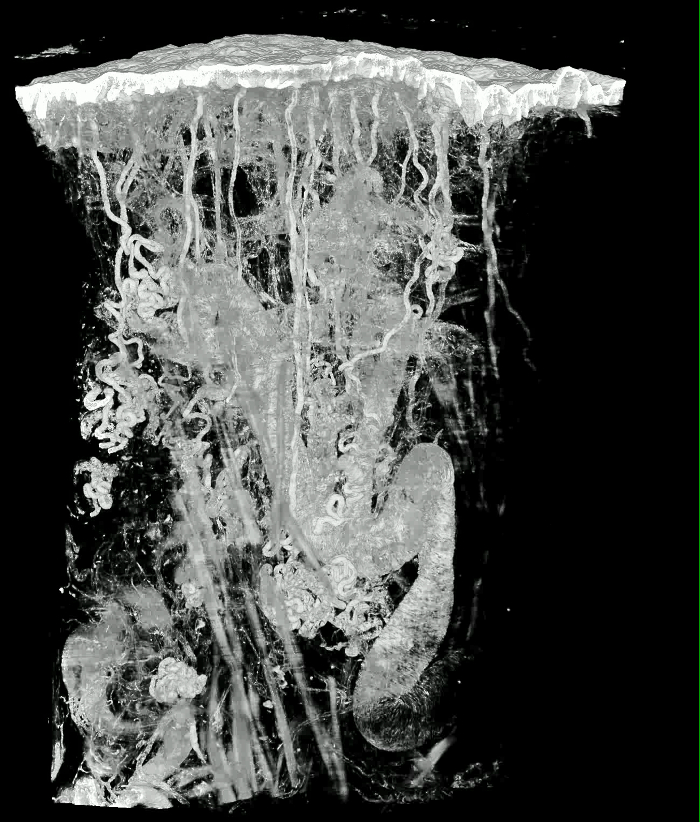
アニメーション1:人間の親指パッドの太い皮のボリュームレンダリングモデル。組織ブロックのサイズは、約4.2×2.7×2.7mm 3である 。ボクセルのサイズは1.07×1.07×2μm3です。 このビデオを見るにはここをクリックしてください。 (右クリックしてダウンロードしてください)
アニメーション2:ネイティブの皮膚代用物質のボリュームレンダリングモデル。サンプルのサイズは、約1.2×0.85×0.4mm 3である 。ボクセルサイズは0.54×0.54×2μm3です。 このビデオを見るにはここをクリックしてください。 (右クリックしてダウンロードしてください)
ディスカッション
HREMは、生物医学および産業分野で使用される広範囲の有機材料を視覚化するのに理想的な、非常に堅牢な顕微鏡法である18,21,26,27,28,29,30,31,32,33,34,35,36,37 、 38,39,40 。それは、発達障害メカニズム(DMDD)プログラム41,42によって現在使用されているように、独占イメージングモダリティとして使用することができる、 43,44またはマルチモーダルイメージングパイプライン45の統合部分として使用することができる。
完全に機能するHREMデータ生成装置は、従来の実験室構成要素から組み立てることができ、電動ミクロトーム、顕微鏡、電動クロステーブル、および適切なソフトウェア25を備えたコンピュータを含む。定義された位置で各セクションの後に再現可能に停止するブロックホルダーと、光路内のGFPフィルターキューブを備えたミクロトームを使用することが重要です。ただし、完全に機能するオールインクルーシブソリューションは、Indigo Scientificなどの企業から購入できます。
HREMは、切片作成または切片マウント中にアーチファクトが導入されないことを除いて、すべての組織学的技術と同じ制限に直面する。しかし、切片化する前に標本を染色する必要性から生じる制限があります。埋め込み材料の特性から決定する。十分な組織のコントラストを得るためには、標本全体を通してのエオシンの浸透が必要である。脂肪組織および無機物質は、エオシンの浸透を効果的に妨げ、この結果、物体の中心に染色されていない組織が生じる。特別な固定剤を使用すると、皮膚の標本を汚すのに役立ちますが、問題を完全に解決するための適切な方法はまだありません。もう1つの制限は、2cmよりも高くブロックする樹脂が切断中に破損する傾向があることである。これは、試料と加工部品を別々に切断することによって部分的に回避することができます。
埋め込みの間に金型内の不規則な表面を有する小さなサンプルまたはサンプルの正しい位置決めが問題となることが多い。アガロースでサンプルをカバーし、プロトコルに記載されているようにアガロースブロックを処理すると、通常この問題が解決されます19 。別の方法は、ブロックが部門間に壊れた場合に役立ちます既に硬化したブロックをそのホルダーから取り外し、前述の埋め込み手順に従って新たに埋め込むことである。
典型的なHREMデータセットは、500から3,000の単一画像を含む。その数値分解能は、連続画像間の距離( すなわち 、断面厚さ)、カメラターゲットの特性、および利用される光学系の特性によって決定される。提示されたプロトコールはアーチファクト20,46からの輝きを完全に排除するものではないが、1μm〜5μmの断面厚さを使用し、良好な結果を達成した。これらのアーチファクトは、ブロック内部の深部に位置する激しく染色された組織によって引き起こされ、その結果ブロック表面上の組織情報のぼけが生じる。
カメラの目標寸法は、2,560×1,920ピクセル2,2048×2,048ピクセル2,4,096×4,096ピクセル2であり、コンビネーション1.25倍、2.5倍、5倍、10倍、20倍の対物レンズを搭載しています。これは、0.18×0.18μm2と5.92×5.92μm2の間の数値ピクセルサイズをもたらし、これは、組織構造および細胞形状の3D解析、ならびに核の視覚化に十分であることが判明した。高い数値分解能が与えられれば、他の細胞オルガネラも同様に可視であるべきである。単純なエオシン染色のためにコントラストが不十分であり、目的物の光学特性が構造を識別する可能性を劇的に低下させる。開口数を考慮したHREMデータの最大真の空間分解能はおよそ1 x 1 x 1μm3であるため、およそ3 x 3 x 3μm3を超える構造の有効な識別が可能になります。
すべてのデジタル画像技術に共通する問題は、視野の大きさと、表示可能な標本の部分を定義するカメラターゲット上のd、および画像の数値解像度。視野が広いほど、可能な限り最大の数値分解能が得られます46 。ここで使用するHREM設定では、0.18 x 0.18μm2および12.12 x 12.12 mm 2 (1.25X対物レンズ)の数値分解能で表示された0.74 x 0.74 mm 2 (20X対物レンズ) 2.96×2.96μm2の数値分解能。代替の商業化されたセットアップは、より大きな視野を提供することができますが、真の解決を犠牲にします。それにもかかわらず、DMDDプログラム47のホームページに表示されるデータから明らかなように、優れた結果を提供する。
開示事項
著者は何も開示することはない。
謝辞
著者はTim Mohunに、サンプルを提供するためのHREMとPetra Heffeterの開発に貢献してくれたことに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| JB-4 Plus Embedding Kit | Polysciences Europe GmbH | 18570-1 | includes Benzoyl Peroxide, Plasticized (Catalyst) and Solution A+B |
| Polyethylene Molding Cup Trays, 6 x 8 x 5 mm hexagon (9 cavities) | Polysciences Europe GmbH | 17177A-3 | |
| Polyethylene Molding Cup Trays, 13 x 19 x 5 mm (9 cavities) | Polysciences Europe GmbH | 17177C-3 | |
| JB-4 Plastic Block Holders | Polysciences Europe GmbH | 15899-50 | |
| Eosin | Waldeck GmbH & Co. KG, Division Chroma | 1A-196 | |
| Microtec CUT 4060E | rotary microtome | ||
| Leica DM LM, fluorescence compound microscope | Leica Mikrosysteme Handelges.m.b.H | ||
| GFP filter set | Leica Mikrosysteme Handelges.m.b.H | 11090937180000 | |
| Motorised cross table | Walter Uhl, technische Mikroskopie GmbH & CO. KG | KT5-LSMA | |
| Digital video camera SPOT-FLEX | Visitron Systems GmbH. | ||
| precisExcite High-Power LED | Visitron Systems GmbH. | light source | |
| VisiView 2.1.4 | Visitron Systems GmbH. | Image capturing software | |
| Hard metal knife (tungsten carbide), profile D | Leica Mikrosysteme Handelges.m.b.H | ||
| KL 2500 LCD | Schott AG | light source |
参考文献
- Murray, K. K., Seneviratne, C. A., Ghorai, S. High resolution laser mass spectrometry bioimaging. Methods. 104, 118-126 (2016).
- Holzlechner, M., et al. In Situ Characterization of Tissue-Resident Immune Cells by MALDI Mass Spectrometry Imaging. J Proteome Res. 16 (1), 65-76 (2017).
- Elsayad, K., et al. Spectrally coded optical nanosectioning (SpecON) with biocompatible metal-dielectric-coated substrates. Proc Natl Acad Sci U S A. 110 (50), 20069-20074 (2013).
- Norris, F. C., et al. A coming of age: advanced imaging technologies for characterising the developing mouse. Trends Genet. 29 (12), 700-711 (2013).
- Schneider, J. E., et al. High-resolution imaging of normal anatomy, and neural and adrenal malformations in mouse embryos using magnetic resonance microscopy. J Anat. 202 (2), 239-247 (2003).
- Sharpe, J. Optical projection tomography as a new tool for studying embryo anatomy. J Anat. 202 (2), 175-181 (2003).
- Metscher, B. D. MicroCT for developmental biology: A versatile tool for high-contrast 3D imaging at histological resolutions. Dev Dyn. 238 (3), 632-640 (2009).
- Syed, S. H., Larin, K. V., Dickinson, M. E., Larina, I. V. Optical coherence tomography for high-resolution imaging of mouse development in utero. J Biomed Opt. 16 (4), 046004 (2011).
- Zhang, E. Z., et al. Multimodal photoacoustic and optical coherence tomography scanner using an all optical detection scheme for 3D morphological skin imaging. Biomed Opt Express. 2 (8), 2202-2215 (2011).
- Singh, M., et al. Applicability, usability, and limitations of murine embryonic imaging with optical coherence tomography and optical projection tomography. Biomed Opt Express. 7 (6), 2295-2310 (2016).
- Weninger, W. J., Meng, S., Streicher, J., Müller, G. B. A new episcopic method for rapid 3-D reconstruction: applications in anatomy and embryology. Anat Embryol (Berl). 197 (5), 341-348 (1998).
- Weninger, W. J., Mohun, T. Phenotyping transgenic embryos: a rapid 3-D screening method based on episcopic fluorescence image capturing. Nat Genet. 30 (1), 59-65 (2002).
- Khairy, K., Keller, P. J. Reconstructing embryonic development. Genesis. 49 (7), 488-513 (2011).
- Medalia, O., et al. Macromolecular architecture in eukaryotic cells visualized by cryoelectron tomography. Science. 298 (5596), 1209-1213 (2002).
- Berrios-Otero, C. A., Wadghiri, Y. Z., Nieman, B. J., Joyner, A. L., Turnbull, D. H. Three-dimensional micro-MRI analysis of cerebral artery development in mouse embryos. Magn Reson Med. 62 (6), 1431-1439 (2009).
- Liu, M., et al. Dual modality optical coherence and whole-body photoacoustic tomography imaging of chick embryos in multiple development stages. Biomed Opt Express. 5 (9), 3150-3159 (2014).
- Mohun, T. J., Leong, L. M., Weninger, W. J., Sparrow, D. B. The morphology of heart development in Xenopus laevis. Dev Biol. 218 (1), 74-88 (2000).
- Weninger, W. J., et al. High-resolution episcopic microscopy: a rapid technique for high detailed 3D analysis of gene activity in the context of tissue architecture and morphology. Anat Embryol. 211 (3), 213-221 (2006).
- Mohun, T. J., Weninger, W. J. Embedding Embryos for High-Resolution Episcopic Microscopy (HREM). Cold Spring Harb Protoc. 2012 (6), 678-680 (2012).
- Geyer, S. H., Mohun, T. J., Weninger, W. J. Visualizing vertebrate embryos with episcopic 3D imaging techniques. ScientificWorldJournal. 9, 1423-1437 (2009).
- Bruneel, B., et al. Imaging the zebrafish dentition: from traditional approaches to emerging technologies. Zebrafish. 12 (1), 1-10 (2015).
- Adams, D., et al. Bloomsbury report on mouse embryo phenotyping: recommendations from the IMPC workshop on embryonic lethal screening. Dis Model Mech. 6 (3), 571-579 (2013).
- Heddleston, J. M., Chew, T. L. Light sheet microscopes: Novel imaging toolbox for visualizing life's processes. Int J Biochem Cell Biol. 80, 119-123 (2016).
- Powell, K. A., Wilson, D. 3-dimensional imaging modalities for phenotyping genetically engineered mice. Vet Pathol. 49 (1), 106-115 (2012).
- Geyer, S. H., Mohun, T. J., Kamolz, L. P., Weninger, W. J. High resolution episcopic microscopy - current applications. Current Biotechnology. 1 (4), 281-286 (2012).
- Weninger, W. J., Maurer, B., Zendron, B., Dorfmeister, K., Geyer, S. H. Measurements of the diameters of the great arteries and semi-lunar valves of chick and mouse embryos. J Microsc. 234 (2), 173-190 (2009).
- Geyer, S. H., Maurer, B., Dirnbacher, K., Weninger, W. J. Dimensions of the great intrathoracic arteries of early mouse fetuses of the C57BL/6J strain. The Open Anatomy Journal. 4 (1), 1-6 (2012).
- Geyer, S. H., Maurer, B., Pötz, L., Singh, J., Weninger, W. J. High-Resolution Episcopic Microscopy Data-Based Measurements of the Arteries of Mouse Embryos: Evaluation of Significance and Reproducibility under Routine Conditions. Cells Tissues Organs. 195 (6), 524-534 (2012).
- Geyer, S. H., Weninger, W. J. Some Mice Feature 5th Pharyngeal Arch Arteries and Double-Lumen Aortic Arch Malformations. Cells Tissues Organs. 196 (1), 90-98 (2012).
- Kee, H. J., et al. Ret finger protein inhibits muscle differentiation by modulating serum response factor and enhancer of polycomb1. Cell Death Differ. 19 (1), 121-131 (2012).
- Geyer, S. H., Nohammer, M. M., Tinhofer, I. E., Weninger, W. J. The dermal arteries of the human thumb pad. J Anat. 223 (6), 603-609 (2013).
- Geyer, S. H., Weninger, W. J. Metric characterization of the aortic arch of early mouse fetuses and of a fetus featuring a double lumen aortic arch malformation. Ann Anat. 195 (2), 175-182 (2013).
- Maurer, B., Geyer, S. H., Weninger, W. J. A Chick Embryo With a yet Unclassified Type of Cephalothoracopagus Malformation and a Hypothesis for Explaining its Genesis. Anat Histol Embryol. 42 (3), 191-200 (2013).
- Geyer, S. H., et al. High-Resolution Episcopic Microscopy (HREM): A Tool for Visualizing Skin Biopsies. Microsc Microanal. 20 (5), 1356-1364 (2014).
- Weninger, W. J., et al. Phenotyping structural abnormalities in mouse embryos using high-resolution episcopic microscopy. Dis Model Mech. 7 (10), 1143-1152 (2014).
- Geyer, S. H., et al. High-resolution episcopic microscopy (HREM): A useful technique for research in wound care. Ann Anat. 197, 3-10 (2015).
- Captur, G., et al. Morphogenesis of myocardial trabeculae in the mouse embryo. J Anat. 229 (2), 314-325 (2016).
- Wong, R., Geyer, S., Weninger, W., Guimberteau, J. C., Wong, J. K. The dynamic anatomy and patterning of skin. Exp Dermatol. 25 (2), 92-98 (2016).
- Jenner, F., et al. The embryogenesis of the equine femorotibial joint: The equine interzone. Equine Vet J. 47 (5), 620-622 (2015).
- Wiedner, M., et al. Simultaneous dermal matrix and autologous split-thickness skin graft transplantation in a porcine wound model: a three-dimensional histological analysis of revascularization. Wound Repair Regen. 22 (6), 749-754 (2014).
- Mohun, T., et al. Deciphering the Mechanisms of Developmental Disorders (DMDD): a new programme for phenotyping embryonic lethal mice. Dis Model Mech. 6 (3), 562-566 (2013).
- Wilson, R., et al. Highly variable penetrance of abnormal phenotypes in embryonic lethal knockout mice. Wellcome Open Res. 1, 1 (2016).
- Wilson, R., McGuire, C., Mohun, T. Deciphering the mechanisms of developmental disorders: phenotype analysis of embryos from mutant mouse lines. Nucleic Acids Res. 44 (D1), D855-D861 (2016).
- Dickinson, M. E., et al. High-throughput discovery of novel developmental phenotypes. Nature. 537 (7621), 508-514 (2016).
- Pieles, G., et al. microMRI-HREM pipeline for high-throughput, high-resolution phenotyping of murine embryos. J Anat. 211 (1), 132-137 (2007).
- Weninger, W. J., Geyer, S. H. Episcopic 3D Imaging Methods: Tools for Researching Gene Function. Curr Genomics. 9, 282-289 (2008).
- . Deciphering the Mechanisms of Developmental Disorders: DMDD Available from: https://dmdd.org.uk/ (2017)
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved