このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
サンプル抽出、ドキソルビシン、マイトマイシン C 以下の組み合わせへのドラッグデリバリー ナノ粒子の担癌マウスの同時のガスクロマトグラフィーによる定量
要約
このプロトコルは、サンプル抽出の効率的かつ便利な分析プロセスと心肺毒性 DOX 代謝物、生物学的に doxorubicinol (DOXol)、マイトマイシン C (MMC)、ドキソルビシン (DOX) 複数の薬の同時定量法について説明します。相乗効果薬の組み合わせのナノ粒子製剤の前臨床乳房腫瘍モデルからサンプルが扱われます。
要約
併用化学療法クリニックでのがん治療に多用します。ただし、正常組織に関連付けられている副作用は、その治療の恩恵を制限があります。ナノ粒子ベースの薬の組み合わせは、遊離型薬物併用療法で発生する問題を軽減するために示されています。私たちの以前の研究が 2 つ、抗がん剤ドキソルビシン (DOX) とマイトマイシン C (MMC) の組み合わせを示す、両方のマウスに対する相乗効果を生産、ひと乳癌細胞の in vitro。DOX と MMC の共同読み込まれたポリマー脂質ハイブリッド ナノ粒子 (DMPLN) には、多剤耐性と乳房腫瘍モデルで実証された効果を与える各種の排出トランスポーター ポンプがバイパスされます。従来のソリューションのフォームと比較して、DMPLN のような優れた効果は、DOX と MMC により、ナノキャリア pln へ腫瘍細胞内で増加した細胞内薬物バイオアベイラビリティの同期の薬物動態に起因しました。
薬物動態と生物の分布を評価するには、共同投与 DOX と MMC 無料のソリューションでナノ粒子の形態、逆相分配高速液体クロマトグラフィー (HPLC) を使用してシンプルで効率的な多剤の分析法開発しました。プラズマで DOX または MMC を個別に分析メソッドは以前に報告したと対照をなしてこの新しい HPLC メソッドは DOX、MMC および主要な心臓毒性 DOX 代謝物、様々 な生物学的マトリックス (の doxorubicinol (DOXol)、同時に量的に表わすことができます。例えば、全血、乳房の腫瘍と心)。デュアル蛍光灯や紫外線吸収プローブ 4-メチルウンベリフェロン (4 MU) は、異なる検出波長の複数の薬品分析学ワンステップ検出用内部標準 (インフォメーションシス テムズ) として使用されました。このメソッドが正常に終了すると、DOX と全血でのナノ粒子とソリューションの両方のアプローチと同所性乳房腫瘍マウスモデルのさまざまな組織によって提供される MMC の濃度を決定するためにしました。分析手法は、薬剤の組合せのナノ粒子ベースの配信の前臨床試験の解析のための便利なツールです。
概要
まだそれは重大な副作用と薬剤耐性のため限られた有効性と他の要因1,2,3に関連付けられて多くの場合、化学療法は多くのがんの主な治療法です。化学療法の結果を改善するために薬レジメンは非重複毒性、薬物作用、および非クロス薬剤抵抗4,5のさまざまなメカニズムなどの考慮事項に基づいて診療所に適用されています。,6。 臨床試験で、より良い奏効率がしばしば観察された連続的な薬物配信7,8のレジメンと比較して薬剤の併用投与を同時に使用します。ただし、無料薬剤のサブ最適な生物分布、複数の薬の同時投与は治療効果9,10,11を上回る著名な正常組織毒性を引き起こすことができます。ナノキャリアを用いたドラッグデリバリー システムは、薬物動態およびカプセル化された薬剤、腫瘍ターゲット蓄積12,13,14の強化の生物分布を変更する示されています。相乗効果の薬剤の組合せを装荷した共同ナノ粒子の制御された時空共同配信のための無料の薬の組み合わせで発生する問題を軽減するために機能を実証している、私たちの最近の記事でレビュー済み腫瘍組織に複数薬の4,,1516細胞ガンに対する薬物の相乗効果を有効にします。その結果、優れた治療効果と低い毒性は、両方の前臨床および臨床的研究4,17,18で実証されています。
以前の in vitro研究 2 抗癌剤ドキソルビシン (DOX) とマイトマイシン C (MMC) の組み合わせがいくつか乳房癌細胞ラインに対して相乗効果を生成を発見し、さらに、共同 DOX と MMC 内での読み込みポリマー脂質ナノ粒子 (DMPLN) は、様々 な関連の多剤耐性排出ポンプ (例えばP-糖タンパク質と乳癌癌耐性蛋白質)19,20,21を克服しました。生体内で、DMPLN 有効に DOX と腫瘍のサイトに MMC の時空の共同配信と癌細胞内薬物のバイオアベイラビリティの向上 DOX 代謝物 doxorubicinol (DOXol)22の形成の緩和によって示される。結果として、DMPLN 強化腫瘍細胞のアポトーシス、腫瘍増殖阻害、DOX と MMC の組み合わせまたはリポソーム DOX 定式化22,23,24、無料と比較して長期ホスト生存 25。
実際に共同、ナノキャリアによって引渡された薬物の量の分析は、効果的なナノ粒子製剤の設計にとって重要です。高速液体クロマトグラフィー (HPLC) だけを使用して単一の DOX または MMC 投与または質量分析法 (MS)26,,2728との組み合わせでの血漿中濃度を分析する多くの方法が開発されています。,29,30,31,32,33,34します。 ただし、これらのメソッドがよくかかり、現実的併用療法の生体試料数が多い (時々 薬物代謝物を含む) 複数の薬物の分析を別途準備する必要があります。DOX と MMC の強い血漿蛋白結合、に加えて赤血球があるバインドし、多く抗がん剤35,36を集中する能力が高い。したがって、DOX または MMC のプラズマ解析は実際の血中薬物濃度を難読化があります。同時に抽出し、量的に表わす DOX、MMC および全血や様々 な組織 (から DOX 代謝物 doxorubicinol (DOXol) 逆相高速液体クロマトグラフィーを使用して複数の薬物分析方法、シンプルで堅牢なを説明します (図 1) の現在の仕事例えば、腫瘍)。それは正常に、がんの薬物動態およびバイオ - DOX、MMC の配布だけでなく、無料のソリューションまたは (すなわちDMPLN とリポソーム DOX) ナノ粒子のフォームを介して薬剤投与後 DOXol の形成を決定するために適用されています。静脈後マウス乳腺腫瘍マウスモデルを注入注入22。
プロトコル
すべての動物実験は動物ケア委員会の大学健康ネットワークによってオンタリオ癌研究所で承認されカナダ評議会動物ケアのガイドラインに従って実施します
。1 生物試料
- 全血、の主要な臓器を収集し、含んでいる薬の静脈投与後の所定の時点で胸の腫瘍製剤 (は 例えば、。DMPLN、リポソーム DOX)
- 準備薬を含む製剤で乳房担癌マウス静注を挿入します 。
- 密閉室に吸入 2% イソフルランを与えることによって指定された時間ポイント (例えば、15 分) でマウスを麻酔します 。
- 背中に麻酔下のマウスを置くし、鼻を通す 2% イソフルランを常に供給するノーズピース
。 注: マウスは、深い麻酔を受けるためには、そっとでピンチ マウスとけいれん動きを見ての前部肢 。
- 70% エタノールを用いた胸部と腹部領域を徹底的に掃除し、ヘパリン 1 mL シリンジと 23 G 針を使用して深い麻酔下マウスの心臓穿刺のターミナルの手順を実行します 。
- 収集全血にラベル付けされたナトリウム ヘパリンはプラスチック製のチューブを噴霧し、優しく収集した全血が管の壁のコーティングのヘパリンと接触するようにチューブを旋回します。50 μ L の全血の最小値を収集します。氷のサンプルを常に保つ
- は、セキュリティ保護し、腹腔内やハサミとピンセットのペアを使用してマウスの胸部を開くには、マウスのすべての 4 つの手足をテープします。側に腸をシフトし、肝臓門脈内を十分に公開する上向きにプッシュします。血の排水のため門脈をカットします 。
- は、25 G 針、10 mL シリンジを使用して心臓を冷たい 0.9% 生理食塩水 50 mL で全体のマウス体内灌流します
。 注意: ポータルの静脈に注射器を導くために 90 ° でニードルを曲げるです 。
- 以下の消費税器官順序: 心臓、肺、肝臓、脾臓、腎臓。次に、マウスの右乳腺の脂肪パッドで切開はさみのペアを使用して周囲の結合組織から乳腺腫瘍を区切ります。1.5 mL ポリプロピレン チューブに個別にすべての器官を収集し、迅速にそれらを液体窒素で凍結します
。 注: 肝臓から胆嚢を区切ります 。
- 後での高速液体クロマトグラフィー分析まで-80 ° C のフリーザーに 4 ° C および摘出組織で全血を格納します 。
- DOX の抽出、MMC および生物学的マトリックスから DOXol。
- は、すぐにすべて冷凍切り裂かれたティッシュの重さし、13 mL 丸みを帯びた底円錐管にそれらを転送します。氷のサンプルを保持可能な薬剤の代謝や分解を避けるためには、
- は、チューブに冷たいセル換散バッファーの 1 ~ 5 mL を追加します
。 注: 使用するバッファーのボリュームによって異なります 1 g: 5 mL (w/v); の組織バッファー率に基づく組織重量比率は、心臓や脾臓などの小器官 1 g: 2 mL 。
- ハンド ホモジナイザーを使用して 18,000 rpm の速度で氷の上の組織サンプルを均一に上下ストローク動作を使用します
。 注: 完成品の均質化が必要です 15 未満の短い均質化プロセスの約 3 に 5 繰り返し組織それぞれの短い均質化間氷の上冷却が続く s 。
- 蒸留脱イオン (DDI) H 2 O、70% エタノール、および DDI H 2 O クロス汚染を避けるために各組織のサンプルの間でホモジナイザーの 10 mm 鋸ジェネレーター プローブを洗うです 。 内部標準 (インフォメーションシス テムズ) 4-メチルウンベリフェロン (4-MU) (2000 ng/mL) をチューブの組織ホモジネートまたは 1.5 mL ポリプロピレン マイクロ遠心チューブに 5 でスパイク全血の転送 50 μ
- μ L.
注: 4 MU ソリューションここでメタノールで調製した 。
- 追加 250 μ L の全血または組織ホモジネートを含むチューブに冷たい抽出溶媒
。 います抽出溶媒で構成されて 60% アセトニ トリル (ACN)、40% アンモニウム酢酸 (5 mM) の ph ph 調整 = 3.5 0.05% ギ酸を用いたします。1:5 (v/v) サンプルを使用: 容積の比率に抽出溶媒 。
- 渦精力的に 2 分、10 分と他の中古冷蔵新鮮なマイクロ遠心チューブに上清のピペット 200 μ L の 4 o C で g フォース x 3,000 で遠心分離混合物 。
- 光からの保護による窒素ガスの遅いストリーム下 60 ° C で蒸発させなさい上澄み 。
- 冷たいメタノール、30 s の別の 5 分の 4 ° C で 3000 × g で遠心分離渦精力的に 100 μ L の乾燥残留物を再構成
- 高速液体クロマトグラフィー バイアル挿入に上清を移すし、注射用オートサンプラー トレイにサンプル瓶を配置します 。
2。高速液体クロマトグラフィー計測器および操作パラメーター
- 一貫性のある再現性準備 HPLC 移動相
- HPLC グレード H 2 O、メスシリンダーを使用しての 500 mL を測定します 。
- 高速液体クロマトグラフィー用アセトニ トリル (ACN) 別のメスシリンダーを使用しての 500 mL を測定します 。
- は、H 2 O の 500 mL のそれぞれにトリフルオロ酢酸 (TFA) (注意) の 0.5 mL を慎重に追加と H 2 O の移動相を取得する ACN と 0.1% を含む ACN TFA、それぞれ
。 注: TFA は腐食性、有毒、研究室の発煙のフードの下で処理する必要があります。すべての溶媒混合物は室温で調製されています 。
- 0.45 μ m のナイロン膜フィルターを介してフィルター移動相細孔サイズときれいな HPLC リザーバー ボトルにそれを転送します 。
- インフォメーションシス テムズと DOXol MMC、DOX 4 MU の同時検出のセットアップ高速液体クロマトグラフィー インストルメンテーション。
- グラデーション ポンプ、解消 · ガッサー、自動サンプラー、フォト ダイオード アレイ検出器、マルチ λ 蛍光検出器に切り替える 。
- 16.5% H 2 O に移動相組成の初期条件を入力 (0.1 %tfa) 83.5 %acn (0.1 %tfa) (v/v).
- 310 で 1 つ 2 つのチャネルに UV 検出器を設定 4 MU (インフォメーションシス テムズ) の nm と他の 360 で MMC の nm 。
- Λ ex で 1 つ 2 つのチャネルの蛍光検出器を設定/λ em = 365/445 4 MU および λ ex で他の nm/λ em DOX と DOXol、480 nm/560 nm をそれぞれ = 。
- 1.0 mL/分のイソクラティック流量を設定
- 基準確立のため 10 分間室温でプリインストールされている逆相 C 18 列 (4.6 mm x 250 mm、5 μ m) を平衡します 。
- 別の薬 (DOX、MMC、DOXol、4 MU) グラデーションの移動相条件を使用します。
- 自動サンプラーによる試料の抽出と濃縮再注入 15 μ 。
- は徐々 に初期の移動相条件を変更 (プロトコル手順 2.2.2 を参照) を 100 %acn (0.1 %tfa) 自動グラデーション ポンプを使用して 18 分以上
。 メモ: 分離プロセス中に 4 チャンネル (2 つの UV 吸収、2 つの蛍光) も同時に表示 1 つの薬剤化合物を表示する各チャンネル (2.2.3 と 2.2.4 プロトコル手順を参照してください). - 維持 ACN の 100% (0.1 %tfa) 1 分と 1 分以内の初期移動相条件に戻る
- 再び条件、初期移動相の流量を 1.5 mL/min で 4 分の次のサンプル注入の列 。
3。高速液体クロマトグラフィー検証
- 4 MU (インフォメーションシス テムズ) と DOXol、MMC DOX の作業標準を準備します。
- DOX と MMC の薬剤粉末 (注意) と新鮮な小さい紙 (3 x 3 インチ 2) の重量を量る 4 MU の重さ別に 1 mg.
全ての抗がん剤は、急性毒性と胚細胞変異原性を発生する吸入または摂取による健康上の危険と見なされますを注意してください。手袋とマスクを慎重に処理する必要があります 。
- 新しい個々 の 1.5 mL のポリプロピレン マイクロ遠心チューブに DOX、MMC および 4 MU の体重を転送します 。
- 覚醒剤の 1 つの mL を追加します。anol と DOX と MMC の 1 mg/mL の濃度を取得する簡単に渦 。
- DOXol (注意) と渦は、簡単に DOXol の 1 mg/mL の濃度を取得する事前重量を量られた 1 mg バイアルにメタノール 1 mL を追加します
。 注: DOXol の心臓毒性代謝物である、慎重に処理する必要があります 。
- DOX、MMC、DOXol、新しい 4 MU の貯蔵液の準備のピペット 20 μ L 1.5 mL ポリプロピレン マイクロ遠心チューブを分離し、各薬品の 20 μ G/ml の作業標準を取得するメタノールの 980 μ L を追加します 。
- 希釈 20 μ G/ml DOX、MMC とメタノールを使用して 50 の作業標準を取得する DOXol の ng の-DOX、MMC、および DOXol の 20 μ g/mL とインフォメーションシス テムズ 4 mu 2000 ng/mL 。
- 作業ソリューション全体チューブ直接光および-20 で店への露出を避けるためにアルミ箔を巻いて、メタノール蒸発を防ぐためにパラフィン フィルム カバーの狭い部分のチューブのキャップのシール ° C
- DOX と MMC の薬剤粉末 (注意) と新鮮な小さい紙 (3 x 3 インチ 2) の重量を量る 4 MU の重さ別に 1 mg.
- 直線性、精度、および DOX、MMC と生物学的マトリックス (すなわち 全血と腫瘍ホモジネート) で DOXol の精度を決定します。
DOX と DOXol の作業標準の
- 同時にスパイク 5 μ L (50 ng/mL の-20 μ G/ml)、MMC (1000 ng/mL - 16 μ G/ml)、および 4 MU (2 μ G/ml) を空白の全血またはポリプロピレン マイクロ遠心チューブに組織ホモジネートの 50 μ L に医薬品化合物の 5 2000 ng/mL から 200 ng/mL 4 MU (インフォメーションシス テムズ) の標準濃度曲線を取得します 。
- プロトコル 1.2 に記載されている薬物の抽出分析を実行します 。
- を使用して、DOX と DOXol の低、中央および高濃度 (50、500、および 2,000 ng/mL) と MMC (100, 1000, 2,000 ng/mL) 内と間日の精度と確度の
。 注: 分析の日に新鮮な標準濃度を準備します 。
- 試料の分析
- 自動サンプラーによる試料の注入 15 μ L.
- 移動相 0 に 18 分以上間隔で ACN の組成の増加に徐々 に変化します 。
- 後 18 分、1 分の移動相条件を保持
- 次の 2 分以上初期状態に戻り、次の注入の前に 4 分間再平衡します 。
- 各サンプルを実行するの後薬化合物の保持時間のピークがとおり表示されていることに注意してください: MMC、DOXol、4 MU (インフォメーションシス テムズ) と DOX 。
- 高速液体クロマトグラフィー ソフトウェアを用いた医薬品化合物の曲線 (AUC) 下ピーク面積を統合します 。
- 化合物個々 の薬剤とインフォメーションシス テムズ (式 1) の AUC の比を計算して DMPLN 製剤に DOX、MMC と DOXol の薬物濃度を決定する同じ抽出手順の中で調製した標準曲線を使用します
。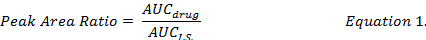
- 再構成する生物学的試料の抽出物からメタノールを使用して薬物濃度を比較することによって薬の回収率 (式 2) を計算します。標準の (" きちんとした ") 薬剤液をメタノール
。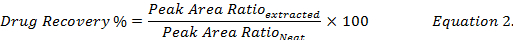
結果
2 つの抗がん剤、DOX MMC と DOX 代謝物、DOXol、同時に蛍光と UV 検出器の両方に、インフォメーションシス テムズとして 4 MU を使用同じ適用勾配高速液体クロマトグラフィー条件下で生物学的干渉されることがなく検出されました。DOX、MMC、DOXol、4 MU DOX (図 2) 11.1 分 4 MU 10.9 分、DOXol 10.4 分 MMC の 5.7 分の保持時間をお互いから十分に分離されました?...
ディスカッション
一度に単一の薬剤の検出を有効にする他のクロマトグラフィー法と比較して、現在の高速液体クロマトグラフィーのプロトコルが同時に変更することがなく同じ生物学的マトリックスの 3 つの薬剤化合物 (DOXol、MMC、DOX) 量的に表わすことができます。移動相。この準備と分析メソッドを正常に薬物動態と生物分布 2 ナノ粒子を用いたドラッグデリバリー システムの決定に適用されている (...
開示事項
著者競合する金銭的な利益と利益相反があります。
謝辞
著者に感謝健康研究 (機構) とカナダ乳がん癌研究 (CBCR) のカナダの研究所から営業許可高速液体クロマトグラフィーの自然科学・ エンジニア リング研究 (レベル) カナダ評議会から機器の助成金X.Y. 呉に同盟と高橋チャンと t. 張さんにトロントの大学奨学金。
資料
| Name | Company | Catalog Number | Comments |
| Doxorubicin | Polymed Theraeutics | 111023 | Anticancer drug |
| Mitomycin C | Polymed Theraeutics | 060814 | Anticancer drug |
| Doxorubicinol (DOXol) | Toronto Research Chemicals | D558020 | Metabolite of DOX |
| 4-Methylumbelliferone sodium salt | Sigma-Aldrich | M1508 | Internal standard |
| Myristic Acid | Sigma-Aldrich | 544-63-8 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (100) Stearate | Spectrum | M1402 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (40) Stearate | Sigma-Aldrich | P3440 | Materials for poly-lipid hybrid nanoparticles |
| Pluronic F68 (PF68) | BASF Corp. | 9003-11-6 | Materials for poly-lipid hybrid nanoparticles |
| Ultrasonication (UP100H) | Hielscher, Ultrasound Technology | NA | Nanoparticle preparation |
| Water Bath (ISOTEMP 3016HS) | Fisher Scientific | NA | Nanoparticle preparation |
| Liposomal Doxorubicin (Caelyx) | Janssen | Purchased from the pharmacy Princess Margaret Hospital | Clinically-approved nanoparticle formulation |
| HPLC-graded Methanol | Caledon Chemicals | 6701-7-40 | HPLC mobile phase composition |
| HPLC-graded H2O | Caledon Chemicals | 8801-7-40 | HPLC mobile phase composition |
| HPLC-graded Acetonitrile | Caledon Chemicals | 1401-7-40 | HPLC mobile phase composition |
| Trifluoroacetic Acid | Sigma-Aldrich | 302031 | HPLC mobile phase composition |
| 0.45 μm Nylon Membrane Filter Paper | Whatman | WHA7404004 | HPLC mobile phase preparation |
| 1cc Plastic Syringes | Becton, Dickinson and Company | 2606-309659 | Treatment injection |
| 5cc Plastic Syringes | Becton, Dickinson and Company | 2608-309646 | Tissue collections |
| 30G 1/2 Needles | Becton, Dickinson and Company | 305106 | Treatment injection |
| 25G 5/8 Needles | Becton, Dickinson and Company | 305122 | Tissue collections |
| Sterile 0.9% Saline | Univeristy of Toronto House Brand | 1011 | Tissue perfusion |
| 13 ml Rounded-bottom conical tube | SARSTEDT | 62.515.006 | Prolyprolene, tissue homogenization |
| Alpha Minimum Essential Medium (MEM) | Gibco | 12571063 | Cell medium |
| 1 x Phosphate Buffer Saline | Gibco | 10010023 | Tissue homogenization |
| Triton X-100 | Sigma-Aldrich | X100-100 ML | Tissue homogenization |
| Formic acid | Caledon Chemicals | 1/5/3840 | Adjust pH for extraction solvent |
| Sodium heparin sprayed plastic tubes | Becton, Dickinson and Company | 367878 | Blood collection |
| Analytical Weigh Balance | Sartorius | CPA225D | NA |
| pH meters | Fisher Scientific | 13-637-671 | accumet BASIC |
| Vortex Mixter | Fisher Scientific | 02-215-365 | Vortexing samples at desired speed |
| 1.5 ml Microcentrifuge Tube | Fisherbrand | 2043-05408129 | Prolyprolene |
| Model 1000 homogenizer | Fisher Scientific | 08-451-672 | Tissue homogenization |
| Centrifuge 5702R | Eppendorf | 5702R | Extraction preparation |
| Heated Evaporator System | Glas-Col | NA | Sample reconstitution |
| HPLC Screw Thread Vials | DIKMA | 5320 | HPLC sample injection |
| HPLC Screw Caps with PTFE White Silicone Septa | DIKMA | 5325 | HPLC sample injection |
| HPLC Polypropylene Insert | Agilent Technologies | 5182-0549 | Maximum volume 250 μl, HPLC sample injection |
| Xbridge C18 Column | Waters Corporation | 186003117 | Drug analysis |
| Gradient pump | Waters Corporation | W600 | Drug analysis |
| Auto-sampler | Waters Corporation | W2707 | Drug analysis |
| Photodiode array detector | Waters Corporation | W2998 | Drug analysis |
| Multi λ fluoresence detector | Waters Corporation | W2475 | Drug analysis |
| EMPOWER 2 | Waters Corporation | NA | Data analysis software |
| Scientist | Micromath | NA | Pharmacokinetic analysis |
| Female Balb/c Mice | Jackson Laboratory | 001026 | In vivo |
| EMT6/WT Breast Cancer Cells | Provided by Dr. Ian Tannock; Ontario Cancer Institute | NA | In vivo |
参考文献
- Holohan, C., Van Schaeybroeck, S., Longley, D. B., Johnston, P. G. Cancer Drug Resistance: An Evolving Paradigm. Nat. Rev. Cancer. 13 (10), 714-726 (2013).
- Szakacs, G., Paterson, J. K., Ludwig, J. A., Booth-Genthe, C., Gottesman, M. M. Targeting Multidrug Resistance in Cancer. Nat Rev Drug Discov. 5 (3), 219-234 (2006).
- Kong, A. -. N. T., Kong, A. .. N. .. T. .. ,. . Inflammation, Oxidative Stress, and Cancer: Dietary Approaches for Cancer Prevention. , (2013).
- Zhang, R. X., Wong, H. L., Xue, H. Y., Eoh, J. Y., Wu, X. Y. Nanomedicine of Synergistic Drug Combinations for Cancer Therapy - Strategies and Perspectives. J Control Release. 240, 489-503 (2016).
- Webster, R. M. Combination Therapies in Oncology. Nat. Rev. Drug. Discov. 15 (2), 81-82 (2016).
- Waterhouse, D. N., Gelmon, K. A., Klasa, R., Chi, K., Huntsman, D., Ramsay, E., Wasan, E., Edwards, L., Tucker, C., Zastre, J., Wang, Y. Z., Yapp, D., Dragowska, W., Dunn, S., Dedhar, S., Bally, M. B. Development and Assessment of Conventional and Targeted Drug Combinations for Use in the Treatment of Aggressive Breast Cancers. Curr Cancer Drug Targets. 6 (6), 455-489 (2006).
- Cancello, G., Bagnardi, V., Sangalli, C., Montagna, E., Dellapasqua, S., Sporchia, A., Iorfida, M., Viale, G., Barberis, M., Veronesi, P., Luini, A., Intra, M., Goldhirsch, A., Colleoni, M. Phase Ii Study with Epirubicin, Cisplatin, and Infusional Fluorouracil Followed by Weekly Paclitaxel with Metronomic Cyclophosphamide as a Preoperative Treatment of Triple-Negative Breast Cancer. Clin Breast Cancer. 15 (4), 259-265 (2015).
- Masuda, N., Higaki, K., Takano, T., Matsunami, N., Morimoto, T., Ohtani, S., Mizutani, M., Miyamoto, T., Kuroi, K., Ohno, S., Morita, S., Toi, M. A Phase Ii Study of Metronomic Paclitaxel/Cyclophosphamide/Capecitabine Followed by 5-Fluorouracil/Epirubicin/Cyclophosphamide as Preoperative Chemotherapy for Triple-Negative or Low Hormone Receptor Expressing/Her2-Negative Primary Breast Cancer. Cancer Chemother Pharmacol. 74 (2), 229-238 (2014).
- Carrick, S., Parker, S., Thornton, C. E., Ghersi, D., Simes, J., Wilcken, N. Single Agent Versus Combination Chemotherapy for Metastatic Breast Cancer. Cochrane Database Syst Rev. 15 (2), 003372 (2009).
- Cardoso, F., Bedard, P. L., Winer, E. P., Pagani, O., Senkus-Konefka, E., Fallowfield, L. J., Kyriakides, S., Costa, A., Cufer, T., Albain, K. S., Force, E. -. M. T. International Guidelines for Management of Metastatic Breast Cancer: Combination Vs Sequential Single-Agent Chemotherapy. J Natl Cancer Inst. 101 (17), 1174-1181 (2009).
- Alba, E., Martin, M., Ramos, M., Adrover, E., Balil, A., Jara, C., Barnadas, A., Fernandez-Aramburo, A., Sanchez-Rovira, P., Amenedo, M., Casado, A. Multicenter Randomized Trial Comparing Sequential with Concomitant Administration of Doxorubicin and Docetaxel as First-Line Treatment of Metastatic Breast Cancer: A Spanish Breast Cancer Research Group (Geicam-9903) Phase Iii. J Clinn Oncol. 22 (13), 2587-2593 (2004).
- Sadat, S. M., Saeidnia, S., Nazarali, A. J., Haddadi, A. Nano-Pharmaceutical Formulations for Targeted Drug Delivery against Her2 in Breast Cancer. Curr. Cancer Drug Targets. 15 (1), 71-86 (2015).
- Devadasu, V. R., Wadsworth, R. M., Ravi Kumar, M. N. V. Tissue Localization of Nanoparticles Is Altered Due to Hypoxia Resulting in Poor Efficacy of Curcumin Nanoparticles in Pulmonary Hypertension. Eur. J. Pharm. Biopharm. 80 (3), 578-584 (2012).
- Li, S. D., Huang, L. Pharmacokinetics and Biodistribution of Nanoparticles. Mol. Pharm. 5 (4), 496-504 (2008).
- Zhang, R. X., Ahmed, T., Li, L. Y., Li, J., Abbasi, A. Z., Wu, X. Y. Design of Nanocarriers for Nanoscale Drug Delivery to Enhance Cancer Treatment Using Hybrid Polymer and Lipid Building Blocks. Nanoscale. 9 (4), 1334-1355 (2017).
- Wang, X., Li, S., Shi, Y., Chuan, X., Li, J., Zhong, T., Zhang, H., Dai, W., He, B., Zhang, Q. The Development of Site-Specific Drug Delivery Nanocarriers Based on Receptor Mediation. J. Control. Release. 193, 139-153 (2014).
- Batist, G., Gelmon, K. A., Chi, K. N., Miller, W. H., Chia, S. K., Mayer, L. D., Swenson, C. E., Janoff, A. S., Louie, A. C. Safety, Pharmacokinetics, and Efficacy of Cpx-1 Liposome Injection in Patients with Advanced Solid Tumors. Clin Cancer Res. 15 (2), 692-700 (2009).
- Mayer, L. D., Harasym, T. O., Tardi, P. G., Harasym, N. L., Shew, C. R., Johnstone, S. A., Ramsay, E. C., Bally, M. B., Janoff, A. S. Ratiometric Dosing of Anticancer Drug Combinations: Controlling Drug Ratios after Systemic Administration Regulates Therapeutic Activity in Tumor-Bearing Mice. Mol. Cancer Ther. 5 (7), 1854-1863 (2006).
- Prasad, P., Cheng, J., Shuhendler, A., Rauth, A. M., Wu, X. Y. A Novel Nanoparticle Formulation Overcomes Multiple Types of Membrane Efflux Pumps in Human Breast Cancer Cells. Drug Deliv Transl Res. 2 (2), 95-105 (2012).
- Shuhendler, A. J., Cheung, R. Y., Manias, J., Connor, A., Rauth, A. M., Wu, X. Y. A Novel Doxorubicin-Mitomycin C Co-Encapsulated Nanoparticle Formulation Exhibits Anti-Cancer Synergy in Multidrug Resistant Human Breast Cancer Cells. Breast Cancer Res Treat. 119 (2), 255-269 (2010).
- Shuhendler, A. J., O'Brien, P. J., Rauth, A. M., Wu, X. Y. On the Synergistic Effect of Doxorubicin and Mitomycin C against Breast Cancer Cells. Drug Metabol. Drug Interact. 22 (4), 201-233 (2007).
- Zhang, R. X., Cai, P., Zhang, T., Chen, K., Li, J., Cheng, J., Pang, K. S., Adissu, H. A., Rauth, A. M., Wu, X. Y. Polymer-Lipid Hybrid Nanoparticles Synchronize Pharmacokinetics of Co-Encapsulated Doxorubicin-Mitomycin C and Enable Their Spatiotemporal Co-Delivery and Local Bioavailability in Breast Tumor. Nanomedicine. 12 (5), 1279-1290 (2016).
- Zhang, T., Prasad, P., Cai, P., He, C., Shan, D., Rauth, A. M., Wu, X. Y. Dual-Targeted Hybrid Nanoparticles of Synergistic Drugs for Treating Lung Metastases of Triple Negative Breast Cancer in Mice. Acta Pharmacol Sin. , 1-13 (2017).
- Shuhendler, A. J., Prasad, P., Zhang, R. X., Amini, M. A., Sun, M., Liu, P. P., Bristow, R. G., Rauth, A. M., Wu, X. Y. Synergistic Nanoparticulate Drug Combination Overcomes Multidrug Resistance, Increases Efficacy, and Reduces Cardiotoxicity in a Nonimmunocompromised Breast Tumor Model. Mol Pharm. 11 (8), 2659-2674 (2014).
- Prasad, P., Shuhendler, A., Cai, P., Rauth, A. M., Wu, X. Y. Doxorubicin and Mitomycin C Co-Loaded Polymer-Lipid Hybrid Nanoparticles Inhibit Growth of Sensitive and Multidrug Resistant Human Mammary Tumor Xenografts. Cancer Lett. 334 (2), 263-273 (2013).
- Rafiei, P., Michel, D., Haddadi, A. Application of a Rapid Esi-Ms/Ms Method for Quantitative Analysis of Docetaxel in Polymeric Matrices of Plga and Plga-Peg Nanoparticles through Direct Injection to Mass Spectrometer. Am. J. Anal. Chem. 6 (2), 164-175 (2015).
- Daeihamed, M., Haeri, A., Dadashzadeh, S. A Simple and Sensitive Hplc Method for Fluorescence Quantitation of Doxorubicin in Micro-Volume Plasma: Applications to Pharmacokinetic Studies in Rats. Iran. J. Pharm. Res. 14, 33-42 (2015).
- Alhareth, K., Vauthier, C., Gueutin, C., Ponchel, G., Moussa, F. Hplc Quantification of Doxorubicin in Plasma and Tissues of Rats Treated with Doxorubicin Loaded Poly(Alkylcyanoacrylate) Nanoparticles. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 887-888, 128-132 (2012).
- Al-Abd, A. M., Kim, N. H., Song, S. C., Lee, S. J., Kuh, H. J. A Simple Hplc Method for Doxorubicin in Plasma and Tissues of Nude Mice. Arch Pharm Res. 32 (4), 605-611 (2009).
- Loadman, P. M., Calabrese, C. R. Separation Methods for Anthraquinone Related Anti-Cancer Drugs. J. Chromatogr. B Biomed. Sci. Appl. 764 (1-2), 193-206 (2001).
- Zhang, Z. D., Guetens, G., De Boeck, G., Van Cauwenberghe, K., Maes, R. A., Ardiet, C., van Oosterom, A. T., Highley, M., de Bruijn, E. A., Tjaden, U. R. Simultaneous Determination of the Peptide-Mitomycin Kw-2149 and Its Metabolites in Plasma by High-Performance Liquid Chromatography. J. Chromatogr. B Biomed. Sci. Appl. 739 (2), 281-289 (2000).
- Alvarez-Cedron, L., Sayalero, M. L., Lanao, J. M. High-Performance Liquid Chromatographic Validated Assay of Doxorubicin in Rat Plasma and Tissues. J. Chromatogr. B Biomed. Sci. Appl. 721 (2), 271-278 (1999).
- Paroni, R., Arcelloni, C., De Vecchi, E., Fermo, I., Mauri, D., Colombo, R. Plasma Mitomycin C Concentrations Determined by Hplc Coupled to Solid-Phase Extraction. Clin. Chem. 43 (4), 615-618 (1997).
- Song, D., Au, J. L. Direct Injection Isocratic High-Performance Liquid Chromatographic Analysis of Mitomycin C in Plasma. J Chromatogr B Biomed Appl. 676 (1), 165-168 (1996).
- Schrijvers, D. Role of Red Blood Cells in Pharmacokinetics of Chemotherapeutic Agents. Clin. Pharmacokinet. 42 (9), 779-791 (2003).
- Colombo, T., Broggini, M., Garattini, S., Donelli, M. G. Differential Adriamycin Distribution to Blood Components. Eur. J. Drug Metab. Pharmacokinet. 6 (2), 115-122 (1981).
- Maeda, H., Nakamura, H., Fang, J. The Epr Effect for Macromolecular Drug Delivery to Solid Tumors: Improvement of Tumor Uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in Vivo. Adv. Drug Deliv. Rev. 65 (1), 71-79 (2013).
- Gustafson, D. L., Rastatter, J. C., Colombo, T., Long, M. E. Doxorubicin Pharmacokinetics: Macromolecule Binding, Metabolism, and Excretion in the Context of a Physiologic Model. J. Pharm. Sci. 91 (6), 1488-1501 (2002).
- Gabizon, A., Shiota, R., Papahadjopoulos, D. Pharmacokinetics and Tissue Distribution of Doxorubicin Encapsulated in Stable Liposomes with Long Circulation Times. J. Natl. Cancer Inst. 81 (19), 1484-1488 (1989).
- Motlagh, N. S., Parvin, P., Ghasemi, F., Atyabi, F. Fluorescence Properties of Several Chemotherapy Drugs: Doxorubicin, Paclitaxel and Bleomycin. Biomed Opt Express. 7 (6), 2400-2406 (2016).
- Mohan, P., Rapoport, N. Doxorubicin as a Molecular Nanotheranostic Agent: Effect of Doxorubicin Encapsulation in Micelles or Nanoemulsions on the Ultrasound-Mediated Intracellular Delivery and Nuclear Trafficking. Mol Pharm. 7 (6), 1959-1973 (2010).
- Cielecka-Piontek, J., Jelińska, A., Zając, M., Sobczak, M., Bartold, A., Oszczapowicz, I. A Comparison of the Stability of Doxorubicin and Daunorubicin in Solid State. J. Pharm. Biomed Anal. 50 (4), 576-579 (2009).
- Gilbert, C. M., McGeary, R. P., Filippich, L. J., Norris, R. L. G., Charles, B. G. Simultaneous Liquid Chromatographic Determination of Doxorubicin and Its Major Metabolite Doxorubicinol in Parrot Plasma. J. chromatogr. B Analyt. Technol. Biomed. Life sci. 826 (1-2), 273-276 (2005).
- Liu, Z. S., Li, Y. M., Jiang, S. X., Chen, L. R. Direct Injection Analysis of Mitomycin C in Biological Fluids by Multidemension High Performance Liquid Chromatography with a Micellar Mobile Phase. J. Liq. Chromatogr. Relat. Technol. 19 (8), 1255-1265 (1996).
- Zhou, Y., He, C., Chen, K., Ni, J., Cai, Y., Guo, X., Wu, X. Y. A New Method for Evaluating Actual Drug Release Kinetics of Nanoparticles inside Dialysis Devices Via Numerical Deconvolution. J. Control. Release. 243, 11-20 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved