Method Article
郭清ときのこ体の免疫蛍光染色と大人のショウジョウバエ脳光受容器ニューロン
要約
このプロトコルは、郭清と大人のショウジョウバエの染色について説明します脳の組織。具体的には、このプロトコルでは、神経の開発の多くの側面の基礎となる原則を明らかに正確に使用することができます例の神経細胞サブセットとしてショウジョウバエのきのこ体と光受容ニューロンの使用を強調表示します。
要約
神経系の開発には、いくつかのシグナル伝達経路と制御ネットワークによって調整されますイベントの一連が含まれます。これらの経路に関与するタンパク質の多くは哺乳類とミバエショウジョウバエ、似たような組織化原理がこれらの開発中に存在することを示唆しているように、他の真核生物の間保存されました。生物。重要なは、ショウジョウバエは、神経新生、分化、軸索誘導、シナプス形成を含む哺乳類に必要なプロセスを制御する細胞・分子メカニズムを識別するために広く使用されています。ハエは、様々 な人間の神経疾患をモデルに正常に使用されているも。ここで順を追ってレーザーマイクロダイ セクション、固定、および大人のショウジョウバエ脳内のタンパク質の蛍光ローカリゼーションのプロトコルについて述べる。このプロトコルでは、2 例の神経集団、きのこ体神経および網膜光受容体に焦点を当てし、抑制型セル マーカー (MARCM) を用いたモザイク解析を使用して個々 のきのこ体ニューロンをトレースするオプションの手順が含まれています。野生型と変異型の両方の脳からサンプル データが軸索ガイダンス欠陥の採点基準の簡単な説明と共に表示されます。このプロトコルは、きのこ体光受容器ニューロン、他のショウジョウバエの脳と他の頭脳領域内の蛋白質の局在化の形態を調査するため 2 つの確立された抗体を強調表示することができます。このプロトコルを使用して調査しました。
概要
ショウジョウバエ神経系は人間および齧歯動物のそれより小さいが、その複雑さは、脊椎動物の対応を理解するための強力な親しみやすいモデルを提供します。多くのケースでは、ハエと脊椎動物のゲノムは神経系発達のメカニズムを定める非常によく似たタンパク質をエンコードします。実際には、遺伝子の多くは脊椎動物の神経の開発のため含め、ハエのオルソログ遺伝子関与しているシグナル伝達経路の制御パターン、ニューロン新生、軸索ガイダンス1,2,3、必要な ,4,5。たとえば、ネトリン哺乳類とキイロショウジョウバエ6,7,8の軸索ガイダンスに必要なリガンドであり。ネトリンだった鶏胚脳組織6から分離されたが、その後の研究によって、そのネトリンショウジョウバエ8胚中枢神経系 (CNS) の開発中に保存された役割を果たしているが明らかにしました。他の研究は、保存されたリガンドと受容体のショウジョウバエと脊椎動物の両方9の経路探索に必要な識別するために萌芽期のショウジョウバエ中枢神経系における遺伝子スクリーニングを使用しています。
中枢神経系胚のフライは過去にリガンド、受容体と軸索ガイダンス8,9に必要な細胞内シグナル伝達タンパク質を識別するために広く使用されています、一方の最近の作品の多くで方法を調査します。これらの蛋白質はまた開発の後の段階の間に経路決定を制御します。具体的には、そのコントロールの草分け、シナプス形成、軸索プルーニングおよび神経の他のいくつかの側面きのこ体 (MB) および網膜光受容ニューロンの開発 (図 1) の調査は、メカニズムに洞察力を提供して開発10、11,12,13,14,15,16,17。光受容器ニューロンは、ラミナと呼ばれる大人の脳の領域に飛ぶ網膜を接続し、延髄と脳 (18,19によって再検討されました)、きのこ体神経細胞中に視覚情報を中継するための重大である、一元的にハエの脳に位置し、学習と記憶の20,21に必要な。ケニヨン細胞と呼ばれるきのこの体の本質的なニューロンと光受容器ニューロン シナプス ターゲットを見つけるに進化上保存された拡散性と接触依存性軸索ガイダンス機構を利用します。成虫の表示だけでなく、感光体と MB ニューロンも直接で視覚化すること幼虫と蛹抗体やレポーター遺伝子22,23,24,25。ニューロン発達の異なる時点でのこれらの 2 つのセットを簡単に視覚化する能力は、神経の開発の多くの側面の見事なモデルとしての使用を推進しています。
通常の神経系発達のメカニズムを理解するためのモデルとして使用されているだけでなく最近の研究を示しているハエがさまざまな壊れやすい X シンドローム (FXS)26 を含む人間の病気の正確なモデルとしても利用できます。、知的障害者 (ID)27,28,29,30,31, その他32。たとえば、ZC3H14 の分子機能を勉強する最近人間の知的障害にリンクされて遺伝子我々 モデルを作成飛ぶ Nab230と呼ばれるフライ ZC3H14 相同のヌル対立遺伝子を使用して ID の。ハエ Nab2 を欠けている重度の記憶障害があると人間の患者で観察されるものの概説ポリ a の尾を拡張、または患者由来細胞ライン33,34。重要なは、Nab2 にまた欠けているハエは、その大人のきのこ体34, FMR135FXS 症候群遺伝子に欠けているハエで観察されるものと同様で重篤な脳形態の欠陥を表示します。したがって、ハエは、通常の脳の発達やそれを混乱させる疾患を研究する重要なモデル有機体として使用できます。
最後に、利用可能な遺伝的ツールの広大な配列と組み合わせて、動作を監視する高スループット メソッドのアクセシビリティをショウジョウバエなど複雑な行動を制御する脳の領域を識別するための選択のモデル生物学習、記憶、睡眠、求愛、口渇等36,37,38,39。ハエの遺伝学者の「ツールボックス」の中心には特に役に立つツールの 1 つは、GAL4/UA システム (図 2) です。このシステム40,41は、遺伝子または遺伝子下流の上流活性化シーケンス (UAS) の発現を増強するのに Gal4 転写活性化因子の組織特異的発現を使用します。このシステムの変更は、たとえば、正確に特定のニューロン42,43、過剰または関心44,の特定の遺伝子をノックダウンの興奮性を制御する研究者を許可している45、リアルタイムのカルシウム動態体内46を分析し、神経系統41をマークするレポーター遺伝子を表現。分裂の再結合が抑制型セル マーカー (MARCM) システム12,47モザイク解析の作成も許可と GAL4/UAS システムの組み合わせ。MARCM は、単一ニューロン トレースで軸索ガイダンス12,47に必要な細胞のシグナリングのコンポーネントを識別するために広く使用されています。これらおよび他の技術は、神経系の働きに必要な細胞メカニズムに関する貴重な洞察力の数を提供している、ほとんどが必要; 最初ショウジョウバエ脳の解剖脳を慎重に除去が頭脳の地域間の正しい脳形態と接続パターンを保持する必要です。次のプロトコルを使用して、きのこ体と光受容ニューロン例として神経集団に従って郭清と免疫蛍光染色大人のショウジョウバエ脳します。
プロトコル
1 ショウジョウバエ 遺伝学および省略可能な熱衝撃手順
。- 一度ハエが交差しているし、F1 子孫孵化した女性および/または適切な遺伝子型の男性入手します。検討されている脳の領域、によってハエが毎日収集する必要があり、セックス区切られた頭脳の結合性の年齢依存性および/または性的に二形のパターンをより簡単に識別できるようにします
。 注: オプション: ハエは抑制型セル マーカー (MARCM) 分析 12 , 47 胚、幼虫、モザイクの分析のために使用されているかどうか、または蛹はショックに 30-45 分の 37 ° C で熱をする必要があります分裂の再結合を誘発します。MARCM 分析のきのこ体の特定の領域を対象にするため熱衝撃は 12 によって決定され、 図 5 B に記載されているスケジュールに従ってタイムアウトする必要があります。きのこ体以外の脳部位を調査する MARCM を使用している場合、パイロット実験は熱ショックに最適なステージを決定する実行必要があります。に関して以下の手順が書かれています、このハエ蛹のケースを取り外した後にこれらの手順を使用して、昆虫の大人を解剖できます 。
2。郭清駅準備
- 顕微鏡と光のソース位置添付大型ベンチトップのファイバー光グースネック。着実な手の動きを促進し、手を減らす " を振る "、解剖しながら顕微鏡周辺の適切な手と腕の残り領域があることが重要です。顕微鏡と顕微鏡のベースとベンチの端の 4-6 インチどちら側約 8-10 インチがあることを確認します 。 ガラスの
- 塗りつぶし 2 または 3 井戸 1.0 mL の PTN バッファー 9 井戸や 3 も皿 (0.1 M リン酸ナトリウム緩衝 pH 7.2, 0.1% 非イオン性界面活性剤は、完全なバッファー コンポーネントの材料表を参照) 氷の上解離性の駅に隣接して配置。新しく解剖脳をこの皿に転送して固定ステップまで格納します。
- 注: 郭清バッファーがリン酸緩衝生理食塩水 (PBS) または HL3 バッファー 48 x 1 をする必要がありますライブ イメージングが必要な場合。細胞内蛋白質のローカリゼーションが必要な場合、PBS は、解離と固定のため、代替バッファーとして使用できます。次の固定、細胞膜の透過し対象となる 0.1% または 0.3% 非イオン性洗剤を含む PTN 洗浄を使用しています 。
- 解剖および固定のため PBS を使用すると場合、ピペット チップが脳がマイクロ遠心チューブ用に転送中にプラスチック製のピペット チップに付着するを防ぐために洗剤を含むバッファー (PTN) などですすぎ、少なくとも 1 回をする必要があります 。
- シリコーン ・ エラストマーを含む解剖皿空 35 ミリメートルのガラスまたはプラスチックのシャーレを使用して構築します。簡単に言えば、メーカーによるとエラストマーのコンポーネントをミックス ' s 方向 35 mm 皿に注ぎ、平らな面に一晩重合せて。郭清の料理を含むエラストマーの鉗子、鉗子とガラス皿などの硬い表面の間の接触が行われた場合に簡単に破損することができます罰金のヒントを保護するために使用してください。我々 はまた、定期的にオンライン小売業者から市販のシリコーン コーティング料理を購入します。解剖の時にコントラストを高める、不活化木炭 (およびこうして色ブラック) シリコーン エラストマー郭清料理が特に便利です 。
3。大人の脳解剖手順
- 麻酔 3 ~ 5 日古い大人 ショージョーバエ ・ CO 2 をまたは使用して氷します。氷を使用している場合バイアル ハエ アップサイド ・ ダウン (ダウン プラグ側) 氷にバイアルを逆さま配置 ~ 5 分の氷のバケツに防止場所ハエ食品の提出になるし。ハエが麻酔されて、一度は、氷やフライのパッドを発光 CO 2 冷たい金属パッドまたはペトリ皿座ってハエを配置します。神経変性を分析するための脳を解剖する場合古いハエも使用できます 。
- 転送ピペットや p200 ピペットを使用して作成する解剖皿の中央に PTN の少量 (150-200 μ L) の場所、" バブル " PTN の。実体顕微鏡下で解剖皿を配置し、照明を調整し、PTN のバブルは、ビューのフィールドを塗りつぶし、均一に照らされたように焦点を当てます 。
- ハエを操作しているという " 腹の上に " (すなわち、腹側を上) 金属または CO 2 パッドに横たわっている間 。
- #5 鉗子の使用 1 つのペアが切り裂かれ、フライを保持完全に水没、PTN の解剖皿の上にフライの腹部を把握します
。 注: プロトコルの残りは、すべて手順を実行 PTN で頭が水没中です 。
- #5 鉗子の 2 番目のペアを使用すると、ハエの口吻の基部を持ち、離れて体からハエの頭をデタッチする鉗子の 2 つのペアを引き出します。腹部と胸部を破棄します。このステップの間に、ない、頭では解放され、PTN の表面に浮くことが重要です。頭がフローティング、一度脳を粉砕することがなく再度把握する非常に困難なことです
。 注: このメソッドを使用して、脳と腹側神経索との間の接続が切断されました。中枢神経系のこれらの地域間のままの接続が必要な場合は、 49 , 50, などの代替解剖プロトコルに従ってください。頭を削除する前にフライの頭から切り離すと、テング、テングがあった穴になります。この場合、1 つ目の近くの穴の端に飛ぶ頭を把握します。互いに離れて鉗子の 2 つのペアを引きながら力の適度な量を使用して頭を削除します。時折、頭を本体から削除すると、腸や腹側神経コードのまま頭部への取り付けし、郭清を続行する前に削除する必要があります 。
- 鉗子の 1 つのペアは、テングを把握しながら、2 番目のペアは飛ぶ右目の内側の端を把握する必要があります。ゆっくりと、互いに離れて鉗子を引き出します。定常横力の少量でこの手順を実行する必要があります。鉗子は互いから離れてゆっくり移動、テングが頭を引き離す、頭キューティクルで中央の穴を作成します。鉗子の最初のペアの 2 番目のペアから右目の内側の部分を解放せず、テングを破棄します
。 注: 大人 ショージョーバエ ・ 脳は、尾で飛ぶ頭の領域 (すなわち 後方/リア)。したがって、頭の地域の把握は避けてください。理想的には、のみ、吻側 (すなわち 前面) 鉗子によって内側の網膜に近い頭の部分を直接把握する必要があります。脳と関連付けられた気管はキューティクルの中央の穴を通して見えるはずです。穴から突き出ている気管の白い糸スレッドの削除、破棄、現時点で 。
- 鉗子の 2 番目のペア (頭のキューティクルの中央の穴の端に) 左の網膜の内側の端を把握します。網膜と関連付けられたキューティクルを削除するには、180 ° の角度で互いに離れて鉗子をゆっくりと引き出します。網膜は、基になる視葉から切り離されますと緊張のわずかな減少を感じるはずです。視葉のテアリングを防ぐためにゆっくり進みます
。 注: この手順の間に余りにすぐに鉗子を分離する回の断裂可能性があります。e 視葉またはきのこ体構造の中断。時折、キューティクルが削除されますが、網膜の視葉に接続されたままになります。イメージングはきのこ体場合、完全に網膜全体を削除する必要はありません。しかし、(光脳葉の網膜ニューロンの神経支配) など他の脳領域の解析は、 48 , 51 のとおり削除する網膜を必要があります
。 注: 網膜は脳の基になる視葉からゆっくりと分かれて、視葉はず観測白、糸の気管で覆われている不透明な白い構造として。1 つの網膜が削除されると、破棄できます。網膜ニューロンの経路を分析する際は、視葉に損傷を防ぐためこのステップの間に特定の注意にすべき。郭清に焦点を当てた追加議定書と生体イメージングによる光受容器ニューロンはまた利用できる 48 。
- 今、慎重にできるだけ目に見える気管の限りを削除します。気管が既に含まれているまたは後フロートし、潜在的に、後の染色手順中に失われる脳を引き起こし、空気でいっぱい。気管を削除する非常に鋭いペア #5 鉗子を使用して脳に狙い撃ちします 。
- は、左フライ網膜の内側の領域を把握する鉗子の両方のペアを使用して、残りの網膜と周囲のキューティクルを削除します。慎重に半分網膜とキューティクルの部分を削除するために網膜を引き裂きます。いくつかのケースで、特に挑戦的な証明する脳を粉砕することがなく残りのキューティクルを削除します。これらのケースで我々 は、腹側神経索の残りの鎖代わりに把握できる 1 組の鉗子で鉗子の他のペアを使用して慎重にキューティクルの最後を削除しながら発見した 。
- PTN を含む 9-3 も料理の 1 つに切り裂かれた脳 p200 ピペットを使用して移動します。同じ遺伝子型の脳は、一緒に同じにもプールし、氷で保たれる必要があります。脳組織は、解離の 1 時間以内固定する必要があります。脳を小ロットで修正し、脳の大きい数が必要な場合をプールできます。ほとんどの状況で経験豊富な研究員が通常脳の解剖し、約 3-5 分のガラス コレクションの皿にそれを転送
4。固定・蛍光汚損プロシージャ
- 0.5 ml PTN で希釈した 4% パラホルムアルデヒドの 0.5 mL 遠心チューブに 9 も皿から切り裂かれた脳を転送 p200 ピペットを使用して、します。同じ遺伝子の少なくとも 10-15 脳は 1 つの遠心チューブに結合できます。0.5 ml の遠心管に (スライド上に脳のマウント) までのすべての残りの手順を完了している
。 注意: パラホルムアルデヒド (PFA) は、ヒューム フードで処理する必要があります。PFA の廃棄物は、保存され、適切に処分する必要があります。ガラス アンプルで購入 20% パラホルムアルデヒドがマイクロ遠心チューブ用に避けようと必要になるまでの-20 ° C で保存されますにすることができます 。
- ヒューム フード内室温で揺動速度が遅いと 20 分 4% パラホルムアルデヒドで脳をインキュベートします 。
- 以下の固定、重力によって遠心管の底に沈殿する脳を許可します
。 注: 時折、脳は、遠心管の側にスティック可能性があります。この場合、人差し指と親指の間チューブを横方向に回転させて、脳の沈降を促進するためにベンチにチューブに非常に軽く通常便利です 。
- 、P1000 を使用して削除固定ピペットし、2 つを実行 " クイック " 洗浄の間遠心管の底に沈殿する脳を許可する PTN の 500 μ L で洗います。これらの迅速な洗浄中に一度すべての脳を遠心管の底に重力によって解決が、PTN すぐに交換できる新鮮なバッファー;追加の洗浄時間は必要ありません
。 注: 通常、脳除去を危険にさらすことが望ましい管に余分なバッファーを残したままです。ピペット チップの精査はしばしばチューブから誤って削除された脳がないことを確認する必要があります。脳は、先端に戻誤っている、遠心チューブにそれらを分配、脳、解決を待って、残っている任意の余分な PTN の取り外し進みます 。
- 最後のクイック洗浄後 3 つを実行する p1000 ピペットを使用して、" 長い " を洗う: 常温ロッカー/nutator を 500 μ L の PTN と 20 分間洗浄を追加。将来のすべて " 長い " 20 分洗浄する必要があります
。 注: 次のこれらの洗浄は、脳を固定で保存されるかもしれない一晩 PTN で 4 ° C. - P1000 ピペットを使用して最後の洗いを外し、ロッカーまたは室温室温で少なくとも 30 分のためのソリューション [PTN + 5% ヤギ血清 (NGS)] ブロックの 0.5 mL で nutator で脳をインキュベートします。
- ヤギ二次抗体は、後続のプロトコルの手順で使用されます。ブロックと抗体のソリューションでよりその種 (NGS) 正常な血清を使用する必要があります別の種からの二次抗体を使用する場合 。
- P1000 ピペットを使用して、ブロッキング液を削除し、PTN (PTN + 5 %ngs + 希釈した一次抗体) で希釈した一次抗体を追加。初めての一次抗体を使用する場合その抗体の希釈、経験的に決定する必要があります
。 注: きのこ体神経を可視化、Fas2 を認識する抗体は通常使用されます。これらの抗体は抗体 1 4 は発達研究ハイブリドーマ銀行 (DSHB) から利用できるし、希釈 1:20 PTN + 5% であるべき NGS
。 注: 光受容器ニューロンを可視化、chaoptin を認識する抗体は通常使用されます。Chaoptin 抗体は抗体 24B10 として DSHB から利用でき、希釈 1:20 PTN + 5% であるべき NGS
。 注: 固定プロセスは通常蛍光緑色蛍光タンパク質 (GFP) などの蛍光タンパク質を排除します。したがって、個々 の MB のニューロンの軸索ガイダンスを分析する MARCM を使用する場合は、GFP を認識する抗体を使用します 。
- ロッカー/nutator の一次抗体溶液中の脳をインキュベート 2 3 4 夜 ° C
- 次の一次抗体の孵化、遠心管の底に沈殿し、一次抗体のソリューションを削除する脳を許可します 。
- 2 p1000 ピペットを使用して実行 " クイック " の洗浄および 3 " 長 " 各ワシントン間遠心管の底に重力によって解決する脳できるように慎重に 20 分は、上記の手順 4.4 と 4.5 の PTN の 0.5 mL で洗浄、
- 適切な蛍光標識二次抗体と室温で 3 時間加温脳。二次抗体は通常 PTN + 5% の 0.5 mL で希釈されて濃度 1: 200 で NGS
。 注意: 蛍光二次抗体を追加すると、脳保管すべき実験の残りの暗闇の中です
。 注: 場合残留の GFP 蛍光遺跡、GFP として同様の励起/蛍光波長を持つ蛍光ラベルの付いた二次抗体を使用することをお勧め MARCM 分析を実行するときに (例えば、フルオレセイン isothyocyanate (FITC) またはAlexa488). - 脳遠心管の底に沈殿し、二次抗体の解決を削除するを許可する次の二次抗体の孵化します 。
- 実行 2 " クイック " の洗浄および 3 " 長 " 各ワシントン間遠心管の底に沈殿する脳できるように慎重に 20 分は、上記の手順 4.4 と 4.5 の PTN の 0.5 mL で洗浄、
- 第三次 " 長い " 20 分の洗浄、使用可能な限り多くのバッファーを削除する p200 ピペット 。
- 蛍光耐フェードの追加 75 μ L 脳にメディアをマウントします。ピペット脳とミックス一度ピペット チップにメディアをマウントします。脳はキャップや遠心チューブの側面に残ることがありますので、チューブを反転されません
。 注: 以下のメディアをマウントでの頭脳の懸濁液、チューブ蛍光消光を遅くアルミ箔に包まれてであろう一晩 4 ° C で保存します。かどうか、必要に応じて脳 4 ° C で数日間保存することができますが、理想的にできるだけ早くスライドに装着する必要があります 。
5。マウント スライドを顕微鏡とイメージングにアダルト ショージョーバエ ・ 脳
- ビルド、" ブリッジ " スライド。2 つの位置 " 基本 " 正荷電スライド coverslips 約 1 cm。スライドの正荷電の側を向いていることを確認します。 図 3 A に示すように、指の爪マニキュアを使用してスライドに coverslips を付着します。これら基本カバー スリップの下でない芯がメディアをマウントできるように爪のポーランド語の各基本カバー スリップの 3 つの外側のエッジをシールする通常便利です。完全に乾燥指の爪マニキュアを聞かせて (10-15 分) 続行する前にします 。
- は、顕微鏡の下でスライドを配置し、間隔を 2 つ coverslips に切り裂かれた脳を含むマウント メディア ソリューションをピペットします。多くのコントラストを提供するためにベンチの上で平行になるので、グースネック ライトを操縦すると便利です 。
- スライドの外脳をピペットに触らない、ピペットを使用してスライドから余分なメディアをマウント削除します 。
- 芯離れて余分なマウント メディア。これは次の手順でより正確に配置される頭脳になります 。
- 鉗子と、実体顕微鏡のペアを使用して位置を間違いなく直面している触角葉とグリッド パターンのスライドの脳
- カバー スリップを配置 (、" ブリッジ ") 頭脳 ( 図 3 A) より。彼らはどこに連絡ブリッジ カバー スリップの側面をシールする指の爪マニキュアを使用、" 基本 " カバー スリップ 。
- 新鮮なマウント メディア ( 図 3 B) と橋の下で中心空洞を入力 p200 ピペットを使用するゆっくりと。センター カバーガラスの端がオープンの時に一滴を置き、センター ブリッジ coverslip の下で放出するメディアをマウントできるようにします。いっぱいは全体の空洞が、メディアのマウントを続行し、上部をシールし、明確な指の爪のポーランド語の下です 。
- 指の爪マニキュアが乾燥していたら、すぐにスライドを画像または-20 の遮光のタイトなスライド ボックスに格納 ° C
- 1 週間以内励起レーザーを用いたレーザー走査型共焦点顕微鏡を用いた脳画像し、選択した蛍光二次抗体に適切なキューブにフィルターを適用します。きのこ体ニューロンの Z スタック画像は通常、20 X、40 X 目標を使用して取得します。網膜の光受容器ニューロンのイメージングは、高倍率を必要があります 。
結果
上記の方法は、大人のショウジョウバエの脳のあらゆる領域の信頼性と再現性のある可視化できます。ここできのこ体と光受容器ニューロンに注力しますが、休眠52、時計ニューロン53,54, などの脳領域を視覚化するための同様のメソッドを使用している他の研究と触角葉投射ニューロン55、多くの他の中で。重要なは、MARCM12,47などの技術を使用してこれらの構造の内で個々 のニューロンと同様、両方の全体の脳の構造を視覚化するこの手法を使用できます。図 4図 5図 6は、この郭清術、免疫染色手法を使用して生成することができます大人の脳のきのこ体と光受容器ニューロンからいくつかの異なる種類のデータを表示します。
まず、直接ファシクリン 2 (Fas2) を認識する抗体またはきのこ体神経34で表されるレポーター遺伝子のいずれかを使用してきのこ体形態を視覚化する上記の方法を使用できます。(程度) を図 4は図 4 bα, β を視覚化する抗体を使用ことができます Fas2 に示すように大人のきのこ体の γ 葉ショウジョウバエ脳を。Fas2 は細胞接着蛋白質ニューロン最大に必要なし、α と β の葉23,56,57、高いレベルで表現されることがこれらのキノコの行き届いた信頼できるマーカー体ニューロン。特に、成人の脳の中央部に位置する円形状の楕円体も視覚化できます (図 4A) この抗体を用いたします。
軸索誘導蛋白質の欠陥はしばしば不完全浸透きのこ体突然変異表現型15,34,35を引き起こします。したがって、ほとんどの状況でいくつかのダース脳撮像、解析。たとえば、Nab2 null ハエのきのこ体 β 葉軸索は不適切な脳の正中線を越えます。この「クロス オーバー」または β 葉「融合」の表現型は通常観察 Nab2 null ハエしますが、主に野生型コントロールから欠席し、分類することができます大人の約 80% で、わずかな、中程度、または融合34を完了します。反対側の脳半球に軸索の不適切な対側投影から正中線を越えて β 葉の「融合」の結果します。図 4Cとの詳細な34,35に示すようにわずかな融合は、適度な融合より実質的に接続されている β 葉中「Fas2 肯定的な繊維の薄い鎖」で接続されている β 葉正中線でわずかに減らされた葉の厚さを示します。完全な (または「極端な」) の融合は、完全に接続されており、葉の厚さや Fas2 が正中線で染色の減少を示さない β 葉を指します。きのこ体 β 葉融合の程度を定量化し、 34,35または形態不良の各種類を示す脳の割合を示す表として示すように表示することができます。
MARCM テクニック12,47,48は Fas2 抗体を用いた染色に加えて、きのこ体組織内の個々 の GFP+ニューロンの軸索ガイダンス決定を視覚化するも使用できます。MARCM は、個々 のニューロンまたは GFP (図 5A) でマークされたニューロンのクローンに関連するグループを作成する開発中の分裂の再結合を利用しています。MARCM は、完全にそれ以外のヘテロ フライ内タンパク質を欠いているニューロンの数が少ないを生成する方法を提供します。など、このテクニックは全体的に個体の生存率12,47にも欠かせないタンパク質の軸索ガイダンス機能の分析に特に便利されています。野生型の遺伝的背景に GFP が付いてニューロンを制御する GFP 付けホモ null ニューロンを直接比較できます。さらに、発展途上の幼虫や蛹が熱ショックによる、に応じてきのこ体神経をすることができますさまざまなクラス対象 (図 5B)。
図 5C、例として野生型 (すなわちコントロール) MARCM のクローンを生成する場所にこの技術を使用して生成されるデータの種類の例を示します。図 5CF1 の開発に個々 の GFP+きのこ体ニューロンを生成するには、幼虫は、25 ° C で収容された当初幼虫孵化後約 5-6 日 (ALH) 蛹だった熱 37 ° C で 30 分間に衝撃を与えた、羽化までの 25 ° C に戻ります。いた脳大人孵化後 PTN の解剖、修正、および同時に Fas2 を認識する抗体とインキュベート (1 4 希釈 1:20 PTN で) および GFP (PTN で希釈 1: 500)。脳、二次抗体とインキュベートされ前述のスライドに取付けた。GFP+セルが識別されたレーザ走査共焦点顕微鏡を用いたイメージングし、最大強度突起は、ImageJ を使用して作成されました。図 5Cコントロール GFP+に示すよう α と β の葉で生成されたニューロンは Fas2 と colocalize、2 つのショウジョウバエの脳の半球を分ける正中線を連絡する前に終了します。単一の軸索のプロジェクトは前方、分割と両方にフォーム、α と β の葉の背側、内側をプロジェクトします。いくつかの以前の研究は、自律的拡張、草分け、分岐、または剪定10を含む、axonogenesis の多くの側面の細胞分裂を勉強するのにために必要なある特定の蛋白質かどうかを調査するのにこの手法を使用しています。 11,12,13,14,15,16,17,34。
きのこ体に加えて網膜光受容器ニューロン (R-細胞) の軸索経路決定することができますもを使用して視覚化 (および郭清法 de 上の郭清方法参照48scribed)。ハエ目内の各のシャコが含まれます (図 1) の 3 つのグループに分類することができます 8 の光受容器ニューロンには: R1 R6 の細胞は、脳の視葉; の表面板に軸索のプロジェクトR7 のセルは、髄質; の深層に M6 に軸索をプロジェクトR8 のセルは、髄質19,58の中間の M3 層へ軸索をプロジェクトします。視細胞の各クラスの投影パターンは広く研究されているし、一緒にこれらの神経細胞が正常に使用されてモデルとして軸索ガイダンス19,59に関与するシグナル伝達経路を理解します。重要なは、蛹、大人の免疫染色によって簡単にすべての光受容体の軸索切り裂かれたショウジョウバエ脳で視覚化することまたは chaoptin を認識する抗体を用いた幼虫組織、細胞表面糖タンパク質24,60,61。 GFP または各 R セル型 (R1 R6、R7、R8 細胞) で β-ガラクトシダーゼ レポーター遺伝子が構築されも、視細胞62の各クラスの視覚化に使用することができます。以来、発展途上の視葉の別のレイヤーで R セルの各タイプが終了すると、各セル正しくターゲットを見つけるために必要なシグナル伝達経路の詳細な比較のためこれらのレポーターが許可されています。プロデュース chaoptin ローカリゼーション (これはすべての光受容器ニューロンのマーカーとして使用可能) との組み合わせでこれらのレポーターの遺伝子の 2 つの表現パターンの例を図 6に示します。R7 視細胞を可視化、R7 固有Rhodopsin4 LacZレポーター遺伝子を含んでいる頭脳は解剖され chaoptin と β-ガラクトシダーゼ抗体で染色します。ロドプシン 4R7 細胞63のサブセットの具体的表現 (Rh4)Rh4プロモーターは、したがって、これらのセルだけにレポーター遺伝子発現をドライブに使用できます。予想通り、R7 セル終了 (黄色点線図 6で示されます) 髄質の深層に M6 のです。同様に、脳の β-ガラクトシダーゼ R8 光受容体63で具体的に表現される、解剖されたロドプシン 6 (Rh6) プロモーターからと chaoptin を認識する抗体を用いた immunostained を表現してΒ-ガラクトシダーゼ。図 6に示すように、R8 視細胞の R3 レイヤーで終了、髄質。ここに示されていませんが、 Rh1 LacZは、ラミナの R1 R6 視細胞の終了を視覚化する使用もできます。
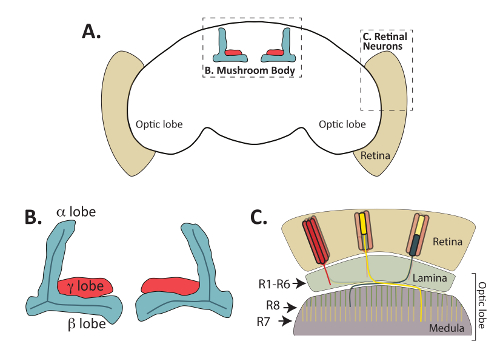
図 1:大人ショウジョウバエ脳が機能的に異なるが、相互接続された領域で構成されています。中心部にあるきのこ体と周辺網膜光受容器ニューロンを強調し大人のキイロショウジョウバエの概要 (A) 脳が表示されます。(B) Fas2 抗体によって認識される (葉とも呼ばれます) の大人のきのこ体軸索束の拡大図。ケニヨン細胞と呼ばれるきのこ体固有のニューロン背側に位置する細胞体 (細胞体がこの図から省略) から前方の軸索のプロジェクトと異なる葉構造を形成します。大人の脳では、軸索の単一の内側のバンドルから γ 葉 (赤で示されている) フォーム背 α と単一軸索から内側 β 葉 (青色で表示) のフォームながら、その経路探索プロセス中を分割します。Α '/β' ニューロン開発軸索の葉を部分的に α/β ニューロンのそれらと重複する Fas2 抗体によって認識されない、この図から省略されます。(C) 網膜の神経細胞は、視葉に網膜からの視覚情報を中継で重要です。板や髄質におけるシナプス標的細胞と網膜 (ベージュ) とフォーム接続に位置する細胞体から軸索のプロジェクト。R1 R6 光受容細胞 (赤色で表示) フォーム特定接続光葉の外側の層で細胞とでは、板と呼ばれます。R7 光受容細胞、髄質の M6 層のターゲットを持つ (黄色) シナプスの (緑色で表示) R8 細胞プロジェクト髄質のわずかにより表層の M3 に軸索中。マクミラン出版業者株式会社からの許可によって適応 C パート: 性質の神経科学 (64を参照、著作権 (2011))。この図の拡大版を表示するのにはここをクリックしてください。
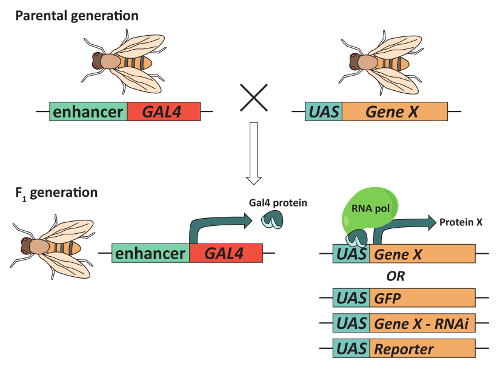
図 2:ターゲット遺伝子発現、GAL4/UAS システムを使用できます。組織の特定のパターンに興味 (「遺伝子 X」) 遺伝子を表現するハエを得るためには、ハエはティッシュ特定エンハンサーの制御の下で Gal4 転写活性化因子蛋白を発現する遺伝子と Gal4 DNA を含む遺伝子両方を含める必要があります。(上流活性化シーケンスまたは UAS と呼ばれる) シーケンスを結合遺伝子 X. 通常に隣接し、この組み合わせはそれぞれが 1 つの遺伝子を含む親のハエの交尾と両方を含む F1子孫の選択によって達成されます。結果 F1世代 Gal4 を表現してティッシュ特定の方法で X 遺伝子の転写を活性化する UAS にバインドされます。重要なは、別の UA を含む遺伝子は同じGAL4 「ドライバー」との組み合わせで使用できます。たとえば、記者を生成する UA 遺伝子や RNA 干渉を用いた遺伝子の発現をノックダウン transgene エクスプレス GFP 遺伝子の UAS を含む、きのこ体 (MBs) で Gal4 を発現する遺伝子を結合できます。この図の拡大版を表示するのにはここをクリックしてください。
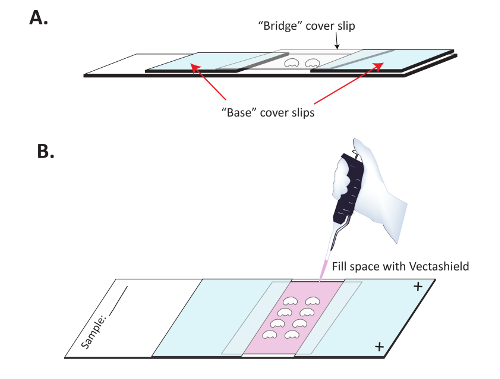
図 3:蛍光イメージングのための準備で脳をマウントします。(A) 脳は脳の平坦化を防ぐためにブリッジ カバー付け SuperFrost プラス スライドに搭載されています。明確な指の爪のポーランド語での Superfrost プラス荷電のスライドに 2 つの「基本」カバー スリップが守られているとそれらの間のスライドに切り裂かれた脳が置かれます。明確な「ブリッジ」カバー スリップは脳の上に配置、基本カバー スリップに付着します。(B) 一度、指の爪マニキュアは乾燥している、Vectashield はゆっくりと二次抗体の蛍光性を維持するために橋の下戻します。明確な指の爪マニキュアは、「ブリッジ」カバー スリップの上下をシールに使用されます。この図の拡大版を表示するのにはここをクリックしてください。
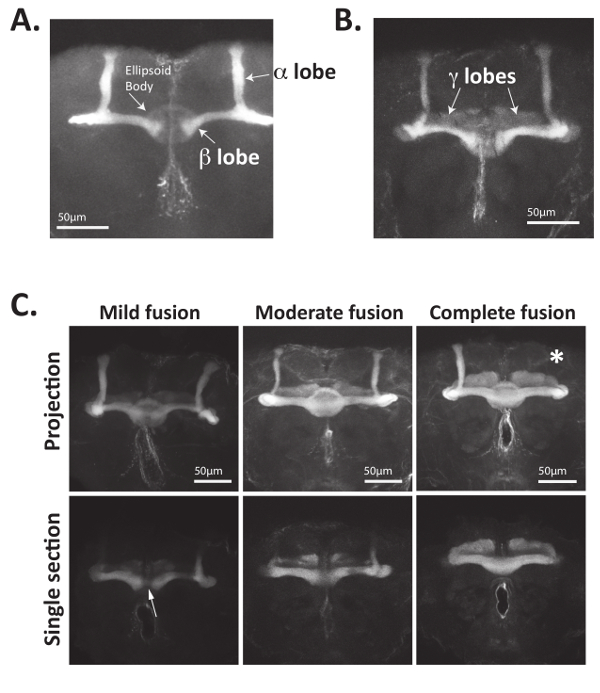
図 4:きのこ体神経軸索は Fas2 を認識する抗体を使用して明確に視覚化できます。(A) 大人のショウジョウバエ脳解剖、固定、そして Fas2 を認識する抗体とインキュベートします。Alexa488 結合ヤギ抗マウス二次抗体を使用して一次抗体も認められ、脳の正荷電のスライド マウントし走査型レーザー共焦点顕微鏡を使ってイメージ化します。Bisymmetrically はあるきのこ体細胞体前方軸索を拡張、分岐、および軸索束 (葉とも呼ばれる) を形成します。Α 葉の背側投影および β 耳たぶの内側に投影を形成する軸索エクスプレス Fas2.批判的に、野生型のハエの β 葉は脳の正中線前に終了します。1 4 を使用して、位置の回転楕円体を視覚化できる抗体。大人のショウジョウバエのきのこ体の内側に投影 (B) γ 葉軸索も Fas2 を表現し、1 の 4 を使用して視覚化することができます抗体。通常、γ 葉軸索における Fas2 の発現は、α と β の葉よりも短いです。Nab2 null 脳の (C) きのこ体軸索 (遺伝子型: Nab2ex3/Nab2ex3) ミス髓プロジェクトし、しばしば葉を欠いています。Nab2 null 脳された解剖、修正、および 1 の 4 で染色抗体きのこ体の α、β、γ の葉を視覚化します。Z スタックの最大強度突起正中領域に焦点を当てただけでなく、個々 の光学セクションが表示されます。野生型のきのこ体 β 葉軸索はほとんど脳の正中線をクロス、Nab2 null 脳は「融合」β 葉で対側の脳半球に正中線を越えて誤投影の様々 な量をあります。軽度の融合を指す参照34,35で定義されている < 正中線、適度な融合を交差軸索のだけいくつか「鎖」で β 葉と Fas2 肯定的な β 葉ニューロンが脳の正中線が β の葉をクロスの状況は、正中線で幅を狭くと、および完全な融合と状況は、葉は脳の正中線を横切るように β 葉厚低減がないです。以来、回転楕円体は、Fas2 の表現も正中線を示す光学セクションが多い β 葉融合の可視化に役立ちます。特に、不足している葉が (白のアスタリスクの付いたここで表されます) もよく観察されます。パーツ C のデータは参照34許可を得てからきのこ体の表現型の定量化であります。この図の拡大版を表示するのにはここをクリックしてください。
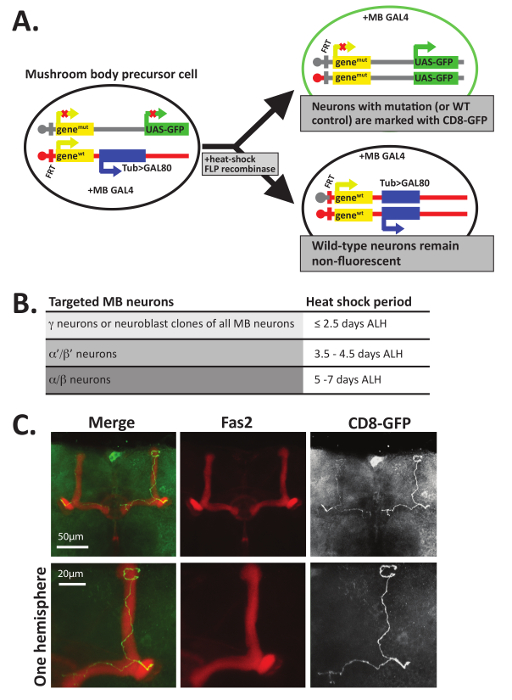
図 5: 単一ニューロンの軸索を視覚化するために MARCM を使用できます。(A) 2 つの娘細胞を作成する抑制型セル マーカー (MARCM) 使用 FLP リコンビナーゼを介した細胞分裂組換え FRT サイトでモザイク解析。この例では、すべてのセルには別の染色体上のきのこ体固有 GAL4 タンパク質が含まれています。次の細胞分裂時に分裂の再結合、1 つの娘細胞 (top) は GFP を表現 (または膜バインド CD8 GFP) と他の娘細胞 (下) 2 つの野生型 (WT) 対立遺伝子を継承しながら、興味の遺伝子の 2 つの突然変異体の対立遺伝子が含まれていますチューブリン プロモーターを用いた Gal80 タンパク質を表現する遺伝子。Gal80 は、Gal80 生産セル非蛍光性になります、ヘテロ接合体、ホモ接合体野生型である必要がありますので、Gal4 を抑制します。GFP+をされているセルだけ突然変異体の対立遺伝子の 2 つのコピーが含まれます。興味の遺伝子の 2 つの突然変異体の対立遺伝子を含む GFP+細胞を生成するためのいくつかのメソッドの 1 つだけが表示されることに注意してください。12,45,56他の例を参照してください。(B) 以来、きのこ体ニューロンの開発から始まる γ ニューロン、α'/β' ニューロンと α/β ニューロン、ニューロンの各クラスで終わる選択的にターゲットおよび視覚化できる異なる発達時点で衝撃的な辛さで。≤2.5 日後に幼虫の孵化 (ALH) を γ 標的; (L3 幼虫) の 3.5 から 4.5 日 ALH を発生するヒート ショック中のニューロンに発生する 37 ° C で 40 分のヒート ショック、α を対象12に従って、'/β' ニューロンとその o を衝撃熱5-7 日 ALH (蛹の発育) 中間 ccurs α/β ニューロン対象となります。(C) 個々 の野生型の軸索は、MARCM を使用して視覚化されました。野生型 5 〜 6 日間の古い蛹 (遺伝子型: hsFLP、UAS CD8 GFP。FRT82B、UAS CD8 GFP/FRT82B、浴槽 > Gal80;OK107-GAL4/+) 熱は分裂の再結合を誘発する 40 分の 37 ° C でショックを受けた。脳解剖、固定、そして GFP (1: 500) および Fas2 を認識する抗体で染色 (1:20)。脳が蛍光に分類された二次抗体とインキュベートし、共焦点顕微鏡による可視化します。このサンプル データは、「コントロール」の遺伝子型、肯定的な MARCM を使用して生成された細胞が野生型 GFP からと 2 つの遺伝子mutの対立遺伝子を含むの代わりに、2 つの遺伝子WT対立遺伝子を含まれてください。きのこ体 β 葉 (Fas2 を認識する抗体を用いて可視化する) を脳の正中線に到達する前に終了します。Α 葉ニューロンもあります。詳細を表示するには、単一の脳半球で拡大されるが、イメージの一番下の行に表示されます。C の部分は、参照34から許可を合わせられました。この図の拡大版を表示するのにはここをクリックしてください。
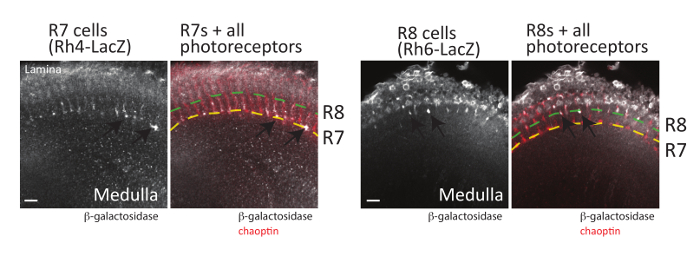
図 6: 視細胞軸索を視覚化もできます。大人脳 R7 光受容体 (左、 Rh4 LacZを使用して) または R8 の光受容体の発現する β-ガラクトシダーゼ (右、 Rh6 LacZを使用して) 解剖、修正、および β-ガラクトシダーゼまたは chaoptin を認識する抗体とインキュベートしました。脳が蛍光に分類された二次抗体とインキュベートし、共焦点レーザー顕微鏡で可視化しました。光学セクションの一つは、それぞれの脳から示しています。左側に、(黄色の点線で表示) 髄質の深層に M6 終了をいくつか R7 視細胞軸索 (矢印) に見ることができます。右側に、R8 視細胞軸索 (矢印) は (緑の点線で示す) 延髄の外側の M3 層で終了します。R7 視細胞エクスプレスか Rh3、Rh4、R8 の視細胞エクスプレス Rh5 または Rh663、単一LacZレポーター遺伝子を用いたすべての R7、R8 の視細胞を可視化ことはできません。スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
上記郭清と可視化の方法はさまざまな免疫染色で使用することができ、ライブ イメージング アプリケーション。我々 は一般的な免疫染色プロトコルの概要を示しているし、個々 のきのこ体ニューロンの軸索形態を視覚化するために MARCM を使用できます 1 つの方法を強調しています。さらに、これらの一般的な手順は固定で他の頭脳領域を画像にも使用できます。 または新たに切り裂かれた大人脳48,65。ライブ イメージングは、例えば模倣66、やレポーター遺伝子エンハンサー トラップの発現パターンを解析するときより効率的なアプローチにあります。防ぐために未固定組織で GFP のライブ イメージ投射の間の細胞死からの人工物をキャプチャするには、脳必要がありますリン酸緩衝生理食塩水 (PBS) または HL3 メディア48x 1 に解剖、PBS (または HL3) x 1 の橋のスライドのマウントし、未満 15 20 分ケアのイメージそれは GFP 蛍光の可視化と干渉できるので解剖脳イメージング前からできるだけ多くの気管を削除するも撮影する必要があります。
きのこ体と光受容ニューロンの形態を評価するための染色条件では比較的老舗24,61,67, これらの細胞への関心の特定の蛋白質の局在化種類は、広範なトラブルシューティングと最適化に必要があります。特に、抗体希釈、ブロック バッファー成分濃度、固定などいくつかの重要なステップは、最も再現性のある、信頼性の高い結果を生成する最適化必要があります。まず、一次抗体の最適濃度を決定する必要があります。市販抗体はしばしば推奨希釈を持って (とその濃度を使用して、まず、多くの場合最初)、これらの値はほとんど経験的に決定ショウジョウバエのティッシュの。したがって、テストは上と下の開始提案を多くの場合で、製造元の範囲がより特定の染色による一次抗体希釈液のシリーズ。一次抗体希釈精度を染色に大きな影響を持つことができ、的確に判断する必要があります時間の脳は一次抗体を含む培養しながらソリューションすることができます全体の結果にはほとんど影響によって大きく変動。たとえば、我々 は 4 ° C で 3 つ、または 4 日間、2 つの脳 Fas2 抗体一次抗体とインキュベート解剖と同様の結果を観察しています。少なくとも 2 泊をお勧めしますがまた一次抗体溶液中の脳を一晩インキュベートし、再現性のある染色を取得しました。脳組織へ二次抗体の制限非特異的結合が重要なは、脳に部屋の温度 (または 4 ° C で 1 泊) 3 h に二次抗体の孵化の時間の量を制限できます。
第二に、不要なバック グラウンド信号を除去するために追加「ブロッキング」試薬を使用する必要があります。オプションがあります 1-10% ウシ血清アルブミン (BSA) を追加するブロックやプライマリ/セカンダリ抗体ソリューションまたはショウジョウバエの胚 (を参照してください 4 ° C で一晩一次抗体の前吸着 〜 10% に NGS の濃度を増加させる68、セクション 2.9、および参照手順 3)。
深遠な違い、洗浄、抗体培養手順 (PLP と PEM、材料表に記載) など他のバッファーでティッシュの固定可能性があります一方、我々 はすべて固定用推奨バッファーとして PTN を使用して上記プロトコルを書かれている、信号の強さ。たとえば、以前の調査は示したサイクリン E は組織が、PBS で希釈した伝統的な 4% パラホルムアルデヒドで固定するとき、幼虫成虫ディスクで検出可能ですが、組織は PLP バッファー (ケン モーベリ、個人で修正されるときがはっきりと見える通信、および参照69)。バッファーの変更に加えて、コンポーネント、ティッシュの固定、蛍光にも大きく影響するため、温度、時間を変更することは染色および必要な場合経験的決定ことができます。一般に、固定時間細胞成分の十分な架橋を許可するのに十分な長さでありながら全体として細胞の形態の長期的な保守限定に架橋し蛋白質エピトープの「埋め」を防ぐために十分。ですから、当初新たに買収した一次抗体の染色条件を最適化するとき通常約 20 分固定時間制限より冷たい温度で組織を修正することはしばしば。
第一次および二次抗体の特異性だけでなく、観察された表現型の遺伝子/遺伝的背景の影響を調査するため, 蛍光抗体法実験のいくつかのコントロールが含まれます。具体的に使用されている一次抗体が興味の蛋白質を認識するかどうかを確認、このタンパク質やタンパク質を過剰発現組織に欠けているハエから組織をコントロールとして含まれている必要があります。一次抗体がハエの脳に他のエピトープを認識するかどうかを決定するため余分な精製抗原タンパク質添加を含めることもできます。最後に、任意の蛍光信号の一次抗体を省略すると、現在は選択した二次抗体による非特異的結合のレベルを表します。
遺伝的背景の貢献や染色強度または細胞の遺伝子の存在を評価するためにいくつかの重要なコントロールが含めます。たとえば、図 5の MARCM 実験で使用されるハエを含む複数の遺伝子 (hsFLP、UAS CD8 GFP、FRT82B、浴槽 >、GAL80 と OK107 GAL4)、きのこ体の形態に及ぼす影響を個別に分析します。ハエの非常に最低、きのこボディ形態で OK107 GAL4 と UAS CD8 GFP の両方を含むを分析する必要があります。ヒート ショックの影響を評価する必要があります、分析によってきのこ体における Flp リコンビナーゼ生産ハエ hsFLP と FRT82B の両方を含みます。MARCM は、特定のタンパク質が自律的軸索ガイダンスを制御するかどうかの重要な洞察を提供できますが、この結論を正確に行うために必要なコントロールの数は、この技法のマイナーな制限をすることができます。それほど複雑な実験では、類似のコントロールも適用されます。例えば、 GAL4/UASシステムがすべてのニューロンの興味の蛋白質のノックダウン式に RNAi 遺伝子との組み合わせで使用されている実験を取る。この実験では、少なくとも 2 つの遺伝子がある: elav-GAL4とUAS RNAi遺伝子などのパン神経 GAL4 ドライバー。ハエが同じ場で両方の遺伝子を抱く実験条件に加えて、単独でこれらの遺伝子の各を含むハエのきのこ体神経細胞の形態を調べる必要があります。
最後に、きのこ体神経に興味の蛋白質を表現するかどうか判断する必要がある通常共同染色脳に Fas2 抗体また、 GAL4/UASシステムを使用し、興味の蛋白質を認識する抗体と組み合わせて使用される蛍光タンパク質 GFP、RFP、または膜が CD8 GFP をバインドされているようを表すこともできます。Fas2 だけきのこ体の α と β の葉を形成した軸索が認識、GAL4 駆動、膜結合型 CD8 GFP の使用が以来きのこ体神経をマーキングする場合に役立ちます。
軸索ガイダンスの欠陥は、しばしば 100% の浸透と同じ遺伝子型のも脳は、いくつかの変動を示すことがあります。したがって、きのこ体や光受容体経路で生成される欠陥の突然変異体の対立遺伝子と新しく分析、異なる対立遺伝子とアプローチの組み合わせを利用する必要があります。文献の研究のほとんどはタンパク質が軸索ガイダンスを制御する細胞自律的役割を果たしているかどうかを調査するいくつかの異なるアプローチを使用: 私) (できれば異なるニューを使用して null のホモのハエで欠陥経路の解析ll の対立遺伝子)、ii) (RNAi) によって通常のニューロンにだけ興味の蛋白質に欠けているハエの欠陥経路の解析 iii) 草分け欠陥と iv の MARCM 解析) 遺伝子のホモ null のニューロンの再発現実験を救出ハエ。理想的には、遺伝子ごとのいくつかのダース脳神経細胞形態の欠陥を分析します。
プロトコルは固定ティッシュ内の蛋白質の蛍光像定位に主に焦点をここで説明するがこの手法のいくつかの将来のアプリケーションは、画像ライブ脳組織に開発されています。25 ° C で数日間、その後培養することができます脳は、(通常の細胞培養媒体) は解剖して、一度彼らこれら体外培養方法は、さまざまな傷害70,71, 細胞軸索再生を促進するタンパク質の活性などの生物学的プロセスを調査するために開発されています。シグナル伝達ダイナミクス72と神経の開発73。
開示事項
著者は、彼らは競合する金銭的な利益があることを宣言します。
謝辞
我々 は最初の教材 SMK 脳解剖技術 Changhui 朴とたラン Vrailas モーティマーを感謝したいです。私たちも批判的に、原稿を読み取るためケン モーベリの実習グループ、特にクリス ラウンドのメンバーに感謝します。Fas2 を認識する抗体 (1 4) chaoptin (24B10) が銀行ハイブリドーマ発達研究から得られました。シーモア ・ ベンザー、南司・ コリー24,60,61抗体 24B10、DSHB に預けて、コーリー ・ グッドマン22,23,56抗体 1 4、DSHB に預けています。はえの在庫は、ブルーミントンのストック センターから得られました。図 4A に脳をイメージするオハイオ州の農業研究および開発センター (OARDC) MCIC イメージング センター共焦点顕微鏡の使用のために感謝したい、B. SMK は発育からの助成金によってサポートされる (1 R15 HD084241 01A1)。
資料
| Name | Company | Catalog Number | Comments |
| Microdissection forceps/tweezers | Ted Pella | 505-NM | |
| Sylgard dishes | Living Systems Instrumentation | DD-50-S-BLK | Available from amazon.com |
| Fas2 Antibody | Developmental Studies Hybridoma Bank | 1D4 | |
| Chaoptin Antibody | Developmental Studies Hybridoma Bank | 24B10 | |
| GFP Antibody | Aves Lab | GFP-1010 | |
| Alexa488 goat anti-mouse secondary antibody | ThermoFisher | A-11001 | |
| Alexa488 goat anti-chicken secondary antibody | ThermoFisher | A-11039 | |
| Alexa647 goat anti-mouse secondary antibody | ThermoFisher | A-21236 | |
| 20% paraformaldehyde | Electron Microscope Services | RT15713 | |
| VectaShield | Vector Labs | H-1000 | |
| SuperFrost Plus Slides | ThermoFisher | 99-910-01 | |
| Coverslips | ThermoFisher | 12-553-454 | |
| Na Phosphate Buffer monobasic | Sigma | S3139 | |
| Na phosphate Buffer dibasic | Sigma | S3264 | |
| Triton X 100 | Sigma | X100-100ml | |
| fingernail polish | Electron Microscope Services (EMS) | 72180 | |
| stereomicroscope | Leica S6D with KL300 LED light source | ||
| 9-well dish (spot plate) | VWR | 89090-482 | |
| nutator/rocker | Fisher | 22-363-152 or 88-861-041 | |
| 35mm dish | Genesee Scientific | 32-103 | |
| Sylgard | Fisher | 50-366-794 | |
| Kimwipe | Fisher | 06-666 | |
| Name | Company | Catalog Number | Comments |
| Potential Fixation Buffers | |||
| PTN Buffer | 0.1M NaPhosphate, pH 7.2, 0.1% Triton-X-100, Typically make up 0.5 L of 0.1M NaPhosphate buffer and aliquote 50ml at a time as needed | ||
| PLP buffer | 2% paraformaldehyde, 0.01M NaI04, 0.075M Lysine, 0.037M NaPO4, pH 7.2, Dissolve 0.36 g lysine in 10 ml H2O + 7.5 ml 0.1 M NaH2PO4 pH 7.2 + 2.5 ml 0.1 M Na2HPO4 on ice. Immediately before use, mix 15 ml of this buffered lysine solution with 50 mg NaIO4 (sodium periodate) + 2ml of the 20% high grade paraformaldehyde (EMS) + 3ml H2O | ||
| PEM buffer | 0.1M PIPES pH 7.0, 2mM MgS04, 1mM EGTA, This buffer can be conveniently made as a 2x stock and diluted with 8% paraformaldehyde (PFA) to give a final concentration of 4% PFA | ||
| Name | Company | Catalog Number | Comments |
| Fly Stocks available from Bloomington | |||
| elav (c155)-GAL4 | BL458 | Pan-neuronal GAL4 driver | |
| w*;;;OK107-GAL4 | BL 854 | GAL4 driver for all mushroom body neurons (OK107-GAL4 insertion is on the 4th chromosome) | |
| y(1), w(67c23); c739-GAL4 | BL 7362 | GAL4 driver for alpha and beta lobes (on 2nd chromosome) | |
| y(1), w(67c23); c739-GAL4, UAS-CD8-GFP | BL 64305 | GAL4 driver for alpha and beta lobes, also contains UAS-CD8-GFP | |
| w*; 201Y-GAL4 | BL 4440 | GAL4 driver for primarily the gamma lobes of mushroom body (on 2nd chromosome) | |
| y(1), w(67c23); 201Y-GAL4, UAS-CD8-GFP | BL 64296 | GAL4 driver for mushroom body gamma lobes, also contains UAS-CD8-GFP | |
| w*, elav (c155)-GAL4, hsFLP; FRTG13, Tub>Gal80/CyO | BL 5145 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| w*, elav (c155)-GAL4, hsFLP, UAS-CD8-GFP | BL5146 | MARCM stock, contains hsFLP, pan-neuronal GAL4, and CD8-GFP on X chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;;FRT82B, Tub>GAL80/TM3, Sb(1);OK107-GAL4 | BL 44408 | MARCM stock for flipping 3rd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP;FRT40A, Tub>GAL80;OK107-GAL4 | BL44406 | MARCM stock for flipping 2nd chromosome | |
| w*, hsFLP, tub>GAL80, FRT19A; UAS-CD8-GFP/CyO;;OK107-GAL4 | BL 44407 | MARCM stock for flipping X chromosome | |
| y(1), w*; UAS-CD8-GFP/CyO | BL 5137 | GFP labels cell surface (CD8 is a transmembrane protein) | |
| y(1), w*; FRTG13, UAS-CD8-GFP | BL 5139 | MARCM stock, contains FRT site and CD8-GFP on 2nd chromosome | |
| y(1), w*, hsFLP, UAS-CD8-GFP; Pin(1)/CyO | BL 28832 | MARCM stock, contains hsFLP and CD8-GFP on X chromosome | |
| w*; FRTG13, Tub>GAL80 | BL 5140 | MARCM stock, contains FRT site and GAL80 on 2nd chromosome | |
| y(1), w*;; FRT82B, Tub>GAL80 | BL 5135 | MARCM stock, contains FRT site and GAL80 on 3rd chromosome |
参考文献
- Reichert, H. Evolutionary conservation of mechanisms for neural regionalization, proliferation and interconnection in brain development. Biol Lett. 5 (1), 112-116 (2009).
- Bellen, H. J., Tong, C., Tsuda, H. 100 years of Drosophila research and its impact on vertebrate neuroscience: a history lesson for the future. Nat Rev Neurosci. 11 (7), 514-522 (2010).
- Bier, E. Drosophila, the golden bug, emerges as a tool for human genetics. Nat Rev Genet. 6 (1), 9-23 (2005).
- Oortveld, M. A., et al. Human intellectual disability genes form conserved functional modules in Drosophila. PLoS Genet. 9 (10), 1003911(2013).
- Sanchez-Soriano, N., Tear, G., Whitington, P., Prokop, A. Drosophila as a genetic and cellular model for studies on axonal growth. Neural Dev. 2, 9(2007).
- Serafini, T., et al. The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6. Cell. 78 (3), 409-424 (1994).
- Kennedy, T. E., Serafini, T., de la Torre, J. R., Tessier-Lavigne, M. Netrins are diffusible chemotropic factors for commissural axons in the embryonic spinal cord. Cell. 78 (3), 425-435 (1994).
- Harris, R., Sabatelli, L. M., Seeger, M. A. Guidance cues at the Drosophila CNS midline: identification and characterization of two Drosophila Netrin/UNC-6 homologs. Neuron. 17 (2), 217-228 (1996).
- Seeger, M., Tear, G., Ferres-Marco, D., Goodman, C. S. Mutations affecting growth cone guidance in Drosophila: genes necessary for guidance toward or away from the midline. Neuron. 10 (3), 409-426 (1993).
- Huberman, A. D., Clandinin, T. R., Baier, H. Molecular and cellular mechanisms of lamina-specific axon targeting. Cold Spring Harb Perspect Biol. 2 (3), 001743(2010).
- Hattori, D., et al. Dscam diversity is essential for neuronal wiring and self-recognition. Nature. 449 (7159), 223-227 (2007).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker for studies of gene function in neuronal morphogenesis. Neuron. 22 (3), 451-461 (1999).
- Reynaud, E., et al. Guidance of Drosophila Mushroom Body Axons Depends upon DRL-Wnt Receptor Cleavage in the Brain Dorsomedial Lineage Precursors. Cell Rep. 11 (8), 1293-1304 (2015).
- Reuter, J. E., et al. A mosaic genetic screen for genes necessary for Drosophila mushroom body neuronal morphogenesis. Development. 130 (6), 1203-1213 (2003).
- Ng, J. Wnt/PCP proteins regulate stereotyped axon branch extension in Drosophila. Development. 139 (1), 165-177 (2012).
- Lai, Y. W., et al. Drosophila microRNA-34 Impairs Axon Pruning of Mushroom Body gamma Neurons by Downregulating the Expression of Ecdysone Receptor. Sci Rep. 6, 39141(2016).
- Watts, R. J., Hoopfer, E. D., Luo, L. Axon pruning during Drosophila metamorphosis: evidence for local degeneration and requirement of the ubiquitin-proteasome system. Neuron. 38 (6), 871-885 (2003).
- Borst, A., Helmstaedter, M. Common circuit design in fly and mammalian motion vision. Nat Neurosci. 18 (8), 1067-1076 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35 (5), 827-841 (2002).
- Schurmann, F. W. Fine structure of synaptic sites and circuits in mushroom bodies of insect brains. Arthropod Struct Dev. 45 (5), 399-421 (2016).
- Heisenberg, M. Mushroom body memoir: from maps to models. Nat Rev Neurosci. 4 (4), 266-275 (2003).
- Hummel, T., Krukkert, K., Roos, J., Davis, G., Klambt, C. Drosophila Futsch/22C10 is a MAP1B-like protein required for dendritic and axonal development. Neuron. 26 (2), 357-370 (2000).
- Grenningloh, G., Rehm, E. J., Goodman, C. S. Genetic analysis of growth cone guidance in Drosophila: fasciclin II functions as a neuronal recognition molecule. Cell. 67 (1), 45-57 (1991).
- Fujita, S. C., Zipursky, S. L., Benzer, S., Ferrus, A., Shotwell, S. L. Monoclonal antibodies against the Drosophila nervous system. Proc Natl Acad Sci U S A. 79 (24), 7929-7933 (1982).
- Zipursky, S. L., Venkatesh, T. R., Teplow, D. B., Benzer, S. Neuronal development in the Drosophila retina: monoclonal antibodies as molecular probes. Cell. 36 (1), 15-26 (1984).
- Wan, L., Dockendorff, T. C., Jongens, T. A., Dreyfuss, G. Characterization of dFMR1, a Drosophila melanogaster homolog of the fragile X mental retardation protein. Mol Cell Biol. 20 (22), 8536-8547 (2000).
- Androschuk, A., Al-Jabri, B., Bolduc, F. V. From Learning to Memory: What Flies Can Tell Us about Intellectual Disability Treatment. Front Psychiatry. 6, 85(2015).
- Bolduc, F. V., Tully, T. Fruit flies and intellectual disability. Fly (Austin). 3 (1), 91-104 (2009).
- van der Voet, M., Nijhof, B., Oortveld, M. A., Schenck, A. Drosophila models of early onset cognitive disorders and their clinical applications. Neurosci Biobehav Rev. 46, Pt 2 326-342 (2014).
- Pak, C., et al. Mutation of the conserved polyadenosine RNA binding protein, ZC3H14/dNab2, impairs neural function in Drosophila and humans. Proc Natl Acad Sci U S A. 108 (30), 12390-12395 (2011).
- Gatto, C. L., Broadie, K. Drosophila modeling of heritable neurodevelopmental disorders. Curr Opin Neurobiol. 21 (6), 834-841 (2011).
- van Alphen, B., van Swinderen, B. Drosophila strategies to study psychiatric disorders. Brain Res Bull. 92, 1-11 (2013).
- Kelly, S. M., et al. A conserved role for the zinc finger polyadenosine RNA binding protein, ZC3H14, in control of poly(A) tail length. RNA. 20 (5), 681-688 (2014).
- Kelly, S. M., et al. The Drosophila ortholog of the Zc3h14 RNA binding protein acts within neurons to pattern axon projection in the developing brain. Dev Neurobiol. 76 (1), 93-106 (2016).
- Michel, C. I., Kraft, R., Restifo, L. L. Defective neuronal development in the mushroom bodies of Drosophila fragile X mental retardation 1 mutants. J Neurosci. 24 (25), 5798-5809 (2004).
- Yamamoto, D., Koganezawa, M. Genes and circuits of courtship behaviour in Drosophila males. Nat Rev Neurosci. 14 (10), 681-692 (2013).
- Busto, G. U., Cervantes-Sandoval, I., Davis, R. L. Olfactory learning in Drosophila. Physiology (Bethesda). 25 (6), 338-346 (2010).
- Ueno, T., et al. Identification of a dopamine pathway that regulates sleep and arousal in Drosophila. Nat Neurosci. 15 (11), 1516-1523 (2012).
- Vogelstein, J. T., et al. Discovery of brainwide neural-behavioral maps via multiscale unsupervised structure learning. Science. 344 (6182), 386-392 (2014).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in Drosophila: a fly geneticist's Swiss army knife. Genesis. 34 (1-2), 1-15 (2002).
- Hamada, F. N., et al. An internal thermal sensor controlling temperature preference in Drosophila. Nature. 454 (7201), 217-220 (2008).
- Hodge, J. J. Ion channels to inactivate neurons in Drosophila. Front Mol Neurosci. 2, 13(2009).
- Neumuller, R. A., Perrimon, N. Where gene discovery turns into systems biology: genome-scale RNAi screens in Drosophila. Wiley Interdiscip Rev Syst Biol Med. 3 (4), 471-478 (2011).
- Ni, J. Q., et al. A Drosophila resource of transgenic RNAi lines for neurogenetics. Genetics. 182 (4), 1089-1100 (2009).
- Seelig, J. D., et al. Two-photon calcium imaging from head-fixed Drosophila during optomotor walking behavior. Nat Methods. 7 (7), 535-540 (2010).
- Lee, T., Luo, L. Mosaic analysis with a repressible cell marker (MARCM) for Drosophila neural development. Trends Neurosci. 24 (5), 251-254 (2001).
- Williamson, W. R., Hiesinger, P. R. Preparation of developing and adult Drosophila brains and retinae for live imaging. J Vis Exp. (37), (2010).
- Boerner, J., Godenschwege, T. A. Whole mount preparation of the adult Drosophila ventral nerve cord for giant fiber dye injection. J Vis Exp. (52), (2011).
- Sweeney, S. T., Hidalgo, A., de Belle, J. S., Keshishian, H. Dissection of adult Drosophila brains. Cold Spring Harb Protoc. 2011 (12), 1472-1474 (2011).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A Simple One-step Dissection Protocol for Whole-mount Preparation of Adult Drosophila Brains. J Vis Exp. (118), (2016).
- Liu, Y., Liao, S., Veenstra, J. A., Nassel, D. R. Drosophila insulin-like peptide 1 (DILP1) is transiently expressed during non-feeding stages and reproductive dormancy. Sci Rep. 6, 26620(2016).
- Shafer, O. T., Helfrich-Forster, C., Renn, S. C., Taghert, P. H. Reevaluation of Drosophila melanogaster's neuronal circadian pacemakers reveals new neuronal classes. J Comp Neurol. 498 (2), 180-193 (2006).
- Rieger, D., Shafer, O. T., Tomioka, K., Helfrich-Forster, C. Functional analysis of circadian pacemaker neurons in Drosophila melanogaster. J Neurosci. 26 (9), 2531-2543 (2006).
- Hillebrand, J., et al. The Me31B DEAD-Box Helicase Localizes to Postsynaptic Foci and Regulates Expression of a CaMKII Reporter mRNA in Dendrites of Drosophila Olfactory Projection Neurons. Front Neural Circuits. 4, 121(2010).
- Goodman, C. S., Davis, G. W., Zito, K. The many faces of fasciclin II: Genetic analysis reveals multiple roles for a cell adhesion molecule during the generation of neuronal specificity. Cold Spring Harb Symp Quant Biol. 62, 479-491 (1997).
- Fushima, K., Tsujimura, H. Precise control of fasciclin II expression is required for adult mushroom body development in Drosophila. Dev Growth Differ. 49 (3), 215-227 (2007).
- Prokop, A., Meinertzhagen, I. A. Development and structure of synaptic contacts in Drosophila. Semin Cell Dev Biol. 17 (1), 20-30 (2006).
- Hadjieconomou, D., Timofeev, K., Salecker, I. A step-by-step guide to visual circuit assembly in Drosophila. Curr Opin Neurobiol. 21 (1), 76-84 (2011).
- Van Vactor, D. Adhesion and signaling in axonal fasciculation. Curr Opin Neurobiol. 8 (1), 80-86 (1998).
- Reinke, R., Krantz, D. E., Yen, D., Zipursky, S. L. Chaoptin, a cell surface glycoprotein required for Drosophila photoreceptor cell morphogenesis, contains a repeat motif found in yeast and human. Cell. 52 (2), 291-301 (1988).
- Tahayato, A., et al. Otd/Crx, a dual regulator for the specification of ommatidia subtypes in the Drosophila retina. Dev Cell. 5 (3), 391-402 (2003).
- Cook, T., Desplan, C. Photoreceptor subtype specification: from flies to humans. Semin Cell Dev Biol. 12 (6), 509-518 (2001).
- Hakeda-Suzuki, S., et al. Goal collaborates with Flamingo in conferring synaptic-layer specificity in the visual system. Nat Neurosci. 14 (3), 314-323 (2011).
- Wu, J. S., Luo, L. A protocol for mosaic analysis with a repressible cell marker (MARCM) in Drosophila. Nat Protoc. 1 (6), 2583-2589 (2006).
- Venken, K. J., et al. MiMIC: a highly versatile transposon insertion resource for engineering Drosophila melanogaster genes. Nat Methods. 8 (9), 737-743 (2011).
- Crittenden, J. R., Skoulakis, E. M., Han, K. A., Kalderon, D., Davis, R. L. Tripartite mushroom body architecture revealed by antigenic markers. Learn Mem. 5 (1-2), 38-51 (1998).
- Muller, H. A. Immunolabeling of embryos. Methods Mol Biol. 420, 207-218 (2008).
- Baker, N. E., Li, K., Quiquand, M., Ruggiero, R., Wang, L. H. Eye development. Methods. 68 (1), 252-259 (2014).
- Ayaz, D., et al. Axonal injury and regeneration in the adult brain of Drosophila. J Neurosci. 28 (23), 6010-6021 (2008).
- Fang, Y., Bonini, N. M. Axon degeneration and regeneration: insights from Drosophila models of nerve injury. Annu Rev Cell Dev Biol. 28, 575-597 (2012).
- Tomchik, S. M., Davis, R. L. Dynamics of learning-related cAMP signaling and stimulus integration in the Drosophila olfactory pathway. Neuron. 64 (4), 510-521 (2009).
- Rabinovich, D., Mayseless, O., Schuldiner, O. Long term ex vivo culturing of Drosophila brain as a method to live image pupal brains: insights into the cellular mechanisms of neuronal remodeling. Front Cell Neurosci. 9, 327(2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved