このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
有害な効果の低圧プラズマ滅菌を使用して住んでいる携帯顕微鏡枯草菌胞子の生存に調査
要約
このプロトコルは追跡による活力パラメーターと枯草菌胞子を低圧プラズマ治療後復活で DNA 修復プロセスの監視の関連性を評価するために必要な重要な連続した手順を示しています蛍光標識された DNA は、時間分解共焦点顕微鏡と走査電子顕微鏡でタンパク質を修復します。
要約
プラズマ滅菌は、工業、医療、および宇宙飛行の目的の従来の殺菌法に有望な代替手段です。低圧プラズマ (LPP) 放電には、急速な微生物の不活化につながる活性種の広範なスペクトルが含まれています。効率と LPP による殺菌のメカニズムを研究、従来の滅菌手順に対する異常な抵抗のため試験生物枯草菌の胞子を使用します。B. 枯草菌胞子膜、二重誘導結合プラズマ反応器、走査型電子顕微鏡 (SEM) を用いて胞子形態の評価低圧プラズマによる滅菌処理の生産について述べると、発芽と生細胞顕微鏡検査によって胞子の副産物の分析。プラズマ種の主要なターゲットはゲノム物質 (DNA)、胞子復活時にプラズマ照射誘起 DNA 傷害の修復は生物の生存のため重要です。ここでは、胞子の発芽能力を研究および DNA の役割が追跡する蛍光標識 DNA 修復タンパク質 (RecA) 時間分解共焦点蛍光顕微鏡を用いた LPP 治療後胞子の発芽および伸長中に修復します。扱われ、未処理胞子膜の発芽の活性化し個々 の胞子の反応に従うことに時間をかけて倒立共焦点ライブセル顕微鏡で可視化します。我々 の観察が種子の発芽と手狭になったため胞子の割合 LPP 治療後 120 秒 RecA YFP (黄色蛍光タンパク質) 蛍光がいくつかの胞子でのみ検出され、すべてで開発された最小値に達する期間の依存を明らかにLPP 扱われる胞子のわずかな上昇と細胞は手狭になった。また、栄養の細菌のいくつかは LPP 扱われる胞子細胞質の増加を示したから派生し、溶解する傾向があった。個々 の胞子の分析記述されている方法は、胞子の発芽および伸長の他の側面に関する模範的な可能性があります。
概要
宇宙開発の主要な目標は、生命と他の惑星や太陽系の衛星生体分子の署名の検索です。微生物の伝達や生体関連物質探査の重要な領域への地球の起源の開発と惑星火星、エウロパの1などの生命検出ミッションの整合性に影響を与える特定のリスクです。他の惑星、その衛星、小惑星、および他の天体への有人とロボット ミッションに厳格な規制を課すの空間研究委員会 (日本) によってを 1967 年に設立、惑星保護の国際ガイドラインと規制、クリーニングおよび地球の微生物の汚染を排除し、天体2の交差汚染を防止するために起動する宇宙船と重要なハードウェア コンポーネントの事前の滅菌。最後の 10 年間、非熱平衡プラズマ中のアプリケーションは、医学・栄養の研究だけでなく宇宙飛行アプリケーション3,4、5ワイドの注目を集めています。プラズマ滅菌は、機密にやさしい、熱に不安定な物質でありながら迅速かつ効率的な微生物不活化6を提供しています従来の滅菌法に有望な代替手段です。プラズマ放電には、フリーラジカル、荷電粒子、中立/励起原子、急速な微生物不活化3につながる uv (紫外線) と真空紫外 (VUV) スペクトルの光子などの反応剤の混合物が含まれています。本研究では枯草endospores ガラス試料の表面上に分散を不活化するのに二重低圧誘導結合プラズマ (DICP) ソース7,8によって生成された低圧プラズマを使用します。
家族同定のグラム陽性菌は土壌、堆積物、空気とクリーン ルーム設備、国際宇宙ステーションの9,10 など異常な環境の自然の生息地に広く分布します。 ,11。属細菌の最も明確な特徴は、栄養枯渇12などの不利な条件を生き残るために強い休眠 endospores (以下、胞子) を形成する能力です。胞子は、様々 なトリートメント、熱、紫外線、γ 線照射、乾燥、機械的な混乱、強力な酸化剤などの有害化学物質などの環境ストレスに植物細胞により一般的にはるかに耐性や(参照13,14の見直し) pH 変更エージェント微生物不活化手法の有効性をテストするための理想的なオブジェクトであるためです。ゲノム DNA は細菌15,16, プラズマ照射誘起 DNA 傷害の修復のプラズマ治療の主要な目標 (例えば DNA 二重鎖切断) 胞子に復活は細菌13の生存のために重要な 17。
したがって、我々 は次の個々 の胞子によって低圧アルゴン プラズマを用いた胞子の治療後胞子の発芽および伸長中に胞子の発芽能力と DNA 修復の役割を研究し、蛍光標識された DNA の発現を修復時間分解共焦点蛍光顕微鏡を用いたタンパク質 RecA。我々 は、再現性のあるテスト結果、殺菌用低圧プラズマを用いた胞子膜の処理、プラズマ処理胞子のための準備を達成するため単分子膜におけるB. 枯草菌芽胞の準備のステップバイ ステップの説明を与えるアクティブな DNA の監視と連携して個々 の胞子のレベルで走査型電子顕微鏡 (SEM) と生細胞顕微鏡による解析を用いた微細構造の評価は、プラズマ治療への反応で細胞内で発生するプロセスを修復します。
プロトコル
1枯草菌胞子生産と精製。
- 胞子生産のため転送のそれぞれ 5 mL 一晩文化 200 mL 二重強度液体シェーファー胞子形成培地 (リットル 16 g 栄養流体培養基、塩化カリウム 2 g、0.5 g MgSOごとに、適切な抗生物質を添加した枯草株4* 7 H2O, 2 mL 1 M Ca (3)2, 2 mL 0.1 M MnCl2 * • 4 H2O、2 mL の 1 mM の FeSO4、2 mL 50% (w/v) グルコース18) 72 h、または文化の > 95% までの 37 ° C で積極的な曝気を養うと同属には。次の菌株の胞子を使用:枯草PY79 (野生型)枯草PY79ΔrecA:: ネオ (DNA 修復タンパク質 RecA の欠乏)枯草PY79 recA yfp:: 猫 (RecA 黄色との融合蛍光蛋白質 [YFP]19)。
- 50 mL チューブに 3,000 × g で 15 分遠心分離によって胞子を収穫し、繰り返し洗浄のステップ (最大 15 倍) 位相差顕微鏡による純度と発芽状態の滅菌蒸留水 H2O とチェックを使用して、サンプルを浄化します。胞子懸濁液段階明るい胞子 (> 99%) から構成される、顕微鏡実験を邪魔することができますさらにそれ以外の場合栄養細胞 (ロッド)、発芽胞子 (黒/グレーの外観) や細胞の残骸の自由ことを確認します。目的の純度までサンプルを洗います。
- 伸育の LB 寒天培地上の 10 倍のシリアル希薄の 50 μ L をめっきによって胞子価 (すなわち: 使用 30 μ L のサンプル + 270 μ L の滅菌水に 1:10 の希釈。270 μ H2O 1: 100 希釈のために特定の希釈から 30 μ L を取るなど) する CFU (コロニー形成単位) を計算し、37 ° C でプレートを一晩インキュベートします。CFU 決定後集中または滅菌水で希釈して 1 mL あたり 10 の9胞子にサンプルを調整します。
2. 試料エアロゾル堆積枯草菌の胞子の
注: 蓄積し胞子が重なる可能性があります治療中の遮蔽効果に最終的に偽造された不活性の結果します。、この問題を最小限に抑えるエアロゾルデ ポジション法テクニック20胞子サンプルを準備します。簡単に言えば、コンサートの流れの液体のスループットを調節する電気のタイマー制御高精度 2 物質ノズルは、キャリアガス (ここで N2) 加圧。窒素ガス流を用いたノズル吹出口から注入された液体サンプルを分散させます。
- (生存の動力学) の滅菌の顕微鏡スライドの形でサンプル キャリアを配置または円形 25 mm coverslips (DNA 修復の蛍光の追跡のプロセス/cLSM; 共焦点レーザ走査型顕微鏡) 噴霧ユニット電動エアロゾル中ノズルを配置。使用される胞子濃度に対応する必要があります、目的の最終濃度の 100 倍。
- ノズル液インレットに胞子文化の 1 mL を転送し、0.1 の溶射プロセスを開始 1.3 バールの圧力で s。溶射胞子懸濁液 (1 x 10 の7) は、数秒以内に等分胞子の単分子膜を形成する急速に乾く顕微鏡スライドに薄膜を形成します。部屋の温度で滅菌した容器に扱われたサンプル キャリアを格納します。
3. 低圧プラズマ処理
- 生体試料の治療のためプラズマ システムを準備し、5 でシステムを動作 500 W 5 分でアルゴン プラズマを用いた Pa。これにより、システム内のすべてのサーフェスが掃除し、ウォーム アップ。これは、システムをぶちまけてから周囲の空気、窒素、酸素、水、すなわち分子の付着を低減します。システムの前処理後、チャンバーをぶちまけるし、ガラス棚の助けを借りて、原子炉容器の中心に慎重にサンプルを置き。
- 少なくとも 3 つの生物学的複製を使用します。商工会議所を閉じるし、2 次避難ペンシルバニア州はその後、商工会議所に処理ガスを埋めます。5 システムの圧力を調整するペンシルバニア州
- プロセスの定義の後に、電力やガスの供給を切り、試料ホルダーからサンプルを吹いているを防ぐためにシステムを慎重にぶちまけます。換気後、サンプルを削除し、システムの次のパラメーターのサンプルを置きます。プラズマ処理したコントロールのみを掃除するサンプルを公開 (5 Pa) プラズマ応用最長時間に相当のプロセスガスの存在で。
4. 回復と胞子の生存率の評価
- オートクレーブ 10% ポリ酢酸ビニル (PVA) のソリューションを準備し慎重に約 500 μ L のサンプルのキャリアをカバーさせ、4 h ストリップの風乾 (胞子サンプルを今含んでいる) 乾燥した PVA 層を滅菌ピンセットを使用して、2 mL に転送反応管。管に 1 mL の滅菌水を追加し、ボルテックスによる PVA 層を溶解します。この手順は、> 胞子の 95% 回復、その発芽能力21は影響しません。
- 連続的 (すなわち μ L 滅菌 H2O + 30 μ L のサンプル/元希釈 270) 96 ウェル プレートで滅菌水で 1:10 でサンプルを希釈します。各希釈ホストゲノム スープ寒天 (LB) の 50 μ L をプレート、37 ° C でプレートを一晩インキュベートして成長したコロニー (CFU) 数を列挙します。
5 ライブ携帯顕微鏡と胞子の発芽における DNA 修復過程の追跡
- 700 μ L 中、ピペットを沸騰して発芽実験準備 1 mm 厚 1.5 %lb 寒天パッド顕微鏡滅菌シャーレに。10 分後、8 x 8 mm x 1 mm LB 寒天培地滅菌メス パッドをカットし、慎重に 25 mm ガラス coverslips に休んでいる、胞子膜の上に寒天を転送します。
注: この手順は、個々 の胞子の可視化に非常に重要ですし、寒天培地による発芽の活性化に向けて、彼らの反応を次を許可します。したがって、LB 寒天は染色体の表面に沿って、光のピントを回避して、表面で胞子を修正するには (1) と (2) 発芽胞子をアクティブにする 2 つの目的を提供しています。 - 寒天サンプルをカバー後、転送ガラス基板迅速にイメージングの商工会議所および顕微鏡に自動化された共焦点レーザー走査顕微鏡でサンプル 63 X を用いた倒立光学系/1.3 平面アポクロマート油浸対物レンズ。
-
イメージングを実行 520 と 560 nm 励起蛍光 (YFP) の 514 nm の発光波長を検出できます。
- スキャン写真乗算器 (透過光パス) のいずれかのモードでは明視野画像を記録します。
- 2.6% のレーザー パワーとコマ撮りシリーズを録画と共焦点絞り値 5 風通しの良い台と 30 あたり 1 フレームのサンプル周波数で s 0 h から 5 h、実験によって。それは特定のノート 514 のイルミネーションを単色の高用量にレーザーの nm は完全に (図 1A, B) の発芽を阻害します。
- イメージング プロセス全体の中に 37 ° C (周囲の空気湿度) で加熱段階でのサンプルを保ちます。それぞれの条件の少なくとも 3 つの生物学的複製を使用します。胞子集計、多層の胞子の分布やダスト粒子による汚染の場合に発生する可能性があります (「シャド ウイング」) プラズマ処理のブロックと (図 1C、D) 影胞子の発芽を有効にします。
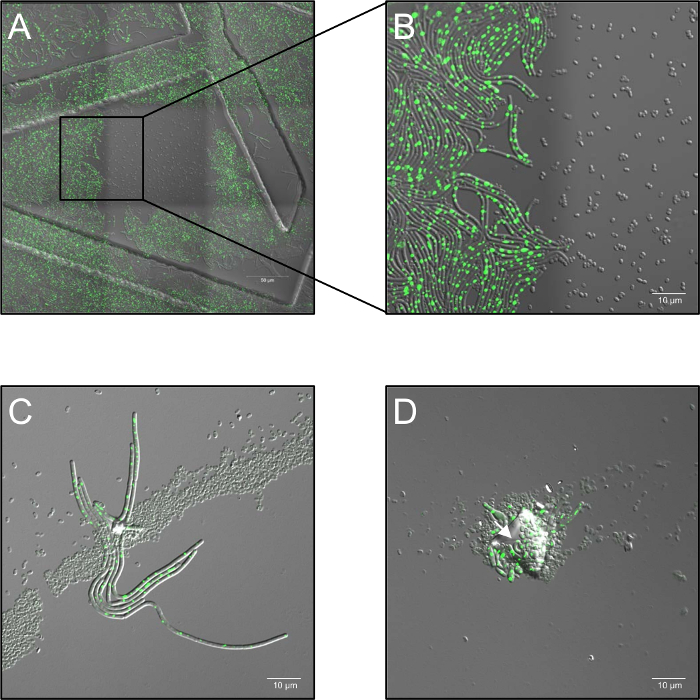
図 1: プラズマ処理胞子の生きているセルの共焦点蛍光顕微鏡の中に潜在的な問題が観察。(A, B)単色の高用量で胞子の発芽の抑制 (514 nm) レーザーの照明。(A) 概要 (3 ステッチ フレーム x 3)枯草(LAS72、RecA YFP) の胞子の発芽開始後 180 分。周辺地域 (= フレーム) が点灯していないに対し、途中でフレームが (514 nm、70% レーザ) レーザ光の高用量の 30 秒間隔で公開された (明視野チャネルおよび RecA YFP 蛍光; のマージされた画像の構造を注文35 mm プリント 500 μ m のグリッドが付いている皿をイメージングを使用してによって引き起こされる).(B) に示します 4 X では胞子に対し単色レーザー照明の高用量にさらされた胞子はないに発芽し、成長を示す点灯・非点灯の地域間のボーダーの拡大表示非照射領域は完全に明るい RecA YFP 蛍光 (緑の信号) を表現する生長する細菌に回復します。(C, D)汚染粒子で覆われた胞子または胞子 (矢印) の複数の層が基になる胞子をプラズマ処理による不活化から保護し、発芽、伸長 (「遮蔽」) を許可するようです。(C) 胞子が発芽のまたは (D) 開始後 60 s やイメージ 180 分のプラズマ治療 120 s 240 分後イメージとこの図の拡大版を表示するのにはここをクリックしてください。
6. 走査型電子顕微鏡 (SEM)
- 走査型電子顕微鏡を使用して、未処理のコントロールと比較するとプラズマ処理胞子の表面形態に関する微細構造の情報を提供します。金パラジウム coverslips に乾燥した胞子を単分子膜をコート (3 nm) スパッタ コーターを使用しています。イメージングのサンプル、地形の対照を明らかにするためレンズの二次電子検出器を含む 5 kV 加速電圧での電界放射走査型電子顕微鏡を使用します。
7. データ解析
- CFU 扱われたサンプルの平均値、N は、N0は平均未処理の真空コントロールの CFU 商 N/N0から胞子の生存を決定します。秒単位で時間の関数としてアルゴン プラズマ処理による胞子不活性化をプロットします。平均値と標準偏差としてすべてのデータを表す (n = 3)。
- イメージング ソフトウェアを使用して生きているセルイメージ投射によって得られた画像を分析します。胞子の発芽率を定量化し、4 時間後だけでなく、実験の先頭フレームの代表の胞子の数がプラズマ治療後手狭になったため。胞子生存アッセイにおける意義を一方通行 ANOVA テスト (分散分析) ソフトウェアで使用統計)。P値 < 0.05 は、統計的に有意と見なされます。
結果
プラズマ処理による枯草生存胞子します。
B. 枯草菌芽胞のプラズマ処理が、プラズマ処置 (図 2) の持続期間の増加とともに生存率の低下をこの研究ショーで使用されます。RecAを表現するひずみの胞子-YFP 融合遺伝子は、遺伝子組み換えに細菌の生命力に大きな影響がないことを示?...
ディスカッション
低温を使用して表面の殺菌、低圧プラズマは、電離放射線、化学物質による治療などではなく従来の滅菌手順に有望な代替手段 (例えばガスのように H2O2または酸化エチレン) または乾燥及び湿潤熱23。普通の滅菌方法ほとんど効果的な殺菌がオペレーターの潜在的なリスクを示し、治療材料に影響を与える知られています。低圧プラズマは紫外線の光?...
開示事項
利害の対立が宣言されていません。
謝辞
著者はアンドレア ・ シュレーダーのビデオの撮影中に彼女の援助のためのこの仕事と Nikea ・ j ・ ウルリッヒの部分の間に彼女の優秀な技術的な支援をありがちましょう。枯草菌の彼の寛大な寄付のライル ・ A. シモンズに感謝したいと思います: LAS72 と LAS24。この仕事支えられて部分で補助金ドイツ研究振興協会 (DFG) Paketantrag (PlasmaDecon 朴 728) から PA (AW 7/3-1) に、RM (MO 2023/2-1) と DLR (F.M.F、原産地、r. m.) に Teilprogramm 475, Programm RF FuW DLR FuW Projekt ISS 生命を付与します。F.M.F. は、ヘルムホルツ協会 (ヘルムホルツ Gemeinschaft) (6 年の期間にわたって資金が供給されたケルン、ドイツでドイツ航空宇宙センター (DLR) でヘルムホルツ宇宙生命科学研究学校 (SpaceLife) の博士課程奨学金によって支えられました。グラント号VH-KO-300) 理事航空宇宙航空宇宙医学研究所など、DLR から追加の資金を受け取ったとします。本研究の結果はフェリックス ・ m. フックス博士論文の中に表示されます。
資料
| Name | Company | Catalog Number | Comments |
| Two substance nozzle (model 970-8) | Schlick | 14,404 | 230 V, 50 Hz, D 4.484/8, 0.8 mm bore diameter |
| Luria Bertani Medium | Sigma Aldrich | 70122-100G | |
| Tube connectors | Festo | n/a | G 1/8 |
| Magnetvalve DO35-3/2NC-G018-230AC | Bosch Rexroth | 820005100 | |
| PLN Polyamid tube | Festo | 558206 | d = 6 mm |
| Glass slides | VWR | 48300-026 | |
| Electric Timer 550-2-C | Gefran | F000074 | 220 V |
| attofluor cell chamber | Menzel, Fisher Ref. | 3406816 | d=25 mm, round |
| MgSO4*7 H2O | Sigma Aldrich | 13152 | |
| Ca(NO3)2 | Sigma Aldrich | 202967 | |
| MnCl2 * 4 H2O | Sigma Aldrich | 244589 | |
| FeSO4 * 7H2O | AppliChem | 13446-34-9 | |
| Glucose | Merck | 215422 | |
| KCl | Sigma Aldrich | P9541-500G | |
| Nutrient Broth (NB) | Merck | 105443 | |
| Luria-Bertani (LB) | Merck | 110283 | |
| 96-wellplate | ThermoFisher | 243656 | |
| Zeiss LSM 780, Axio Observer Z1 | Carl Zeiss Microscopy GmbH | n/a | |
| Leo 1530 Gemini | Carl Zeiss Microscopy GmbH | n/a | |
| ZEN 2 and ZEN lite 2012 (Software) | Carl Zeiss Microscopy GmbH | n/a | |
| SigmaPlot, version 13.0 (Statistic software) | Systat GmbH, Erkrath, Germany | n/a | |
| Attofluor cell chamber | Invitrogen | A7816 | |
| µ-Dish 35 mm, high Grid-500 Glass Bottom | ibidi | 81168 |
参考文献
- Nicholson, W. L., Schuerger, A. C., Race, M. S. Migrating microbes and planetary protection. Trends Microbiol. 17, 389-392 (2009).
- COSPAR. COSPAR Planetery Protection Policy. Space Research Today, COSPAR's Information Bulletin. 193, 1-14 (2015).
- De Geyter, N., Morent, R. Nonthermal plasma sterilization of living and nonliving surfaces. Annu Rev Biomed Eng. 14, 255-274 (2012).
- Shimizu, S., et al. Cold atmospheric plasma - A new technology for spacecraft component decontamination. Planet. Space Sci. 90, 60-71 (2014).
- Lerouge, S., Fozza, A. C., Wertheimer, M. R., Marchand, R., Yahia, L. H. Sterilization by Low-Pressure Plasma: The Role of Vacuum-Ultraviolet Radiation. Plasma Polym. 5, 31-46 (2000).
- Rossi, F., Kylián, O., Rauscher, H., Gilliland, D., Sirghi, L. Use of a low-pressure plasma discharge for the decontamination and sterilization of medical devices. Pure Appl. Chem. 80, 1939-1951 (2008).
- Halfmann, H., Hauser, J., Awakowicz, P., Koller, M., Esenwein, S. A. A double inductively coupled low-pressure plasma for sterilization of medical implant materials. Biomed Tech (Berl). 53, 199-203 (2008).
- Halfmann, H., Denis, B., Bibinov, N., Wunderlich, J., Awakowicz, P. Identification of the most efficient VUV/UV radiation for plasma based inactivation of Bacillus atrophaeus spores. J. Phys. D: Appl. Phys. 40, 5907 (2007).
- Vaishampayan, P., et al. Bacillus horneckiae sp. nov., isolated from a spacecraft-assembly clean room. Int J Syst Evol Microbiol. 60, 1031-1037 (2010).
- Mandic-Mulec, I., Stefanic, P., van Elsas, J. D. Ecology of Bacillaceae. Microbiol Spectr. 3, (2015).
- Alekhova, T. A., et al. Diversity of bacteria of the genus Bacillus on board of international space station. Dokl Biochem Biophys. 465, 347-350 (2015).
- Claus, D., Bekerley, R. C. W., Sneath, P. A. Genus Bacillus Cohn 1872. Bergey's manual of systematic bacteriology. 2, 1105-1141 (1986).
- Setlow, P. Spore Resistance Properties. Microbiol Spectr. 2, (2014).
- Setlow, P. Spores of Bacillus subtilis: their resistance to and killing by radiation, heat and chemicals. J Appl Microbiol. 101, 514-525 (2006).
- Roth, S., Feichtinger, J., Hertel, C. Characterization of Bacillus subtilis spore inactivation in low-pressure, low-temperature gas plasma sterilization processes. J Appl Microbiol. 108, 521-531 (2010).
- Roth, S., Feichtinger, J., Hertel, C. Response of Deinococcus radiodurans to low-pressure low-temperature plasma sterilization processes. J Appl Microbiol. 109, 1521-1530 (2010).
- Setlow, B., Setlow, P. Role of DNA repair in Bacillus subtilis spore resistance. J Bacteriol. 178, 3486-3495 (1996).
- Schaeffer, P., Millet, J., Aubert, J. P. Catabolic repression of bacterial sporulation. Proc. Natl. Acad. Sci. 54, 704-711 (1965).
- Simmons, L. A., et al. Comparison of responses to double-strand breaks between Escherichia coli and Bacillus subtilis reveals different requirements for SOS induction. J Bacteriol. 191, 1152-1161 (2009).
- Raguse, M., et al. Improvement of Biological Indicators by Uniformly Distributing Bacillus subtilis Spores in Monolayers To Evaluate Enhanced Spore Decontamination Technologies. Appl Environ Microbiol. 82, 2031-2038 (2016).
- Horneck, G., et al. Protection of bacterial spores in space, a contribution to the discussion on Panspermia. Orig Life Evol Biosph. 31, 527-547 (2001).
- Opretzka, J., Benedikt, J., Awakowicz, P., Wunderlich, J., Keudell, A. v. The role of chemical sputtering during plasma sterilization of Bacillus atrophaeus. J. Phys. D: Appl. Phys. 40, 2826 (2007).
- Stapelmann, K., et al. Utilization of low-pressure plasma to inactivate bacterial spores on stainless steel screws. Int. J. Astrobiol. 13, 597-606 (2013).
- Raguse, M., et al. Understanding of the importance of the spore coat structure and pigmentation in the Bacillus subtilis spore resistance to low-pressure plasma sterilization. J. Phys. D: Appl. Phys. 49, 285401 (2016).
- Pandey, R., et al. Live cell imaging of germination and outgrowth of individual Bacillus subtilis spores; the effect of heat stress quantitatively analyzed with SporeTracker. PloS one. 8, e58972 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved