Method Article
蛍光寿命イメージングによる細胞内のスネアを可視化
要約
このプロトコルでは、蛍光共鳴エネルギー移動し、蛍光寿命イメージングに基づく SNARE タンパク質の複合体形成の定量的可視化を可能にする新しいメソッドについて説明します。
要約
可溶性Nエチルマレイミド感受性融合蛋白質 (NSF) 添付ファイル蛋白質受容体 (スネア) 蛋白質は、彼らは真核生物の細胞内膜融合を触媒膜が人身売買のためのキーです。SNARE タンパク質ファミリーは、約 36 の異なるメンバーで構成されています。特定の細胞内の輸送ルートは、特異性に貢献する 3 または 4 の SNARE タンパク質の特定のセットと膜輸送の忠実度によって触媒されます。ただし、SNARE タンパク質の精密な機能を勉強しては技術的に難しく、ほとんどスネア複数持っていると関数を重複とスネアが非常に豊富な機能的冗長ので。このプロトコルでは、生きた細胞の SNARE 複合体形成の可視化のための新しい方法を説明します。この手法は SNARE タンパク質の C 末端蛍光タンパク質を融合を表現することにし (FRET) による蛍光寿命イメージング (FLIM) を転送フェルスター共鳴エネルギーの相互作用を測定します。多成分の減衰モデルと蛍光寿命のヒストグラムをはめ込んでフレット FLIM は異なる小胞で SNARE 複合体形成の割合の半定量的評価を可能です。このプロトコルは SNARE 複合体形成膜、哺乳類細胞株および主な免疫細胞のエンドソーム コンパートメントを視覚化に正常に適用されているし、他の細胞内小器官でスネア関数の研究を容易に拡張することができます。動物・植物・真菌細胞。
概要
膜の売買は、真核細胞、どこ膜小胞ドナー細胞器官から発芽し、移動し、ターゲット器官1,2ヒューズの中心的な機能です。ミトコンドリアを除くすべての膜融合手順は SNARE 蛋白質家族1,2のメンバーによって触媒されます。SNARE タンパク質ファミリーは哺乳類の細胞の約 36 メンバーと酵母2の約 20 のメンバーから成っています。SNARE 蛋白質領域を含める 1 つまたは 2 〜 52 残基長、ネイティブ構造化されていない、スネア モチーフと呼ばれます。SNARE タンパク質は C 末端の膜貫通ヘリックス1,2で膜にしばしば繋留します。スネアは、アルギニン (R) とグルタミン (Q) スネア1,2に複雑なスネアに貢献する中央残留に基づいて分類できます。膜融合は、一緒に 4 スネア モチーフを貢献し、ドナーとアクセプターの両方の膜1,2に分散されている 3 または 4 の同種スネアの相互作用によって駆動されます。SNARE 複合体は、1 つの R スネア モチーフと 3 Q スネア モチーフ (Qa、Qb、および Qc と呼ばれます) で構成されます。複雑な形成が始まるいわゆるトランスを形成のスネア モチーフの N 末端-スネア-複雑なcisと呼ばれるタイトな α ヘリカル コイルのバンドルを形成、C テルミニへ向かって -スネア-複雑な。複雑な単一スネアとの錯形成ドナーとアクセプタの膜を一緒にドラッグし、膜融合3に対するエネルギー障壁を克服します。
セル内の特定のトランスポート ルートに異なるスネア錯体を割り当てることは多くの場合技術的に難しきます。スネアは膜輸送の特異性に明確に貢献する、無差別、機能的冗長とその機能重複1,2。このため、遺伝子ノックアウト、RNA 干渉、支配的な陰性として水溶性のスネア フラグメントまたは遮断抗体の導入によって、スネアを対象化摂動実験頻繁で起因しない他の明確な表現型スネアは、2、4を補正します。スネアは複数のトランスポート ルート2でかかわることができるので、さらに上流の人身売買イベントから特定の膜融合手順を区別するために困難です。スネアの反応蛍光レポーター蛋白質、遺伝子融合を使用した顕微鏡手法による機能局在論の問題に苦しむこと: 彼らはしばしば複数の人身売買の手順、および (ii) を仲介として複数の器官にスネア (i) を検索彼らのローカライズは、SNARE 複合体形成に従事する機能を自動的に意味しません。最後に、SNARE 複合体は、免疫沈降実験のターゲットとして餌と他のスネア スネアのいずれかを使用してを使用して識別できますが、これは特定の細胞小器官または人身売買ルートにこれらの複合体の割り当てはできません。したがって、現在、核分解能でスネアの複合体を可視化する方法はありません。蛍光抗体法はスネアの相互作用を証明することができないが、共局在の有無のみを表示することができます、免疫沈降法のみを表示することができます全体のスネア相互作用細胞母集団しますが、細胞小器官を割り当てないどここれら相互作用が発生します。
これらの制限を克服するために、核解像度の生細胞内 SNARE 複合体の定量的可視化を可能にする手法は最近 Verboogenらによって開発されました。5このメソッドは C 末端の膜貫通ヘリックスを融合したスペクトル シフトの蛍光タンパク質を用いたスネアのペアの式に基づいています。Cisの形成と膜融合の完了の後の複雑な罠、これら膜貫通へリックスの C 末端の fluorophores が付いてすぐに互いに並置されています。Fluorophores が付いている、フェルスター距離内で (通常 < 5 nm)、赤いシフト アクセプター fluorophore5,6グリーン シフト供給の fluorophore からフレットで生じる。供給の fluorophore とドナーとアクセプター発光 (レシオ フレット) の比から測定することができます受容体 fluorophore の排出増の焼入れにおける結果を心配しないでください。しかし、レシオ メトリック 2 つの異なる分子間フレット難しいは異なる細胞内小器官と細胞7,8の間でドナーとアクセプターのスネアの蛍光クロストークとは異なるレベルのため。フレットは、励起と光子の放出時間である蛍光寿命から測定することができます。供給の fluorophore はそのエネルギーを解放できる場合、この競合により蛍光寿命の明白な短縮、フレットします。これは、FLIM7,8で測定できます。寿命蛍光寿命は、蛍光体の組み込みプロパティで、その濃度に敏感ではない 2 つの異なる分子間相互作用測定のフレットはレシオ メトリック フレットよりもずっと頑丈。また、フレットの効率はドナーとアクセプター フルオロ (本質的にステップ関数) の間の距離の 6 乗に反比例するので、フレットは近似による定量的、です。したがって、二重コンポーネント減衰モデルの記録によって、FLIM 蛍光寿命ヒストグラムをはめ込んでフレット FLIM は SNARE 複合体形成5従事スネア分子量の半定量的推定できます。
このフレット FLIM メソッドが Verboogenらによって使用された最近では、免疫システムの5の主樹状細胞の SNARE 複合体形成を視覚化。病原性刺激に遭遇、樹状細胞を再ルーティングこと、膜の特に Qa スネア変異シンタキシン 4 R スネア小胞膜蛋白質 (ヴァンプ) 3 の増加錯化を伴う売買を示した、細胞膜。この増加の SNARE 複合体形成は、インターロイキン 65などの炎症性サイトカインの分泌を分泌容量の増加を満たすために可能性が高い必要があります。このプロトコルは、フレット FLIM SNARE 複合体の可視化と半定量的測定のデータの取得に必要な実験の手順を説明します。それは、モノと bi 指数減衰機能で、スネアの相互作用を定量的な見積もりとして明白な蛍光寿命の結果全細胞の蛍光寿命ヒストグラムに合わせて方法を説明します。このプロトコルでは、例として広く使用されている HeLa 細胞ラインを使用が、メソッドは他の真核生物の細胞でスネア錯体の研究を容易に拡張することができます。
プロトコル
1. 顕微鏡試料の調製
- Qa スネア シンタキシンがはたす 4 発現融合 mCitrine (シンタキシンがはたす 4-mCitrine; 供給の fluorophore) と R スネア VAMP3 融合 mCherry (VAMP3-mCherry)
注: 蛍光タンパク質の C 末端の膜貫通ヘリックスに融合を用いた他のスネアを使用もできます。MCitrine-mCherry ではなく、蛍光物質スペクトル分離の他のドナー ・ アクセプターのペアが使用される (例えば、CFP YFP) にこともできます。- HeLa 細胞の成長し、3 35 φ ガラス底培養皿顕微鏡に適した以上 900,000 HeLa 細胞を分割します。
注: 原則として、このプロトコルが他の真核生物の細胞の種類と顕微鏡の料理に適応ですることができます。- 10 ml ダルベッコの変更イーグル培地 (DMEM)、5% と 1% 抗生物質抗真菌薬 (ストレプトマイシン、ペニシリン、含んでいるアムホテリシン B) 37 ° C で 10% 牛胎児血清 (FCS) を添加した高グルコースの T75 フラスコで HeLa 細胞培養を維持 CO2細胞文化のインキュベーターで。
- 週に 2 回メディアを補充し、週に一度またはセルが新しい合流 T75 フラスコ (500,000 セル/フラスコ、平均) 85-90% に到達するときに、セル 1:10 を分割します。
- DMEM を取り外して滅菌リン酸緩衝生理食塩水 (PBS) 3 分間の 8 mL で 2 回 hela 細胞膜を洗浄します。
- PBS を削除し、2 mL の PBS で 2 mM エチレンジアミン四酢酸 (EDTA) を追加します。
- インキュベート細胞文化のインキュベーターで CO2を 37 ° C、5% で 5 分間細胞とその後軽くフラスコの底から HeLa 細胞を分離するフラスコを揺り動かします。
- 10 mL の培地で細胞を洗い流す、懸濁液を 15 mL チューブに転送し、カウント 10 μ 因数を削除します。
- 0.4% トリパン ブルー染色で 1:1 の約数を希釈し、Bürker 検定9セルをカウントします。
注: は、セル/mL の数を 10,000 に 2 つの 4 x 4 の正方形、複数のセルの数をカウントします。 - 15 mL チューブから取る 900,000 セルを数えるセル 3 ガラス底培養皿を (ステップ 1.1.1 参照) して、上それらを分割後、transfection のため準備します。
- エレクトロポレーション10セルを transfect (材料の表を参照してください) mCitrine と mCherry (シンタキシンがはたす 4 mCitrine 構造体 (ドナーのみ、サンプル #1) と融合した VAMP3 mCherry (サンプル #2)、および変異シンタキシン 3 シンタキシンがはたす 4 mCitrineサンプル #3)。
注: 他のセルの transfection 方法の使用11はすることができます。サンプル #3 のタンデム構造は、最短有効期間期待できる (すなわち、最大期待できるフレット) を推定するための肯定的な制御です。
- HeLa 細胞の成長し、3 35 φ ガラス底培養皿顕微鏡に適した以上 900,000 HeLa 細胞を分割します。
- セルは、高グルコース 10 %fcs と 1% 5% CO2細胞文化のインキュベーターで 37 ° C では抗真菌抗生物質 DMEM で一晩文化。
- DMEM を吸引、ライブセル イメージング中に一度セルを洗浄 (140 mM の NaCl、KCl、1.8 mM CaCl2、1 ミリメートル MgCl2、20 mM HEPES、pH 2.5 mM = 7.4 mOsm = 300;材料の表を参照してください) 2 分後新鮮なイメージングにセルを配置し、媒体。
2. FLIM データの記録
- 場所サンプル # 2 パルス励起源と共焦点顕微鏡 (すなわちmCitrine) 供給の fluorophore および時間分解データ集録の FLIM 時間ドメインで。37 ° C 加熱ステージで細胞を維持します。
注: このプロトコルで使用されている共焦点顕微鏡は、63 X 1.20 NA 水浸対物レンズ、パルス白色光レーザー搭載 (80 MHz のパルス、< 100 ps パルス持続時間)、光子増倍管 (PMT) と、Time-Correlated 単一光子を数える (ピコ) システム (使用される特定の設定の材料表を参照してください)。その他の FLIM の顕微鏡は使用される (例えば白色光パルス レーザーの代わりに単一の波長パルス レーザー光電子増倍管ではなく単一光子アバランシェ ダイオード (SPAD)) も可能です。 - MCitrine と SNARE タンパク質の mCherry ラベルの式が表示されているセルを選択し、各 FLIM 測定前に両方の fluorophores の同時励振で 256 × 256 ピクセルの共焦点画像を記録します。回折顕微鏡の空間分解能の制限よりも小さい約倍のピクセルずつ (~ 200 nm) 使用する必要があります。MCitrine のエキサイト、516 nm 帯および収集発 521 565 nm;mCherry の 613 668 nm から 610 nm と収集の放出で刺激します。
注: は撮像面が皿の底に近すぎる位置ではなく (内 〜 2 μ m の距離)、蛍光寿命ヒストグラムの反射ピークになります。ドナーとアクセプターの fluorophores の同時励起お勧め、サンプルを移動の潜在的な問題を克服することができます。ただし、連続励起を同様に使用できます。 - ステップ 2.2 FLIM 画像と同じ寸法の空間分解能共焦点イメージとして映像 FLIM でFLIM の実行をクリックして記録を記録します。全体セル FLIM の解析、または少なくとも 400 光子/ピクセルのイメージ、少なくとも 50,000 フォトンを記録します。のみエキサイト mCitrine 供給の fluorophore と mCherry 受容体分子蛍光しないとこうして 521 565 nm から 516 nm と収集の放出でエキサイトします。
- 複数のセル、その他のサンプル #1 (ドナーのみ) とサンプル #3 (mCitrine mCherry タンデム コンストラクト) 2.1 2.3 の手順を繰り返します。
- 計器の応答関数 (IRF) を記録します。(例えば、510 550 nm からレコード放出) 励起波長を発光検出器の分光器を調整し、 FLIM の実行ボタンをクリックしてきれいなガラス カバー スリップからの後方散乱の FLIM の画像を記録します。同じの励起波長を使用 (516 nm) とレーザー パワー ステップ 2.1 2.4 でセルのデータを記録するために使用されます。
注: IRF に表示、ピークは複数放出モノクロ メーターをチューニングできない場合や、IRF も測定可能の超高速の有効期間、蛍光色素の溶液で例えば水溶液飽和の有機性染料の蛍光消光によってヨウ化カリウムの溶液。また、蛍光性のヒストグラムの崩壊斜面は、IRF のデコンボリューションすることがなく取り付けることができますので、それは、IRF を記録する必須ではありません。しかし、IRF 光子検出器使用のタイミング特性を補正することができます、それによって寿命ヒストグラムのフィットが正確になります。
3。光子録音 FLIM 画像を変換
- ダウンロードし、PT32ICS 変換ソフトウェア5をインストールします。
注: 有効期間のデータは、いくつかの顕微鏡のベンダーからソフトウェアを含む他のソフトウェアによっても分析できます。 - PT32ICS ソフトウェアを構成します。
- 設定で 256 × 256 ピクセル イメージ サイズにサイズを設定 |サイズ。
- 設定経由で2 チャンネルを設定 |サイズ。
注: mCitrine 排出量のチャネルは専ら顕微鏡の構成によって異なります。間違ったチャンネル画像になります、FLIM ない光子 (すなわち、黒いイメージ) と、結果として空の 'LifetimeTable.txt'-ファイル。正しいチャネルは、トライアル アンド エラーによって識別できます。 - ImageJ (xyz)に出力を設定 (またはTRI2 (xyt)) FLIM イメージ (ステップ 3.4) を生成します。
- 変換を押すし、1 つまたは複数の光子の痕跡 (.pt3 ファイル) を読み込みます。複数の光子のトレースを選択するには、 Ctrlキーを押しを保持します。
注: 新しい 64 ビット .ptu 形式を変換もできます。 - PT32ICS ソフトウェアが pt3 ファイルの保存先と同じフォルダーに次のファイルを生成する: .pt3 光子トレース イメージ フローサイトメトリー標準形式 (.ics)、.pt3 光子トレース (.bmp) ごとに 1 つのビットマップ ファイル、コンバージョンあたりのテキスト ファイルごとの 1 つの光子スタック(_Report.txt) 情報を含む光子統計 (すなわち、各 .pt3 光子トレース検出器の時間分解能で光子の総数)、および 2 番目のテキスト ファイル変換 (_LifetimeTable.txt) あたりの合計を含む各 .pt3 光子トレースのタブ区切り形式の蛍光寿命ヒストグラム。
注: FLIM 画像、例えば TRI2 ソフトウェア12,13またはフィジー ImageJ14,15の図書館、スリムな曲線を生成するためにフィッティングの単一のピクセルの .ics ファイルを使用できます。このファイルも使用できますフェーザ解析16、例えば Spechron からフィージーの時間ゲート フェーザ プラグイン。ビットマップ ファイルには、有効期間の情報が含まれていません。2 番目のテキスト ファイルを使用して、手順 4 で全細胞 FLIM の分析のため。
4. 蛍光寿命ヒストグラム全体セル FLIM の分析のためのフィッティング
注: この手順 (IRF の deconvoluted 継手) deconvoluted フィッティングが可能なソフトウェアが必要です。IRF のデコンボリューションなし蛍光性のヒストグラムの斜面をフィッティングは、同様に他のソフトウェアを行うことができます。
- デコンボリューション (材料表) に合うことができるデータ解析ソフトウェア プログラムを開き、各光子のトレース (_LifetimeTable.txt)ファイル経由でのヒストグラムを含むテキスト ファイルをインポートする |インポート |ASCII のシングル。
- IRF が (コピーと貼り付けを使用して) テーブルの 2 番目の列には、テーブルを再編成します。最初の列 A の時刻の値の横にある 2 番目の列 B で IRF を配置します。
- Ctrl キーを押しながら Aを押すと、のプロットを選択してすべての列を選択することによって記録されたフォトン トレースの品質を決定する |複数パネル |9 パネル。高反射ピーク (図 4 階) を持つ光子トレースを分析しません。
- IRF Ctrlを使用して B 列にだけでなく、装備、品質制御寿命ヒストグラムを含むすべての列キーし、解析による非線形フィッティングをロードを選択 |フィッティング |非線形カーブ フィット |ダイアログを開く。
- 解析ソフトウェアにこの機能を追加することによって (補足ファイル 1で利用可能) deconvoluted フィット関数を読み込む (カテゴリを介して |ユーザー定義 |関数 |追加)。フィット関数ファイル 'FLIM_convoluted_IRF.fdf' を選択します。この関数収まるモノ指数関数的減衰機能付き蛍光寿命ヒストグラム IRF (すなわちテーブルの 2 番目の列 B) と deconvoluted (式 1)。
 (関係式 1)
(関係式 1)
t時間τ明白な蛍光寿命、 A振幅、およびy0オフセット。
注: 別のオプションは、bi 指数フィット関数 (式 2) と有効期間のヒストグラムに合わせてです。
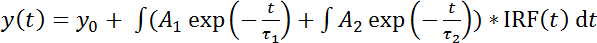 (式 2)
(式 2)
ドナーの唯一の条件に遅いコンポーネント (τ1) の有効期間を固定することによって (1.1.2 のステップ: サンプル #1) タンデム構成 (サンプル #3) 高速コンポーネント (τ2)、これにより、率の推算法遅い (1)と (2A; 参照議論; 高速コンポーネントの振幅から (F) 複合体における SNARE タンパク質式 3):
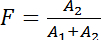 (式 3)
(式 3)
Deconvoluted bi 指数フィット 'FLIM_convoluted_IRF_biexp.fdf' のフィット関数ファイルは補足のファイル 2で利用可能です。 - 選択装着曲線 |X データ型として入力データと同じ。
注: これにより、適切なx-軸の近似曲線のスケーリングします。 - フィットフィットを押すことによって、カーブ。
注: これはフィットを変換し、配列の蛍光寿命、オフセット、および振幅を含むテーブルがレポート シートを生成します。近似曲線とフィットの残差データ シートも生成されます。
結果
フレット FLIM でスネアの相互作用を測定するアッセイの原理は図 1に示します。同種の SNARE タンパク質の膜貫通へリックスの C 末端はスペクトル シフト蛍光蛋白質 (例えば、mCitrine および mCherry) のペアに融合しました。Cisの形成-互いに並列になってすぐにこれらの蛍光タンパク質の膜融合結果に複雑なスネアし、フレットします。図 2は、HeLa 細胞の SNARE タンパク質の蛍光標識を表現する代表的な共焦点画像を示しています。シンタキシンがはたす 4 mCitrine 構造 (ドナーのみ; ないフレット) と変異シンタキシン 3 両方 mCitrine に融合のみを発現する細胞の制御条件だけでなく、セルを表現している変異シンタキシン 4 mCitrine (供給の fluorophore) VAMP3-mCherry (アクセプタの fluorophore) とを示すタンデム (最大期待できるフレット) の mCherry。付属の蛍光寿命とモノラル指数関数的減衰関数 (図 3 a-B) と bi 指数関数的減衰機能 (各ピクセルの生涯ヒストグラムをフィッティングによって生成された FLIM イメージ図 3が示しています図 3-D).図 4 aは、顕微鏡のカバーガラスの後方散乱を用いて我々 のセットアップの IRF を示しています。図 4 b-E、セル全体と共に付随するフィット FLIM 分析の代表的な蛍光寿命ヒストグラム モノラル指数関数的減衰関数の曲線が表示されます。図 4 階は、顕著な反射ピークで顕微鏡のカバーガラスの表面に近すぎるイメージング実験の蛍光寿命ヒストグラムを示しています。図 4は、bi 指数関数的減衰関数と合う担当者と有効期間のヒストグラムを示しています。

図 1: フレットで SNARE 複合体を可視化するための理論的根拠のスキーム。(A) 神経わな (タンパク質データベース 3HD717) 胞結合膜タンパク質 (ヴァンプ) 2 の構造モデル (青;R)、変異シンタキシン 1 (赤;Qa-SNARE)、および SNAP25 (グリーン; 両方 Qb と Qc スネア モチーフが含まれている)。MCitrine (供給の fluorophore; タンパク質データベース 3DQ118) に変異シンタキシン 1 の膜貫通へリックスの C 末端を活用します。MCherry (アクセプタ fluorophore; タンパク質データベース 2H5Q19) に VAMP2 の膜貫通へリックスの C 末端を活用します。(B) 方式のスネアは、フレットの膜融合を仲介しました。Cisの形成による膜融合後の複雑なスネア、スネアはすぐに各フレットの結果の他に並置されています。この図の拡大版を表示するのにはここをクリックしてください。
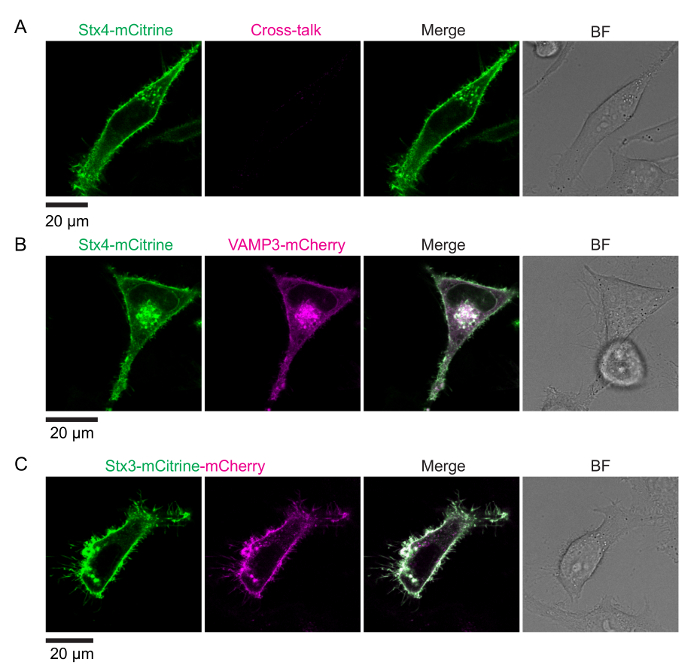
図 2: 蛍光タンパク質を融合した SNARE タンパク質の発現します。最初の列: 516 に興奮している供給の fluorophore nm。2 列目: アクセプター分子蛍光、610 に興奮して nm。(A) ドナーの条件のみ。シンタキシンがはたす 4 mCitrine (供給の fluorophore; マージでは緑) を表現する HeLa 細胞の代表的な共焦点画像。受容体チャネル (2 列目) 蛍光クロストークを示しています。(B) のネガティブ コントロール (フレットない)。VAMP3 mCherry (アクセプタ fluorophore; マージでマゼンタ) と両方のシンタキシンがはたす 4-mCitrine を表現する HeLa 細胞の代表的な共焦点画像。(C) 肯定的な制御 (最大期待できるフレット)。変異シンタキシン 3 mCitrine mCherry タンデムを表現する HeLa 細胞の代表的な共焦点画像を構築します。MCitrine と mCherry の蛍光信号の信号は完全にオーバー ラップ、mCherry と比較してライソゾームの分解する mCitrine の低い抵抗のため可能性があります注 (ディスカッション セクションを参照)。BF: 明視野。スケール バー、20 μ m.この図の拡大版を表示するのにはここをクリックしてください。
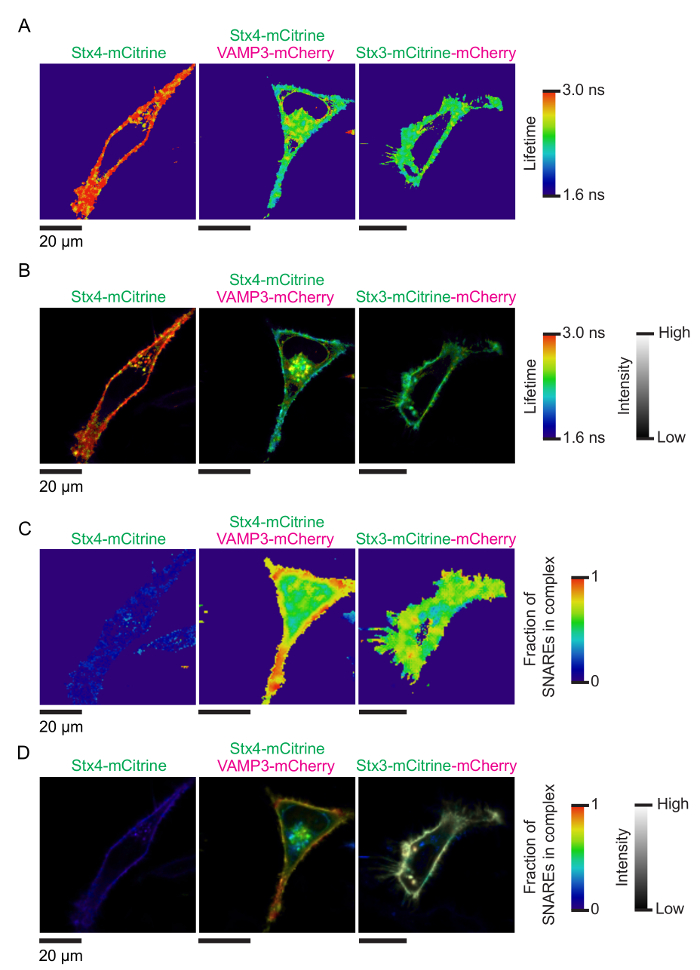
図 3: SNARE 複合体形成の FLIM イメージ。図 2に示すように細胞の (A) 代表的な蛍光寿命画像。画像は、イメージ フローサイトメトリー標準 (.ics) PT32ICS ソフトウェアを使用する最初にピコ システム (.pt3) によって記録されたフォトン トレース変換によって生成されました。単一のピクセルは、画像 15 100% 強度、7 ピクセルビニング円形および変動調整アルゴリズム (マルカート) から処理付き TRI2 ソフトウェア12,13を使用して生成し、蛍光寿命を装着しました。色は、明白な蛍光寿命を示します。(B) FLIM 画像 (図 2に示すように) mCitrine 供給の fluorophore の蛍光強度と蛍光寿命画像 (A に示すパネル) が複雑な場所。フィジー ImageJ のカスタム マクロを使用して畳み込みを行った (材料の表を参照してください)。(C) 蛍光寿命とシンタキシンがはたす 4-mCitrine と VAMP3-mCherry の両方を表現する bi 指数関数的減衰曲線のフィッティングしますが、今からパネル A ・ B、HeLa 細胞の FLIM 画像 (; 条件を制御する固定の有効期間を参照してください 4.4 のステッププロトコル)。ピクセルの色を示す変異シンタキシン 4 の複合体の VAMP3 とF推定の分数 (式 3)。(D) パネル B と同じ bi 指数、フィット。フィジー ImageJ のカスタム マクロを使用して畳み込みを行った (材料の表を参照してください)。この図の拡大版を表示するのにはここをクリックしてください。
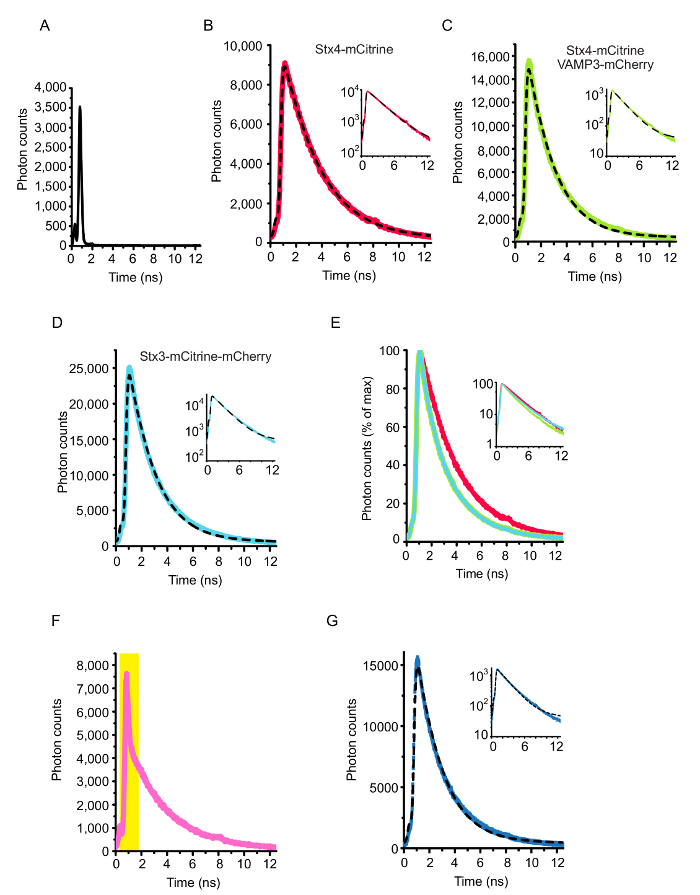
図 4: セル全体 FLIM 解析します。(A) のセットアップの機器応答関数 (IRF)。IRF は、(きれいなガラスの水の入った皿を顕微鏡を使用して) ガラス-水界面の後方散乱を用いて測定しました。(B-E)図 2と図 3に示すように細胞の寿命ヒストグラムをセル全体。画像内に存在すべての光子を集めた。曲線は、IRF で deconvoluted され、モノラル指数関数的減衰関数 (式 1) が装備。これらの細胞の蛍光寿命は 2.82 の得られた ns (パネル B; ドナーのみ唯一シンタキシンがはたす 4 mCitrine を発現する細胞) 2.09 ns (シンタキシンがはたす 4-mCitrine VAMP3 mCherry との共発現細胞; パネル C) と 2.08 ns (細胞変異シンタキシン 3-mCitrine mCherry タンデムを構築します。最大の期待できるフレット制御;パネル D)。解りますが、対数の y 軸のスケールを持つ今の同じグラフを表示します。パネル E で減衰曲線パネル B + のオーバーレイを表示します。蛍光寿命のヒストグラムの例を (F) は、顕微鏡のカバーガラスの表面に余りに近く記録されます。これは、結果、大きな反射ピーク (黄色の斜線部分が描かれている)。(G) パネル C、今有効期間で bi 指数関数的減衰曲線のフィッティングと同じ固定制御条件 (プロトコル 4.4 を参照)。(1)高速および低速(2)コンポーネントの振幅であった 14.42 0.01、0.99 (式 3) の複雑なFスネアの推定割合の結果します。この図の拡大版を表示するのにはここをクリックしてください。
の補足ファイル 1。関数ファイル FLIM_convoluted_IRF このファイルをダウンロードするここをクリックしてください。
の補足ファイル 2。関数ファイル FLIM_convoluted_IRF_biexp このファイルをダウンロードするここをクリックしてください。
ディスカッション
このプロトコルは、フレット FLIM のスネア シンタキシンがはたす 4 とライブの HeLa 細胞における VAMP3 の相互作用の可視化の使用方法を示します。シンタキシンがはたす 4 は、主にそれが開口放出1,2,20,21を仲介する細胞膜で検索 Qa わな蛋白質です。VAMP3 は、エンドソーム コンパートメントをリサイクルで検索する主に説明されているし、膜1,2,20に関しても他のエンドソームに人身売買を仲介する R スネアです。ただし、フレット FLIM の試金は他の SNARE タンパク質を研究するために容易に適応することができます。唯一の条件はこれらのわなを含む C 末端の膜貫通ヘリックスところ1,2でほとんどの SNARE 蛋白質のためのケースであります。さらに、ここで説明されているプロトコルは、植物、酵母など真核細胞の種類で SNARE 複合体の可視化に適応することができます。このプロトコルでは供給の fluorophore の蛍光寿命の短縮をフレットの尺度として使用されます。補完的なアプローチとしてアクセプター分子蛍光の寿命を検討できる、鋭敏化の排出が明確な上昇の段階に原因が発生したその共鳴エネルギー移動明確な証拠を提供します。
現在、フレット FLIM 技術ライソゾーム コンパートメントでスネアの複合体を可視化することができるかもしれません。変異シンタキシン 3 mCitrine mCherry タンデム構造の mCherry 蛍光されることが多いより蓄積された mCitrine 信号が細胞で豊富であるに対しライソゾーム コンパートメントに対応可能性があります juxtanuclear 領域で周囲5。MCitrine と比較して mCherry のような juxtanuclear 蓄積は認めこれらの蛍光タンパク質を融合した同じ SNARE タンパク質の共発現5頃。リソソームは、非常に低い pH によって特徴付けられる (< 4) 蛋白質分解酵素の高活性。MCherry 蛍光 mCitrine 蛍光体と比較してライソゾームの分解のより高い抵抗によって原因は mCherry の juxtanuclear の蓄積です。MCherry の juxtanuclear の蓄積はまた細胞5の固定の際に発生する、mCitrine の pH 焼入れのためは。したがって、フレット FLIM 技術 juxtanuclear (ライソゾーム) 地域でフレットの量を過小評価してこれはリソソームのルーメン内での厳しい条件に耐える他の蛍光レポーター蛋白質を必要となります。
原則としてフレット FLIM は、複雑な5でスネアの端数の半定量的推定値を得ることができます。我々 はこのプロトコルで説明した、ようこの必要があります二重指数関数的減衰関数 (式 2) と蛍光寿命ヒストグラムのフィッティング複雑な (高速コンポーネントの振幅がスネアの割合に比例して式 3)。しかし、2 成分モデルでこのような継ぎ手は技術的に挑戦的です。複数の無料フィット パラメーター (2 つの蛍光寿命と 2 つの振幅) とともに継ぎ手パラメーターが互いに影響し、一生の間に小さなエラーは、振幅と副に影響、特に以来光子の非常に大きな数が必要です。逆。これらのフィットの問題を克服するために遅い成分の蛍光寿命をドナー唯一の条件 (すなわち、ないフレット; 現在 mCitrine のみ) の有効期間に固定できるし、タンデムの有効期間に高速コンポーネントの構築 (最大の期待できるフレット) を。しかし、これも解釈すべき注意を払って、蛍光寿命がこれらのコントロールの状態と同じにできない場合があります (自己消光、双極子の向き、ラットモデル変奏曲) 複数の理由のため乖離する可能性がため。近くに複数のスネアの錯体 (< 10 nm) することができます間隔依存したフレット、フレット「分子定規」として使用することができるのと同じ原理で結果がこの場合、不明瞭 SNARE 複合体の定量。また、定量的な見積もりは常に意味を持ちませんラベル付きスネア内因性 (ラベルなし) スネアと競うためです。結果として、mCherry ラベル スネアの発現レベルは、割合フレット5の主要な決定要因です。すべてのこれらの警告のためモノラル指数関数的減衰関数 (式 1) と蛍光寿命のヒストグラムに合うようにそれをお勧めします。有効期間の事前知識は必要ありませんし、結果の明白な平均蛍光寿命は、スネア錯5固体測定の利点があります。
それにもかかわらず、2 成分フィッティング モデルによる定量的フレット FLIM イメージングは強力な将来のアプリケーションを持つことが期待されます。染色体内の遺伝子のスネア エンコーディングは、CRISPR/CAS9 で、たとえば蛍光レポーター蛋白質と融合します。これは内因性のタンパク質のレベルとラベルのないわな、背景なし、内因性の SNARE タンパク質の蛍光標識の結果し、のフレット FLIM で SNARE 複合体画分の有意義な定量的評価により。内因性スネアの表現のレベルがかなり低く、与える蛍光信号が比較的低い、それは全体のセルを必要とする光子の数 1,000 のみ) FLIM の特に、光子の十分な数を得られることを期待です。また、これらフレット FLIM の測定はまた高い蛍光信号とより良い光子統計より敏感なアバランシェ フォト ダイオード検出器を実行できます。
開示事項
著者が明らかに何もありません。
謝辞
この仕事は科学研究 (NWO; Radboud 大学医療センター、人間科学フロンティアから、キャリア ・ デベロップメント賞、オランダの組織から引力プログラム 2013 ヒュパティアの交わりによって支えられました。ICI-024.002.009)、NWO (ALW ビディ 864.14.001) から開始許可欧州連合の第 7 フレームワーク プログラム (グラント契約番号 336479) の下で欧州研究会議 (ERC) から、ビディを付与します。
資料
| Name | Company | Catalog Number | Comments |
| Plasmid DNA 'syntaxin 4-mCitrine' | Addgene | ID 92422 | Other SNAREs with fluorescent proteins fused to their C-terminal transmembrane helices can also be used. Instead of mCitrine-mCherry, other donor-acceptor pairs of spectrally separated fluorophores can also be used (e.g., CFP-YFP). |
| Plasmid DNA 'VAMP3-mCherry' | Addgene | ID 92423 | Other SNAREs with fluorescent proteins fused to their C-terminal transmembrane helices can also be used. Instead of mCitrine-mCherry, other donor-acceptor pairs of spectrally separated fluorophores can also be used (e.g., CFP-YFP). |
| Plasmid DNA 'syntaxin 3-mCitrine-mCherry' | Addgene | ID 92426 | Positive control for maximum achievable FRET. |
| Hela cells | |||
| 35 mm glass bottom dishes | Willco Wells | HBST-3522 | Other live cell imaging chambers will work as a substitute |
| Dulbecco's Modified Eagle Medium | Gibco, Life Technologies | 31966-021 | |
| Fetal calf serum | Greiner Bio-one | 758093 | |
| Antibiotic-antimycotic solution | Gibco, Life Technologies | 15240-062 | Pen/Strep will work as a substitute |
| Live cell imaging medium | Thermo Fisher Scientific | A14291DJ | Any other live cell imaging solution will work, as long as fluorescence from the medium is prevented |
| Leica SP8 confocal microscope with a 63x 1.20 NA water immersion objective | Leica | SP8 | Other confocal microscopes capable of time-domain FLIM can also be used |
| Pulsed white light laser | Leica | SP8 | Other pulsed laser sources can also be used |
| Time-Correlated Single Photon Counting (TCSPC) system | PicoQuant | PicoHarp 300 | |
| PT32ICS conversion software | Available at the 'Software'-section of www.membranetrafficking.com | ||
| data analysis software programme capable of deconvolution | Originlabs | OriginPro 2016 | |
| Fiji ImageJ | |||
| Custom-made Fiji ImageJ macro for convolution of FLIM image with Intensity | Fiji ImageJ | Available at the 'Software'-section of www.membranetrafficking.com | |
| Bürker Haemocytometer | VWR | 630-1541 | |
| HeLa cells | ATCC | ATCC CCL-2 | |
| PBS | B Braun Melsungen AG | 362 3140 | |
| EDTA 2 mM | Merck | 108417 | CAS: 60-00-4 |
| 15 mL tubes | Greiner Bio-one | 188271 | |
| Trypan blue | Sigma Aldrich | 93595 | CAS: 72-57-1 |
| NEON cell electroporation device | Thermo Fisher Scientific | MPK5000S |
参考文献
- Jahn, R., Scheller, R. H. SNAREs - engines for membrane fusion. Nat Rev Mol Cell Biol. 7 (9), 631-643 (2006).
- Hong, W. SNAREs and traffic. Biochim Biophys Acta. 1744 (2), 120-144 (2005).
- van den Bogaart, G., Jahn, R. Counting the SNAREs needed for membrane fusion. J Mol Cell Biol. 3 (4), 204-205 (2011).
- Bethani, I., Werner, A., Kadian, C., Geumann, U., Jahn, R., Rizzoli, S. O. Endosomal fusion upon SNARE knockdown is maintained by residual SNARE activity and enhanced docking. Traffic. 10 (10), 1543-1559 (2009).
- Verboogen, D. R. J., González Mancha, N., Ter Beest, M., van den Bogaart, G. Fluorescence lifetime imaging microscopy reveals rerouting of SNARE trafficking driving dendritic cell activation. eLife. 6, (2017).
- Degtyar, V., Hafez, I. M., Bray, C., Zucker, R. S. Dance of the SNAREs: assembly and rearrangements detected with FRET at neuronal synapses. J Neurosci. 33 (13), 5507-5523 (2013).
- Jares-Erijman, E. A., Jovin, T. M. FRET imaging. Nat Biotechnol. 21 (11), 1387-1395 (2003).
- Wallrabe, H., Periasamy, A. Imaging protein molecules using FRET and FLIM microscopy. Curr Opin Biotechnol. 16 (1), 19-27 (2005).
- JoVE Science Education Database Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE. , (2017).
- Thermo Fisher Scientific. . NEON transfection system cell protocols HeLa. , (2017).
- Kim, T. K., Eberwine, J. H. Mammalian cell transfection: the present and the future. Anal Bioanal Chem. 397 (8), 3173-3178 (2010).
- Barber, P. R., Ameer-Beg, S. M., Gilbey, J. D., Edens, R. J., Ezike, I., Vojnovic, B. Global and pixel kinetic data analysis for FRET detection by multi-photon time-domain FLIM. Proc. SPIE. 5700, 171 (2005).
- Barber, P., et al. Multiphoton time-domain fluorescence lifetime imaging microscopy: practical application to protein-protein interactions using global analysis. J R Soc Interface. 6 (Suppl 1), S93-S105 (2009).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Hinde, E., Digman, M. A., Welch, C., Hahn, K. M., Gratton, E. Biosensor Förster resonance energy transfer detection by the phasor approach to fluorescence lifetime imaging microscopy. Microsc Res Tech. 75 (3), 271-281 (2012).
- Stein, A., Weber, G., Wahl, M. C., Jahn, R. Helical extension of the neuronal SNARE complex into the membrane. Nature. 460 (7254), 525-528 (2009).
- Barstow, B., Ando, N., Kim, C. U., Gruner, S. M. Alteration of citrine structure by hydrostatic pressure explains the accompanying spectral shift. PNAS. 105 (36), 13362-13366 (2008).
- Shu, X., Shaner, N. C., Yarbrough, C. A., Tsien, R. Y., Remington, S. J. Novel chromophores and buried charges control color in mFruits. Biochemistry. 45 (32), 9639-9647 (2006).
- Veale, K. J., Offenhäuser, C., Lei, N., Stanley, A. C., Stow, J. L., Murray, R. Z. VAMP3 regulates podosome organisation in macrophages and together with Stx4/SNAP23 mediates adhesion, cell spreading and persistent migration. Exp Cell Res. 317 (13), 1817-1829 (2011).
- Gómez-Jaramillo, L., et al. Syntaxin-4 is implicated in the secretion of antibodies by human plasma cells. J Leukoc Biol. 95 (2), 305-312 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved