このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
筋ジストロフィーのマウス ・ モデルで歩行を測定するためのシンプルで低コスト分析
要約
このプロトコルでは、オープン フィールド活性測定法でマウス歩行を測定するためフレキシブル、低コストのシステムについて説明します。このシステムに基づいて 6 分間歩行試験mdxマウスにおける随意運動の減少を検出し、正確にこれらの動物の筋特異救助の改善を区別することを示す.
要約
前臨床試験の重要な側面は、筋ジストロフィーの治療に機能的な成果を測定します。マウスモデルの自主的な歩行の評価は、直接患者の歩行 6 分間歩行試験などの対策に似ています、モビリティのスコアを関連非侵襲的で再現可能な作業の試金。マウス歩行スピードと距離をテストするための多くの一般的な方法は、アリーナ内の動物の自由運動が時間をかけて測定されるオープン フィールド試験に基づいています。このアプローチの 1 つの主要な欠点はその商業ソフトウェアと高解像度モーショントラッ キング用機器は高価なマウスをテストするための専門施設に転送する必要があります。ここでは、無料とオープン ソース ソフトウェアを利用してマウス歩行を測定するための低コスト、ビデオベースのシステムについて述べる。デュシェンヌ型筋ジストロフィー (DMD) は野生型マウスの活動の相対的な減少はジストロフィン null mdxマウス モデルにおいて、自主的な歩行を示すこのプロトコルを使用して、.Mdxの研究遺伝子を発現するマウス、これらの活動の財政赤字は観察されないし、旅の総距離は野生型マウスと区別。このメソッドは、筋ジストロフィーの病理学に関連する自主的な歩行の変化の測定に有効ですし、多様な研究設定に容易に合わせることができる汎用性の高いプラットフォームを提供します。
概要
筋機能の信頼性と再現性のある測定は DMD の潜在的な治療の効果を評価するために重要です。DMD は、進歩的な筋肉弱さ、歩行、および最終的な心肺不全の損失につながるジストロフィン遺伝子の変異による遺伝性疾患です。DMD の最も広く利用された動物モデルはジストロフィン null mdxマウスです。機能テストのバッテリは、ジストロフィーなどの筋疾患のような動物モデルの同様、 mdxマウスの病気の進行を評価するためのルーチンのアッセイとして浮上しています。一般的に使用される生体内での試金、前肢握力、トレッドミル、ランニング、モーター アクティビティの追跡中に枯渇する時間、rotarod 最大、時間を掛かっている線があります。前臨床研究間のばらつきを軽減しマウス1,2でテスト治療のトランスレーショナルリサーチの可能性を高める目的と、これらのテストを標準化するフィールドには相当な努力をされています。
前臨床試験の 1 つの重要なカテゴリは、随意運動、筋ジストロフィー症マウスモデル内が頻繁に変更されるパラメーターの測定値です。これはオープン フィールドの活動の監視に基づくアッセイによってテストは通常、数分または数時間の2,3,4のコース上 (歩行) 水平または垂直 (飼育) の動きを評価する可能性があります。研究の数は、運動後特にmdxマウスに変更される随意運動を示しているし、薬物治療と病気の進行を重視するこれらの測定値が示されています。これらの試金の実行の 1 つの主要な制限は、専門的な高額の機器を必要です。ここでは、マウス歩行の容易に利用可能なリソースの使用を追跡する低コストの方法が表示されます。
6 分間歩行距離は、デュシェンヌ型筋ジストロフィー5,6を持つ個人で臨床の評価ツールとして一般的に使用される指標です。このメジャーの変更は、 mdxマウス7ゴールデン ・ リトリーバー (GRMD) 筋ジストロフィー犬8などデュシェンヌ型筋ジストロフィーのモデル動物での結果を評価するために使用されています。本研究では軽度の運動課題の直後 6 分で自主的なオープン フィールドの動きを記録します。歩行距離、時間をかけて水平方向の動きを測定する無料のオープン ソース ソフトウェアを使用してを求めた。
この方法の主な利点は、分析のための専用の機器や高コストの商業ソフトウェアを必要とせずさまざまな設定で動物をテストできることです。この分析の 1 つの重要な側面は、移動または専門中核施設にビバリウムからマウスを転送しなくても基本的な実験室の設定で実行できることです。ここで説明ビデオ追跡プロトコルは比較的短時間の期間にわたって歩行の評価に適してことができます野生型およびmdxマウスの活性の違いを検出し、救助の機能向上を明らかにします。DMD のモデル。
プロトコル
ここで説明する方法は、動物介護制度およびカリフォルニア大学ロサンゼルス校で使用委員会によって承認されました。野生型 (c57bl/6 j) およびmdxマウス (C57Bl/10ScSn バック グラウンド) は、商業ソースから購入しました。mdx: 研究 Tg マウス ケイ ・ デイヴィスからの許可とジェームズ Ervasti から贈られ、 mdxの背景に維持されました。歩行アッセイは、生後 6 ヶ月で雄マウスで行われました。マウス機関動物ケアによって確立されたガイドラインに従う寺崎生命科学ビバリウムで維持および使用委員会カリフォルニア大学、ロサンゼルス (承認 #2000-029-43)、これらの研究のための承認を受けた、カリフォルニア大学ロサンゼルス校動物福祉保証 (承認 #A3196-01)。
1. 商工会議所の準備
- 日9の一貫した時に静かで、温度調整された部屋でデータ収集を実行します。遺伝子型とテストされているマウスの治療に目がくらんでテストを実行します。
- この分析の任意のオープン フィールド チャンバー方式を適応します。
注: この研究では、大きなゴミ箱から構築した安価で簡単にトランスの記録室を使用します。オープン フィールド アリーナは、ケージまたは同じような高架のプラットフォームに設定トレイです。 - 完全アリーナ全体を記録するチャンバーの上の金網にカメラを配置します。
- 各試験の前に消毒記録室をきれいに。
2. 事前運動プロトコルとデータ収集
- 必要に応じて、直前の活動記録、筋肉の活性化のプロトコルで各マウスに挑戦します。
注: これはオプションですが推奨されるmdxマウス実験で。- デジタルフォース ゲージの引き棒をつかんで軽く引いて引き棒がリリースされるまでには、マウスを許可します。トライアル 5 回この手順を繰り返します。
- トライアルごとにレコードのピーク張力 (N)。
注: 歩行の試金のための練習課題として機能に加えて、このグリップ強度アッセイ中に動物によって加えられた力は追加機能結果メジャー2,10として使用できます。 - 各試行間の残りの 1 分で各マウスの 5 つの総試験を実行します。
- 活動室でマウスを置くグリップ強度試験や他の運動のプロトコルの直後します。
- 室内楽の分野でマウスの動きのビデオ録画を開始します。6 分を自由に探索するマウスを許可します。
- 6 分で録画を停止し、その家のケージにマウスを返します。
3. ビデオ分析
- 必要に応じて、フレーム レートを減らすことによって分析のためビデオを準備します。追跡分析のフレーム レートを減らすために 2 の要因によってビデオのフレーム レートを削減するのにはビデオ編集ソフト (例えば、iMovie または同様のプログラム) に次のプロトコルを使用します。
注: ビデオの長さやフレーム レートに応じてことができます分析の前にビデオのフレーム レートを削減します。本研究では 30 フレーム/秒 (6 分記録、合計約 10,800 フレーム) で撮影しました。- ソフトウェアにビデオをロードします。
- '速度'] メニューの [を選択 '速度: 高速' し速度を 2 倍に設定します。
- .Mp4 ファイル形式分析を追跡するための間引きビデオをエクスポートします。
- ソフトウェア プログラムで解析のためのビデオを開きます。[線] ツールを使用して、記録ビデオの調整を設定します。商工会議所の 1 つの側面に沿って線を引きます。行を右クリックし、「キャリブレーション測定...」を選択商工会議所側の実際のサイズをセンチメートル単位で入力します。
- マウスの位置の半自動追跡を開始、'移動' のカーソルをクリックします。
ビデオの最初のフレームから開始して、追跡する; ポイントを右クリックしてください。追跡ポイントは、青い円で示されます。
注: 本研究では各動物の位置は尾のベースをトレースによって追跡されました。 - キーボードの右向きの矢印をクリックして、フレームを進める追跡ポイントは、尾の基点の位置に基づいて自動的に移動する必要があります。
- 追跡位置は特定のフレームへの関心のポイントと揃っていない場合手動で、尾の根元にある青い丸を合わせます。
注: ビデオの品質とマウスの速度、に応じて追跡は興味のポイントとの整合性を維持するためにユーザー入力の変数のレベルを必要があります。マウスの軌跡は、ビデオのコースを進める必要があります。
- 追跡位置は特定のフレームへの関心のポイントと揃っていない場合手動で、尾の根元にある青い丸を合わせます。
- 完全なビデオのトラッキングが完了すると、ビデオ、およびトレースのオーバーレイを保存します。「スプレッドシートにエクスポート」を選択することによって、トレースの位置データをエクスポートします。
4. データ解析
- 表計算ソフトで位置データを開きます。運動解析ソフトウェアは、X, Y 座標の各フレームで、マウスの位置を報告します。
- フレームによって走行距離を計算する次の式を使用 (1 つのフレーム内の位置が、x1, y1フレーム 2、x2y2)。
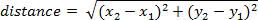
注: 時間の経過と共に累積距離は、各フレームの間の距離を追加することによって計算できます。
結果
オープン フィールド測定のバリエーションは、筋ジストロフィー症で病気の進行をテストする効果的な方法であると示されています。ここでは、汎用性の高いビデオ追跡二次元のマウスの動きを容易に利用できる録音機器とオープン ソース ソフトウェア (図 1 a-B) の解析手法を示す.Mdxマウスは、野生型マウス (
ディスカッション
オープン フィールド試験は筋疾患のマウスモデルの運動機能をテストするのには効果的かつ非侵襲的な方法を提供し、このアッセイのバリエーションは、前臨床試験のための貴重なエンドポイント測定として使用できます。このタイプの試金と 1 つの主要な制限は、活動監視システムの高コストと限られたアクセシビリティです。本研究では、既存の商業ソフトウェアおよび装置と同様の結...
開示事項
著者が明らかに何もありません。
謝辞
この作品は、国立衛生研究所 [R01 AR048179 と R.C.W、T32 AR059033、F32 AR069469to E.M.G R01 HL126204] と [274143 と R.C.W. に 416364] 筋ジストロフィー協会米国からの補助金によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| Video camera | Apple Inc. | ME553LL/A | For recording ambulation video, iPhone 5S Plus (or equivalent) |
| Kinovea software (version 0.8.15) | Kinovea Association | Open source video analysis software. Free download, PC compatible (Version 0.8.15, www.kinovea.org) | |
| iMovie (version 10.0.6) | Apple Inc. | Any similar software can be used to reduce video frame rate (optional) | |
| Roughneck 32 Gallon Black Round Trash Bin (Open field chamber) | Rubbermaid | # 1778013 | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. |
| Avant White Plastic Tray 15"W x 10"D x 1.45"H (Open field chamber) | US Acrylic, LLC | Any open field chamber system can be adapted for recording. This study uses a recording chamber constructed out of a tray on a platform, at the bottom of a large trash bin. | |
| C57BL/6J | Jackson Laboratory | #000664 | Male 6 month mice |
| C57BL/10ScSn-Dmd/J (mdx) | Jackson Laboratory | #001801 | Male 6 month mice |
| mdx: utrophin-Tg (fiona) | Gift from from James Ervasti, with permission from Kay Davies | Male 6 month mice |
参考文献
- Nagaraju, K., Carlson, G., De Luca, A. Behavioral and locomotor measurements using open field animal activity monitoring system. TREAT-NMD SOP Number M2.1.002. 2. 2, (2010).
- Tatem, K. S., et al. Behavioral and locomotor measurements using an open field activity monitoring system for skeletal muscle diseases. J Vis Exp. (91), e51785 (2014).
- Kobayashi, Y. M., et al. Sarcolemma-localized nNOS is required to maintain activity after mild exercise. Nature. 456 (7221), 511-515 (2008).
- Belanto, J. J., et al. Microtubule binding distinguishes dystrophin from utrophin. Proc Natl Acad Sci U S A. 111 (15), 5723-5728 (2014).
- McDonald, C. M., et al. The 6-minute walk test in Duchenne/Becker muscular dystrophy: longitudinal observations. Muscle Nerve. 42 (6), 966-974 (2010).
- Mazzone, E., et al. Star Ambulatory Assessment, 6-minute walk test and timed items in ambulant boys with Duchenne muscular dystrophy. Neuromuscul Disord. 20 (11), 712-716 (2010).
- Kobayashi, Y. M., Rader, E. P., Crawford, R. W., Campbell, K. P. Endpoint measures in the mdx mouse relevant for muscular dystrophy pre-clinical studies. Neuromuscul Disord. 22 (1), 34-42 (2012).
- Acosta, A. R., et al. Use of the six-minute walk test to characterize golden retriever muscular dystrophy. Neuromuscul Disord. 26 (12), 865-872 (2016).
- Sousa, N., Almeida, O. F., Wotjak, C. T. A hitchhiker's guide to behavioral analysis in laboratory rodents. Genes Brain Behav. 5, 5-24 (2006).
- Gibbs, E. M., et al. High levels of sarcospan are well tolerated and act as a sarcolemmal stabilizer to address skeletal muscle and pulmonary dysfunction in DMD. Hum Mol Genet. 25 (24), 5395-5406 (2016).
- Gillis, J. M. Multivariate evaluation of the functional recovery obtained by the overexpression of utrophin in skeletal muscles of the mdx mouse. Neuromuscul Disord. 12, S90-S94 (2002).
- Tinsley, J., et al. Expression of full-length utrophin prevents muscular dystrophy in mdx mice. Nat Med. 4 (12), 1441-1444 (1998).
- Song, Y., et al. Suite of clinically relevant functional assays to address therapeutic efficacy and disease mechanism in the dystrophic mdx mouse. J Appl Physiol. 122 (3), 593-602 (2017).
- Bolivar, V. J. Intrasession and intersession habituation in mice: from inbred strain variability to linkage analysis. Neurobiol Learn Mem. 92 (2), 206-214 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved