このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
腸管上皮細胞の透磁率を決定する体外と体内アプローチ
* これらの著者は同等に貢献しました
要約
2 つのメソッドは、腸管のバリア機能を決定するここで掲載されています。上皮メーター (ボルト/オーム) は、組織培養の井戸に直接培養上皮細胞の上皮電気抵抗の測定に使用されます。マウスで FITC デキストラン強制経口投与メソッドを使用して、体内の腸の透過性を判断します。
要約
腸粘膜バリアーを病原性微生物と微生物毒素に対して守る。その機能はタイトな接合部の透過性と上皮細胞の整合性によって調整され、腸管バリア機能の破壊は、消化管と全身性疾患の進行に貢献します。2 つの単純な方法は小腸上皮の透過性を測定するとおりです。体外、単層として炭酸カルシウム 2BBe 細胞培養ウェルズにメッキパーツをし上皮電気抵抗 (テル) は上皮 (ボルト/オーム) 計で測定できます。このメソッドは、そのユーザーフレンドリーな操作性と再現性のため説得力が。生体内で、マウスが 4 kDa かに (FITC) と gavaged-デキストランと FITC デキストラン濃度上皮の透過性を決定するためのマウスから収集された血清検体で測定されます。経口は、正確な用量を提供します、生体内で腸の透磁率を測定する方法です。一緒に取られて、これらの 2 つの方法腸上皮体外と体内の透水性を測定することができます、したがって病気とバリア機能間の接続を調査する使用します。
概要
腸管上皮細胞のみ、栄養素の吸収に責任がないが、また、病原性微生物や微生物毒素に対して守るために重要な障壁を形成します。この腸管バリア機能はタイトな接合部の透過性と上皮細胞の整合性1,2,3、によって調整され上皮バリア機能の機能不全、炎症性腸に関連付けられて病気 (IBD)。Perijunctional アクトミオシン リング (PAMR) タイトな接合に密接に隣接セルの中にあります。ミオシン軽鎖 (MLC) によって規制されている PAMR の収縮はタイト結合透磁率4,5,6,7、8の規則のために重要です 9,10。腫瘍壊死因子 (TNF) 骨折腸上皮 MLC キナーゼ (軽) 式、オクルディン内面11,12,13を誘導する腸の壁損失の中心です。
+の Na および Cl-などのイオンは、孔またはリーク経路14傍細胞領域を越えることができます。「漏れやすい」上皮におけるテル変化主に透磁率変化のタイトな接合を反映します。テルの測定は、タイトな接合部の透過、+の Na および Cl-、主に細胞膜のインピー ダンスに基づくを定量化する一般的な電気生理学的アプローチです。腸管上皮細胞、肺の上皮細胞と血管内皮細胞を含む多様な細胞型は、テル測定の報告されています。この方法の利点は、テルの測定が、非侵襲的、リアルタイムで生きているセルの監視に使用することができることです。さらに、テルの測定技術、薬剤毒性研究15に適しています。
カコ 2BBe 細胞は、構造と機能分化の小さい腸上皮細胞に似たひと上皮大腸腺癌細胞: たとえば、これらの細胞がある微絨毛と小さい腸ブラシに関連する酵素境界線。したがって、培養炭酸カルシウム 2BBe 単分子膜がバリア機能をテストするための in vitroモデルとして利用されています。
マウス腸管傍細胞透過性を勉強する 1 つの方法は、FITC デキストランの内腔から血液に入り込む能力を測定することによってです。したがって、腸の透過性は gavaging デキストラン投与によりマウスと血液内の蛍光測定に直接によって評価されます。次のプロトコル記述する腸上皮の透過性を評価するために 2 つの単純なメソッドの in vitroとin vivoの両方。
プロトコル
本研究は、動物のケアし使用プロトコルのケンブリッジ須田ゲノム リソース センター (カム SU)、東呉大学によって承認されました。
1. めっきと多孔性ポリカーボネート膜カコ 2bbe のメンテナンス
- メディアと T75 フラスコ内のセルの成長 (10% を含む DMEM FBS)。フラスコは、細胞密度によって定期的に供給する必要があります。
注: 最適なめっき細胞が急速に分割し、セルが成長段階にあることを示すフラット「目玉」の形をしています。 - 一度細胞が 80% 合流、インキュベーター外フラスコを取る、メディアを取り出します。1-2 ml の滅菌 PBS (せずに Ca2 +) の任意の残留メディアをすすいでください。ピペット 1.5 mL のトリプシン-EDTA フラスコに、優しくロック フラスコ;その後、揺動なし 20 分の 37 ° C の定温器にフラスコを配置します。
- 一方、細胞がトリプシン、24 ウェル プレートに多孔性ポリカーボネート膜 (細孔径、0.4 μ m; 表面積 0.33 cm2材料の表を参照してください) を含む場所を挿入します。基底の商工会議所 (膜の下の領域) に 1.0 mL の培地を追加します。
- ピペット 5 mL のフラスコと精力的にピペットにメディアのフラスコの側に対する細胞 5-10 倍緩い、個々 のセルまたは 2-3 セルを達成するために群生します。
-
頂の商工会議所 (膜の上部の空間) に (1:8 の希釈倍率を達成する) セルの 0.166 mL をプレートします。3 週間、37 ° C で孵化させなさい。
- フィードのセル 3 回毎週よく圧力ポンプを使用してそれぞれの基底のコンパートメントからメディアを慎重に吸引します。軽く各挿入の頂の商工会議所にメディアの 1 mL を滴下します。
2. 上皮メーター (ボルト/オーム) テルを測定するための使用
注: ポリカーボネート膜における文化の約 3 週間後炭酸カルシウム 2BBe セル、テルの測定にも対応。
- サイトカイン研究、測定、前日は肝腎の 10 ng/mL を含むメディアで基底メディアを置き換えます。実験の日、TNF の 2.5 または 7.5 ng/mL を含む HBSS でメディアを置き換えます。
注: 肝腎治療 TNF 受容体 2 (TNFR2) の発現を増加させる16。 - メーターを修正するには、入力ポートに補正電極を挿入し、「オーム」モードを選択します。メーター表示 1,000 Ω を読むまでは、ドライバーで R Adj スクリューを調整します。
- 15-30 分の 70% エタノールにそれらを置くことによって電極を滅菌し、それら空気乾燥 15 s. リンス実験細胞の培地に電極します。
- 電源をオンにし、「オーム」モードを選択します。慎重に基底の商工会議所と根尖部の商工会議所に短い端に電極橋の長い端を配置します。長い電極メディアがこれらの組織培養インサートの表面の下の短い電極を維持しながら、皿の底に触れることを確認します。電極を垂直に保つために。
- サンプル挿入の抵抗を測定し、0、1、2、3、4 h サイトカイン治療後に (すなわち、文化挿入セルなく HBSS) 空白を挿入します。抵抗値を記録します。
- 異なるプレート フォーマット間での一貫性を達成するため、抵抗と有効膜面積の積を計算します。
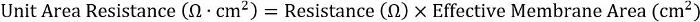
24 ウェル挿入、有効膜面積は 0.33 cm2です。
3. デキストラン硫酸ナトリウム (DSS) のマウスモデル-誘発大腸炎
- 3.5% (重量/巻) の最終濃度にオートクレーブ養生水に DSS を追加します。
- 3.5% を管理する 7 日間の合計は 8 週齢雄 c57bl/6 マウス DSS。コントロール マウス DSS せず定期的な飲料水を与えます。
- 7 日後、定期的な飲料水に DSS を含む水を切り替えます。
- マウスの重さし、毎日各マウスの臨床スコアを評価します。その初期の体重ごとのマウスの体重を正規化します。スコアは、疾患の重症度によると 4 つのパラメーターによって定義されます: アクティビティ (0-2)5出血 (0-2)、スツールの一貫性 (0-2) 直腸脱 (0-2)。最終的な臨床スコアのこれらのパラメーターからの点数を合計します。
- 結腸組織の病理組織学的条件を分析し、1.2% (巻/巻) Avertin (0.6 mL/10 g 体重) 7 日間ポスト DSS 処理 (i. p.) 腹腔内注入によるマウスを安楽死させます。100% タヴェルタンの在庫を準備、tert アミル アルコール 10 ml で 2,2,2 tribromoethanol の 10 g を混ぜます。 4 ° C で暗闇の中で保存します。使用して、水で 2% に 100% 株式を希釈します。
- コロンおよび盲腸を切り分け、コロン5の長さを測定します。
- 一晩 10% ホルマリン 10 mL を含む 15 mL ファルコン管内遠位大腸や修正から 0.5 cm セグメントをカットします。傾斜エタノール固定組織を洗う (75、95、および 100%)、キシレン。パラフィンの組織を埋め込み、ヘマトキシリン ・ エオジン染色8の 6 mm のセクションをカットします。
4. DSS 誘発大腸炎マウス上皮関門の透過性の測定
- DSS 投与の開始後 7 日関門の透過性を測定します。
- アッセイの日、3 h のマウスの高速します。
- オートクレーブ、強制経口投与は不妊、150 μ L 80 mg/mL 4 kDa 滅菌水で FITC デキストラン、強制経口投与マウスを確実に針し、血清コレクション後標準曲線を測定する未使用の FITC デキストランを維持します。透過性の計算のためのマウスの重量を量る。
注: FITC デキストラン ソリューションは、水にすべきであります。 - はさみのペアを使用して、尾の 1 cm 部分をクリップし、血清採血管に尾から 100 μ L の血液を収集します。室温で 10 分間、10,000 × g で収集した血液をスピンします。
- 血清 1:4 水で希釈します。標準的なカーブ、000、000、1:3、1:1、1: 300 で水と未使用 FITC デキストランを希釈する 1:10、000、1:30, 000、1: 100 000、1: 300 000、1:1, 000, 000、1:3, 000, 000。96 ウェル プレートに 100 μ L/ウェルの血清および標準曲線サンプルを追加します。
- 485 励起/528 発光プレート リーダーの蛍光を読み取る。基準曲線に基づいた透磁率の値を計算し、希薄化の修正に 4 を掛けます。
- (これによりマウスが病気および重量を失っている場合に FITC デキストラン配信の違いを正規化) 値を正規化する重量で FITC デキストラン濃度を割ります。
結果
文化では、カコ 2BBe 細胞が単層として成長し、ゆっくりと刷子縁がある成熟の吸収上皮細胞に分化します。このプロトコルでは炭酸カルシウム 2BBe セルされたポリカーボネート膜の高密度めっきし、細胞に達した 100% の confluency 播種後 1 日。ただし、セルは、この段階では差別化ではない: 完全にセルを区別するためにメディアが 3 週間ごとに 2-3 日間に変更されまし...
ディスカッション
プロトコルのいくつかの重要な手順があります。カコ 2BBe (ブラシの境界線-表現) 細胞は常にブラシの縁の蛋白質の表現のため炭酸カルシウム 2 細胞ラインから選択したテル測定用します。カコ 2BBe 細胞膜絨毛の吸収性表現型があるとき (文化後合流点の約 3 週間) 後十分に区別される17。測定時の汚染を避けるために、電極を滅菌する必要があります。プロシージャが非滅菌...
開示事項
著者は競合する金銭的な利益を宣言しません。
謝辞
ジェロルド ・ r ・ ターナーの博士、Brigham および女性の病院、ハーバード大学医学部からは、本研究を完了するために彼の寛大な助けを感謝いたします。この作品に支えられて (許可番号 81470804、31401229、および 81200620) 中国の国家自然科学基金、自然科学財団の江蘇省 (許可番号 BK20180838、および BK20140319)、研究開発、イノベーション プログラム江蘇省の大学の卒業生 (許可番号 KYLX16-0116)、東呉大学の研究プロジェクトの高度な (許可番号 SDY2015_06)、クローン ・大腸炎財団研究奨励賞 (許可番号 310801)。
資料
| Name | Company | Catalog Number | Comments |
| 22 G gavage needle | VWR | 20068-608 | |
| 4 kDa FITC-dextran | Sigma | 46944 | |
| Avertin | Sigma | T48402 | |
| Black 96-well plates for fluorescence | Fisher | 14-245-197A | |
| C57/B6 mice | Nanjing Biomedical Research Institute of Nanjing University | ||
| Caco-2BBe cells | ATCC | CRL-2102 | |
| Dextran sulphate sodium | MP Biomedicals | 2160110 | |
| DMED with high glucose and sodium pyruvate | Hyclone | SH30243.01B | |
| Epithelial (Volt/Ohm) Meter | Millicell-ERS | MERS00002 | |
| Ethanol | Sinopharm ChemicalReagent | 10009218 | |
| Falcon tube (15 mL) | Corning | 430791 | |
| FBS | Gibco | 10437-028 | |
| Fluorescence microscope | Olympus | FV1000 | |
| Fluorometer | Biotek | Synergy 2 | |
| HBSS | 138 mM NaCl, 0.3 mM Na2HPO4, 0.4 mM MgSO4, 0.5 mM MgCl2, 5.0 mM KCl, 0.3 mM KH2PO4, 15.0 mM HEPES, 1.3 mM CaCl2, 25 mM glucose | ||
| IFNg | PeproTech | 315-05-20 | |
| Modular Tissue Embedding Center | Leica | EG1150H | |
| Serum collection tubes | Sarstedt | 41.1378.005 | |
| T75 flask | corning | 430641 | |
| TNF | PeproTech | 315-01A | |
| Parraffin | Sigma | A6330-1CS | |
| Polycarbonate membranes (Transwell) | Costar | 3413 | |
| Pressure pump | AUTOSCIENCE | AP-9925 | |
| Rotary Microtomy | Leica | RM2235 | |
| Trypsin-EDTA | Gibco | 25200-056 | |
| Xylene | Sinopharm ChemicalReagent | 10023418 |
参考文献
- Turner, J. R. Intestinal mucosal barrier function in health and disease. Nature reviews. Immunology. 9, 799-809 (2009).
- Odenwald, M. A., Turner, J. R. The intestinal epithelial barrier: a therapeutic target?. Nature reviews. Gastroenterology & hepatology. 14, 9-21 (2017).
- Clarke, H., Soler, A. P., Mullin, J. M. Protein kinase C activation leads to dephosphorylation of occludin and tight junction permeability increase in LLC-PK1 epithelial cell sheets. J. Cell Sci. 113 (Pt 18), 3187-3196 (2000).
- Clayburgh, D. R., et al. A differentiation-dependent splice variant of myosin light chain kinase, MLCK1, regulates epithelial tight junction permeability. J.Biol. Chem. 279, 55506-55513 (2004).
- Su, L., et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis. Gastroenterology. 145, 407-415 (2013).
- Su, L., et al. Targeted epithelial tight junction dysfunction causes immune activation and contributes to development of experimental colitis. Gastroenterology. 136, 551-563 (2009).
- Zha, J. M., et al. Characterization of isoform expression and subcellular distribution of MYPT1 in intestinal epithelial cells. Gene. 588, 1-6 (2016).
- He, W. Q., et al. Altered contractile phenotypes of intestinal smooth muscle in mice deficient in myosin phosphatase target subunit 1. Gastroenterology. 144, e1451-e1455 (2013).
- He, W. Q., et al. Myosin light chain kinase is central to smooth muscle contraction and required for gastrointestinal motility in mice. Gastroenterology. 135, 610-620 (2008).
- Li, H. S., et al. Myosin regulatory light chain phosphorylation is associated with leiomyosarcoma development. Biomed. Pharmacother. 92, 810-818 (2017).
- Clayburgh, D. R., et al. Epithelial myosin light chain kinase-dependent barrier dysfunction mediates T cell activation-induced diarrhea in vivo. J. Clin. Invest. 115, 2702-2715 (2005).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. Am. J. Pathol. 166, 409-419 (2005).
- Ye, D., Ma, T. Y. Cellular and molecular mechanisms that mediate basal and tumour necrosis factor-alpha-induced regulation of myosin light chain kinase gene activity. J. Cell Mol. Med. 12, 1331-1346 (2008).
- Turner, J. R., Buschmann, M. M., Romero-Calvo, I., Sailer, A., Shen, L. The role of molecular remodeling in differential regulation of tight junction 300 permeability. Semin. Cell Dev. Biol. 36, 204-212 (2014).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J. Lab. Autom. 20 (2), 107-126 (2015).
- Wang, F., et al. IFN-gamma-induced TNFR2 expression is required for TNF-dependent intestinal epithelial barrier dysfunction. Gastroenterology. 131, 1153-1163 (2006).
- Peterson, M. D., Mooseker, M. S. Characterization of the enterocyte-like brush border cytoskeleton of the C2BBe clones of the human intestinal cell line Caco-2. J. Cell Sci. 102 (Pt 3), 581-600 (1992).
- Wang, L., et al. Methods to determine intestinal permeability and bacterial translocation during liver disease. J. Immunol. Methods. 421, 44-53 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved