このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
レーザーによる肺の結核病変における薬物の空間の定量化をキャプチャ レーザーマイクロダイ セクション液体クロマトグラフィー質量分析法 (LCM-LC/MS)
要約
ここでは、結核の肉芽腫内の薬剤分布の定量化が空間的に LC/MS 分析と相まってマイクロダイゼクション キャプチャを使用してプロトコルについて述べる。アプローチは高い空間の詳細で組織内の薬物濃度を定量化する幅広い適用性。
要約
結核はまだ罹患率と死亡率の世界の主要な原因であります。既存の薬物療法への改善と新規治療法の開発が緊急に必要です。成功した治療的介入に到達し、悪い血管壊死領域内 (caseum) 肺肉芽腫の細菌を滅菌する投与の結核薬の能力は欠かせません。効果的な化学療法従って有利な caseum の浸透性薬剤を含める必要があります。生体内薬物レベルを定量化するため現在の LC/MS メソッドの内で見られるよう小さな組織コンパートメント内にある絶対薬物濃度を正確に決定するが難しく、空間分解能機能が制限します。壊死性肉芽腫。病理学的個別組織領域のレーザー キャプチャ レーザーマイクロダイ セクション (LCM) を組み合わせて LC/MS 定量化のプロトコルをご紹介します。この手法は肉芽腫 caseum、周辺細胞の病変と関与しない肺組織内で薬の絶対定量を提供し、したがって、正確に殺菌濃度が達成されているかどうかを判断します。結核研究に加えて技術罹病組織における薬の空間分布の定量化のための多くの潜在的なアプリケーションには。
概要
空間的解決および薬剤のレベルを定量化する能力は、抗結核薬殺菌濃度1で肺の病変内細菌集団に達するかどうかを決定するための重要な要件です。特に重要なは通常細菌の最大数が含まれていますし、悪い血管新生の不在のための薬にアクセスできること (呼ばれる caseum) 部位、壊死性コアに麻薬浸透を決定です。
切除肺の病変の均質化を伴う病変の浸透を評価するために伝統的な方法溶媒抽出と液体クロマトグラフィー質量分析法 (LC/MS) の分析に続いて、高選択性の薬剤のため関心します。ただし、これらのメソッドは、貧しい空間については、元の均質化組織のサイズに制限を提供しています。エレクトロ スプレー イオン化 (デジ)4または液体が強化された表面抽出5、質量分析を用いたイメージング技術、マトリックス支援レーザー脱離イオン化 (MALDI)2,3などが脱離します。 6高空間分解イメージング機能を提供するが、直接定量は非常に挑戦的なまたは異種イオン抑制効果と様々 な細胞から試料の異なる抽出効率のために不可能することができますまたは、組織の7種類します。また、最も直接組織 MS イメージング技術は本質的にイオン化し、組織から薬物の低い溶媒抽出効率を奪い合う内因性種のクロマト グラフ分離の不足のための液体クロマトグラフィー/質量よりも敏感です。
レーザー キャプチャ レーザーマイクロダイ セクション (LCM) 液体クロマトグラフィー/質量分析と組み合わせるが日常的に分離し、異なる組織領域を特徴づけるプロテオーム研究8,9に適用されており、最近薬の定量化のために利用で投与動物組織10。ここで明確な肉芽腫コンパートメント内にある抗結核薬を定量化する LCM (LCM-LC/MS) の液体クロマトグラフィー/質量分析と組み合わせるを適用した最適化されたプロトコルを提案する.レーザー キャプチャ レーザーマイクロダイ セクション処理で紫外線レーザー焦点カットし、ユーザーが定義したパスに従うことによって目的の組織領域を分離する組織切片上に対物レンズ。重力アシスト LCM (本研究の要素技術) のティッシュ セクションは高分子薄膜の膜スライド (ペットまたはペン) にマウントされ、組織がスライドの下に配置されているコレクション チューブ キャップでキャプチャされます。薬を摘出組織から抽出し、標準の LC/MS のアプローチを用いて定量化.収集するために必要な組織の量は、予想される組織内に存在の薬物濃度と LC/MS 法の感度から最終的に決定されます。薬物治療上のレベルで投与を行い, 組織のルーチンのトリプル四重極質量分析計、300 万 μ m2 (3 mm2) を使用して多くの解析面積で十分です。
このプロトコルを記述する空間プロファイルの強力な組み合わせとにおける定量化提供 LCM-LC/MS による結核の肉芽腫のすべてのコンパートメント内にある絶対薬物濃度を提供します。技術は、重要な薬の発見と開発の情報を提供する多くの異なる病気にかかったティッシュで薬物濃度を決定するのにも適用可能性があります。
プロトコル
すべての動物の研究は、ケアと機関の動物愛護からの承認と健康の国民の協会の実験動物の使用および使用委員会の NIAID (NIH)、ベテスダ、メリーランド州のガイドに従って行われました。
1. 動物実験とティッシュのコレクション
プロトコルのこのセクションでは、動物の手続きとバイオ セーフティ レベル 3 (BSL3) の条件下でサンプルのコレクションについて説明します。結核菌エアロゾル感染プロシージャおよび薬物の管理のウサギのプロトコルがされている詳細なプロトコルは前述11,12。
- 感染結核HN878 とニュージーランド白ウサギ (男性と 4-5 ヶ月の古い女性)11鼻専用のエアゾール システムを使用すると、前述したようです。
- 2、6、および投与 24 h で動物の安楽死し、最寄りのルート経由で選択した薬 (ここで紹介する例ではエタンブトール) を管理します。まず、5 mg/kg では 35 mg/kg とキシラジン投与ケタミンでウサギを麻酔します。10 分待つし、尾をつまんと目に優しく触れ、適切な anesthetization を確認します。反応がない場合は、1 mL/4.5 kg 2 mL 滅菌生理食塩水でペントバルビ タールとフェニトイン (材料の表参照) の静脈内投与によって安楽死させます。
注: これらの縦長、エタンブトールの薬物動態学的プロファイルをカバーするために最適であり、他の研究薬の調整/最適化する必要があります。 - 鉗子、はさみ、メスを使用して、胸腔内から肺を削除、周囲の関与しない肺組織 (前述3) に埋め込まれた大きな壊死性肉芽腫を含む肺生検を切除します。壊死性肉芽腫が表示されますのベージュの色し、周囲の赤/ピンク色の肺から通常わずかに突出しています。簡単なセクショニングを促進するため、生検、2 × 1.5 × 1.5 cm を超えないように。
- 鉗子を使用して、トレイのベースとの直接接触に必要な切削面をあらかじめラベル付き cryomold トレイの上に生検を配置します。フリーズの後これは凍結切片がカットされます平らな面を提供します。
- 液体窒素の蒸気で生検を凍結します。液体窒素で 2 インチの深さに発泡スチロール容器を満たし、金属電線管ラックを配置します。ラックは必要があります組織トレーが配置されている平らな面を提供する液体窒素の表面上に突出しています。発泡スチロール容器にふたを閉めて 10 分の間完全に凍結する組織を残します。
- ティッシュ トレイを取り外してすぐにアルミ フィルムでラップにジッパーのついたビニール袋やシールを個別にラベルを配置します。ストレージの-80 ° C のフリーザーに転送します。
注: 手順 1.1 1.6 は BSL3 条件 (感染した臓器や組織の処理とすべての動物の仕事を含む) で実行されます。ガンマ照射 BSL3 格納容器外の処理を有効にする 3 メガラドに肺生検。施設安全プロトコルを承認された場合は、場所 BLS3 内無殺菌組織マイクロダイゼクション キャプチャが行われます。ただし、このプロトコルの残りの部分は、BSL 2 施設の下流の処理について説明します。
2. ティッシュ
- クリオスタットを必要な切削温度に設定します。クリオスタットに-80 ° C のストレージからガンマ線照射肺生検を転送し、組織温度を平衡に 30 分間放置します。注:-20 ~-22 ° C は結核病変の生検に最適です。
- ピンセットを使用して、クライオスタット チャック チャックに組織の基本を遵守する最適な切削温度接着剤 (OCT) の少量を使用するために生検を修正します。平らな面 (つまり、cryomold のベースと接触していた) が切断の表面組織に合わせます。これは後続の質量分析を妨げる可能性がある OCT は組織表面を汚染しないようにします。
- 25 μ m の厚みで 3 つの組織切片をカットし、ペット膜スライド上にマウントします。優しくティッシュ セクションに膜をタッチし、削除します。あまりにも多くの圧力を適用すると、薄い膜が破ける可能性があります。
- ティッシュ セクションの帯電と貧しい接着になるペット膜になるのでマウントする前にスライドの過剰な処理を避けてください。膜スライドは膜組織の融解取付や成功を付着できるように室温で保たれることを確認します。
- クリオスタットからスライドを削除し、3 分間の空気乾燥することができます。LCM-LC ・ MS/MS は直ちには行われず場合は、シール気密密閉式の小袋と郭清の必要になるまで-80 ° C のストレージに転送のスライドです。
- 10-12 μ m と雪解け-マウント ヘマトキシリンとエオシン (H & E) 染色および参照のための標準的なガラス スライド上で隣接するセクションをカットします。追加のセクションは、この時 (結核菌 (MTB) を可視化する抗 Niellsen) などの他の目的の組織化学汚れにカットできます。
3. レーザーマイクロダイ セクション
- -80 ° C のストレージからスライドを含んでいる密封された袋を取り外し、5 分間室温に到達することができます。
注: 場合は冷たいスライドは研究室の雰囲気にさらされてすぐに、組織が凝縮、被覆となるし、薬剤の空間の整合性が危険にさらされる可能性があります。 - 顕微鏡やレーザーをオンに (レーザーは、切断を開始する前に 5 〜 10 分のウォーム アップを必要と)。フラット キャップ 0.20 mL PCR チューブをホルダーに読み込みます。
- 袋からスライドを外し、フラット ベッド スキャナーを使用してペット スライドの組織切片の光学像を取る。
- スライド ホルダー (組織面を下に向けて) にスライドを配置し、顕微鏡のソフトウェアを使用して興味の特定の肉芽腫領域に別のコレクション チューブを割り当てます。通常、これらは関与しない 『 肺 』、'細胞肉芽腫、' になり、'caseum' (壊死部) であるが、特定の肉芽腫/生検病理によって異なります。
- 対物レンズ × 5 を使用して組織に焦点を当てます。この倍率は、両方の細胞と壊死性肉芽腫領域を含む組織の良い概要を提供する必要があります。ソフトウェア組織の下の位置に移動する 'caseum' を指定したチューブを選択します。
- 必要な解剖パラメーターを入力します。25 μ m 厚の肺セクションの典型的な設定はレーザー パワー 30、速度 15 と絞り値 35 (任意の単位)。ただし、これらは使用顕微鏡とレーザの年齢のための力の低下の可能性に応じて異なります。
- ' 自由に描画」ツールを選択し、マウスまたはタッチ スクリーンのペンを使用して、郭清の目的の地域を説明します。地域の面積は、ソフトウェアで表示されます。500,000 μ m2 (0.5 mm2) 容易に解離を容易にするために選択された領域を維持します。チューブ キャップの合計で収集された 300 万 μ m2 (3 mm2) まで郭清を繰り返します。
- 機会に、切り裂かれた地域があります (たとえば静的魅力) のための周囲の膜に立ち往生のままし、コレクション キャップに分類されません。ソフトウェア内で手動で削除するを選択して、累積的な表面積の合計からこれらの領域を削除します。
- '細胞病変」のキャップを選択し、300 万 μ m2 3.7 のステップで説明したように同じプロセスを使用して組織を収集します。
- '関与しない肺' 用のキャップを選択し、300 万 μ m2 3.7 のステップで説明したように同じプロセスを使用して組織を収集します。多くの細気管支および肺胞腔が関与しない肺組織に含まれていることに注意してください。郭清のために定義された組織領域から除外する注意を払います。
- キャップ ホルダーをはずし、慎重に外す、シール、各チューブにラベルを付けます。周囲の空気妨害 (開いたドアから空気流れ中断など) から切り裂かれたティッシュを保護します。切り裂かれたティッシュをすぐに分析または-80 ° C で保存し、解凍処理および LCMS 分析する前に。
4. 抽出および LCMS 分析
- 1:1 アセトニ トリル/メタノール エタンブトール d-10 内部標準を含む抽出液を準備します。使用、安定したラベル付きの試料薬剤 (のような重水素標識 EMB は、このデモで使用) 同位体を避けるために十分な質量シフトと十字の形態の試料薬と標準 (通常 4 ダルトン最低) 話内部標準を選択すると、.
注: は、ホモジネートの基準を作成するための非常に限られたコントロール組織があるため困難です各それぞれの組織型の磨砕液の規格を作成します。スパイク ホモジネート サンプルからの標準を作る代わりに、標準は空白組織とテスト混合物抽出と一緒を追加することによって作成できます。研究サンプルの切片のターゲット ・ ボリュームに合ったホモジネートの管理組織のボリュームは、特定の濃度であると思われる試験化合物の量と直接結合されます。 - 表面積と組織切片の厚さに基づいて対象となる組織の体積を計算し、標準や QC サンプルに追加されますホモジネートのボリュームを使用して磨砕液のために必要な希釈倍率を決定します。25 μ m の厚みと磨砕液 2 μ L 量 300 万 μ m2 (3 mm2) 解剖ターゲット領域の計算が下図の。
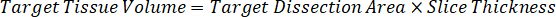
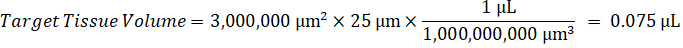
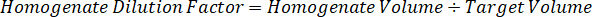

- 管理組織の 50 mg を計量し、希釈する PBS バッファーを追加して磨砕液のストックを準備組織密度 1 g/mL と仮定すると (26.67 磨砕液の希釈係数を用いたステップで計算された 4.2, 希釈剤は 1.283 mL)。ビーズ ビーズ ホモジナイザーで 1750 rpm で 5 分間肺組織と PBS バッファーを打つことによって均質化します。
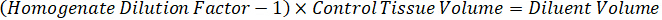
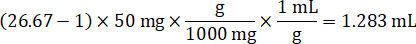
- ソリューションをスパイク標準曲線を作成する 1:1 アセトニ トリル/水 1 mg/mL 医薬品株濃度を希釈します。スパイク スパイク ボリュームとターゲットの組織ボリュームに基づき標準的な濃度を決定します。図示の例は 100 ng/mL 10 μ L スパイク ボリュームを使用して標準的なのです。
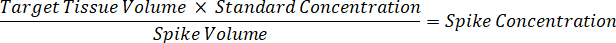
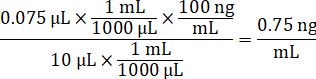
- -80 ° C のストレージから microdissected 組織を含むチューブを削除し、5 分間室温に到達できるようにします。
- Microdissected 組織を含むチューブと 1:1 アセトニ トリル/水液の 10 μ L と 2 μ L の PBS バッファーを追加します。
- 標準曲線および品質管理チューブ、コントロール肺乳剤を 2 μ l 添加するソリューションをスパイクの 10 μ L を追加します。
- 各チューブに抽出溶液 50 μ L を追加します。
- 渦各チューブ、5 分間 5 分間超音波し、フィルムや各管内組織のペレットを形成する 5 分間 5000 RPM で遠心分離機します。
- 深井戸 96 ウェル プレートに上澄みの 50 μ L を転送し、各ウェルの脱イオン水の追加の 50 μ L で希釈します。
- クロマトグラフィー/タンデム質量分析 (前述の記載は詳細12) エタンブトールとエタンブトール d10 の内部標準に最適化された計測器パラメーターを使用してを実行します。
- 各サンプルの解剖組織の正確な量を補正するためには、希釈係数を使用します。
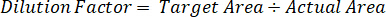
5. 方法の検証
- 1 部分肺、2 部分 PBS 3 4 スチール ビーズを組み合わせることにより制御肺組織で、磨砕液を作成します。ビーズ ホモジナイザーを使用して 1750 rpm で 5 分間肺組織と PBS バッファーを破った。
- 1 分の 10,000 の ng/mL (10 mg/mL) と渦の最終濃度を作成する 990 μ L ホモジネートに 1 mg/mL エタンブトール DMSO 株式の 10 μ L を追加することで磨砕液をスパイクします。
- Cryomold に磨砕液を注ぐと 5 分のドライアイスで急速に凍結して冷凍ホモジネート ブロックを作成します。
- 手順 2.1 2.5 でホモジネート ブロックから 25 μ m 厚いセクションを準備します。
- 3.2 3.10 の手順で指定したターゲット組織領域を分析します。
- Microdissected 組織を含むチューブに 10 μ L 1:1 アセトニ トリル/水と 2 μ L の PBS バッファーを追加します。
- 各チューブに抽出溶液 50 μ L を追加します。標準曲線を作成し、組織ホモジネート ブロック内薬物濃度を判断 4.9 4.12 の手順に従います。
- 以下の数式を使用して抽出効率を計算します。
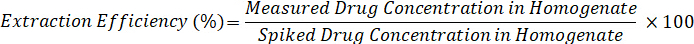
結果
LCM LC/MS アプローチの概要を図 1に示します。Γ 線照射による組織を殺菌後 (ティッシュ以降) からすべての後続の手順は BSL3 条件外開催します。図 2は、LCM によって組織分離の前後に、病変生検セクションを示しています。結核病巣の壊死と携帯電話のエリアを簡単に識別および光学画像 (隣接する組織の組織学的染色のセ?...
ディスカッション
肺の結核病巣内薬剤の空間分解の定量化は、薬曝露異なる病変コンパートメント内に存在する細菌の集団に殺菌濃度に達するかどうかを決定する必要があります。ここで説明した LCM LC/MS メソッドには、合計だけ 1-3 切片を使用して細菌の豊富な caseum を含むすべての病変のコンパートメント内にある抗結核薬の絶対定量ができます。伝統的な組織の均質化、しばしば体内薬物定量化の LC/MS 方...
開示事項
著者が明らかに何もありません。
謝辞
原稿のレーザーマイクロダイ キャプチャおよび Jansy Sarathy 前にウサギの組織の γ 線照射と助け、ポール o ' brien、Marizel ミナと動物実験のイザベラ ・自由民権、ジャ ・ ゴンザレスと NIH/NIAID からダニエル Weiner に感謝します。考えやアドバイス。この作品は、ビルからの資金によって支えられた、メリンダ ・ ゲイツ財団 (OPP1174780) と共有 NIH 計装 1S10OD018072 を付与します。ありがとう Eliseo A. Eugenin ライカ LMD 6500 顕微鏡へのアクセスを提供し、専門知識やアドバイスを共有します。購入・継続的な支援、LMD 6500 国立精神衛生研究所の助成金、MH096625、国立神経疾患と脳卒中、NS105584、運輸 (E.A.E) への資金と (E.A.E) に GSK 貢献によって資金を供給されました。
資料
| Name | Company | Catalog Number | Comments |
| New Zealand White rabbits | Covance | N/A | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| Acetonitrile (LC-MS grade) | Fisher | A955-212 | |
| Methanol (LC-MS grade) | Fisher | A456-212 | |
| Formic Acid (LC-MS grade) | Fisher | A117-50 | |
| Water (LC-MS grade) | Fisher | W6212 | |
| 0.2 mL flat-cap PCR tubes | Corning | 07-200-392 | |
| Steel frames, PET-membrane | Leica | 11505151 | |
| Premium Frosted Microscope Slides | Fisher | 12-544-2 | |
| 96 Deep well plate 2.0ML PP RB | Fisher | NC0363259 | |
| Zorbax SB-C8 column (4.6 by 50 mm; particle size, 3.5 μm) | Agilent | 820631-001D | |
| "Zipper” Seal Sample Bags | Fisher | 01-816-1B | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| CM1850 cryostat | Leica | Discontinued | Leica CM1860 is the current model |
| Laser Microdissection System 6500 | Leica | Discontinued | Leica LMD 6 is the current model |
| Agilent 1260 Infinity II HPLC | Agilent | ||
| API 4000 QTRAP Mass Spectrometer | Sciex |
参考文献
- Dartois, V. The path of anti-tuberculosis drugs: From blood to lesions to mycobacterial cells. Nat Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
- Roscioli, K. M., et al. Desorption electrospray ionization (DESI) with atmospheric pressure ion mobility spectrometry for drug detection. Analyst. 139 (7), 1740-1750 (2014).
- Prideaux, B., et al. Mass spectrometry imaging of levofloxacin distribution in TB-infected pulmonary lesions by MALDI-MSI and continuous liquid microjunction surface sampling. Int J Mass Spectrom. 377, 699-708 (2015).
- Griffiths, R. L., Randall, E. C., Race, A. M., Bunch, J., Cooper, H. J. Raster-mode continuous-flow liquid microjunction mass spectrometry imaging of proteins in thin tissue sections. Anal Chem. 89 (11), 5683-5687 (2017).
- Prideaux, B., Stoeckli, M. Mass spectrometry imaging for drug distribution studies. J Proteomics. 75 (16), 4999-5013 (2012).
- Dilillo, M., et al. Mass spectrometry imaging, laser capture microdissection, and LC-MS/MS of the same tissue section. J Proteome Res. 16 (8), 2993-3001 (2017).
- Xu, B. J. Combining laser capture microdissection and proteomics: methodologies and clinical applications. Proteomics Clin Appl. 4 (2), 116-123 (2010).
- Cahill, J. F., Kertesz, V., Van Berkel, G. J. Laser dissection sampling modes for direct mass spectral analysis. Rapid Commun Mass Spectrom. 30 (5), 611-619 (2016).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: A failed host immune response. Open Biol. 1 (4), 110016 (2011).
- Zimmerman, M., et al. Ethambutol partitioning in tuberculous pulmonary lesions explains its clinical efficacy. Antimicrob Agents Chemother. 61 (9), (2017).
- Kempker, R. R., et al. Cavitary penetration of levofloxacin among patients with multidrug-resistant tuberculosis. Antimicrob Agents Chemother. 59 (6), 3149-3155 (2015).
- Zhao, Y., et al. Unraveling drug penetration of echinocandin antifungals at the site of infection in an intra-abdominal abscess model. Antimicrob Agents Chemother. , (2017).
- Pascal, J., et al. Mechanistic modeling identifies drug-uptake history as predictor of tumor drug resistance and nano-carrier-mediated response. ACS Nano. 7 (12), 11174-11182 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved