Method Article
単一細胞のゲノムの配列のための超高スループット マイクロ流体プラットフォーム
要約
単一セル配列は生物学的システムにおける遺伝的異質性を明らかに、現在の技術は群集組成と機能の深いプロファイリングに必要なスループットを欠けています。ここでは、配列のためのマイクロ流体ワークフローについて述べる > 多様なから 50,000 の単一細胞ゲノム細胞群。
要約
シーケンス テクノロジーは、生物学的システムの一括から細胞多様性の役割の進化の理解への応答の単一セルの解像度へのパラダイム シフトを受けています。ただし、大規模な集団の単一セル配列をゲノム配列のための処理の制限によって妨げられています。本稿で単一細胞のゲノム液滴マイクロ流体を使用して、分離、増幅、単一細胞のゲノム解読 (SiC seq) とバーコードの手法について述べる。Microgels の電池を封止材により区分された精製と DNA の tagmentation マイクロ合併効率的にユニークな単一セル オリゴヌクレオチド バーコードを各ゲノムのペア間を許可する > シーケンスする 50,000 の単一細胞ごとに実行します。シーケンス データはバーコードで読み取り単一細胞由来のグループを生成する反多重送信します。単一セルの配列の高スループットと低バイアス方法として SiC seq は多様な細胞集団を対象としたゲノム研究の広い範囲を可能になります。
概要
ゲノムは提供しています携帯電話 id および有機体の全体を含む関数の青写真の潜在性をコーディングします。ゲノムのレベルで細胞生物学の理解は、異種細胞集団内で観察される表現型の多様性を説明できます。この不均一性は生物学的システムに明らかで、人間の健康および病気の広範な影響。たとえば、腫瘍細胞の中で遺伝子コピー数変異は進化とガン1,2の普及にリンクされています。細菌感染症で、病原性諸島ゲノムのごく一部に存在は水平方向に転送することができ、抗生物質耐性菌3,4の増殖に 。単一細胞レベルのゲノムの研究に主な課題は、DNA は細胞の何千もを分析する必要性と同様にフル遺伝子型の多様性をサンプルの少量です。これらの理由から、実験的スループットの制限は、単一細胞研究、最も豊富なセルに向かって結果をバイアスの効果を妨げています。5,6、光ピンセット7、一括ゲル8、およびマイクロ9の埋込みを並べ替えの流れなど単一細胞分離技術は、細胞配列の何百もの処理が可能ただし、これはほとんどのサンプルの小さい一部分だけを表します。大幅により高いスループットの単一細胞ゲノムの配列決定法によりこれらのコミュニティ内での遺伝的多様性の役割の解明、細胞集団のより深くより完全なプロファイリングできるようになります。
液滴マイクロ細胞と何百万もピコリットル分原子炉の内で生物学的試薬の高速操作ができます。までに、技術は、異種組織10、11,12, からの細胞の中で発現パターンの研究に使用されている点滴深くシーケンス長い分子1314, ,15、および単一セル16の行為クロマチン免疫沈降シーケンス (チップ seq) 分析。確かに、微小油滴中、高スループット、区分された操作、単一細胞ゲノムで影響を受けやすいアプリケーションを作ることができます。この技術の開発は、しかし独自のユニークな技術課題を提示します。細胞の分離、精製と一様にサンプルの細胞集団に、最小限のバイアスを増幅する必要があります。さらに、哺乳類細胞における polyadenylated mRNA のコピーと異なり無い対等な分子モチーフで、ターゲット核酸の捕獲を促進する遺伝子。これらの理由から、単一細胞ゲノムは液滴のプラットフォームで実装することは困難されています。
この作品は、以前に報告した単一細胞マイクロ取り組み17単一の実験で細胞の数万人のゲノムを配列することができるの詳細なプロトコルを提供します。SiC seq と呼ばれるこの技術は、細菌細胞のミクロン スケール ゲルのカプセル化し個別に溶解し, tagmented, とを介して細胞のゲノム DNA に融着接続はユニークなオリゴヌクレオチド バーコードを含む液滴を吸収合併、シングル オーバー ラップ拡張子ポリメラーゼの連鎖反応 (PCR)。ゲルは、高分子量 DNA 立体包み込まれている、洗剤などにアクセスし、バーコード18前に DNA を浄化する溶菌酵素より小さい分子を許可する分離のコンテナーとして機能します。このプロトコルの処理 > バーコード ライブラリ シーケンスの準備ができて、時間の問題で 50,000 の単一細胞。次のシーケンスは、読み取り、読み取りの数百万から成る細胞インデックスを持つ各データセットの結果、単一セル バーコード順序に従ってデマルチプレクスされました。
プロトコル
1. マイクロ流体デバイスの作製
- 準備、マイクロ コンピューター支援設計 (CAD) ソフトウェア (として提供されますを使用してマスクの設計。DWG;補助ファイルを参照)。プリント基板フィルム 10 μ m の解像度を持つベンダーがこれらのデザインをしています。
注: 多層マイクロ流体デバイスの対応するマスクにはアライメント マークが含まれます。 -
各デバイスのとおり SU 8 マスター金型 (図 1 a) を作製します。
- ウェハの中心に SU 8 3025 フォトレジストの約 1 mL を注ぐことによって直径 3-シリコン ・ ウエハを準備します。吸引を適用することによって、スピンコーターのウェハ チャックを固定します。
- 層の厚さの一覧については表 1を参照してください、各デバイスの速度をスピンします。すべてのデバイスに 30 でスピン コーティングを開始 500 rpm で s に続いて 30 示された速度で s。
- スピンコーター、柔らかく焼く鉄板の 135 ° C で 30 分間に設定ことが焼成後の部屋の温度に冷却するウェーハから SU 8 シリコンウエハを削除します。
- 3 分平行 190 mW、365 nm の UV LED の下で適切なマイクロ マスクによる SU-8-si ウエハを公開します。
- 曝露後ハード焼くホット プレート、ウエハーは 135 ° C、1 分に設定します。次のこのベーキング ステップ、部屋の温度に冷却するウェーハを許可します。
- 単層マイクロ流体デバイスの 1.2.7 のステップに進みます。多層マイクロ流体デバイス 1.2.1 - 1.2.5 フォトレジスト (図 1 b) の 2 番目の層のための手順を繰り返します。
- 次の単一のレイヤー デバイス (または多層デバイスの 2 番目のハード ディスク焼く) の最初ハード焼く、プロピレング リコール プロピレングリコールモノメチル エーテル アセテート (PGMEA) 30 分間の浴に浸漬することによってウェハを開発します。
- ウェーハの開発後、ウエハを洗浄するのに PGMEA を含むホヤの瓶を使用します。ホヤの瓶に乾燥する 1 分 135 ° C のホット プレートに置く前にイソプロパノールを含むウェーハ、すすぎ。
- ポリジメチルシロキサン (PDMS) 鋳造用シャーレにウェハ (今後マスターと呼ばれる) を配置します。
-
1.2 準備したマスター、PDMS 鋳造によるデバイス作製を行うに進みます。
- 質量 11:1 の比率で硬化剤とシリコーン系を組み合わせることにより、PDMS を準備します。攪拌棒で手でシリコーン ベースと硬化剤を混ぜます。
- ドガ、PDMS の脱ガス室にそれを置き、真空を加えることによって。ドガの空気の泡が表示されなくなるまでに PDMS を許可 (通常 30 分)。
- 脱 PDMS を最終 PDMS 層厚さの約 5 mm. 空気の泡の除去のように、再び PDMS ドガに、マスターに慎重に注ぐ。
- 脱気後、PDMS と 80 分で 80 ° C でマスターを焼きます。
- 慎重にかみそりの刃を使用して焼かれたマスターから硬化 PDMS スラブを切除します。シリコンウエハ上にあるすべてのカットが確実します。
注: シリコンウエハを任意のカット唇均一接着を防止する可能性があります。 - インレットとアウトレット 0.75 mm 生検パンチを使用してをパンチします。浮遊 PDMS 包装テープを用いたデバイスの機能面および塵を取除きます。
- プラズマ デバイスの処理、前にスライド ガラス 50 × 75 mm をイソプロパノールで洗浄して乾かしてきれい。
- プラズマ処理上向き機能を持つプラズマ ボンダーに PDMS スラブとガラス スライドを配置します。1 分接着ガラスにデバイスを露出することでスライドまたは顔を上げて一緒に側面の 1 mbar O2プラズマを用いたプラズマ処理を実行します。
- プラズマ治療後 40 分の 80 ° C でデバイスを焼きます。
- 最後に、疎水性マイクロ チャネルをレンダリングする入口の 1 つにガラス表面処理液を注入します。すべてのチャンネルがソリューション完全に殺到している各 dropmaker の注射を繰り返すことを確認します。過剰の溶媒を蒸発させるため 10 分の 80 ° C で処理デバイスを焼きます。
2 アガロース Microgels 細胞のカプセル化
注: は、図 2 aを参照してください。
- 3 w/v の x トリス EDTA (TE) バッファー 1 での低融点温度の agarose の 1 mL を準備します。アガロース溶液を注射器を読み込む直前まで 90 ° C の熱ブロックに離さない.
-
細胞懸濁液を準備します。
注: このプロトコルとその関連するマイクロ流体デバイスは、細菌細胞、冷凍ストックまたは新鮮な準備から作業に検証されています。哺乳類セルのセルの種類によってより大きなセル サイズに対応するマイクロ チャンネルの寸法の調整を必要があります。- リン酸緩衝生理食塩水 (PBS) の 1 mL の細胞を再懸濁します。
- 診断または流れを並べ替えるセルをカウントします。25 μ m microgels ターゲット細胞のカプセル化率 1 で 10、107セル/mL x 2.4 の最終的な集中で細胞を懸濁液の 1 mL を準備します。
- 3,000 x g で 3 分間吸引上澄みでセルをスピンダウンし、17 %v/v 密度勾配媒体の 1 mL の細胞ペレットを再懸濁します (材料表参照) PBS の。注射器ロードするまで氷の上におきます。
- 2%/w パーフルオロポリ エーテル ポリエチレン グリコール (PFPE PEG) 界面活性剤を含むフッ素オイル (HFE) 3 mL シリンジをロード、27 G 針と合う、シリンジ ポンプにそれを置きます。
注: フィットすべて注射器、マイクロ流体用 27 G 針付きは、このプロトコルで手順します。偶発的な穴をあけることのリスクを減らすためには、ポンプの運転が開始されるまですべての針にキャップを維持します。 - 1 mL 注射器に細胞懸濁液、溶融アガロースを読み込む、27 ゲージ針の両方に適合し、シリンジ ポンプにこれらを配置します。
- Agarose 注射器やポンプを agarose の注射器とインレット チューブでゲル化を防ぐために小さいスペース ヒーターで温めてください。スペース ヒーターを高に設定し、加熱面が注射器から約 10 cm それを配置します。注射器で測定された温度が約 80 ° C であることを確認します。
注: ユーザーはチューブの融解を含む機器の破損のリスクを軽減するポンプ装置からの推奨距離では、ヒーターを維持するためにお勧めします。 -
共同流れ dropmaking デバイスを使用して 25 μ m マイクロジェル滴を生成します。
メモ: デバイスの試薬の入口と出口の位置を示す概略図図 3 aを参照してください。- ポリエチレン (PE) 管の断片を用いたマイクロ流体デバイスの入り江に注射針を接続します。チューブを装置に挿入すると前、に首相のラインから空気を除去するポンプを実行します。
- チューブの部分をコンセントに接続し、15 mL 採取管の自由端を配置します。
- Dropmaking の次の (推奨) の流量を使用: 800 μ L/h HFE 2 %w/w PFPE ペグ。PBS; の細胞懸濁液 200 μ L/h3% の w/v agarose の 200 μ L/h。
- Dropmaking 後、4 ° C、30 分 agarose の完全なゲル化を確保するためにコレクションの管を配置します。
3. 速報、アガロース Microgels を洗浄
- 20 G 針、アガロース液滴の最上層を邪魔しないように世話を搭載 3 mL シリンジを使用してコレクションの管から油の下の層を削除します。
-
Perfluorooctanol (PFO) とエマルジョンを破る。
- アガロース滴に HFE の 10 %v/v PFO の 1 mL を追加します。ピペット、エマルジョンを徹底的にコートに 1 分のアップとダウンこのソリューション。
注: すべてのマイクロジェル洗浄のステップ、ピペット 1,000 μ L チップ ソリューションです。マイクロジェル サスペンションが均質とそれをピペッティング後塊の無料表示されます。 - アガロース microgels を収集するために 1 分間 2,000 x g で円錐形の管をスピンします。吸引; PFO/HFE 上清を除去します。microgels は、その界面活性剤層の無料今、明確なようで。
- アガロース滴に HFE の 10 %v/v PFO の 1 mL を追加します。ピペット、エマルジョンを徹底的にコートに 1 分のアップとダウンこのソリューション。
-
ヘキサン界面活性剤と microgels を洗ってください。
注意: ヘキサンは揮発性有機溶剤、発煙のフード 3.3 の手順で洗浄を実施する必要があります。- 1 %v/v ソルビタン モノオレート非イオン性界面活性剤 2 mL を追加 (材料表参照) アガロース microgels にヘキサン中。ミックスに 10 倍上下ピペット、ペレット、マイクロジェルの完全な崩壊を確保します。
- Microgels を収集するために 1 分間 1,000 x g でチューブをスピンします。界面活性剤/ヘキサン溶液を削除する上清を吸引します。
- 界面活性剤/ヘキサン洗浄を繰り返します。
-
残留有機溶剤を削除する緩衝水溶液で、microgels を洗います。
- 5 mL のテト バッファーを追加 [0.1 %v/v オクチルフェノールエトキシ レート非イオン性洗剤 (材料の表を参照) 1 x テで] 円錐管に。ミックスに 10 倍上下ピペットで移しなさい。
- Microgels を収集するために 2 分間 2,000 x g で円錐形の管をスピンします。テトのバッファーを削除する上清を吸引します。
- テトは 2 x を洗浄を繰り返します。
- 円錐管に 5 mL の 1 x TE バッファーを追加します。ミックスに 10 倍上下ピペットで移しなさい。
- Microgels を収集するために 2 分間 2,000 x g で円錐形の管をスピンします。TE バッファーを削除する上清を吸引します。
- テ洗浄を繰り返します。
- 10 μ 因数が付いているゲルの染色により顕微鏡 400 倍の倍率で microgels で電池の封止材を確認 1 x 核酸染色 (材料の表を参照してください)。
注: Microgels は、DNA、GFP チャネル (497/520 nm 励起/蛍光波長) の下で蛍光を発する携帯しながら透明なチャンネル クリアに表示されます。図 4 aに示すように、透明性と蛍光チャンネルのオーバーレイ、microgels のセルが表示されます。
4. 溶菌酵素を介して Agarose の細胞の換散
- 1 mL の酵素リゾチーム (凍結乾燥粉末)、EDTA (0.5 M 株の 15 μ L の 60 mg TE バッファー (1 x)、酵母細胞壁溶解酵素 (5 U/μ L ストック、最終 10 U/mL) ジチオトレイトール (1 M 在庫、最終的な 30 mM) の 30 μ L の 2 μ L の 800 μ L を使ったカクテルを準備します。、最終的な 7.5 mM)、ムタノリジン (100 U/μ L ストック、最終 200 U/mL) 2 μ L、lysostaphin (10 U/μ L ストック、最終 20 U/mL) の 2 μ L、塩化ナトリウム (1 M 在庫、最終的な 30 mM) の 30 μ L。
- 1 つの mL にボリュームを表示する追加の TE を追加します。ボルテックスによって、ソリューションをミックスします。
- 洗浄 microgels 1 mL 以上に溶解酵素溶液全体の 1 mL を追加します。ピペッティングの 10 倍で混ぜます。37 ° C で混合物を孵化させなさい > (最大値は一晩インキュベート) シェーカーの 2 h。
5. 洗剤ベース マイクロジェル治療
-
溶菌酵素 (ステップ 4) で溶解後、microgels を洗います。
- スピン ・ ダウン 2 分 2,000 x g で microgels と、上清を吸引します。水滴は、ペレットで分散した細胞の残骸のための不透明な白が表示されます。
- 10 mM トリス塩酸バッファーとミックスする 10 倍上下ピペット 5 ml、microgels を再懸濁します。
- 2 分 2,000 x g で混合物をスピンダウンし、清を吸引により除去します。
-
Microgels で洗浄処理を実行します。
- リチウム dodecyl 硫酸塩 (ふた) 換散バッファーでゲルを再懸濁します (20 mM トリス-HCl でふたを 0.5 w/v)、3 mL の最終巻に 0.5 M の EDTA の 60 μ L。
- プロティナーゼ K 酵素 (800 U/mL 在庫) の 5 μ L を追加します。上下に 10 倍、ミックスにピペットで移しなさい、細胞膜可溶化およびタンパク質の消化に 1 h 用熱ブロックの 42 ° C で混合物を孵化させなさい。
-
洗剤の治療の後、microgels を洗います。
- スピンダウン、microgels と円錐管 2,000 x g で 2 分間削除で上清吸引。
- 2 %v/ポリソルベート 20 水 10 mL で microgels を洗ってください。ミックスに 10 倍上下ピペットで移しなさい。
- 2 分間、2,000 x g で円錐形の管をスピンダウンし、清を吸引により除去。
- 残留酵素を不活性化し、100% エタノール 10 mL で microgels を洗ってください。ミックスに 10 倍上下ピペットで移しなさい。
- 2 分間、2,000 x g で円錐形の管をスピンダウンし、清を吸引により除去。
- 0.02 %v/ポリソルベート 20 水 10 mL で microgels を洗ってください。ミックスに 10 倍上下ピペットで移しなさい。
- 2 分間、2,000 x g で円錐形の管をスピンダウンし、清を吸引により除去。
- ポリソルベート 20 の繰り返しを洗う 3 x。任意の大きな塊を削除する最後の洗浄の前に 100 μ m セル ストレーナーをソリューションを通過します。
- 5 mL の DNA の劣化を防ぐため 10 mM トリス塩酸バッファーで、microgels を再懸濁します。Microgels は、tagmentation (ステップ 7) 前まで 1 週間の 4 ° C で保存されるかもしれない。
6. デジタル PCR によるバーコード液滴を生成します。
- X 低バインド チューブ TE バッファー 1 のプライマー (表 2) バーの 500 分在庫を準備します。各使用する前に 13 の在庫にプライマーを希釈し、ヒート ブロック 1 分 70 ° C まで加熱します。
- 75 を使用して 150 μ L の PCR 反応ミックスを準備 μ L の忠実度の高いホット スタート マスター ミックス (材料の表を参照してください) (2 x) 42 μ L の PCR グレード水、DNA_BAR プライマー (10 μ M 株式最終 0.2 μ M) の 3 μ L、P7_BAR プライマー (10 μ M 在庫 3 μ L、最終的な 0.2 μ M)、バーコード希釈 (40 fM 最終 13 株式) の 6 μ L、ポリソルベート 20 (50 %v/v 在庫、2%)、6 μ、15 μ L ペグの 6 k (50 w/v 在庫、5% の最終)。10 倍上下ピペッティングで混ぜます。
- 注射器に油を HFE の 200 μ L を描画することによって HFE バックアップの注射器を準備し、針に適合。PE 管のセクションを針に付けるし、手でラインをプライムします。ターゲット ソリューションに PE チューブの先端を挿入し、慎重に PE チューブと注射器に PCR ミックスの 150 μ L すべてを描画します。シリンジをシリンジ ポンプに読み込みます。
- ロード 2%/w パーフルオロポリ エーテル ポリエチレン グリコール (PFPE PEG) 界面活性剤を含むフッ素オイル (HFE) を 1 mL の注射器、針と合う、シリンジ ポンプにそれを置きます。
-
共同流れ dropmaking デバイスを使用して 25 μ m バーコード滴を生成します。
メモ: デバイスの試薬の入口と出口の位置を示す概略図図 3 aを参照してください。- 鉛の小片を持つ共同流 dropmaker デバイスの細胞口に差し込みます。
- HFE と読み込まれた注射器を接続し、PCR ミックスは PE 管の断片を用いたマイクロ流体デバイスの入り江にバーコードの溶融 Agarose入口を使用して PCR ミックス。チューブを装置に挿入すると前、に首相のラインから空気を除去するポンプを実行します。
- チューブの部分をコンセントに接続し、0.2 mL PCR チューブに自由端を置きます。Dropmaking の次の (推奨) の流量を使用: 600 μ L/h HFE 2 %w/w PFPE ペグと PCR ミックス 200 μ L/h。各チューブに水滴の約 50 μ L で PCR チューブに滴を収集します。
- Dropmaking 後、ゲル読み込みピペット先端を使用してエマルジョンから HFE 油の下の層を慎重に取り外し、5%/w PFPE ペグ界面活性剤を含む FC 40 フッ素オイルを置き換えます。次のプロトコルと熱サイクル: 3 分の 98 ° C、40 x (98 ° C、10 s、62 ° C、20 s、20 の 72 ° C s)、5 分と 12 ° C でし、保持のための 72 ° C
注: 熱循環液滴は 1 日最大 4 ° C で保存されるかもしれない。 -
バーコードの増幅とカプセル化の率を確認します。
- 1 x の核酸を準備 2%/w PFPE ペグ界面活性剤; で HFE で (材料の表を参照) を染色汚れは HFE に若干混和性、液滴に DNA にバインドされます。
- バーコードの熱循環エマルジョンの 1 μ L を汚す石油の 10 μ L に追加します。室温で 5 分間インキュベートそれら。
- 200 倍の倍率で蛍光顕微鏡 (GFP チャネル, 497/520 nm 励起/蛍光波長) による水滴のイメージ、バーコード カプセル化率をカウントします。信号が離散されることに注意してください: 増幅されたバーコードを含んでいる小滴、蛍光を発する明るく、一方、空の滴は暗く表示され (図 4 b)。
7 滴でゲノム DNA の Tagmentation
注:図 2 bを参照してください。
- 500 μ L の次世代シーケンシング ライブラリの準備から試薬を用いる tagmentation ソリューションを準備キット (材料の表を参照してください)。Tagmentation 酵素の 7 μ L、tagmentation バッファーの 250 μ L、243 μ L の PCR グレードの水を使用します。ボルテックスでそれらをミックスし、収集するために混合物をスピンダウンします。HFE オイル バックアップ 1 mL 注射器にこのソリューションを読み込むし、針と合います。
-
Microgels を還元に備えます。
- 2,000 x g で 2 分間マイクロジェル管でスピンダウンし、上清を吸引します。ゲルの 200 μ L をゲル読み込みピペット先端部で HFE バックアップ注射器の上部に転送し、テープの小片とノズルのシールします。
- 3 D プリントされた遠心分離機のアダプターを使用して (補足のファイル 1と2を参照)、3,000 x g で 3 分のマイクロジェル シリンジをスピンします。
- ゲルの読み込みのピペット チップを使用して注射器から液の上清を削除します。シリンジ ノズルのベースにマイクロジェル層をプッシュします。針と注射器を合います。
- ロード 2%/w パーフルオロポリ エーテル ポリエチレン グリコール (PFPE PEG) 界面活性剤を含むフッ素オイル (HFE) 3 mL の注射器、針と合う、シリンジ ポンプにそれを置きます。
- 再 tagmentation 試薬を含んでいる小滴に、microgels をカプセル化します。
メモ: デバイスの試薬の入口と出口の位置を示す概略図図 3 bを参照してください。- HFE、tagmentation ミックス、および PE 管の断片を用いたマイクロ流体デバイスの入り江に microgels を含む注射器に接続します。チューブを装置に挿入すると前、に首相のラインから空気を除去するポンプを実行します。
- チューブの部分をコンセントに接続し、1 mL の線に描かれたプランジャーと空 1 mL の注射器で自由端を配置します。
- Dropmaking の次の (推奨) の流量を使用: HFE 2 %w/w PFPE ペグ 2,000 μ L/h、200 μ L/h、microgels、tagmentation ミックス 500 μ L/h。
- 400 倍の倍率で光学顕微鏡下のマイクロジェル カプセル化率を確認します。図 4に示すように、水滴の約 80-90% は、マイクロジェルを含める必要があります。
- Tagmentation エマルジョンの入った針付き注射器をフィットし、熱ブロックやゲノム DNA を断片化する 55 の ° C で 1 時間オーブンで直立それを孵化させなさい。
8 単一細胞マイクロ ダブル合併によるバーコード
注: は、図 2を参照してください。
- FC 40 石油留分を HFE 2%/w PFPE ペグに置き換えることによって合併のバーコード液滴を準備します。慎重にこれらの滴を 1 mL 注射器に転送、針と合う、シリンジ ポンプにそれを置きます。
- 孵化と tagmented のマイクロジェル液滴シリンジをシリンジ ポンプに読み込みます。
- 500 μ L の PCR ミックスを準備します。沈殿物の形成を防ぐために以下の順番で試薬を追加: 140 μ L の PCR グレード水 P5_DNA プライマー (10 μ M 株式最終 0.2 μ M) の 10 μ L、P7_BAR プライマー (10 μ M 株式最終 0.2 μ M) の 10 μ L、6 k (50 w/v 純正ペグの 50 μ L、5% 最終)、ポリソルベート 20 (50 %v/v、株式 5% 最終) 50 μ、250 μ L の Taq マスター ミックス (2 x) (材料の表を参照)、等温ポリメラーゼの 10 μ L (材料の表を参照)、および中和バッファーの 10 μ L (材料の表を参照してください)。10 倍上下ピペッティングでそれらをミックスし、それを収集するために混合物をスピンダウンします。HFE バックアップ 1 mL 注射器にこのソリューションを読み込み、針と合う、シリンジ ポンプにそれを置きます。
- 負荷 3 3 mL 注射器フッ素オイル (HFE) を含む 2%/w パーフルオロポリ エーテル ポリエチレン グリコール (PFPE PEG) 界面活性剤、針でそれぞれに合うし、シリンジ ポンプに配置します。
- 2 M NaCl を 3 つ 1 mL シリンジ、針でそれぞれに合うし、脇に設定します。
-
バーコード小さな tagmented ゲノム滴をマージし、PCR ミックス ダブル合併デバイスを使用します。
メモ: デバイスの試薬と電極の入口と出口の位置を示す概略図図 5を参照してください。- 2 電極の入り江や PE 管の単一堀 inletusing ピース 3 塩化ナトリウム注射器に接続します。ため、電極用圧力注射器に手動で適用電極は完全に食塩水で満ちているまで。充填後、電極は堀が塗りつぶされるまでに堀注射器に手動圧力を適用します。鉛の小片と堀の無料の端を差し込みます。
- 2 スペーサー オイルの入り江と PE チューブの dropmaking オイル inletusing 部分にポンプに装着 3 の HFE の注射器を接続します。チューブを装置に挿入すると前、に首相のラインから空気を除去するポンプを実行します。
- PCR ミックス シリンジを接続、マイクロジェル滴注射器、およびバーコード PE チューブを使用して彼らのそれぞれの入り江に注射器が値下がりしました。注射針; にそれらを接続する前に帯電防止の銃を持つすべての液滴還元チューブを撮影します。帯電防止処理は、PE 管の静電気による液滴の合体の危険を減らします。
- PE チューブの部分をコンセントに接続し、0.2 mL PCR チューブに自由端を置きます。
- 電極注射器の針をワニ口クリップを使用して冷陰極蛍光灯インバーターに接続します。インバーターの DC 電源を 2 V に設定します。
- 推奨流量とダブル合併デバイスを実行: tagmented マイクロジェル滴 300 μ L/h、バーコード滴、HFE 2 %w/w PFPE ペグ (dropmaking オイル) 1500 μ L/h、600 μ L/h の増幅に 100 μ L/h ミックス、HFE 2%/w PFPE ペグ (200 μ L/hバーコード スペーサー油)、および HFE 2 %w/w PFPE ペグ (マイクロジェル スペーサー油) の 700 μ L/h。エマルジョン各管内の約 50 μ L の PCR チューブに滴を収集します。
- サーマル サイクリング前にゲル読み込みピペット先端を使用してエマルジョンから HFE 油の下の層を慎重に取り外し、置き換えて FC 40 フッ素オイル 5%/w PFPE ペグ界面活性剤を含みます。次のプロトコルと熱サイクル: 65 ° C、5 分、2 分の 95 ° C、30 x (95 ° C、15 秒、1 分、72 ° C 1 分の 60 ° C)、72 ° C、5 分後 12 ° c. で開催
-
熱循環の液滴から DNA バーコードを回復します。
- 微量遠心チューブに水滴をプール、PFO の 20 μ L を使用してエマルジョンを破る。渦 10 のためにそれらをミックスする s。
- 水溶液 (上) と (下) の油相に混合物を分別に 1 分間、10,000 × g でチューブをスピンします。慎重に、ピペットを使用してチューブから上方の水層を削除し、新しい微量遠心チューブにそれを転送します。油相を破棄します。
- 製造元のプロトコルに従ってスピン列にバーコードの PCR の製品の浄化、1 x TE バッファーの 20 μ L の溶出です。
- 実行シーケンスと 9 と 10 の手順に従って分析に進みます。
9. 図書館準備とシーケンス
- 製造元のフラグメント サイズ選択及び定量化のプロトコルに従うことによって、シーケンスの単一セル ライブラリを準備します。
- シーケンス 1 読み取りと読み取り 2 にデフォルト化学とペアエンド ライブラリ。カスタム インデックス 1 プライマー I7_READ を使用 (表 2) 15 bp インデックス読み取り、単一セルのバーコードに対応するため。
10. 単一セルのデータ解析
注: 品質管理および SiC seq データの予備的分析のカスタムの Python スクリプトは、https://www.github.com/AbateLab/SiC-seq からダウンロードできます。
- "BarcodeCleanup.py"バーコード読み取りに品質管理を行い、SQLite データベースに単一セルのデータをエクスポートするスクリプトを実行します。制御実験用このスクリプトを"-整列"フラグが既知の参照ゲノムに読み取りを合わせて設定。
- スクリプト"purity.py"を使用してバーコードのグループ (の制御実験) の純度を分析し、図 6Bで一貫性のある高純度の値を確認します。
結果
SiC seq 実験ワークフローでは、3 の PDMS マイクロ流体デバイス作製ソフト ・ リソグラフィー プロシージャ (図 1) を使用して含まれています。共同流 dropmaker (図 3 a) は、25 μ m の単一細胞意識付いている genomic DNA の分類のためのデジタル バーコード液滴を生成します。バーコード オリゴヌクレオチドは、PCR 増幅 (表 2、プライマー バー) のハンドルが並ぶ 15 bp 縮退シーケンスで構成されます。バーコードは、単一分子カプセル化を達成するためのフェムトモル濃度に希釈が、全て滴が 0 または 1 のいずれかのバーコード断片を受け取る。バーコードを含んでいる小滴が増幅され、二本鎖バーコード amplicons の多くのコピーを降伏します。核酸染色を使用して、成功の増幅を確認しバーコード フラグメント (図 4 b) のカプセル化率を定量化できます。Microgels は、細菌の細胞懸濁液と等しい流速 (図 2 a) で溶融 agarose のゲル流によって生成されます。共同流れ dropmaking プロセスは効果的に 2 の要因によって水溶液を希釈、agarose が目的の最終濃度 2 倍で用意しています。Agarose が冷えると、液滴の球の体積を占める 25 μ m 径マイクロジェルに固化します。
一連の洗浄および換散の手順は、microgels (図 2 b) における高分子量の DNA を浄化します。エマルションを破壊後水性洗浄トレースを下流の酵素治療を阻害することができる有機溶剤を希釈する大ボリュームで実行されます。洗浄 microgels は、細胞カプセル化率 (図 4 a) を確認するには顕微鏡の下で観察されます。幅広い溶菌活性を持つ酵素は、細菌や真核微生物19の細胞壁を消化するマイクロジェル サスペンションに追加されます。プロティナーゼ K と洗剤第 2 処置は蛋白質が低下し、可溶性細胞の残骸。
浄化された DNA の Tagmentation は水滴 microgels18の間の小さな tagmented DNA のフラグメントの拡散から生じる潜在的なクロス汚染を避けるために行われます。液滴封止のデバイス (図 3 b) 個人的各マイクロジェル同時にも"タグ付けしながら"それとプリロードされたオリゴヌクレオチド20二本鎖 DNA のフラグメント バッファーと tagmentation 酵素。Microgels は、いくつかダブレット21 (図 4) のすべてのドロップの 1 マイクロジェルに近づいているカプセル化率を達成するため、密充填粒子として水滴に読み込まれます。
マイクロ流体ワークフロー (図 2) の最後のステップでは、デバイスは 1 滴、バーコード、1 マイクロジェル含むドロップ制御段階で増幅ミックスを組み合わせることダブル合併操作を行います。まず、PCR 試薬を含む液滴がペアになって、黄色 (図 5) に示すように地域でバーコード ドロップを吸収合併します。マイクロ流路中で塩水の電極は、液滴の合併をトリガーする高電界勾配を生成します。同様の方法で最初のマージされた液滴はマイクロジェル液滴とペアになって、赤で示した地域で 2 番目の時間を吸収合併します。水滴は、収集され、熱循環シングル重複の拡張 (SOE) PCR のチップをオフ。バーコードと tagmented のゲノム DNA の重複の相補的な両端は融合とのみ正しくバーコード構造の指数関数的増幅を許可します。
シーケンス データの読み取り品質によって最初フィルターし、15 bp 単一セル バーコード順序に従って読み取りをグループ化して解析されます。有効と見なされるバーコードのグループ、それは読み取り; の最小数を含める必要があります。この閾値はシーケンス データの有用な量のセルに分析を制限し、データセットから PCR 変異バーコード「孤児」を削除します。このサンプルを実行すると、最小値はグループごとの 7.5 kbps に設定 (150 50 読み取り各 bp)。グループ サイズ対バーコード数のヒストグラムは、しきい値のサイズ (図 6 a) のすぐ上にある有効なバーコード グループの重要な部分を示しています。
微生物群集の組成は知られている制御実験、純度および相対的な豊かさの指標を使用して SiC seq の実行の品質を評価します。ここでは、3 グラム陰性細菌、5 グラム陽性菌および 2 酵母から成る合成 10 細胞社会を分析します。指定されたバーコード グループの純度は、グループに読み取りの合計数で割った値グループで最も一般的なゲノムへのマッピングの読み取りの数として定義されます。バーコード グループの大半はある純度 0.95 (図 6 b) より大きいです。細胞の種類の相対的な豊かさは、raw 読み取りをカウントすることによって、グループは、そのメンバーの読み取り (図 6) の合意に対応する携帯型を割り当て、バーコード グループを数えることによって計算されます。読み取りやバーコード グループの豊富な細胞集団がその特定の種が過度に小規模または大規模なバーコード グループに含まれていないサンプルされていることを示す、ほぼ等しい割合で追跡します。ほとんどまたはまったくドロップ アウト領域 (図 7) の全体のゲノム全体にわたる高いカバレッジを示します単一種からすべてのバーコード グループの集計範囲をプロットします。正規化された範囲値、平均値を中心としたほとんどの値の頻度分布とカバレッジの均一性を確認できます (図 7、挿入)。
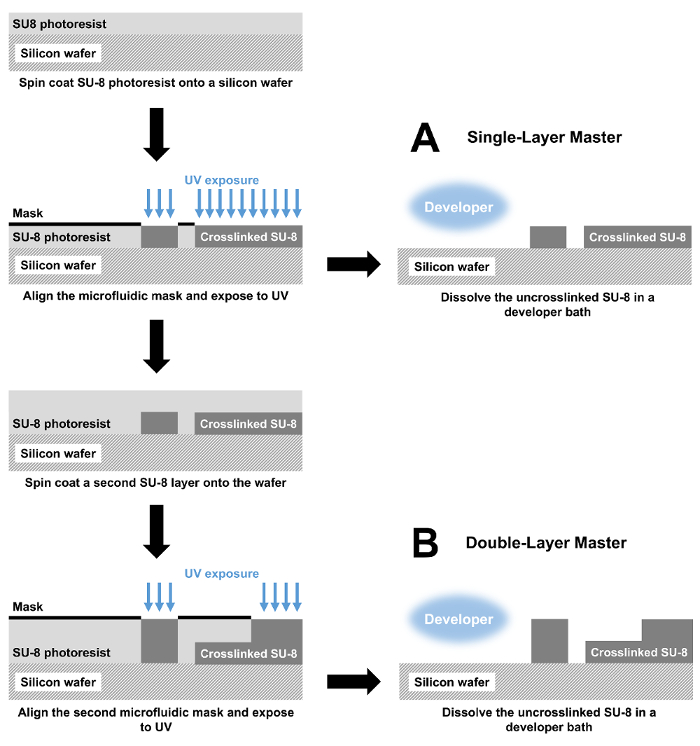
図 1: フォトリソグラフィによるマイクロ流体デバイスの作製します。(A) マスター スピン コーティング シリコン ・ ウエハに SU 8 フォトレジスト層によって単一機能の高さと金型を作製します。フォトレジストは、フォトリソグラフィー マスクと紫外光、架橋露出 SU 8 模造されました。最後に、uncrosslinked SU 8 開発者風呂に溶解しています。結果の型を使用して、完全なマイクロ流体デバイスを生成するスライド ガラスに接合された PDMS をキャストします。(B) 二重層デバイスの製造は同様にスピン コーティングと露出の手順で開始します。これらの手順を繰り返します 2 層デバイスを作成します。この図の拡大版を表示するのにはここをクリックしてください。
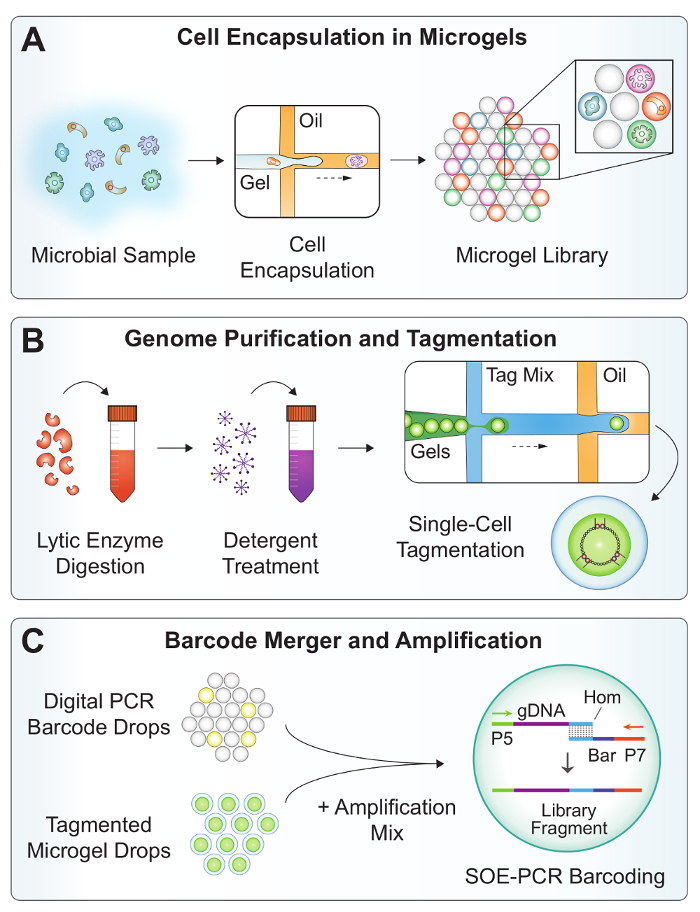
図 2:SiC seq のワークフローの概要。(A) A 菌懸濁液は microgels 内の単一セルをカプセル化する dropmaker デバイスで溶融 agarose が付いて共同流れた。(B)、microgels は細菌のゲノム DNA を浄化する洗浄のシリーズにさらされます。溶菌酵素消化のグラム陽性菌や酵母、細胞壁と洗剤可溶性細胞の残骸。Microgels は、再交差汚染を減らすために tagmentation の液滴にカプセル化。(C) マイクロ合併を組み合わせたデジタル PCR バーコード、tagmented マイクロジェル ゲノム、率で増幅ミックス > 1 kHz。オフチップ SOE PCR 継手 tagmented ゲノム上に一意の単一セルのバーコードとバーコードの構成要素を選択的に増幅完全に。この図の拡大版を表示するのにはここをクリックしてください。
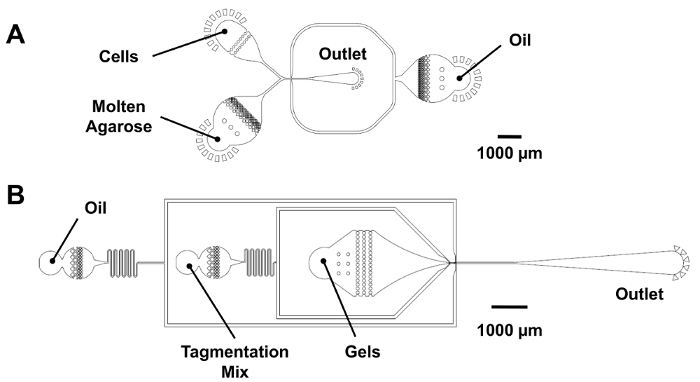
図 3:Dropmaking、マイクロジェルの再封止用マイクロ流体デバイス。(A) このパネル共同流 dropmaker (機能の高さの 25 μ m) を示しています。25 μ x 25 μ m ジャンクション 25 μ m の液滴を生成する同じ流量でデバイスに細胞溶解アガロースを紹介します。デジタル バーコード dropmaking 携帯入口が差し込まれている、アガロース入口に PCR ミックスを導入します。(B) このパネルは、マイクロジェル再封止のデバイス (機能の高さの 25 μ m) を示しています。Microgels は稠密順序を維持し、25 μ x 30 μ m ジャンクションで再封止の前に tagmentation ミックスの量を受け取る漏斗状の口に流れ込みます。この図の拡大版を表示するのにはここをクリックしてください。

図 4: Microgels と液滴の顕微鏡写真です。(A) このパネル洗浄酵素溶解前に 25 μ m の microgels を示しています。細菌は、カプセル化率の定量化のため蛍光染色します。ポアソン統計を読み込むセルが 10 で 1 滴の割合でカプセル化されたまたは複数カプセル化イベントの頻度を最小限に抑える以下であることを指示します。(B) このパネルは核酸染色処理 25 μ m デジタル バーコード液滴の蛍光顕微鏡像を示しています。増幅バーコードの断片を含んでいる小滴は、強い蛍光信号を生成します。(C) このパネルは、50 μ m の水滴にカプセル化再 microgels を示しています。カプセル化に関しましてはいくつかダブレット 1 ドロップ 1 ゲル、microgels の近いパッキングが可能です。この図の拡大版を表示するのにはここをクリックしてください。
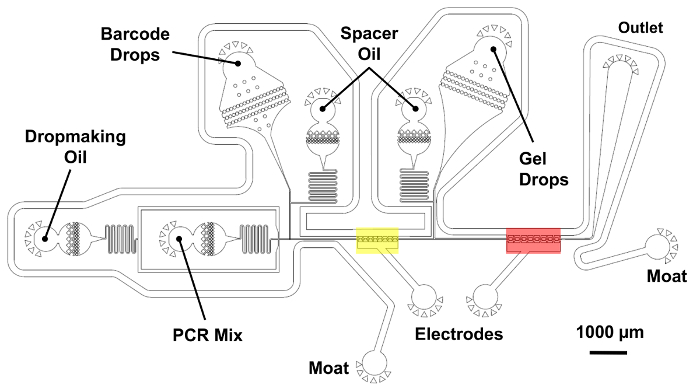
図 5: 単一細胞のゲノム バーコード二重合併マイクロ流体デバイス。2 段階合併操作高スループットで tagmented ゲノム バーコード液滴をペアします。PCR ミックスの液滴は最初生成され、塩水電極を用いた黄色で示されている地域でバーコードの水滴を吸収合併します。次に、マイクロジェルを含む液滴を導入し、赤で示した地域で 2 番目の時間を吸収合併します。オイルの入り江還元液滴間の間隔の正確な制御を可能にします。バーコード還元チャンバーとそのスペーサーの油は、青の網かけ、短い 25 μ m レイヤーに配置されます。他のすべてのデバイスの機能は、全体の高さの 45 μ m 厚い層に属しています。この図の拡大版を表示するのにはここをクリックしてください。
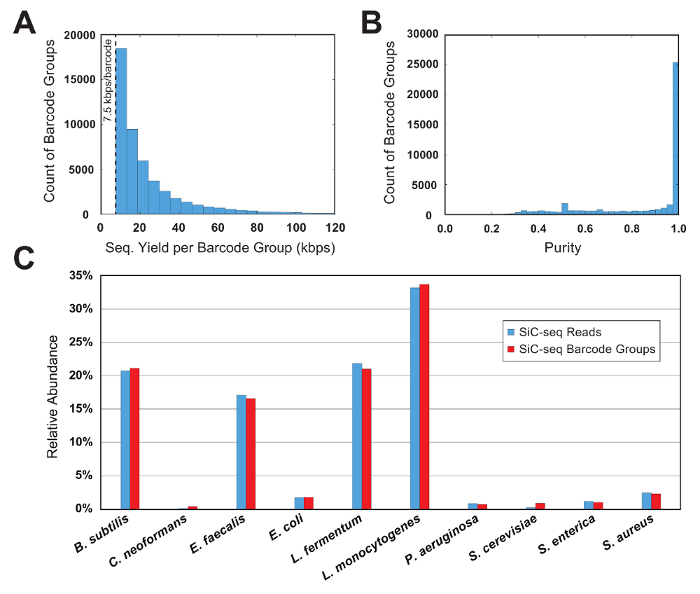
図 6: 10 セル合成微生物群集のバーコード グループ メトリック。(A) このパネルは、バーコードの配布グループのサイズを示します。指定したサイズのグループの数は、グループのサイズが増加するにつれて指数的に減少します。グループごとの 7.5 kbps の最小しきい値解析に十分な情報量を持つグループを制限し、PCR 変異シーケンス「孤児」を削除します(B) このパネルは、バーコードの配布グループ純度を示しています。大半 (> 90%) のグループは非常に高純度 (> 95%)。(C) このパネルは、読み取りとバーコードのグループ レベルで計算された 10 種の相対的な豊かさを示しています。類似結果のバーコード グループ サイズが種を越えた一貫性のあることを示すがカウントは 2。この図の拡大版を表示するのにはここをクリックしてください。
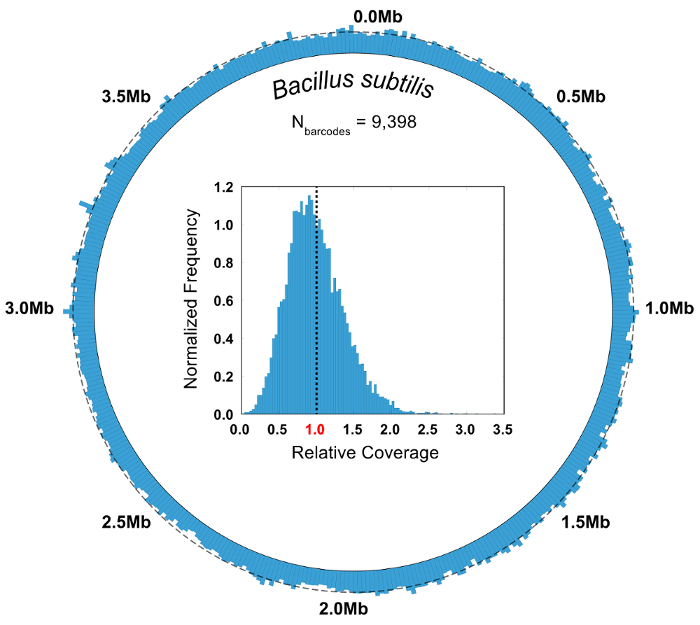
図 7: のゲノムのカバレッジを集計枯草菌バーコード グループ。枯草菌へのマッピングのすべてのバーコード グループからの読み取り (N = 9,398) がプールされて、集計分析しました。円形カバレッジ マップは、SiC シーケンシャル ・ リード数、ない観察可能なドロップ アウト領域のカバレッジの均一性を示しています。まわりを点線を示します平均カバレッジ (5.55 x)。相対被度周波数のはめ込みヒストグラムは、基地の大部分がゲノム全体の平均に近い深さで覆われていることを示しています、破線で表されます。この図の拡大版を表示するのにはここをクリックしてください。
| デバイス | 第 1 層の高さ (μ m) | 第 1 レイヤーの回転速度 (rpm) | 第 2 レイヤーの高さ (μ m) | 第 2 レイヤーの回転速度 (rpm) |
| 共同流れ dropmaker | 25 | 4000 | N/A | N/A |
| ゲル再エンキャプスレータ | 25 | 4000 | N/A | N/A |
| ダブルの合併 | 25 | 4000 | 20 | 5000 |
表 1: マイクロ流体デバイス作製パラメーター 。次の表は、(SU 8 3025、製造元の仕様に基づいて) フォトレジスト スピン コーティングのための彼らの必要な速度の SiC シーケンシャル ワークフローで使用されるマイクロ流体デバイスの一覧を示します。
| ラベル | シーケンス (5' > 3') | ||||
| バー | GCAGCTGGCGTAATAGCGAGTACAATCTGCTCTGATGCCGCATAGNNNNNNNNNNNNNNNTAAGCCAGCCCCGACACT | ||||
| DNA_BAR | CTGTCTCTTATACACATCTCCGAGCCCACGAGACGTGTCGGGGCTGGCTTA | ||||
| P7_BAR | CAAGCAGAAGACGGCATACGAGATCAGCTGGCGTAATAGCG | ||||
| P5_DNA | AATGATACGGCGACCACCGAGATCTACACTCGTCGGCAGCGTC | ||||
| I7_READ | GCCCACGAGACGTGTCGGGGCTGGCTTA | ||||
表 2: プライマー シーケンスします。
補足ファイル 1:このファイルをダウンロードするここをクリックしてください。
補足ファイル 2:このファイルをダウンロードするここをクリックしてください。
ディスカッション
SiC seq マイクロ ワークフローは、細菌細胞の数千から単一細胞のゲノム シーケンス データを生成します。マイクロジェル カプセル化細胞のゲノムに融着接続デジタル バーコード バーコード読み取り同じ細胞由来のグループに NGS データのインシリコデコンボリューションを可能にします。知られている組成物の微生物群集と制御実験はバーコード グループの純度を評価するために必要です。低純度のグループの大部分は細胞のカプセル化率が高すぎるまたはマイクロ流体処理手順中に発生した重要な液滴交差汚染があることを示します。ポアソン統計によると複数のカプセル化イベントをすべての非空の液滴の 5% 未満の速度を制限するすべての 10 滴の 1 の粒子の目標比率でバーコードとセルをカプセル化する必要があります。これより高い、カプセル化率 dropmaking プロセス中にカプセル化率の検証は非常に重要ですので指数関数的に、ダブレットの率を増加します。同じバーコード シーケンスを共有して別のセルからの読み取りは、区切られた bioinformatically をすることはできませんので、ユーザーは単一マイクロジェルの複数のセルをカプセル化特に警戒しなければなりません。ケースその 1 セル受信 2 異なるバーコード、バーコード シーケンスで数えるときに豊かさ指標が偏っているが、バーコード グループ純度は影響を受けません。
液滴クロスコンタミネーションも次善の合併の条件が原因で起こる可能性があります。成功した操作中にマイクロ合併デバイス (図 5) することができます制御用対 1 マイクロジェル 1 バーコード液滴と PCR 試薬の量。不適切な比率でのペアリング液滴の非理想的な流量になります: 1 バーコードはたとえば 2 microgels を組み合わせることができます。プロトコルに記載されているすべての流量は、見積もりをしてデバイスのジオメトリと液滴のサイズのわずかな変化によって調整する必要があります。高速録画機能カメラへのアクセスを持つユーザー (> 10,000 フレーム/秒) 正しい液滴合併先頭およびマイクロ操作の経過を確認してください。高速カメラへのアクセスのないユーザーは、マージされた出力の小さいボリュームを収集でき、顕微鏡液滴サイズを手動で測定します。液滴サイズを均一にする必要があります: 未反映バーコードまたはマイクロジェル滴の過剰は、還元率を小さく必要がありますを示します。
いくつかの一般的な注意事項は、それらの整合性を維持するために microgels および微小油滴中の処理にすべき。機械的に堅牢なのに Microgels は破壊と完全なゲル化を確保するための手順を洗浄する前に十分に冷却する必要があります。非球面 microgels が agarose がなかったことを示す固化する十分な時間を与えられました。Microgels を洗濯の際は、ダウン懸濁液を製品の損失を避けるために必要な速度で回転します。Agarose のゲルは密接に一致する水の屈折し、管22, ユーザーが吸引前にゲル-液晶境界を慎重に識別する必要がありますので見にくい場合があります。研究室手袋、チューブを静的な力23のビルドアップで合体に水に油滴が受けます。この理由から、読み込み素手液滴還元注射器とポンプのプライミングの前に帯電防止銃を持つすべての還元ラインを治療することをお勧めします。大規模な結合された液滴は、ゆっくりと注射器のエマルジョンを回転と手動で彼らのより大きい浮力のため上部に蓄積するより大きい低下を吸引によって削除できます。
SiC seq の単一細胞ゲノム配列を示す最初の技術 > 50,000 細菌細胞。このプラットフォームは、既存のアプローチに比べてスループットの重要な利点を提供していて、深く異種微生物サンプリングします。日には、マイクロ流体技術による単一細胞ゲノム microchambers9マイクロウェル24電池隔離および増幅が数十数百のセルのみの範囲において両者を採用しています。Wellplates5,6に単一のセルの並べ替え流専門マイクロ流体計測は必要ありませんが、同様に低いスループットを所有しています。環境から採取された土壌・水は一般のアルファ多様性を持つ > 種で 1,000 レベル25,26, SiC seq は有機体のはるかに大きな数をサンプルにその能力のおかげで非常に有利です。SiC seq ワークフローは、研究室文化、自然環境、またはホストの生活からのセル入力に適応可能です。セルのサンプル必要がありますのみ水性懸濁液でできる、無料の大きな粒子の (> 10 μ m) マイクロ カプセル化に適していること。たとえば、メソッドは、以前海水洗浄の一連を使用して、フィルター処理のカプセル化17前に細胞を前処理する手順のサンプルに適用されています。
SiC seq プロトコルは、各単一セルから比較的疎配列データ量を生成し、すべてのアプリケーションに適していない場合があります。呼び出すゲノムのde novoアセンブリまたは単一のヌクレオチドのバリアント (SNV) などいくつかのバイオインフォマティクス アルゴリズムには、効果的に動作する高いカバレッジの深さが必要があります。代わりに、バーコード グループことができますにあるクラスター化インシリコ分類合算方法27によって、読み取りのより大きなセットでアルゴリズムを適用することができます。SiC シーケンシャル ワークフローの比較的低い全体的なバーコード効率は、入力サンプルの可用性が低い場合に課題を提示可能性がありますも。SiC seq ポアソン分布のバーコードのカプセル化手順に依存している、したがって細胞の約 10% は分子バーコードを受け取るし、最後のライブラリの準備手順の間に増幅されます。これは他の点滴ベースのバーコード方式10に匹敵する、貴重な細胞サンプルを操作するユーザー シーケンスの適切なライブラリの利回りを達成する難しさがあります。、最終的に PCR のサイクル数を増やす必要があります。拡大のステップ。マイクロ流体の専門知識を持つユーザーのための別の潜在的なソリューション デジタル PCR のステップのためバーコード化効率をもたらす後正バーコード液滴をソートすることです > 8528。
SiC seq 技術の潜在的な将来の方向性は、哺乳類細胞、臨床的単一細胞研究の新しい道を舗装を使用するワークフローを適応されています。たとえば、1 つの癌の間でのコピー数変動の解析細胞 5 月癌病理学2の不均質性の役割の理解を深めます。また、subpopulations の対象となる単一セル配列またはセルの珍しい系統は、プローブし、利息29の dna 塩基配列を豊かに既存のメソッドと SiC seq の統合が有効にします。環境試料とには、知られている代謝経路内から遺伝子が対象指定および隣接する新規遺伝子領を識別する遺伝子と一緒にコンテンツ分析します。人間のホスト環境内で低価病原細菌サンプル隔離されかねないから密接に病原性の遺伝的起源の詳細を確認する単一細胞レベルでシーケンス処理します。
開示事項
このワークフローに係る特許可能性がありますどのアダム ・ r ・ アバテのミッション バイオにライセンスは株主です。
謝辞
この作品は全米科学財団のキャリア賞 (許可番号 DBI 1253293) を支えられ国立衛生研究所 (NIH) (許可番号 HG007233-01、R01-EB019453-01、1R21HG007233、DP2-AR068129-01、R01 HG008978);防衛先端研究プロジェクト庁生活ファウンドリ プログラム (契約番号 HR0011-12-C-0065 N66001-12-C-4211, HR0011-12-C-0066)。
資料
| Name | Company | Catalog Number | Comments |
| 3" silicon wafers, P type, virgin test grade | University Wafers | 447 | |
| SU-8 3025 photoresist | Microchem | 17030192 | |
| Spin coater | Specialty Coating Systems | G3P-8 | |
| Photomasks | CadArt Servcies | (custom) | See Supplemental Files for mask designs |
| PGMEA developer | Sigma-Aldrich | 484431 | |
| Isopropanol | Sigma-Aldrich | 109827 | |
| Sylgard 184 silicone elastomer kit | Krayden | 4019862 | |
| Degassing chamber | Bel-Art | 42025 | |
| 0.75 mm biopsy punch | World Precision Instruments | 504529 | |
| Glass microscope slides (75 mm x 50 mm) | Corning | 294775X50 | |
| Aquapel (hydrophobic glass treatment) | Pittsburgh Glass Works | 47100 | |
| PE-2 polyethylene tubing | Scientific Commodities | B31695-PE/2 | |
| 1 mL syringes | BD | 309628 | |
| 27 gauge needles | BD | 305109 | |
| Syringe pump | New Era Pump Systems | NE-501 | |
| Novec HFE-7500 fluorinated oil (HFE) | 3M | 98-0212-2928-5 | |
| FC-40 fluorinated oil | Sigma-Aldrich | F9755 | |
| PEG-PFPE surfactant | Ran Biotechnologies | 008-FluoroSurfactant | |
| Space heater | Lasko | CD09250 | |
| Agarose, low gelling temperature | Sigma-Aldrich | a9414 | |
| TE (10X) | Rockland | mb-007 | |
| PBS 1X, pH 7.4 | E&K Scientific Products | EK-65083 | |
| OptiPrep (density gradient medium) | Sigma-Aldrich | d1556 | |
| 1H,1H,2H-Perfluoro-1-Octanol (PFO) | Sigma-Aldrich | 370533 | |
| Span 80 (sorbitane monooleate) | Sigma-Aldrich | s6760 | |
| Hexane | Sigma-Aldrich | 139386 | |
| Tween 20 (polysorbate 20) | Sigma-Aldrich | p2287 | |
| Lysozyme Type IV | MP Biomedicals | 195303 | |
| Mutanolysin | Sigma-Aldrich | M9901 | |
| Zymolyase (yeast lytic enzyme) | Zymo Research | e1004 | |
| Lysostaphin | Sigma-Aldrich | L7386 | |
| Sodium chloride | Sigma-Aldrich | S9888 | |
| EDTA | Sigma-Aldrich | E6758 | |
| Tris-HCl, pH 7.5, 1M | Invitrogen | 15567-027 | |
| Dithiothreitol (DTT) | Teknova | d9750 | |
| Lithium dodecyl sulfate | Sigma-Aldrich | L9781 | |
| Proteinase K | New England Biosciences | P8107S | |
| Ethanol, 200 Proof (100%) | Koptec | V1001 | |
| SYBR Green I (nucleic acid stain) | Invitrogen | S7563 | |
| PEG 6k | Sigma-Aldrich | 81260 | |
| Triton X-100 (octylphenol ethoxylate) | Sigma-Aldrich | t8787 | |
| Nextera DNA Library Prep Kit | Illumina | FC-121-1030 | |
| Phusion Hot Start Flex Master Mix (High-Fidelity Hot Start Master Mix) | New England Biosciences | m05365 | |
| Platinum Multiplex PCR Master Mix (Taq Master Mix) | Applied Biosystems | 4464263 | |
| Warmstart 2.0 Bst Polymerase (isothermal polymerase) | New England Biosciences | m0538m | |
| NT buffer from Nextera XT kit (neutralization buffer) | Illumina | FC-131-1024 | |
| Cold cathode fluorescent inverter | (custom) | (custom) | |
| DC power supply | Mastech | HY1503D | |
| Zerostat 3 anti-static gun | Milty | 5036694022153 | |
| 3D-printed centrifuge syringe holder | (custom) | (custom) | See Supplemental Files for 3D print file |
| Zymo DNA Clean & Concentrator-5 | Zymo Research | D4003 |
参考文献
- Navin, N., et al. Tumour evolution inferred by single-cell sequencing. Nature. 472 (7341), 90-94 (2011).
- Ni, X., et al. Reproducible copy number variation patterns among single circulating tumor cells of lung cancer patients. Proceedings of the National Academy of Sciences of the United States of America. 110 (52), 21083-21088 (2013).
- Schmidt, H., Hensel, M. Pathogenicity islands in bacterial pathogenesis. Clinical Microbiology Reviews. 17, 14-56 (2004).
- Martínez, J. L., Baquero, F. Interactions among strategies associated with bacterial infection: pathogenicity epidemicity, and antibiotic resistance. Clinical Microbiology Reviews. 15 (4), 647-679 (2002).
- Rinke, C., et al. Obtaining genomes from uncultivated environmental microorganisms using FACS-based single-cell genomics. Nature Protocols. 9 (5), 1038-1048 (2014).
- Rinke, C., et al. Insights into the phylogeny and coding potential of microbial dark matter. Nature. 499 (7459), 431-437 (2013).
- Zhang, H., Liu, K. K. Optical tweezers for single cells. Journal of the Royal Society Interface. 5 (24), 671-690 (2008).
- Xu, L., Brito, I. L., Alm, E. J., Blainey, P. C. Virtual microfluidics for digital quantification and single-cell sequencing. Nature Methods. 13 (9), 759-762 (2016).
- Gawad, C., Koh, W., Quake, S. R. Dissecting the clonal origins of childhood acute lymphoblastic leukemia by single-cell genomics. Proceedings of the National Academy of Sciences of the United States of America. 111 (50), 17947-17952 (2014).
- Macosko, E. Z., et al. Highly parallel genome-wide expression profiling of individual cells using nanoliter droplets. Cell. 161 (5), 1202-1214 (2015).
- Klein, A. M., et al. Droplet barcoding for single-cell transcriptomics applied to embryonic stem cells. Cell. 161 (5), 1187-1201 (2015).
- Rotem, A., et al. High-throughput single-cell labeling (Hi-SCL) for RNA-Seq using drop-based microfluidics. PLoS One. 10 (5), 1-14 (2015).
- Amini, S., et al. Haplotype-resolved whole-genome sequencing by contiguity-preserving transposition and combinatorial indexing. Nature Reviews Genetics. 46 (12), 1343-1349 (2014).
- Zheng, G. X. Y., et al. Haplotyping germline and cancer genomes with high-throughput linked-read sequencing. Nature Biotechnology. 34 (3), 303-311 (2016).
- Lan, F., Haliburton, J. R., Yuan, A., Abate, A. R. Droplet barcoding for massively parallel single-molecule deep sequencing. Nature Communications. 7, 11784(2016).
- Rotem, A., et al. Single-cell ChIP-seq reveals cell subpopulations defined by chromatin state. Nature Biotechnology. 33 (11), 1165-1172 (2015).
- Lan, F., Demaree, B., Ahmed, N., Abate, A. R. Single-cell genome sequencing at ultra-high-throughput with microfluidic droplet barcoding. Nature Biotechnology. 35 (7), 640-646 (2017).
- Novak, R., et al. Single-cell multiplex gene detection and sequencing with microfluidically generated agarose emulsions. Angewandte Chemie Internation Edition. 50 (2), 390-395 (2011).
- Gill, C., Van De Wijgert, J. H. H. M., Blow, F., Darby, A. C. Evaluation of lysis methods for the extraction of bacterial DNA for analysis of the vaginal microbiota. PLoS One. 11 (9), 1-16 (2016).
- Picelli, S., et al. Tn5 transposase and tagmentation procedures for massively scaled sequencing projects. Genome Research. 24 (12), 2033-2040 (2014).
- Abate, A. R., Chen, C. H., Agresti, J. J., Weitz, D. A. Beating Poisson encapsulation statistics using close-packed ordering. Lab on a Chip. 9 (18), 2628(2009).
- Jain, A., Yang, A. H. J., Erickson, D. Gel-based optical waveguides with live cell encapsulation and integrated microfluidics. Optic Letters. 37 (9), 1472(2012).
- Karbaschi, M., Shahi, P., Abate, A. R. Rapid chemical-free breaking of microfluidic emulsions with a hand-held antistatic gun. Biomicrofluidics. 11 (4), 1-6 (2017).
- Gole, J., et al. Massively parallel polymerase cloning and genome sequencing of single cells using nanoliter microwells. Nature Biotechnology. 31 (12), 1126-1132 (2013).
- Chao, Y., et al. Metagenomic analysis reveals significant changes of microbial compositions and protective functions during drinking water treatment. Scientific Reports. 3 (1), 3550(2013).
- Fierer, N., et al. Cross-biome metagenomic analyses of soil microbial communities and their functional attributes. Proceedings of the National Academy of Sciences of the United States of America. 109 (52), 21390-21395 (2012).
- Mande, S. S., Mohammed, M. H., Ghosh, T. S. Classification of metagenomic sequences: methods and challenges. Briefings in Bioinformatics. 13 (6), 669-681 (2012).
- Eastburn, D. J., et al. Microfluidic droplet enrichment for targeted sequencing. Nucleic Acids Research. 43 (13), e86(2015).
- Clark, I. C., Abate, A. R. Finding a helix in a haystack: nucleic acid cytometry with droplet microfluidics. Lab on a Chip. 17 (12), 2032-2045 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved