Method Article
マウスの主な腎尿細管上皮細胞の分離と性質、高スループットの細胞フラックスの解析
要約
このプロトコルは、分離し腎作用前のヴィヴォ、ミトコンドリアの生体エネルギーを含む評価するためにその後サブ培養することができますマウス主要な腎尿細管細胞を特徴付けるコスト効率の高いアプローチを提供します。
要約
腎尿細管上皮細胞 (TECs) ミトコンドリア機能障害は腎線維症、慢性腎臓病 (CKD) の主な原因につながります。したがって、プライマリ テクスでミトコンドリアの機能を評価する CKD の病態への洞察力を提供する細胞の生体エネルギーの状態に貴重な洞察力あります。分離そして種近位尿細管の浄化のための複雑なプロトコルの数がある、フィールドには尿細管細胞の分離精製を必要とせずに最適コスト効果の高い方法が欠けています。ここでは、両方に焦点を当てて研究マウス近位および遠位腎 TECs を可能に隔離のプロトコルを提供します。コスト効率の高い試薬とこのプロトコルに必要な最小限の動物手順に加え隔離されたセルは分離後高エネルギーのレベルを維持、準連続的な研究を可能にする 4 つの通路まで培養することができます。さらに、高スループット細胞フラックス アナライザーを使用してセル密度と化合物の濃度の最適化に関する推奨事項を提供私たち 96 ウェル プレートで分離のテクスに直接ミトコンドリア呼吸を評価する.これらの観察は、腎 TECs の一貫性のある、よく標準化された生産と腎尿細管ex vivo研究このプロトコルを使用することができることをお勧めします。このプロトコルは、創薬や薬物評価目的のため腎疾患に伴うミトコンドリア機能障害を勉強するより広範な将来のアプリケーションがあります。
概要
腎尿細管上皮細胞 (TEC) 関数は、強く腎臓の全体的な健康状態に関連付けられます。腎線維症と慢性腎臓病 (CKD)1,2で主要な役割を果たしている、TECs の脱分化を引き起こす腎臓の病理組織学的シグナル伝達します。非常に精力的な器官として腎臓、酸素消費量、主にミトコンドリアの酸化的リン酸化3を通じて心に次ぐ。電子顕微鏡を用いた研究は、尿細管4の病理学的イベントにミトコンドリアの形態変化の正の相関関係を明らかにしました。テクスでミトコンドリアの機能不全を引き起こす上皮間葉系に転換5と欠陥のある脂肪酸酸化6腎線維化。線維症は、CKD の進行性腎病理です。CKD の病態生理を明らかにする必要がしたがって、腎 TECs のエネルギッシュな状態を理解することです。
大人腎臓7で > 20 種類の細胞があります。TECs の機能を研究、化学治療や遺伝子操作などの分子生物学のアプリケーションのためのプラットフォームとして腎上皮細胞の初代培養が必要です。重要な生体内で遺伝子を介して、または分離の主細胞と遺伝子操作すでに AAV 遺伝子配信テクニック8を使用してマウスの遺伝的操作を行うことができます。人間17、ウサギ15,16, イヌ14ラット11,12,13マウス9,10から主な腎尿細管細胞の分離 ,18は、純粋な近位尿細管細胞を生成する精製ステップで報告されています。近位尿細管細胞の分離に焦点を当てるこれらの以前に発行されたプロトコル浄化目的19勾配遠心法と並べ替えの実験を行った。これらのプロトコルは、近位尿細管を勉強するために貴重な彼らは近位および遠位尿細管が調査されるべき必要な場合十分なありません。たとえば、近位および遠位尿細管疾患進行20で重要な役割を再生し、文化で尿細管の両方の種類を調べる必要があるため、アルポート症候群に関する我々 の研究が明らかにしました。腎のフッ化物の毒性に関する最近の研究はまた、近位および遠位尿細管21の病理学的変化が起こったことを示した。したがって、この隔離のプロトコルを設計して、試薬および簡単な手順の最小限のコストでのマウスの腎臓の近位および遠位尿細管細胞の最適化します。また、捜査官がステップ 3.1 までプロトコルに従ってまだ、しこれ以降純粋な近位尿細管細胞の分離精製手順9を追加できます。
隔離されたセルは高エネルギー レベルを示し 4 通路にサブカルチャー後腎上皮特性を維持します。ハイスループット細胞フラックス アナライザーを使用して直接セル密度最適化に関するさらなる知見につながる 96 ウェル プレートで分離 TECs ミトコンドリア呼吸を評価します。腎尿細管ex vivo研究腎 TECs の一貫性のある、よく標準化された生産をこのプロトコルを適用できることが示唆されました。このプロトコルの追加された意義は近位および遠位尿細管細胞のミトコンドリアのエネルギー代謝の前のヴィヴォ特性評価のための高スループット ツールとして可能な使用法です。したがって、創または腎疾患の薬剤評価の目的のためのプラットフォームとして利用することができます。
プロトコル
動物を含むすべての実験は、動物介護制度と NIH のガイドラインに準拠したマイアミ大学使用委員会によって承認されました。
1. プレートのコーティングと試薬の調製
- コラーゲン コーティングを準備します。
- コラーゲンの 35 μ L を追加シングル 60 mm のペトリ皿に事前フィルター 20 mM 酢酸溶液 2 mL に。1 時間室温でインキュベート、それを空気乾燥、紫外線にさらします。
- コーティングを洗って 3 x 任意の酸性残基を削除し、37 ° C CO2で保存する PBS の-無料の携帯文化のインキュベーター細胞播種の準備ができているまで。コラーゲン コーティングの最終濃度は 5 μ g/cm2です。
- 灌流のバッファーを準備: 30 mL の PBS にペニシリン-ストレプトマイシン (P/S) の 300 μ L を追加し、分離が開始されるまで 37 ° C の水浴中で混合物を温めます。
- 消化バッファーを準備: コラゲナーゼ 30 mL に PBS の 2 種類の 3.9 mg を溶解、0.2 μ m ボトル上部フィルターを通してソリューションをフィルター、分離が始まるまで 37 ° C の水浴中でウォーム アップ。
- 細胞の培養基を準備します。
- 部屋の温度にサプリメントをもたらします。濾過せず腎の 500 mL にサプリメント (牛胎児血清、上皮成長因子、インスリン、エピネフリン、ヒドロコルチゾン、トランスフェリン、5 μ g/mL と triiodo L 七の 4 pg/mL の 36 ng/mL の 0.5 μ g/mL の 5 μ g/mL の 10 ng/mL の 0.05 mL) を追加します。上皮細胞成長基礎培地 2。
- 37 ° C の水浴を使用する準備ができるまでのメディアを暖かい。
- 化合物の準備: 50 mM FCCP の準備、50 ミリメートル etomoxir、50 mM の L-カルニチン、10 mM アンチマイシン A 10 mM オリゴマイシン 10 mM ロテノン、DMSO、分注ですべてのソリューションを株式、-20 ° C の化合物を格納
- パルミチン酸ナトリウム 2.5 mM 150 mM NaCl 水溶液の 220 ml を準備し、パルミチン酸を完全に溶解するまでに 75 ° C の水浴のソリューションを温めます。
- ウシ血清アルブミン (BSA) の準備: 150 mM の NaCl の 250 mL の無脂肪 BSA を 0.34 mM を準備します。BSA の制御は、次のステップ 1.8 で準備できるパーム BSA ソリューションのネガティブ コントロールとして機能します。
- BSA (パーム BSA) にパルミチン酸を共役します。
- それがまだ熱い間、パルミチン酸ソリューションを BSA 溶液に徐々 に追加します。PH 7.4 に調整し、活用を完了する、少なくとも 1 h 37 ° C でそれらをミックスします。
- 接合が完了すると、150 mM の NaCl の別の 150 mL をソリューションに追加、それを混ぜるし、因数-20 ° C で保存最終的な解決策は、1 mM ナトリウムのパルミチン酸と 0.17 mM の BSA を含み、脂肪酸系細胞フラックス法で細胞の脂肪酸基板として使用されます。
- 細胞外のフラックス測定基底メディアを準備します。
- オートクレーブ dH2O の 1 L に DMEM パウダー 1 袋・ 200 mm L-グルタミン (最終的な 4 mM) 20 mL を追加し、軽く混ぜます。
- 生体エネルギー実験の日、グルコースや脂肪酸ベースの呼吸の試金で使用される細胞外フラックス アッセイ メディアの以降準備のため準備された基底メディアに 100 μ M ナトリウム ピルビン酸を追加します。
- ブドウ糖ベースのメディアを準備します。
- 解糖系を介して細胞呼吸容量を計測するには、1.9 の手順で上記基底メディアに 17.5 mM グルコース パウダー、100 μ M 制御 BSA (として 1.7 の手順で説明)、(脂肪酸の酸化を抑制する) に 20 μ M の etomoxir を追加します。
- 37 ° C でメディアを温める、pH 7.4 に調整細胞フラックス試金で使用されるまで、37 ° C の水浴中保管してください。
- 脂肪酸ベースのメディアを準備します。
- 脂肪酸酸化による細胞の呼吸容量を計測する追加 10 mM 2 D ブドウ糖粉末 (グルコースの解糖系を阻害するアナログ)、100 μ M 基底メディアに L-カルニチンが 1.9 の手順で上記パーム-BSA (に記載されているステップ 1.8) として、100 μ M。
- 37 ° C でメディアを温める、pH 7.4 に調整細胞フラックス試金で使用されるまで、37 ° C の水浴中保管してください。
2. 血流、消化とマウスの腎臓の収穫
- イソフルラン フローとマウスを麻酔し、仰臥位でそれを修正します。分離のみ開始後動物を失いその立ち直り反射、麻酔の深さが前に、と手順22における非外科的鉗子を使用してピンチの評価によって監視されていることを確認します。
- 毛皮、腹部領域にマウスの胸の脱毛クリームを使用してを削除、ヨウ素を殺菌してヨウ素残留。
- 胸の切開をする、全腹部領域を開くには切り傷、心臓や腎臓を公開します。
- 32 mL/分で灌流ポンプを設定し、灌流を開始する前にチューブの任意の泡を削除します。
- バッファーがいっぱい心にすぐに心尖を左心室に 27 G 針を挿入し、灌流バッファー心臓のポンプとしても流通して、最終的に右心房の出口から削除を取得しますので、出口を作成する右房内を突きます。
- 灌流後、30 mL/分消化のためにポンプの速度を切り替えます。
- 消化の 20 mL の後にバッファーは頂点を通して灌流、尿細管細胞分離の両方の腎臓を摘出します。
3. ティッシュの処理とプライマリ尿細管細胞分離
- 腎カプセルを外し、髄質、小さな断片に両方の腎臓をミンチ、10 mL の 5 分の緩やかな回転と 37 ° C のオーブンで消化バッファーにそれらを孵化させなさい。
- 70 μ m のフィルターを通してバッファーを渡すことによって、未消化の腎組織を削除します。消化を停止する培地 10 mL を追加します。
- 尿細管細胞を収集するには、最初のペレットを収集するために 5 分間 50 x g でフィルター処理された細胞懸濁液を遠心します。上清を新しいチューブに転送し、2 番目のペレットに収集されますすべての尿細管細胞を確保するため 5 分間 50 × g で遠心分離培地 5 mL を追加します。
遠心分離は主に重い尿細管をペレットに低い速度では。その後、セルは分離から回復後、純粋な管状文化は、サブの文化の中に高速で遠心は。 - 20 mL の培地で最初のペレットを再懸濁し、3 番目のペレットを収集するために 5 分間 50 × g で遠心分離機します。
- 1 mL の培地で 2 番目と 3 番目のペレットを再懸濁します。トリパン ブルーの 10 μ L 細胞懸濁液のミックス 10 μ L は、チャンバー A カウントのスライドとのレコード自動から細胞生存細胞カウンター (材料の表を参照してください) に混合物をロードします。
- シングル 60 mm ディッシュを7セル (異種集団) を 10 までシード コラーゲンでプレコート、尿細管細胞の一晩を添付します。
4. プライマリ尿細管細胞サブカルチャーとキャラクタリゼーション
- 分離後の 1 日目、文化メディアを収集し、任意の浮動の細管をペレットに 5 分間 50 × g で遠心分離機します。上澄みを除去し、新鮮な培地と同じ培養皿にプレートの 4 つの mL で細胞ペレットを再懸濁します。
- 分離の後の 4 日目、古い培地を削除し、新鮮なメディアを追加します。
- 分離後 7 日、37 ° c 反応を停止し、5 分間 250 × g で遠心分離によって細胞を収集する文化メディアの 5 分追加 3 mL の 0.25% トリプシン-EDTA の 2 mL でそれらの孵化によってセルをデタッチします。
- サブカルチャー、P0 から P1 の細胞を特徴付けるシード 24 ウェル プレートのウェルあたり 5,000 セルでコーティングされたコラーゲン私前述のよう。
- 手順 4.4 後、24 h 4 %p1 のセルを修復する 10 分間、PFA は 0.2% とそれらを permeabilize 3 分トリトン X-100 10% ロバ血清 (DS) 室温で 1 時間でそれらをブロックして。
- 希薄化は 10% で 1: 100 まで次の蛋白質の各 DS: 近位管状マーカー アンジオテンシノーゲン (AGT) とアクアポリン 1 (AQP1);遠位尿細管マーカー E-カドヘリン;メサンギウム マーカー CD90/Thy1;・ マクロファージ マーカー EGF のようなモジュールを含む粘液のようなホルモン受容体-1 (F4/80) やクラスターの分化 68 (CD68) ような 4 ° C で一晩細胞とそれらを孵化
- 次の日、検出を使用して任意の染色 1: 200 反うさぎ、抗マウスまたは抗ラット蛍光二次抗体 45 分。図 2 aに示すように、マーカーの発現を確認する共焦点顕微鏡画像を取る。
- P1 のサブカルチャーの後の 3 日目、4.5 の手順で説明されている管状、メサンギウムとマクロファージのマーカーの染色によるサブカルチャーと P2 で評価のための細胞をデタッチします。図 2 aに示すように、マーカーの発現を確認する共焦点顕微鏡下で染色をイメージします。
- P2 のサブカルチャーの後の 3 日目、4.5 の手順で説明されている管状、メサンギウムとマクロファージのマーカーの染色によるサブカルチャーと P3 で評価のための細胞をデタッチします。図 2 aに示すように、マーカーの発現を確認する共焦点顕微鏡下で染色をイメージします。
- 組織染色を準備します。
- 野生タイプの冷凍と常温で 1 h Col4a3-/-腎臓スライドを風乾してそれらを修正 4 %pfa で 10 分間は 0.2% とそれらを Permeabilize トリトン X-100 10 分の室温で 1 時間 10% ロバ血清 (DS) とそれらをブロックと。1: 200 で 4.5 の手順に従ってマーカー蛋白に対する抗体を加えて一晩 4 ° C でそれらを孵化させなさい。
- 次の日は、1: 200 反うさぎ、抗マウスまたは抗ラット蛍光二次抗体と 45 分の任意の染色を検出します。図 2 bおよび2 Cに示すように、マーカーの発現を確認する共焦点顕微鏡画像を取る。
5. ミトコンドリア生体エネルギー測定
- 20,000 や 30,000、40,000 細胞/ウェルの 96 ウェル マイクロ プレートに培養媒体 100 μ l にシード P1 尿細管細胞でプレコート 5 μ g/cm2コラーゲン私細胞フラックスの試金の前日。
- センサー カートリッジの水和のためセンサー カートリッジを持ち上げるし、フィル各校正溶液 200 μ L をプレートのも。慎重にカートリッジをロード校正ソリューションでセンサーが水没するバック。少なくとも 7 使用前に h CO2なし 37 ° C のオーブンでカートリッジを配置します。
最良の結果を一晩カートリッジ水和の使用をお勧めします。 - 混合物の準備: 8 μ M のオリゴマイシン、FCCP、9 μ M (ステップは 1.10 で説明) グルコースと脂肪酸 (に記載されている手順 1.11) 細胞外フラックス アッセイ メディアの両方で 20 μ M ロテノン/アンチマイシン A の混合物を準備します。
- メディアの変更: 細胞の培地を吸引、グルコースや脂肪酸の分析メディアの 175 μ L を追加 (は化合物に依存して、働いているを参照してくださいステップ 5.3)、37 ° C CO2で 1 時間インキュベートするそれらと -無料インキュベーター。
- 次の化合物の 25 μ L でカートリッジ ポートをロード: 1 μ M の最終的な集中を達成するためにポート A の 8 μ M のオリゴマイシン (注: それぞれはよく、メディアの 175 μ L が含まれる、ように化合物は希釈 8 になる x)、9 μ M 1 の最終的な集中を達成するためにポート B で FCCPΜ M (注: メディアの 175 μ L プラス 25 μ L 注入ポート A からソリューションのそれぞれが含まれますも、化合物希薄 9 が表示されます x)、20 μ M ロテノン/アンチマイシン A ポート C 各化合物 (注 2 μ M の最終的な集中を達成するために: 各はよくメディアの 175 μ L 加え、ポート A と B から注入溶液 50 μ L を含んでいるが、化合物は希釈 10 になる x)。
- ポート D のすべての井戸と背景の井戸 (セルの) の他のすべてのポートに水を追加します。37 ° C CO2のカートリッジを孵化させなさい-10 分のための無料のインキュベーター。
- 細胞外フラックス アナライザーとコント ローラーを入れます。
- アナライザー ソフトウェアを開き、次のプロトコルを入力します。
- 標準的な測定法を選択します。分析ウィザードを押します。化合物] タブを使用して、化合物のレイアウトを割り当てるし、グループおよびラベルタブを使用して、実験グループにラベルを付けます。背景として (セル) を持たない空の井戸を割り当ててください。
- [プロトコル] タブで、利用可能なコマンドを使用して表 1に示されているように次のミックスとメジャーのサイクルを設定: キャリブレーション、2 分のミックス、2 分待って、3 分のための測定 (サイクルを繰り返すこの 2 〜 3 倍)。ポートは、2 分のミックスを注入、2 分、3 分のための測定を待つ (繰り返しこのサイクル 2-3 x);ポート B を注入、ミックス 2 分、2 分、3 分のための測定を待つ (繰り返しこのサイクル 2-3 x);ポート C を注入、ミックス 2 分、2 分、3 分のための測定を待つ (このサイクルを繰り返して 2 3 倍)。エンド ウィザードを押します。また、将来の使用の現在のテンプレートを保存することが可能です。
- キャリブレーションを開始する開始を押してください。アナライザーは、自動的にプレート ホルダーを取り出し、挿入されるカートリッジ プレートを要求します。
- (通常は 20-25 分) に校正手順が終わったら、セル板にカートリッジ プレートを変更し、実行を続行するプロンプト コマンドを押します。
- 実行が完了すると、データを転送し、96 ウェル プレートを削除します。それぞれの試金井戸のヘキスト (1:1, 000) を追加し、37 ° C で 5 分間インキュベートします。355 nm 励起と 460 nm の発光を読んでヘキスト蛍光測定による細胞数に OCR データを正規化します。
結果
腎臓の血流と消化非常に現実的な尿細管上皮細胞をもたらします。
マウス腎尿細管上皮細胞は、上記で説明したプロトコルのセクション 1-3 に記載されている手順に従って分離されました。
消化力後、腎細胞、不完全消化管および 70 μ m よりも小さく、他の組織の破片の異種集団は分離日培養皿上にメッキされました。0 日目から分離は通常細胞の成長ではなく細胞にのみ見られることを期待される後 1 日目に変わります。フローティングの異種の人口を見ると、のみいくつかの尿細管細胞は日 1 (図 1 a) に付した。1 日目で細胞、遠心分離、再メッキ ・再収集を光の残骸を削除し、小さな尿細管尿細管細胞リリース小品を解決助けた。3 日目に 1 日からの変更はより良い細胞接着のみならず (図 1 a) は 1 日目と比較して 3 倍に細胞の密度を大幅に向上セル成長率を期待されていた。初期成長段階でセルはいくつかコロニーを形成したが、植民地の周りされ。この時点から隔離されたセルは完全に回復した、健康的な増殖を表示されます。5 日目、細胞細胞とコロニーをコロニーの間いくつかのスペースを 60 mm のペトリ皿の 80-90% の confluency に (図 1 a) いた。
サブカルチャーと孤立した尿細管細胞のキャラクタリゼーション:
手順を上記で説明したプロトコルのセクション 4 で評価次サブ分離腎尿細管上皮細胞培養。
5 日からセルは完全に分離から回復し、活発に増殖し始めた。60 mm のペトリ皿の confluency に細胞増殖を分離後、1 週間。通過 0 で培養 1 週間後セルがサブ通路 1 と、その後、2 より多くの通路のために培養すること準備ができていた。1 の通路と通路 2 で似たような成長パターンが観察されました。通常、通路 1 と 2 さらにサブカルチャー (図 1 b) の confluency に成長する細胞の週よりも少ないがかかります。似たような液体の排泄場所通路 2、広範なドーム形成23,24 (図 1 b)、隔離されたセルが健康維持されることを示唆を示した状態に 0 の通路から合流細胞の連続培養生体内の状態。これは、プレートを持ち上げますが、タイトな接合を介して接続を維持するために細胞の膜を発生します。
文化の細胞を特徴付ける 4、通路通過 1 から培養細胞だけでなく、制御線人間近位腎上皮 HK 2 細胞の免疫蛍光染色を行った。近位尿細管のマーカー、アクアポリン 1 (AQP1) 上皮性マーカー平滑筋アクチン (SMA)26,27,28、遠位尿細管マーカー E カドヘリン25アンジオテンシノーゲン (AGT)925メサンギウム マーカー胸腺細胞分化抗原 1 (Thy1/CD90) および CD6830、マクロファージ マーカー F4/8029 9は特性の研究に使用されました。AQP1 と AGT 両方の近位管状の蛋白質が一貫して高い通路 4 同様に肯定的な制御の香港 2 腎上皮細胞 (図 2 a) のように、1 通路から分離尿細管細胞で表されます。遠位尿細管蛋白質 E-カドヘリン 4 通路を通って分離尿細管細胞で発現させたし、HK 2 細胞 (図 2 a) が認められました。SMA は、分離尿細管細胞と、パブリッシュされたレポート26,27と一貫性のあるコントロール HK 2 細胞豊富に示した。一方、メサンギウム タンパク質 Thy1 とマクロファージ タンパク質 F4/80 欠席した孤立した尿細管細胞の制御 HK 2 の細胞 (図 2 a)。CD68 は香港 2 セルで最小限の式を示し 1 の通路と通路 2 と、その式で分離尿細管細胞で検出不能となった通路 4 (図 2 a) 通過 3 から。このプロトコルを次した細胞が近位および遠位尿細管細胞のミックスであることが示唆されました。これらのマーカー蛋白質の生体内で式を比較するには、冷凍腎組織で染色を行った。管状のマーカーはメサンギウムと E-カドヘリン、AGT、AQP1 タンパク質 Thy1 を含む野生型健康なマウス (図 2 b) から収穫される腎臓において高い発現が見つかりました。F4/80 および CD68 の低式は野生型腎臓の観察が広く採集場所マクロファージ浸潤20,31 (で腎不全を開発 Col4a3-/-マウスの腎臓で表現図 2)。
分離の主な尿細管細胞のミトコンドリアの生体エネルギー試金:
上記で説明したプロトコルのセクション 5 にミトコンドリア呼吸の試金のステップのとおりです。
分離の主な尿細管細胞のミトコンドリアの呼吸は、異なるめっき密度で酸素消費量 (OCR) の細胞外フラックス解析によって測定されます。メッキ密度を滴定する 20,000 や 30,000、ウェルあたり 40,000 プライマリ TECs 播種 96-well XF96 に (約 20 の前に h) 前日細胞フラックス測定 (図 3 a)。次の細胞フラックス解析 OCR 測定は、ヘキスト染色の定量化による細胞数を正規化されました。20,000 で TECs をメッキ、30,000、または 40,000 細胞/ウェルのそれぞれ 25、45、または 50 pmol/分、平均基底 OCR の結果 (図 3 a)。また、メッキの細胞の顕微鏡画像を 40,000 細胞/ウェル カバー (図 3 b) 他のめっき密度よりマイクロ プレートのウェルの底の表面全体を明らかにしました。最大の OCR が 30,000 細胞密度と比較してセルが 40,000 セルを使用して増加していないにもかかわらず約 40,000 セルと化合物の最適な相互作用の細胞/ウェルの細胞密度をお勧めします。
また、実験では、ランプ/阻害化合物の最適な濃度を示した 1 μ M オリゴマイシン、1 μ M、FCCP および 2 μ M ロテノン/アンチマイシン A (細胞外フラックス アッセイとポート注射のプロトコルはの表 1 に記載されて;最適化実験は表示されません)。ただし、これらの化合物は、理想的には低いし公開された値よりも高い濃度で予備テストを実行するすべてのユーザーは、最良の結果を保証するをお勧めします。
細胞外フラックス アッセイ腎 TECs のエネルギー代謝を評価するための重要なパラメーターの数が得られます。例えば、脂肪酸酸化のテクスで具体的には欠陥があるととおり、解糖作用 (2 DG) の阻害剤と基質脂肪酸 (パルミチン酸) を含むメディアの使用が TECs の脂肪酸酸化を直接評価するための有用なツールとして使用できます。で通路 1 と 2 (図 3)。腎線維化の場合、細胞全体の呼吸容量はブドウ糖ベースのメディアの違いを明らかに可能性がありますも、健康な腎臓のそれよりも低くなる予定です。
一緒に取られて、特に脂肪酸の酸化能力を評価するために、細胞外のフラックス アッセイは生体エネルギー プロフィール再生に影響を与える、病理学的変化の腎 TECs のエネルギッシュな状態を評価する有益な手段として利用できる、腎線維化と腎不全への進行に大きな役割。
| 手順 | 時間 (分) |
| キャリブレーション | |
| 平衡します。 | 00時 12分: 00 |
| 測定 1 | 3 ループ |
| ミックス | 00時 02分: 00 |
| 待機 | 00時 02分: 00 |
| メジャー | 00時 03分: 00 |
| ミックス | 00時 02分: 00 |
| 待機 | 00時 02分: 00 |
| メジャー | 00時 03分: 00 |
| ミックス | 00時 02分: 00 |
| 待機 | 00時 02分: 00 |
| メジャー | 00時 03分: 00 |
| 注入ポート (1 μ M オリゴマイシン) | 2 ループ |
| ミックス | 00時 02分: 00 |
| 待機 | 00時 02分: 00 |
| メジャー | 00時 03分: 00 |
| ミックス | 00時 02分: 00 |
| 待機 | 00時 02分: 00 |
| メジャー | 00時 03分: 00 |
| ポート B (1 μ M FCCP) を注入します。 | 2 ループ |
| ミックス | 00時 02分: 00 |
| 待機 | 00時 02分: 00 |
| メジャー | 00時 03分: 00 |
| ミックス | 00時 02分: 00 |
| 待機 | 00時 02分: 00 |
| メジャー | 00時 03分: 00 |
| ポート C (2 μ M Rotenon/アンチマイシン) を注入します。 | 2 ループ |
| ミックス | 00時 02分: 00 |
| 待機 | 00時 02分: 00 |
| メジャー | 00時 03分: 00 |
| ミックス | 00時 02分: 00 |
| 待機 | 00時 02分: 00 |
| メジャー | 00時 03分: 00 |
表 1。主な尿細管細胞に最適な OCR の測定のためのプロトコルを実行している細胞フラックス解析を標準化しました。
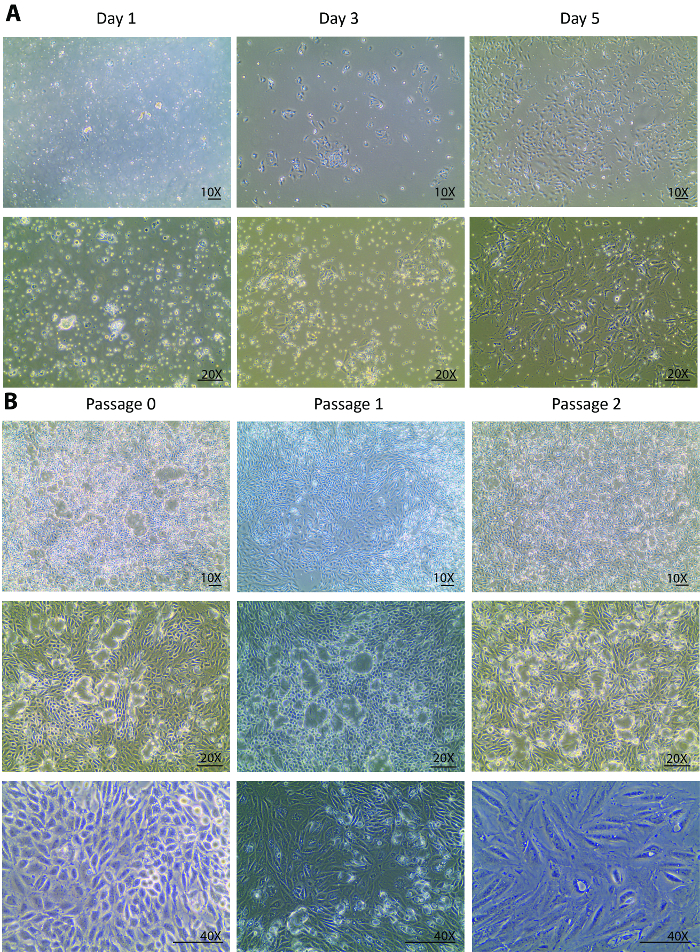
図 1。分離の主な尿細管細胞の培養します。(A) 分離の主な尿細管細胞の 1 日目に初期接続し、3 日目から 5 日目に確実に成長します。画像は、10 X、20 X 目標下撮影です。このパネル (B) では、0 の通路から通路 3 に主な尿細管細胞は分離のサブカルチャーを示しています。画像は、10 X、20 X 目標ビジョン セル ドームの下の通路を形態学的変化の視野のための 40 × 対物下撮影です。縮尺記号 = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
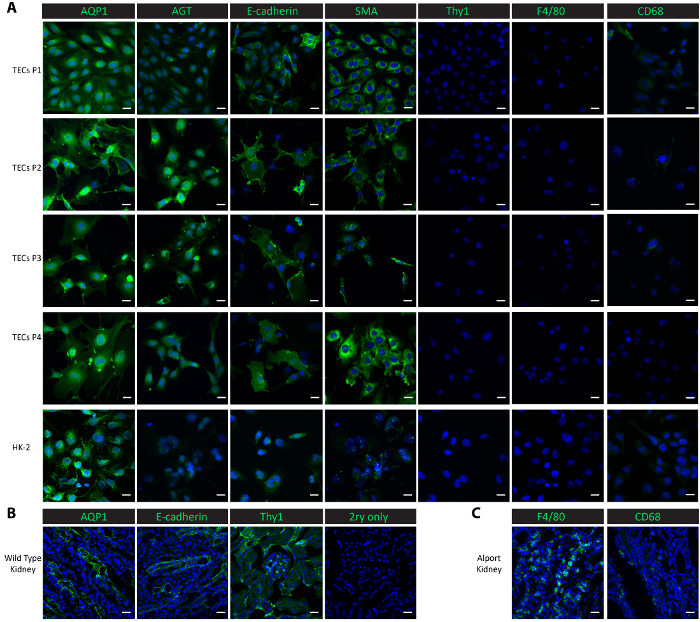
図 2。分離の主な尿細管細胞のキャラクタリゼーション。(A) マクロファージ蛋白質 (F4/80, CD68) やメサンギウム蛋白質 (Thy1) 上皮タンパク質 (SMA) 遠位尿細管蛋白質 (E-カドヘリン) (AQP1、AGT) 近位尿細管の蛋白質に対する抗体染色を示す孤立したプライマリ尿細管細胞とその後サブカルチャーは、純粋な近位および遠位尿細管の細胞です。(B) このパネルは、近位尿細管、遠位尿細管および健康の野生型マウスから腎組織にメサンギウム蛋白質の汚損の肯定的な制御といいえ主ネガティブ コントロールとして表示されます。(C) このパネルは、マクロファージ タンパク質 F4/80 および CD68 陽性対照としてCol4a3-/-マウスから収集した腎組織の染色性を示しています。縮尺記号 = 20 μ m。DAPI は、青で表示されます。マーカー蛋白質は緑色で表示されます。この図の拡大版を表示するのにはここをクリックしてください。
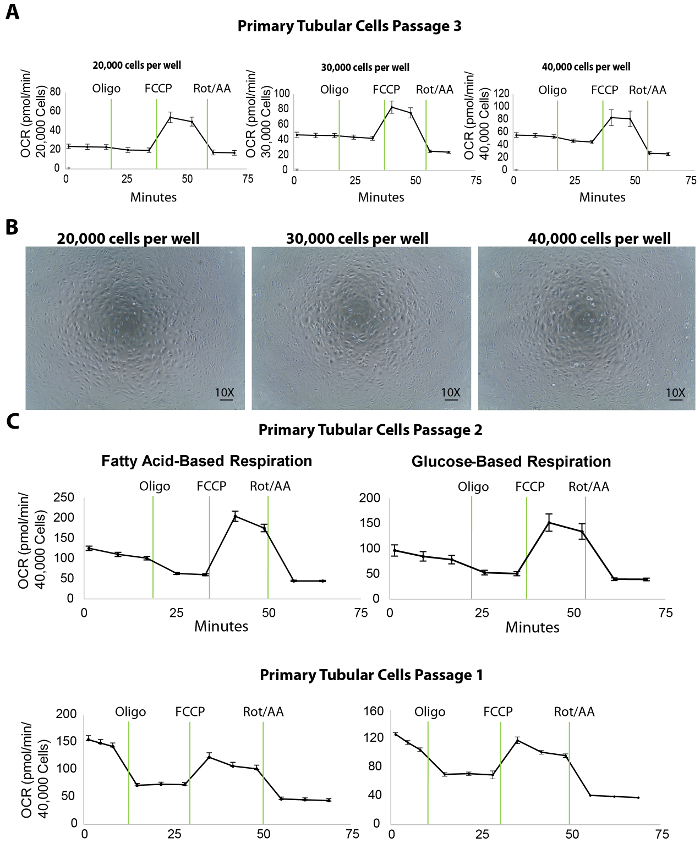
図 3。異なるめっき密度でプライマリ尿細管細胞細胞フラックス アッセイ。(A) 増加の細胞密度をめっき 3 の通路でテスト プライマリ尿細管細胞の基底呼吸レベルの向上します。(B) このパネルは、プライマリ尿細管細胞の顕微鏡画像培養 30,000、20,000、40,000 の細胞/ウェル密度で播種 XF96 マイクロ プレートです。縮尺記号 = 100 μ m。 このパネル (C) 2 と 1 の通路でプライマリ尿細管細胞の脂肪酸やブドウ糖による細胞フラックス測定を示しています。データは、平均 ± SEM.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
マウス腎尿細管上皮細胞 (TECs) の効率的な分離を可能にするプロトコルを最適化し、, セルが存在下における脂肪酸のミトコンドリアの呼吸を評価する細胞外フラックス解析のためサブ培養することができます。および/またはブドウ糖ベース基板。このプロトコルは近位および遠位尿細管細胞に着目した研究のため、テック病理学関連の腎疾患の理解のためのより複雑な実験を構築するフレームワークとして提供しています。以前に公開されたプロトコル9,10,19に比べると、このメソッドの並べ替えに勾配分離遠心時間が長くまたは十分な抗体の使用量を必要としない、したがってよりを提供しています腎尿細管代謝分野で働く研究者のための効率的かつ最適化されたガイド。このプロトコルは、消化、再収集とメッキ密度細胞フラックスの試金のための化合物の最適化などでいくつかの重要な手順があります。
腎組織から成功した消化力および尿細管細胞の解離をキーは、コラゲナーゼと最適濃度の正しい種類を選択します。2 型コラゲナーゼにはコラーゲンの他のタイプと比較して、プロテアーゼ活性、コンパクトな腎の構造を分離することができるの比較的高いレベルが含まれています。、長時間血流と消化時間の結果、汚染の可能性を最小限に抑える 0.013 %2 型コラゲナーゼは 30 mL/分で灌流。腎被膜は、両方の腎臓を動物から収穫し、滅菌細胞文化フードに転送後にのみ削除されました。腎臓は、小さな断片にみじん切りしたし、完全な消化力と尿細管細胞の最大のリリースのための別の 5 分消化バッファーによる 10 mL の培養を続けた。
消化後組織懸濁液は、非常に大規模な組織の部分を削除する 70 μ m フィルターを通過は、されますが、未消化の尿細管はフィルターを通過し、細胞懸濁液内にとどまる、培養皿の上にメッキを得る。これらの尿細管尿細管細胞を解放し、培養皿をしっかりと付けるのため通常よりも長い時間がかかります。したがって、むしろ細胞懸濁液を収集し、遠心分離機のペレット未接続尿細管及びセル セルめっき後 2 日目にすることが重要です。この低速遠心分離のステップは、さらに尿細管細胞よりも軽量化は、他の細胞型を削除し、未接続の尿細管と尿細管細胞を解決することができます。
適切な細胞密度の識別は、正常細胞フラックスの試金のためのキー最初のステップです。XF96 マイクロ プレートのウェルあたり 40,000 の細胞は脂肪酸やグルコースを用いた呼吸法 (図 3) のプライマリ尿細管細胞の理想的な結果を示した。このプロトコル分離尿細管細胞は、1 と 2 の通路で細胞外のフラックスの試金のために使用されていました。サブ鋼管マーカー (図 2) と生体エネルギーの試金 (図 3 a) でまともな性能の表現を維持し、通路 2 と比較して減少した基底呼吸レベルを示した 3 を通過する培養細胞(図 3図 3 aの右端のパネルで OCR を比較することによって示されている)。この減少は可能性があります (たとえば、若い野生型マウスから分離したもの) 実質的に健康的な尿細管の細胞には影響を与えません。ただし、既に減少ミトコンドリア呼吸を持っている CKD マウス モデルから分離された細胞の研究、細胞の高い通路は基底の呼吸細胞フラックス アッセイの結果に影響を与えるのさらなる減少あります。研究はここでは、実施 1 の通路通路 2 高を示した基底呼吸レベルから細胞。したがって、このプロトコルに従って、これらの 2 つの初期の通路を用いた健康と病気動物から分離した細胞ミトコンドリア呼吸研究することをお勧めします。通路 1 サブカルチャーにフラックスの試金のための十分な細胞が得られない場合、2 の通路からセルを考慮取らまだべきであります。生体エネルギーの研究に加えて私たちの以前の研究は、通路 3 プライマリ TECs を化合物のタンパク質と RNA 研究 (データは示されていない) が続くと治療に非常に有用することができますを示しています。つまり、私達は調査官の尿細管細胞を分離するこのプロトコルを使用するが異なる研究用途に最適な通路を慎重に選択する必要があります提案します。
細胞外フラックス解析の動作原理は、ランプの効果と呼吸鎖複合体注入の化合物間の相互作用に基づいています。オリゴマイシンは複雑な V (ATP 合成酵素) の抑制剤である、ATP リンク酸素消費量およびミトコンドリア内膜32間で正規のプロトン漏れを克服するために必要な酸素消費量を区別するために使用されます。FCCP ミトコンドリア膜電位を混乱させることによって ATP の生産から酸素消費量の情報から切り離します。したがって、それは、膜を介したプロトン輸送を許可することで ATP 合成酵素によるプロトン イオン流出の限られた容量を回避最大呼吸能力の測定を提供します。アンチマイシン A 複雑な III の阻害剤とロテノン、複雑な私のブロッカー、非ミトコンドリアの酸素消費量、ミトコンドリアとの区別をできるように全体のミトコンドリア呼吸をシャット ダウンする組み合わせで使用されてセルをします。これらの化合物は、細胞外のフラックス測定前に最適な OCR 曲線をもたらす最適な濃度を決定する特定のセルタイプの常に滴定する必要があります。ここでは、1 μ M のオリゴマイシン、FCCP の 1 μ M、ロテノン/アンチマイシン A プライマリ TECs の細胞フラックスの試金のための 2 μ M をお勧めします。
結論としては、このプロトコルは、腎主近位および遠位尿細管上皮細胞前のヴィヴォミトコンドリアの生体エネルギーを評価するために使用できるを分離する簡単かつコスト効果の高い方法を提供します。このプロトコルは、腎尿細管上皮細胞の生物機能の探索分子生物学の広い範囲で役に立ちますが、純粋な近位または遠位尿細管を必要とする研究に適用するとき我々 はその限界を認めます。たとえば、Lowe 症候群、選択的近位尿細管機能障害33、または遠位腎尿細管性アシドーシス、遠位尿細管機能障害34, に関する研究に関する研究が細胞分離のより高度なプロトコルを必要と浄化。ただし、糸球体と尿細管を比較研究の大半および一般に尿細管細胞の潜在的なミトコンドリア呼吸レギュレータを選別する研究では、プロトコルは高いスループットを実現可能なアプローチを提供します。したがって、このプロトコルには、検出またはターゲット検証目的で薬腎疾患に伴うミトコンドリア機能障害を研究する広範なアプリケーションがあります。
開示事項
著者申告するものがあります。
謝辞
この作品はリナ shehadeh A.-投稿日時に対する次の補助金によって支えられた: 国立衛生研究所の (R56HL132209 および 1R01HL140468) およびマイアミの心研究所。
資料
| Name | Company | Catalog Number | Comments |
| Collagen I Rat Protein, Tail | ThermoFisher Scientific | A1048301 | |
| Acetic Acid | J.T.Baker | 9508 | |
| Collagenase Type II | Worthington | LS004176 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Renal Epithelial Cell Growth Medium 2 Kit | PromoCell | C-26130 | |
| 2-Deoxy glucose | Sigma | D6134 | |
| Glucose | Sigma | G8270 | |
| L-Carnitine | Sigma | C0283 | |
| Etomoxir | Sigma | E-1905 | |
| Oligomycin | Sigma | 75351 | |
| Carbonyl cyanide 4-(trifluoromethoxy) phenylhydrazone (FCCP) | Sigma | C2920 | |
| Rotenone | Sigma | R8875 | |
| Antimycin-A | Sigma | A8674 | |
| Bovine Serum Albumin (BSA) | Sigma | A7030 | |
| Sodium palmitate | Sigma | P9767 | |
| NaCl | Sigma | S7653 | |
| Sodium pyruvate | Sigma | P5280 | |
| L-Glutamine 200mM solution | Sigma | G7513 | |
| DMEM powder | Sigma | D5030-1L | |
| Hoechst 33342 | LifeTechnologies | H3570 | |
| Trypan Blue Staining (0.4%) | LifeTechnologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Micro Dissecting Forceps | Roboz | RS-5101 | |
| TC10 automated cell counter | Bio-Rad | 506BR2119 | |
| MINIPULS 3 Peristaltic Pump | Gilson Inc. | GM3P | |
| Seahorse XFe96 Analyzer | Seahorse Bioscience | S7800A | |
| Seahorse XFe96 FluxPack (includes sensor cartridges, microplates, and calibrant) | Seahorse Bioscience | 10260-100 |
参考文献
- Bielesz, B., et al. Epithelial notch signaling regulates interstitial fibrosis development in the kidneys of mice and humans. Journal of Clinical Investigation. 120 (11), 4040-4054 (2010).
- Fabian, S. L., et al. Hedgehog-Gli pathway activation during kidney fibrosis. American Journal of Pathology. 180 (4), 1441-1453 (2012).
- Forbes, J. M. Mitochondria-power players in kidney function. Trends in Endocrinology & Metabolism. 27 (7), 441-442 (2016).
- Suzuki, T., Furusato, M., Takasaki, S., Ishikawa, E. Giant mitochondria in the epithelial cells of the proximal convoluted tubules of diseased human kidneys. Laboratory Investigation. 33 (6), 578-590 (1975).
- Yuan, Y., et al. Mitochondrial dysfunction accounts for aldosterone-induced epithelial-to-mesenchymal transition of renal proximal tubular epithelial cells. Free Radical Biology & Medicine. 53 (1), 30-43 (2012).
- Kang, H. M., et al. Defective fatty acid oxidation in renal tubular epithelial cells has a key role in kidney fibrosis development. Nature Medicine. 21 (1), 37-46 (2015).
- Al-Awqati, Q., Oliver, J. A. Stem cells in the kidney. Kidney International. 61 (2), 387-395 (2002).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Therapy. 21 (6), 618-628 (2014).
- Kamiyama, M., Garner, M. K., Farragut, K. M., Kobori, H. The establishment of a primary culture system of proximal tubule segments using specific markers from normal mouse kidneys. International Journal of Molecular Sciences. 13 (4), 5098-5111 (2012).
- Terryn, S., et al. A primary culture of mouse proximal tubular cells, established on collagen-coated membranes. American Journal of Physiology-Renal Physiology. 293 (2), F476-F485 (2007).
- Tang, M. J., Suresh, K. R., Tannen, R. L. Carbohydrate metabolism by primary cultures of rabbit proximal tubules. American Journal of Physiology. 256, C532-C539 (1989).
- Gesek, F. A., Wolff, D. W., Strandhoy, J. W. Improved separation method for rat proximal and distal renal tubules. American Journal of Physiology. 253, F358-F365 (1987).
- Vinay, P., Gougoux, A., Lemieux, G. Isolation of a pure suspension of rat proximal tubules. American Journal of Physiology. 241 (4), F403-F411 (1981).
- Taub, M., Chuman, L., Saier, M. H., Sato, G. Growth of Madin-Darby canine kidney epithelial cell (MDCK) line in hormone-supplemented, serum-free medium. Proceedings of the National Academy of Sciences of the United States of America. 76 (7), 3338-3342 (1979).
- Chung, S. D., Alavi, N., Livingston, D., Hiller, S., Taub, M. Characterization of primary rabbit kidney cultures that express proximal tubule functions in a hormonally defined medium. Journal of Cell Biology. 95 (1), 118-126 (1982).
- Rubera, I., et al. Chloride currents in primary cultures of rabbit proximal and distal convoluted tubules. American Journal of Physiology. 275, F651-F663 (1998).
- Inoue, C. N., et al. Use of cultured tubular cells isolated from human urine for investigation of renal transporter. Clinical Nephrology. 53 (2), 90-98 (2000).
- Van der Hauwaert, C., et al. Isolation and characterization of a primary proximal tubular epithelial cell model from human kidney by CD10/CD13 double labeling. PLoS One. 8 (6), e66750 (2013).
- Helbert, M. J., Dauwe, S. E., Van der Biest, I., Nouwen, E. J., De Broe, M. E. Immunodissection of the human proximal nephron: flow sorting of S1S2S3, S1S2 and S3 proximal tubular cells. Kidney International. 52 (2), 414-428 (1997).
- Wen Ding, K. Y., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Quadri, J. A., et al. Fluoride-associated ultrastructural changes and apoptosis in human renal tubule: a pilot study. Human & Experimental Toxicology. , (2018).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Experimental Animals. 60 (5), 481-487 (2011).
- Condorelli, L., et al. Effect of fluid shear stress on tubular kidney epithelial cell structure. World Congress on Medical Physics and Biomedical Engineering. 25 (10), 50-52 (2009).
- Aschauer, L., et al. Delineation of the key aspects in the regulation of epithelial monolayer formation. Molecular and Cellular Biology. 33 (13), 2535-2550 (2013).
- George, S. K., et al. Potential use of autologous renal cells from diseased kidneys for the treatment of renal failure. PLoS One. 11 (10), e0164997 (2016).
- Elberg, G., et al. MKL1 mediates TGF-beta1-induced alpha-smooth muscle actin expression in human renal epithelial cells. American Journal of Physiology-Renal Physiology. 294 (5), F1116-F1128 (2008).
- Elberg, G., Guruswamy, S., Logan, C. J., Chen, L., Turman, M. A. Plasticity of epithelial cells derived from human normal and ADPKD kidneys in primary cultures. Cell and Tissue Research. 331 (2), 495-508 (2008).
- Cai, Q., et al. Toxicity of acetaminophen, salicylic acid, and caffeine for first-passage rat renal inner medullary collecting duct cells. Journal of Pharmacology and Experimental Therapeutics. 306 (1), 35-42 (2003).
- Zhao, Y., et al. Isolation and epithelial co-culture of mouse renal peritubular endothelial cells. BMC Cell Biology. 15, 40 (2014).
- Barros, M. H., Hauck, F., Dreyer, J. H., Kempkes, B., Niedobitek, G. Macrophage polarisation: An immunohistochemical approach for identifying M1 and M2 macrophages. PLoS One. 8 (11), e80908 (2013).
- Kim, M., et al. Progression of Alport kidney disease in Col4a3 knock out mice is independent of sex or macrophage depletion by clodronate treatment. PLoS One. 10 (11), e0141231 (2015).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthethase system. Methods in Enzymology. 55, 472-518 (1979).
- Bockenhauer, D., et al. Renal phenotype in Lowe Syndrome: a selective proximal tubular dysfunction. Clinical Journal of the American Society of Nephrology. 3 (5), 1430-1436 (2008).
- Ranawaka, R., Dayasiri, K., Gamage, M. A child with distal (type 1) renal tubular acidosis presenting with progressive gross motor developmental regression and acute paralysis. BMC Research Notes. 10 (1), 618 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved