このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
蛹化の好みとEctropis grisescensの出現成功の勉強をお選びいただき、いいえ選択生物検定
要約
ここでは、提案する土壌要因 (例えば基板の種類と含水率) への応答でEctropis grisescensの成熟した幼虫の蛹化の好みを調査するためのプロトコル選択生物検定を使用します。蛹化の動作に影響を与える要因を決定するない選択生物検定のプロトコルとの生存本e. grisescens.
要約
多くの昆虫は幼虫と大人として生きる地上と地下蛹として。ライフ サイクルの地上の段階と比較して、少ない注目されているどのように環境影響を及ぼす因子に関するこれらの昆虫土の中でさなぎになるとき。紅茶ルーパー、ウォーレン ・ Ectropis grisescens (鱗翅目: シャクガ科) チャの深刻な害虫であり、南中国で巨大な経済的損失を引き起こした。説明プロトコルここ多肢選択生物検定を通じて、調査することを目指して、最終齢を熟すかどうかE. grisescens幼虫は基板の種類と含水率など土壌変数を識別できなし選択を判断生物検定、蛹化挙動に基板の種類と含水率の影響の出現成功e. grisescens.結果e. grisescensの蛹の生態学の理解を高めるだろうし、 e. grisescensの人口を抑制するための土壌管理戦術に洞察力をもたらす可能性があります。さらに、これらの生物検定は、蛹化挙動に及ぼす諸因子の影響と土壌 pupating 害虫の生存に関する研究に変更できます。
概要
昆虫の幼虫及び成虫の段階と比較して、蛹期は非常に危険な状況から逃げることのできない急速に蛹のモバイル機能が制限されるため脆弱です。昆虫の多様なグループによって使用される共通の戦略は、地面の下 pupating (例えば、双翅目の注文で1,2,3,4, 甲虫5, ハチ目の6、アザミウマ目7と鱗翅目8,9,10、11,12) 地上の捕食者や環境の危険からそれらを保護するために。それらの多くは深刻な農業・林業害虫1,2,3,4,5,6,7,8 ,9,10、11,12。これら土壌 pupating 昆虫の成熟した幼虫は通常彼らのホストを残す、地面に落ちる、適切なサイトを見つけ、土に穴を掘る、pupating8,10蛹室を構築をましょう。
紅茶ルーパー、ウォーレン ・ Ectropis grisescens (鱗翅目: シャクガ科)、ツバキの sinensis ・ l ・13の植物は茶の最も重要な defoliator の害虫の 1 つ。Ectropis とプラウトとして識別されて誤っているが、この種は最初に 1894 年に説明、(鱗翅目: シャクガ科) 過去に何十年も14,15。形態、生物学、および 2 つの兄弟種の間の地理的分布の違いは、いくつか最近研究14,15,16に記載されています。たとえば、張ら15 E. grisescensはに比べてはるかに広い分布に対しE. 斜めが主に中国の 3 つの州 (安徽省、江蘇省、浙江省) の境界で発生したことが報告されたe. 斜め。したがって、 e. grisescensによって引き起こされる経済的損失が見落とさ、この害虫の知識は広範囲にわたって改訂する必要があります、16,17,18,19 を更新.私たちの以前の研究は示したその大腸菌 grisescens土の中で蛹になるを好むが、土壌が利用可能 (条件なし蛹化基板)11,12も蛹でした。
本稿は、(1) 決定に応えてE. grisescensの蛹化嗜好因子基板の種類などし水分多肢選択生物検定を使用して、コンテンツ、(2) 非生物的要因の影響を判断する手順を説明します蛹化行動と選択を有しない生物検定を使用してE. grisescensの出現成功。よく管理された実験室の状態の下でこれらの生物検定のすべてを行っています。また、これらの生物検定は多様な土壌 pupating 昆虫の生存と蛹化挙動に関する他の要因の影響を評価するために合わせられます。
プロトコル
1. 水分選択生物検定e. grisescensの蛹化の優先順位を決定するには
-
E. grisescensの成熟の最終齢幼虫を取得
- 新鮮な枝 (長さ 30-40 cm) 茶植物 (ツバキの sinensis l.) をカットします。250 mL の三角フラスコに 25-30 撮影を挿入します。水道水でフラスコを満たします。プラスチック盆地 (茶芽) と 3-4 フラスコを置く (アッパー サイド: 直径 51 cm; 下側: 直径 40 cm; 高さ: 16 cm)。
- それぞれの流域で茶芽の葉にe. grisescensの研究所コロニーの 1,000-2,000 幼虫 (2 番目に 5 番目令) をリリースします。制御された実験室でこれらの幼虫を維持 [光の 14 時間の日長に続いて闇の 10 h (14:10 L:D)、60-90% 相対湿度 (RH)、24-28 ° C]。慎重にすべての 1-2 d 手で新鮮な葉に幼虫を転送します。毎日は、盆地の底から糞便および残骸を削除します。
- 茶芽の葉から落ちるし、洗面器の下に積極的にさまよう成熟の最終齢幼虫を選択します。十分な幼虫の生物検定の利用を確実にする、少なくとも 240 の成熟した幼虫を取得します。
注: のみ、実験のため積極的に放浪の幼虫を選択します。これらは蛹になる準備ができていないので、葉に幼虫を選択しません。また、彼らがされないため積極的に適切な条件のバイオアッセイ アリーナにリリースされた後に限られたモバイル活動と一緒に前蛹を選択しません。
-
基板の準備
- 収集し、基板の 4 種類を識別する (例えば、砂、砂質ローム 1、砂ロームの 2、およびローム シルト) 比重計法20を使用して。土壌と乾燥機 > 3 d、80 ° C オーブンで砂を殺菌し、完全に乾燥土と砂 50 ° C で数週間時間をかけてもう基板サンプルの乾燥重量は変わりません。
- 地面めかごとモルタル乾燥した土壌。3 mm ふるい砂および接地の土をふるいにかけるし、密閉式のビニール袋に保存します。
- 各基板の別の水分含量を計算 (砂、砂ローム 1、砂ロームの 2、またはローム シルト)2を次のよう。
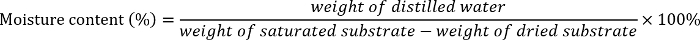
- 乾燥土壌または 5 を準備する砂を含む密閉式のビニール袋に蒸留水の必要な量を追加 % - 20% に 35%、50%、65%、80% の水分の基板。徹底的に蒸留水と土や砂を混ぜます。
-
バイオアッセイ アリーナ準備
- ポリプロピレン容器で均等に分割 (アッパー サイド: 長さ 20.0 cm × 13.5 cm 幅、下側: 長さ 17.0 cm × 10.0 cm 幅、高さ: 6.5 cm) 防水ポリ塩化ビニル (PVC) シートが付いている 6 部屋に (高さ: 3.5 cm)。PVC シートを修正し、ホット接着剤を使用して亀裂をシールします。
注: 完全に水の浸透を防ぐために任意の亀裂をシールします。 - 各テストでは、同じ種類の基板を用いた水分含量の異なる 6 室を埋める (5% - 20% に 35% - 50%、65%、80% の水分) (図 1 a)。
注: のみ、各テストでの水分含量の異なる基板の 1 種類を使用します。6 水分含量を有する基板を含む部屋の順序をランダムに割り当てます。 - (図 1 b) ポリプロピレン容器の蓋の内側の表面をカバーするテープの小片を使用して新鮮な茶葉の 4 ~ 6 個セットを貼り付けます。
- ポリプロピレン容器で均等に分割 (アッパー サイド: 長さ 20.0 cm × 13.5 cm 幅、下側: 長さ 17.0 cm × 10.0 cm 幅、高さ: 6.5 cm) 防水ポリ塩化ビニル (PVC) シートが付いている 6 部屋に (高さ: 3.5 cm)。PVC シートを修正し、ホット接着剤を使用して亀裂をシールします。

図 1: 選択テストのためのバイオアッセイ アリーナの例。(、) 防水性のポリ塩化ビニル (PVC) シートは、ポリプロピレン容器で 6 室に均等に分割されます。PVC シートはホット接着剤で固定されており、任意の亀裂は慎重に封入します。この例では、砂壌土 2 異なる含水率 (5%、20%、35%、50%、65%、80% の水分) をランダムに割り当てられた注文のチャンバーが記入されます。(b) 新鮮な茶葉が蓋の内側に貼り付け、成熟したEctropis grisescens幼虫が発売予定します。(c) PVC シートはポリプロピレンの容器に 4 室の 4 種類で満ちている均等に分割する使用される基板 (砂、砂ローム 1、砂ロームの 2、およびローム シルト) 50% の水分。この図は、王らから変更されています。11.この図の拡大版を表示するのにはここをクリックしてください。
-
バイオアッセイ設定とデータ記録
- 30 成熟した最終齢幼虫 (1.1.3 の手順で得られた) ポリプロピレン容器の蓋に貼り付けられた新鮮な茶葉をリリースします。慎重に蓋を覆すし、ポリプロピレンの容器をしっかりとカバーします。
- 各繰り返しは、8 x をテストします。14:10 (L:D) 日長と 26 ° c. で商工会議所環境設定で生物検定のアリーナを維持します。
- 5 日目、各商工会議所では、土壌の表面に蛹の数をカウントします。また、生物検定を解体し、基板内で蛹の数をカウントします。
注: 上または基板内のみライブの蛹をカウントします。鉗子を使用して蛹に触れた後腹部の動きを観察することによって蛹の生存率を確認してください。
-
データ解析
- 各テストでは、各複製の各商工会議所は、蛹の割合を計算します。クセラ、Malmgren21によって提供されるメソッドを使用してログ比割合データを転送します。
- 各商工会議所、一方向の分散分析 (ANOVA) を使用して中の蛹 (変換されたデータ) の割合を比較します。有意水準を α に設定テストごとに 0.05 を =。
2. 基板選択生物検定e. grisescensの蛹化の優先順位を決定するには
- 手順 1.1 成熟直前の幼虫を入手するを繰り返し、ステップ 1.2 水分含量の異なる基板を準備します。今回は、20%、50%、80% の水分基板のみが必要です。
-
生物検定のアリーナの準備
- 1.3.1 をステップ、PVC シートを使用して 4 室にポリプロピレンの容器で均等に分割に似ています。PVC シートを修正し、ホット接着剤を使用して亀裂をシールします。
- 各テストでは、4 種類の部屋を埋めるランダムに同じ含水率 (20%、50%、80% の水分) を持つ基板 (砂、砂ローム 1、砂ロームの 2、およびローム シルト) 割り当てられた注文 (図 1 c)。1.3.3 蓋を準備する手順を繰り返します。
- 1.4 生物検定を設定し、データを記録、1.5 のデータを分析するステップの手順を繰り返します。
3. 選択生物検定土壌潜砂行動とe. grisescensの出現の成功を決定するには
- 手順 1.1 成熟した最終齢幼虫を入手するを繰り返し、ステップ 1.2 3 含水率 (20%、50%、80% の水分) で 4 基板 (砂、砂ローム 1、砂ロームの 2、およびローム シルト) を準備します。
-
生物検定の設定
- プラスチックの容器に基板を追加 (アッパー サイド: 直径 11.5 cm; 下側: 直径 8.5 cm; 高さ: 6.5 cm) 3 cm の深さに。合計で 12 トリートメント (4 基板タイプと 3 の水分含量の組み合わせ) があることを確認します。各治療 7 を繰り返します x。
- 各検定のアリーナの基板上に 15 の成熟した最終齢幼虫をリリースします。蓋をしっかりと覆うことによって、コンテナーをシールします。14:10 (L:D) 日長と 26 ° c. で商工会議所環境設定で生物検定を維持します。
注: が必要とされる前述の選択生物検定で蓋の新鮮な茶葉を貼り付ける。
-
データの記録と解析
- 3 日目、各複製の基板の表面に任意の死んだ幼虫と蛹の数をカウントします。次のように、基板に穴を掘ったE. grisescens個人の割合を計算します。
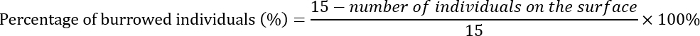
- 記録の羽化成虫数 15 以上の大人が浮上してまで毎日 d. 出現成功を次のように計算します。
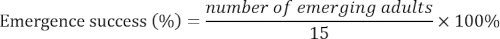
- 穿たれた個人や一方向の分散分析を用いた治療の間で出現成功の割合を比較します。設定有意水準 α = 0.05。
- 3 日目、各複製の基板の表面に任意の死んだ幼虫と蛹の数をカウントします。次のように、基板に穴を掘ったE. grisescens個人の割合を計算します。
結果
水分選択生物検定を示したことにより多くの大腸菌 grisescens個人の背地性大幅または 5% と 35% の水分内砂に比べて水分 80% 砂 (図 2 a)。ただし、著しくより多くの個人は (図 2b 2d) 中間水分があった土 (砂質ローム 1 と 2 および沈泥のローム) 以内に蛹になる優先。
ディスカッション
いくつかの害虫6,9,22,23蛹化設定の異なる土壌変数への応答を調べた。たとえば、増殖 tryoni (Froggatt) 成熟した幼虫の好みを研究する (双翅目: ミバエ科) 異なる土壌水分条件の中で Hulthen とクラーク22設定で満ちている 9 の容器を含む 3 x 3 ラテン広場デザイン各コンテナーの...
開示事項
著者が明らかに何もありません。
謝辞
昆虫飼育、実験の設定で彼らの助け、望月秀次, 温、石屏梁、Shengzhe 建と藤賀李 (林業大学、韓国中国農業大学ランドス ケープ ・ アーキテクチャー) に感謝します。中国の国家自然科学基金 (許可番号 31600516)、広東省自然科学基金 (許可番号 2016A030310445) と科学技術計画プロジェクトの広東省 (許可番号 2015A020208010) によって資金が供給されたこの作品.
資料
| Name | Company | Catalog Number | Comments |
| Triangular flask | Bomex Chemical (Shanghai) Co., LTD | 99 | 250 mL |
| Plastic basin | Chahua, Fuzhou, China | 100 | upper side: 51 cm in diameter; bottom side: 40 cm in diameter; height: 16 cm |
| Zip lock bags | Glad, Guangzhou, China | 126/133 | |
| Polypropylene containers | Youyou Plastic Factory, Taian, China | 139/155/160/161/190 | upper side: 20.0 cm [L] × 13.5 cm [W], bottom side: 17.0 cm [L] × 10.0 cm [W], height: 6.5 cm |
| Waterproof polyviny chloride sheet | Yidimei, Shanghai, China | 141 | |
| Tape | V-tech, Guangzhou, China | VT-710 | |
| Oven drier | Kexi, Shanghai, China | KXH-202-3A | |
| Environmental chamber | Life Apparatus, Ningbo, China | PSX-280H |
参考文献
- Dimou, I., Koutsikopoulos, C., Economopoulos, A. P., Lykakis, J. Depth of pupation of the wild olive fruit fly, Bactrocera (Dacus) oleae (Gmel.) (Dipt., Tephritidae), as affected by soil abiotic factors. Journal of Applied Entomology. 127 (1), 12-17 (2003).
- Chen, M., Shelton, A. M. Impact of soil type, moisture, and depth on swede midge (Diptera: Cecidomyiidae) pupation and emergence. Environmental Entomology. 36 (6), 1349-1355 (2007).
- Holmes, L. A., Vanlaerhoven, S. L., Tomberlin, J. K. Substrate effects on pupation and adult emergence of Hermetia illucens (Diptera: Stratiomyidae). Environmental Entomology. 42 (2), 370-374 (2013).
- Renkema, J. M., Cutler, G. C., Lynch, D. H., MacKenzie, K., Walde, S. J. Mulch type and moisture level affect pupation depth of Rhagoletis mendax Curran (Diptera: Tephritidae) in the laboratory. Journal of Pest Science. 84 (3), 281 (2011).
- Ellis, J. D., Hepburn, R., Luckman, B., Elzen, P. J. Effects of soil type, moisture, and density on pupation success of Aethina tumida (Coleoptera: Nitidulidae). Environmental Entomology. 33 (4), 794-798 (2004).
- Pietrantuono, A. L., Enriquez, A. S., Fernández-Arhex, V., Bruzzone, O. A. Substrates preference for pupation on sawfly Notofenusa surosa (Hymenoptera: Tenthredinidae). Journal of Insect Behavior. 28 (3), 257-267 (2015).
- Buitenhuis, R., Shipp, J. L. Influence of plant species and plant growth stage on Frankliniella occidentalis pupation behaviour in greenhouse ornamentals. Journal of Applied Entomology. 132 (1), 86-88 (2008).
- Zheng, X. L., Cong, X. P., Wang, X. P., Lei, C. L. Pupation behaviour, depth, and site of Spodoptera exigua. Bulletin of Insectology. 64 (2), 209-214 (2011).
- Wen, Y., et al. Effect of substrate type and moisture on pupation and emergence of Heortia vitessoides (Lepidoptera: Crambidae): choice and no-choice studies. Journal of Insect Behavior. 29 (4), 473-489 (2016).
- Wen, Y., et al. Soil moisture effects on pupation behavior, physiology, and morphology of Heortia vitessoides (Lepidoptera: Crambidae). Journal of Entomological Science. 52 (3), 229-238 (2017).
- Wang, H., et al. Pupation behaviors and emergence successes of Ectropis grisescens (Lepidoptera: Geometridae) in response to different substrate types and moisture contents. Environmental Entomology. 46 (6), 1365-1373 (2017).
- Wang, H., et al. No-substrate and low-moisture conditions during pupating adversely affect Ectropis grisescens (Lepidoptera: Geometridae) adults. Journal of Asia-Pacific Entomology. 21 (2), 657-662 (2018).
- Ge, C. M., Yin, K. S., Tang, M. J., Xiao, Q. Biological characteristics of Ectropis grisescens Warren. Acta Agriculturae Zhejiangensis. 28 (3), 464-468 (2016).
- Xi, Y., Yin, K. S., Tang, M. J., Xiao, Q. Geographic populations of the tea geometrid, Ectropis obliqua (Lepidoptera: Geometridae) in Zhejiang, eastern China have differentiated into different species. Acta Entomologica Sinica. 57, 1117-1122 (2014).
- Zhang, G. H., et al. Detecting deep divergence in seventeen populations of tea geometrid (Ectropis obliqua Prout) in China by COI mtDNA and cross-breeding. PloS One. 9 (6), e99373 (2014).
- Ma, T., et al. Analysis of tea geometrid (Ectropis grisescens) pheromone gland extracts using GC-EAD and GC× GC/TOFMS. Journal of Agricultural and Food Chemistry. 64 (16), 3161-3166 (2016).
- Zhang, G. H., et al. Asymmetrical reproductive interference between two sibling species of tea looper: Ectropis grisescens and Ectropis obliqua. Bulletin of Entomological Research. , (2016).
- Luo, Z. X., Li, Z. Q., Cai, X. M., Bian, L., Chen, Z. M. Evidence of premating isolation between two sibling moths: Ectropis grisescens and Ectropis obliqua (Lepidoptera: Geometridae). Journal of Economic Entomology. 110 (6), 2364-2370 (2017).
- Li, Z. Q., et al. Chemosensory gene families in Ectropis grisescens and candidates for detection of Type-II sex pheromones. Frontiers in Physiology. 8, (2017).
- Chen, L. Q. Research on structure of soil particle by hydrometer method. Environmental Science Survey. 29 (4), 97-99 (2010).
- Kucera, M., Malmgren, B. A. Logratio transformation of compositional data: a resolution of the constant sum constraint. Marine Micropaleontology. 34 (1-2), 117-120 (1998).
- Hulthen, A. D., Clarke, A. R. The influence of soil type and moisture on pupal survival of Bactrocera tryoni (Froggatt) (Diptera: Tephritidae). Australian Journal of Entomology. 45 (1), 16-19 (2006).
- Alyokhin, A. V., Mille, C., Messing, R. H., Duan, J. J. Selection of pupation habitats by oriental fruit fly larvae in the laboratory. Journal of Insect Behavior. 14 (1), 57-67 (2001).
- Torres-Muros, L., Hódar, J. A., Zamora, R. Effect of habitat type and soil moisture on pupal stage of a Mediterranean forest pest (Thaumetopoea pityocampa). Agricultural and Forest Entomology. 19 (2), 130-138 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved