このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
末梢血およびリンパ組織から主な人間の T 細胞のシナプスのインタ フェースの評価
要約
プロトコルでは、平面脂質二重膜を用いたシナプス インターフェイスを形成する主なポリクローナル T 細胞の機能を研究する手法について説明します。主に由来するリンパ節、末梢血 T 細胞の差動シナプス形成機能を表示するのにこの方法を使用します。
要約
原動力の現在の理解と T 細胞シナプス インターフェイスの構造機能主平面膜のガラス サポートと体外を使用して決定されています-派生 T 細胞クローンまたはライン1,2 ,3,4。主なヒト T 細胞由来の血液やリンパにこれらの調査結果を適用方法組織知られていない、分析5セルの十分な数を得ることに重要な難しさもあって。ここで活性化し、接着分子を含む平面脂質二重膜を構築するマルチ チャンネル流れスライドを利用する技術の開発を通じてこのアドレスします。流れスライドの高さの低いシナプス界面形成のダイナミックや顆粒放出の速度論を研究する研究者、細胞: 二重添付ファイルを同期するために急速な細胞沈降を促進します。この 10 数としてシナプス インターフェイスを分析するアプローチを採用4 105一次凍結 T 細胞リンパ節 (LN) と末梢血 (PB) から分離されました。新規平面脂質二分子膜技術できる主な T 細胞由来の血液と健康と病気のコンテキストで組織の生物物理特性の研究結果が明らかに。
概要
T 細胞免疫シナプスおよび T 細胞の機能的活動へのリンクの構造機能の科学的知識は、細胞株の研究から主に生成されているし、PB 由来のクローンを作成します。得られる主な T 細胞に関連してこれらの結果どの程度人間のリンパ組織または血液不明のまま、リンパやその他の組織に存在する T 細胞のシナプスのインタ フェースはこれまで分析されていません。重要なは、新たなデータは住民組織とリンパ器官由来の T 細胞表現型、PB6,7で機能活性に有意差があることをお勧めします。これはさらに主な人間の T 細胞の T 細胞のシナプス インターフェイスの機能を理解する必要性を凝固しました。
このため、私たち人間の PB および LN から分離された未満 105主な T 細胞の T 細胞/二分子膜のイメージングを実行するを有効にするマルチ チャンネル流れスライドに組み込まれた脂質二重膜を利用した新規ミニスケール アプローチを開発しました。この手法より良いモデルし、生体内で細胞間の相互作用を理解するために主な人間の T 細胞シナプスのインターフェイスの生物物理学的特性の研究をことができます。
プロトコル
本研究はヘルシンキ宣言に基づき行った。すべての参加者から書面によるインフォームド コンセントを得たし、血とリンパ節のサンプルは、ペンシルベニア州立大学 (IRB #809316、IRB # 815056) 制度検討委員会の承認を得て買収されました。すべての被験者は、大人でした。臍帯血サンプルは、トーマス ・ ジェファーソン大学産科婦人科分娩によって提供された親切。すべてのサンプルはデ識別されました。
1. CD4 の分離+ T 細胞の画像解析
-
107冷凍末梢血単核球 (PBMCs) または収集されたサンプルからリンパ節単核細胞 (LNMCs) を含む 1 mL 因数分解しなさい。無菌フードでペニシリン/ストレプトマイシンとグルタミン添加 RPMI 9 mL に解凍されたセルを追加します。
- Centrifugate 4 ° c、300 x gで 10 分間のセル、上清を吸引し、補われた RPMI 10% 含有の 5 mL の細胞を再懸濁します FBS (完全培地)。37 ° C で CO2インキュベーターで一晩細胞をインキュベートします。
- 次の日、浄化 CD4+ T 細胞の否定的な免疫は、メーカーの説明書によると市販のキットを使用して並べ替えによって。
- 新鮮な精製 CD4 の数を測定する+ T 細胞はトリパン ブルー溶液の等量の細胞懸濁液 5 μ L をミックスします。ロード セル トリパン ブルーと検定青の混合物と、検定の 5 つのセクションの中の生きているセルをカウントします。
- 細胞数の平均を取るし、元のセル中断のセルの数を決定する: セル/1 mL の数 × 2 × 104平均のカウントを =。隔離されたセルの合計数が小さすぎる場合は、カウントせずそのままセルを使用します。
- 300 × g 10 分間で細胞を遠心し、105 で、アッセイのバッファー (20 mM HEPES、pH 7.4 では、137 mM NaCl、2 mM Na2HPO4、5 mM 5 mM KCl、1 mM MgCl2D-グルコース、2 mM CaCl2、および 1% ヒト血清アルブミン) でそれらを再懸濁します セル/50 μ L 以下と実験で使用する準備ができるまで 4 ° C (1-2 時間) で細胞を保ちます。
- 関連する機関のガイドラインによるとすべての生物学的廃棄物の処分します。
- 臍帯血 PBMC から活性化 CD8 T 細胞を準備、文化の T25 フラスコ 10 μ G/ml で 1 μ g/mL 抗 CD28 と抗 CD3 抗体の混合物で覆われて完全培地 5 mL に 10 の7セルに配置コントロール細胞集団として必要な場合、それぞれ。
- 次の日、フラスコからアクティブ化された臍帯血の細胞を削除、洗って新鮮な 1 x 媒体を完了し、組換え IL-2 の存在下で細胞を拡大 (100 U/mL) 2 週間。
- 臍帯血 CD8 を浄化+ T 細胞の否定的な免疫をメーカーの説明書によると市販のキットを使用して並べ替える。セルをカウントし、LN および PB CD8 の 1.3-1.6 の手順で説明するように、アッセイバッファーにメディアを交換+ T 細胞。
2. 平面脂質二重膜の準備のためのコンポーネント
- リポソームも5の 3 種類を準備: (a) 0.4 mM ダイレクトオン (1, 2-dioleoyl -sn- グリセロホスファチジン-3-phosphocholine) リポソーム、(b) 0.4 mM ダイレクトオン リポソーム 33 mol % 犬 NTA (1, 2-dioleoyl -snグリセロホスファチジン - 3-[(N-(5-アミノ 1 carboxypentyl) イミノジ酢酸) サクシニル] (アンモニウム塩)) 4 mol % ビオチニル-キャップ-PE (c) 0.4 mM ダイレクトオン リポソーム、脂質 (1, 2-dioleoyl -snグリセロホスファチジン-3-phosphoethanolamine - N-(キャップ ビオチニル) (ナトリウム塩))。
-
前述5として 5% カゼイン溶液を準備します。
- カゼイン 100 mL の純水に粉末 5 g を溶解し、水酸化ナトリウム 10 M の 350 μ L を追加します。2 時間室温で、利用規模に応じた低速で通常マグネチックスターラーで攪拌すべてと、4 ° C で一晩7.3 と遠心 4 ° C で 100,000 × g で 2 時間のためのソリューションに pH を合わせなさい0.22 μ m の滅菌フィルターで上清をフィルター、-80 ° C で因数でソリューションを保存し、
注意: 水酸化ナトリウム溶液化学やけどを引き起こすことができるし、眼との接触時に永久的な盲目を引き起こす可能性があります。この化学物質またはそのソリューションを処理するときは、安全服、ゴム手袋、眼の保護を使用します。
- カゼイン 100 mL の純水に粉末 5 g を溶解し、水酸化ナトリウム 10 M の 350 μ L を追加します。2 時間室温で、利用規模に応じた低速で通常マグネチックスターラーで攪拌すべてと、4 ° C で一晩7.3 と遠心 4 ° C で 100,000 × g で 2 時間のためのソリューションに pH を合わせなさい0.22 μ m の滅菌フィルターで上清をフィルター、-80 ° C で因数でソリューションを保存し、
-
前述のアプローチ8モノラル bionylated 抗体分子を生成するためにビオチンとラベル抗 CD3 抗体。
- ジメチルスルホキシド (DMSO) 0.1 mg/mL でビオチン PEO4 NHS のソリューションを準備します。リン酸緩衝生理食塩水 (PBS) 100 mM 重炭酸ナトリウムを含む 0.5 mL の抗体の 1 mg ビオチン PEO4 NHS ソリューションの 3.7 μ L を追加します。
- 室温で 2 h の混合物を孵化させなさい。Alexa Fluor 488 NHS エステル 10 mg/ml の DMSO 溶液を準備します。Alexa Fluor 488 NHS エステル ソリューションを 10 倍モル過剰でビオチン PEO4 NHS によってラベル付けされた抗体に追加します。
- 通常磁性攪拌器でゆっくり攪拌しながら室温で 1 h の混合物を孵化させなさい。サイズ排除クロマトグラフィーを使用して非連結の色素を分離します。
- 280 抗体溶液の光学密度を測定することにより抗体の濃度を決定する nm (280)。577 標識抗体の光学密度を測定 nm (577)。
- 次の方程式を使用して染料-抗体比を決定します。
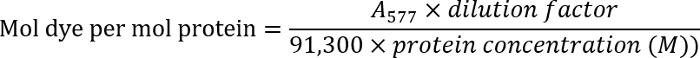
注: 製造元のプロトコルの詳細を見つけます。
-
ショウジョウバエ式システム3,4,9,10を前述のように組換え可溶性 ICAM 1 蛋白質を表現します。
- クローン cDNA のエンコードで、ICAM 1 のショウジョウバエ式に外部ドメイン ベクトル pMT/V5 彼彼が付いた組換えタンパク質を生産するメタロチオネイン誘導性プロモーターと6 C 末端のタグ。
- 共同 transfect 結果 ICAM 1 含むプラスミドと G418 発現ベクター S2 細胞。3 週間 10% 牛胎児血清 (FCS) や G418 の 0.5 mg/mL を添加したシュナイダーのショウジョウバエのメディアを使用して安定した形質転換細胞を選択します。昆虫無血清培地で細胞を展開し、0.5 mM CuSO4 3 d のためのタンパク質の発現を誘導します。
- Dialyzeを介してPBS に対して前述11として接線流コンセントレーターと培養上清 10 x を集中します。
- 共有結合固定化対策 ICAM 1 モノクローナル抗体とセファローズを含む列に濃縮培養上清を適用し、50 mM グリシン バッファー pH 3.0 とバインドされている ICAM 1 を溶出します。すぐに 2 M Tris バッファー pH 8.0 と溶出の ICAM-1 タンパク質を中和します。
- PBS、pH 8.0 に対して溶出物質を dialyze し、列含む Ni NTA アガロースに透析材料を追加します。200 mM のイミダゾール、pH 8.0 で水溶性の ICAM-1 を溶出します。PBS バッファー pH 8.0 に対して溶出素材を dialyze します。
- 製造元の指示に従って Cy5 NHS エステルと精製 ICAM 1 のラベルを付けます。
注: 最高の最終的な色素とタンパク質比率は 1:1 です。
- Fab を作り出すパパイン消化による抗 CD107a 抗体のフラグメントし、Fab を浄化3を前述のようにイオン交換クロマトグラフィーによるフラグメント。製造元の指示に従って Alexa Fluor 568 NHS エステルとフラグメントのすてきなラベルです。
3. ガラス平面脂質二分子膜の形成
- 140 mL の濃硫酸の 30% 過酸化水素の 60 mL を混合することによって新鮮な酸性ピラニア溶液を調製します。それらを浸漬 30 分保持酸ピラニア溶液中ガラス基板ポリプロピレンのシザー型鉗子によって流れスライド ガラス coverslips を洗います。
注意: ピラニア ソリューションは非常に強力な酸化剤です。ソリューションの処理中のすべての回で、安全メガネまたはゴーグルまたは厚いゴム手袋とフルフェイスのシールドしてください。ヒューム フードの下でピラニア ソリューションでのみ動作します。それが爆発すると、暖房、輸送、または、使用中にいつでも揺れを避けてください。鉛を含む穴とガラス瓶の中にピラニアの廃棄物を収集します。適切な廃棄物利用に関する機関の安全委員会にお問い合わせください。 -
リンス洗浄 coverslips 7 x は新鮮な水の入ったビーカーに順番にそれらを転送することによって超純水。残りの水にぬれた coverslips 脇はロールオフ、乾燥したガラスを残して、きれいなガラスのセット。
- また、ピペット チップを真空ポンプに接続を使用、coverslips から残りの水滴を慎重に取り外します。
- 無菌フードで膜を作るためのリポソーム ミックスを生成する各種の脂質成分の希釈液を実行します。まず、ダイレクトオン リポソームの 37 μ L とビオチニル-キャップ-PE リポソームの 3 μ L を兼ね備えてください。第二に、ダイレクトオン リポソームの 14 μ L と犬 NTA リポソーム 15 μ L を混ぜます。第三に、最終的なリポソーム混合物を作製する 2 番目のミックスの 29 μ L に 1 μ L の最初のミックスを追加します。
-
無菌フード乾燥 coverslips にワークスペースを設定してを閉じます。最終的なリポソームの混合物の 2 μ L 分注 (手順 3.3 参照) 粘着スライド チャネルの中心に正確に。すぐに、非常に正確に合わせ清潔乾燥 coverslip のスライド、スライドの粘着面の coverslip をゆっくりと下ろします。
- リポソーム混合物が急速に蒸発するので 1 つ以上のスライドを準備して場合、は、一度に 1 つのスライドに動作します。スライドを裏返し、ポリプロピレンのシザー型鉗子の外側のリングを使用して、スライド、スリップ、漏れを排除するためのスライドにしっかりと接続されていることを確かめる coverslip の周辺の接触に穏やかな圧力を適用します。
注: は、破損したり、coverslip の割れを避けるためにスライドのチャンネルに対して押さないでください。 - 何度もスライドを切り、アセンブリの外部のスライド側に二層の周りの永久的なマーカーと図面の 4 ドットで、coverslip とチャネル スライド ドロップのように形成された二重膜の位置をマークします。
- リポソーム混合物が急速に蒸発するので 1 つ以上のスライドを準備して場合、は、一度に 1 つのスライドに動作します。スライドを裏返し、ポリプロピレンのシザー型鉗子の外側のリングを使用して、スライド、スリップ、漏れを排除するためのスライドにしっかりと接続されていることを確かめる coverslip の周辺の接触に穏やかな圧力を適用します。
- チャネルに液体の最初の注入の前に入力ポートと出口ポートとして他としてチャネルの 1 つのポートを指定し、実験を通してこの指定を維持します。
- 気泡の形成を避けるため、チャネルの入力ポートに直接ピペット先端部の端を挿入します。ゆっくりと暖かいの 50 μ L でスライドのチャンネルを埋める (少なくとも室温) アッセイバッファー (バッファー構成手順 1.5 を参照してください)。
- 0.5 M ニッケル (ii) 塩化物水溶液を準備します。30 分の 37 ° C の水浴中カゼイン溶液 2 mL の約数を解凍し、最終濃度 200 μ M のニッケルの塩化物溶液でそれを補います。
- 最初のチャネルの入力ポートのカゼイン溶液 100 μ L を注入してピペッティングによるスライドの出口ポートから 100 μ L をすぐに取り外し、膜を洗浄します。同じソリューションで脂質をブロックするには、各チャンネルの入力ポートにカゼイン溶液 100 μ L を注入して、45 分間室温では、スライドをインキュベートします。
- Cy5 ICAM 1 彼の6とストレプトアビジン蛋白質の因数分解しなさい。2 μ g/mL の最終的な集中にアッセイバッファーでタンパク質を結合します。遠心分離機の 20,000 × g と集計を削除する 4 ° C で 30 分のためのソリューション。
- ピペッティングでスライド チャネルの出口ポートからブロッキング ソリューションの残りの部分を削除します。入力ポートに icam-1 およびストレプトアビジンを含む溶液 100 μ L を注入します。
- 常温で 45 分間スライドを孵化させなさい。出口ポートから蛋白質の解決の任意の過剰を削除します。2 二層を洗って x 最初のチャネルの入力ポートにアッセイバッファー 100 μ L を注入し、出口ポートから 100 μ L をすぐに削除します。
- Alexa Fluor 488 標識抗 CD3 抗体 2 μ G/ml の最終的な集中にアッセイバッファーで希釈します。スライドの入力ポートに抗体溶液 100 μ L を挿入して、45 分間室温でインキュベートします。出口ポートから蛋白質の解決の任意の過剰を削除します。2 二層を洗う手順 3.11 のようにアッセイバッファーの 100 μ L と x。
4. 平面二重膜と T 細胞の相互作用の可視化
-
予熱段階と共焦点または全内部反射蛍光 (TIRF) 顕微鏡の目的温度は 37 ° C で平衡となるまで温水のステージで、bilayer(s) を使用してスライドを設定します。インク マークに従って適切な位置にステージを移動し、Cy 標識 ICAM 1 分子の蛍光を用いた二層に焦点を当てます。
- 適切なフィルター設定で、全反射顕微鏡共焦点顕微鏡用 61 X 目的または 100 × 対物を使用します。
-
顆粒のため全反射顕微鏡によるイメージングをリリース、追加 Alexa Fluor 568 標識抗 CD107a 抗体 Fab フラグメントの入力ポートに細胞を注入する前に 4 μ G/ml の最終濃度に細胞懸濁液を。
- 準備の CD4 を再懸濁します+ T LN または鉛またはコードから分離した細胞は血液や細胞懸濁液を 50 μ l 添加の 2 層を含むスライド チャンネルの入力ポートを注入します。
- 注入後、フィールドの数が必要な各フィールド 1 x 30 分 2 分毎の画像を記録を選択します。
- 明視野、反射、光と蛍光のチャネル (アレクサ 488 および cy5 の組合せ) 共焦点顕微鏡画像を取得するを利用します。Alexa Fluor 488 と Alexa Fluor 568 蛍光と Cy5 蛍光と TIRF 顕微鏡での明視野イメージングのための広視野の全反射モードを使用します。
5 画像解析
- 適切なソフトウェアを使用して取得した画像を分析します。透過光のイメージや除外クラスター化し、目に見えて破損解析から細胞のアポトーシス細胞の形態を観察します。生産的 (すなわち、界面 Alexa Fluor 488 蛍光 (抗 CD3 抗体) を蓄積細胞) の膜と相互作用する細胞のみを解析に含めます。
- 細胞膜の相互作用の開始後 20 分で細胞接着領域のサイズを決定します。
注意: 接着部は暗い領域の干渉反射顕微鏡 (IRM) 画像のセル膜界面を開発しました。 - 細胞膜界面の分離の Cy ICAM 1 分子による Cy5 ICAM 1 蛍光のすべての蓄積およびリング接合の形成を観察します。蓄積された ICAM 1 分子形成接着リング ジャンクションに少なくとも 2 つの連続した画像の場合は、細胞周辺に超分子活性化クラスター (pSMAC)12の開発としてそのような細胞を指定します。
- 顆粒のリリースを評価するには、セルに近接接触面積外背景の蛍光性の T 細胞膜界面 Alexa Fluor 568 蛍光強度を測定.Degranulating 細胞として少なくとも 1.3 に信号背景に Alexa Fluor 568 の比率を持つセルを指定します。
結果
まず、臍帯血由来の活性化 CD8 によって形成されるシナプスのインターフェイスの構造を比較した+ T 脂質二重膜の細胞構築いずれかの伝統的な大規模なフロー電池システム (詳細については材料の表を参照してください)1 ,2,3,4またはマルチ チャンネル...
ディスカッション
ここで説明する手法コンベンショナル フロー セル5平面膜の構築に必要な同じような試薬を利用し、人間の T 細胞-二層のプライマリ インターフェイス3,4 のイメージングを実行する正常に適用することができます。 ,15。技術蛍光分子使用量の大幅な削減を提供しています 10-20 x フロー電池システム
開示事項
著者が明らかに何もありません。
謝辞
この作品が支持されたマイケル r. ベッツに R01AI118694 NIH グラント、サブ賞 566950 百合 Sykulev に含まれています。我々 は、シドニー ・ キンメルがんセンター バイオ イメージング共有リソースに優れたサポートをありがちましょう。
資料
| Name | Company | Catalog Number | Comments |
| CD4 T cell isolation kit, human | Miltenyl Biotec | 130-096-533 | |
| CD8 T cells Isolation Kit, human | Miltenyl Biotec | 130-096-495 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| DOGS NTA | Avanti Polar Lipids | 790528C | |
| Biotinyl Cap PE | Avanti Polar Lipids | 870273C | |
| Human Serum Albumin | Octapharma USA | NDC 68982-643-01 | |
| sticky-Slide VI 0.4 | ibidi | 80608 | |
| Coverslips for sticky-Slides | ibidi | 10812 | |
| Bioptech FCS2 Chamber | Bioptech | 060319-2-03 | |
| anti-CD3 antibody | Thermo Fisher Scientific | 16-0037-81 | OKT3 clone, hybridoma cells are available from ATCC |
| anti- CD28 antibody | Genetex | GTX14664 | 9.3 clone |
| Casein | Sigma | C5890 | |
| Biotin-PEO4-NHS | Thermo Fisher Scientific | 21329 | |
| DMSO | Sigma | D2650-5 | |
| Alexa Fluor 488 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10235 | |
| Alexa Fluor 568 protein labeling kit with column for labeled protein purification | Thermo Fisher Scientific | A10238 | |
| Amersham Cy5 NHS Ester | GE Life Science | PA15101 | |
| pMT/V5-His A, B, C Drosophila Expression Vectors | Thermo Fisher Scientific | V412020 | |
| pcopneo, G418 Drosophila expression vector for positive selection | ATCC | 37409 | |
| Serum free Drosophial media Insect-XPRESS | Lonza | 12-730Q | |
| Hybridoma YN1/1.7.4 | ATCC | CRL1878 | The hybridoma secrets antibody against ICAM-1. |
| Cyanogen bromide-activated-Sepharose 4B | Sigma-Aldrich | C9142 | Utilized for preparation of Sepharose with covelently bound anti-ICAM antibody. |
| MasterFlex tangential flow concentrator | Cole-Parmer | 77601-60 7592-40 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Centramate Lab Tangential Flow Systems | Pall Laboratory | FS002K10 OS010T12 FS005K10 | Used for ICAM-1 containing supernatant concentration and dialysis of ICAM-1 containing supernant |
| Ni-NTA Agarose | QIAGEN | 30210 | |
| Dialysis tubing | Spectra/Por | 131384 | |
| Papain from papaya latex | Sigma | P3125 | |
| mouse anti-human antibody against CD107a | BD Bioscences | 555798 | Clone H4A3 |
| Ansell Natural Blue Gloves | Fisher Scientific | 19-014-539 | |
| Nalgene Polypropylene Scissor-Type Forceps | Thermo Fisher Scientific | 6320-0010 | |
| Streptavidin | ProZyme | SA10 | |
| Confocal microscope | Nikon | Nikon TiE inverted microscope equipped with PFS for long-term image stability control, 60X oil objectives, 4 lasers with excitation lines at 405, 458, 488, 514, 561, and 640 nm, 2 GaAsP detectors and 2 high sensitivity PMTs, DIC transmitted light, Programmable X,Y,Z stage for multiple positions and stitching of large areas, time lapse functions, Tokai-Hit temperature and CO2-controlled chamber for live imaging, and anti-vibration isolation table | |
| TIRF microscope | Andor | Andor Revolution XD system equipped with Nikon TIRF-E illuminator, Lasers with 405,488,561 and 640 lines, DIC transmitted light, Yokogawa CSU-X1 spinning disk head for confocal imaging, 100/1.49 NA objective, Andor iXon X3 EM-CCD camera, objective heater, and a piezoelectric motorized stage with Perfect Focus System (PFS) | |
| MetaMorph Premier Image Analysis Software | Molecular devices |
参考文献
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285, 221-227 (1999).
- Somersalo, K., et al. Cytotoxic T lymphocytes form an antigen-independent ring junction. Journal of Clinical Investigation. 113, 49-57 (2004).
- Beal, A. M., et al. Protein kinase C theta regulates stability of the peripheral adhesion ring junction and contributes to the sensitivity of target cell lysis by CTL. The Journal of Immunology. 181, 4815-4824 (2008).
- Beal, A. M., et al. Kinetics of early T cell receptor signaling regulate the pathway of lytic granule delivery to the secretory domain. Immunity. 31, 632-642 (2009).
- Dustin, M. L., Starr, T., Varma, R., Thomas, V. K. Supported planar bilayers for study of the immunological synapse. Current Protocols in Immunology. , (2007).
- Reuter, M. A., et al. HIV-Specific CD8(+) T Cells Exhibit Reduced and Differentially Regulated Cytolytic Activity in Lymphoid Tissue. Cell Reports. 21, 3458-3470 (2017).
- Buggert, M., et al. Limited immune surveillance in lymphoid tissue by cytolytic CD4+ T cells during health and HIV disease. PLoS Pathogens. 14, e1006973 (2018).
- Carrasco, Y. R., Fleire, S. J., Cameron, T., Dustin, M. L., Batista, F. D. LFA-1/ICAM-1 interaction lowers the threshold of B cell activation by facilitating B cell adhesion and synapse formation. Immunity. 20, 589-599 (2004).
- Anikeeva, N., et al. Distinct role of lymphocyte function-associated antigen-1 in mediating effective cytolytic activity by cytotoxic T lymphocytes. Proceedings of the National Academy of Sciences of the United States of America. 102, 6437-6442 (2005).
- Steblyanko, M., Anikeeva, N., Campbell, K. S., Keen, J. H., Sykulev, Y. Integrins Influence the Size and Dynamics of Signaling Microclusters in a Pyk2-dependent Manner. The Journal of Biological Chemistry. 290, 11833-11842 (2015).
- Anikeeva, N., Lebedeva, T., Sumaroka, M., Kalams, S. A., Sykulev, Y. Soluble HIV-specific T-cell receptor: expression, purification and analysis of the specificity. Journal of Immunological Methods. 277, 75-86 (2003).
- Monks, C., Freiberg, B., Kupfer, H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395, 82-86 (1998).
- Riddell, S. R., Greenberg, P. D. The use of anti-CD3 and anti-CD28 monoclonal antibodies to clone and expand human antigen-specific T cells. Journal of Immunological Methods. 128, 189-201 (1990).
- Lin, S. J., Yu, J. C., Cheng, P. J., Hsiao, S. S., Kuo, M. L. Effect of interleukin-15 on anti-CD3/anti-CD28 induced apoptosis of umbilical cord blood CD4+ T cells. European Journal of Haematology. 71, 425-432 (2003).
- Anikeeva, N., Sykulev, Y. Mechanisms controlling granule-mediated cytolytic activity of cytotoxic T lymphocytes. Immunologic Research. 51, 183-194 (2011).
- Huppa, J. B., et al. TCR-peptide-MHC interactions in situ show accelerated kinetics and increased affinity. Nature. 463, 963-967 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved