Method Article
体外光線力学的治療へのアプローチ
要約
光線力学療法 (PDT) は、ジベレリン光増感剤 (PS) 目に見える光した後アポトーシス誘導へのインキュベーションを含む医療処置です。PS 培養と光治療パラメーターの差異を検討するために使用可能性があります PDT をシミュレートするように設計の in vitro PDT プロトコルを提案します。
要約
光線力学療法 (PDT) は、細胞のアポトーシスを誘導するために目に見える光した後ジベレリン光増感剤 (PS) の孵化を含む医療処置です。連邦麻薬局が日光角化症の治療の PDT を承認、臨床ガイドラインは、特定の非黒色腫皮膚癌と尋常性ざ瘡の治療薬として PDT をお勧めします。PDT は、それは低コスト、非侵襲的、最小限の副作用に関連付けられてギョッとさせる有利な治療です。PDT の最初のステップで PS は適用、細胞内に蓄積すること。その後の光照射細胞のアポトーシス、膜の中断、ミトコンドリア障害、免疫調節、表皮細胞の増殖とコラーゲン売り上げ高につながる可能性があります最終的に活性酸素種の形成を誘導します。ここに、付着性のセル行における PDT に体外手法を示す.この治療プロトコルは PDT をシミュレートするように設計し、様々 な細胞、光増感剤、培養温度や光の波長で PDT の使用を勉強に調整することがあります。扁平上皮癌細胞培養し, 0、0.5、1.0、および 2 mM 5-アミノレブリン酸 (5-ALA) 30 min と 1,000 の 417 nm の青色光でセンサー s。主要転帰指標はアポトーシスと壊死、アネキシン V 7 aminoactinomycin D フローサイトメトリーによって測定されます。5 アラバマ州の 30 分間インキュベーション アポトーシスの線量依存性増加があった高の間のテストの妥当性を達成するために体外実験を行う際に一貫性のあるインキュベーションと光源のパラメーターを維持するために重要です。PDT は有用な臨床プロシージャおよび生体外での研究、新規 PSs、プロトコル、および PDT の新しい適応の最適化の開発できるようにします。
概要
光線力学療法 (PDT) は、細胞のアポトーシスを誘導するために目に見える光した後ジベレリン光増感剤 (PS) の孵化を含む医療処置です。中央政府薬剤の管理 (FDA) が日光角化症 (AK) の治療の PDT を承認、臨床ガイドラインは、特定の非黒色腫皮膚癌とにきび尋常性1,2のための治療として PDT をお勧めします。PDT 用途新興非皮膚科にはには、消化器、婦人科、前立腺癌3治療が含まれます。PDT は、それは低コストで非侵襲的かつ最小限の副作用と瘢痕2に関連付けられて有利な治療法です。
PDT の最初のステップで PS は適用、2を細胞内に蓄積すること。アメリカ合衆国外用 5-アミノレブリン酸 (5-ALA)、AKs を治療するために使用されます。孵化の間に相、5 ALA が組み込まれた細胞3ヘム生合成経路を介してプロトポルフィリン IX (PP IX) に変換されます。がんや前がん細胞はプロトポルフィリン IX (PP IX)、最終製品に変換、鉄付加酵素の活動を減少しているヘム。その結果、がん細胞は、PP IX 細胞の4、5と比較して蓄積されます。がんや前がん細胞周囲の組織に対する PP IX のこの蓄積 PDT 最小限の有害事象に対象を絞ったアプローチをすることができます。光照射は、酸素が PP IX から励起電子を受け入れるとき活性酸素種 (ROS) の生成に します。PP IX は青と赤の光2を含む、目に見える光のスペクトル全体の小さいピークを持つ紫外スペクトルのピークの吸収です。ROS の生成は最終的に細胞のアポトーシス、膜の中断、ミトコンドリア障害、免疫調節、表皮細胞の増殖とコラーゲン売り上げ高6,7,8,9につながる可能性があります。,10。
PDT は 1970 年代に開発された、進化の治療3です。AKs の処置のための FDA 承認されたプロトコルは、14-18 h、5 ALA 皮膚培養をお勧めしますが、1 ~ 2 時間の孵化は臨床実習2でよく使用されます。体外では、我々 は短い 15 分 5 ALA 孵化が未処理の線維芽細胞11,12と比較して線維芽細胞のアポトーシスを高める可能性がありますを示しています。さらに、新規クロリン、フタロシアニン、およびナノ粒子ベースの PSs が PDT 効果3を改善するために研究されています。ここで、細胞付着性の扁平上皮癌における PDT に体外手法を示す.このプロトコルでは SCC 13 セルは 0、0.5、1.0、および 2 mM 5-翼 30 min とセンサーの 1,000 の 417 nm の青い光と孵化させる s。主要転帰指標はアポトーシスと壊死、アネキシン V 7 aminoactinomycin D (7 AAD) フローサイトメトリーによって測定されます。この治療プロトコル PDT をシミュレートするように設計および他の細胞、光増感剤、培養温度や光の波長で PDT の使用を勉強に調整する可能性があります。追加の管理グループの準備必要、含む無染色、単一分子蛍光染色、フローサイトメトリー用、正および負のコントロールがあります。理論、プロトコル、実験的なデザイン、およびアポトーシス/壊死フローサイトメトリー用ゲートの包括的な見直しは13他の場所で見つけることができます。
プロトコル
1. 細胞の調製
- バイオ セーフティ キャビネットの無菌技術を使用して 6 ウェル プレートの各ウェルに培地 2 mL に 20,000 の細胞をプレートします。
- 6 ウェル プレートをプレートに付着する細胞をできるように 24 時間加湿インキュベーター (37 ° C、5% CO2) に配置します。
2. 光増感剤の細胞の治療のための準備
- 培地の 0.5、1、および 2 mM 5 ALA ソリューションを準備します。ウシ胎児血清 (FBS) は、培地の成分が場合を準備し、細胞培養液 0.1% 溶液中 5 ALA の治療の孵化の FBS。11,12この場合、SCC 13 セルは必要ありません FBS、5 ALA は無血清培地ウシ脳下垂体抽出物および表皮成長因子を添加したケラチノ サイトに直接追加されたので。
- 培養培地を吸引し、少なくとも 2 ml のリン酸緩衝生理食塩水 (PBS) の細胞を洗ってください。
- PBS を吸引し、個別の刷版や井戸に 0、0.5、1、または 2 mM 5 ALA ソリューションの 2 mL を追加します。
- 0、0.5、1、セルを孵化させなさいまたは暖房の 30 分のブロック 36、37 ° C で 2 mM 5 ALA はアルミ箔を使用して潜伏中に露光量から細胞を保護します。
- 0、0.5、1、および 2 mM 5 ALA ソリューションを吸引し、2 ml の PBS のセルを洗ってください。
- PBS を吸引し、青色光照射用培養液 2 mL を追加します。
3. ブルーライト光線
- 青い光のデバイス (例えば、発光ダイオード、蛍光灯、またはハロゲン ライト) オンにセルを照射する前に、1 つのサイクルを実行 (1,000 s) デバイスを暖める。青い光デバイス必要があります 5 +/-417 の出力波長 nm。治療の前に 1 つのサイクルを実行するデバイスを許可する青い光の波長や放射照度の光位相で一貫していることを保証します。
- 光度計を使用して、セル表面の放射照度を測定します。細胞表面の青い光の照度は、10 mW/cm2をする必要があります。光とセル間の距離は、光源の強さに応じて 10 mW/cm2の照度を達成するために調整する必要があります。
- 青い光源下で黒の表面に 0、0.5、1、2 mM の ALA の治療グループを配置します。1,000 の青い光で細胞を照射秒 (16 分と 40 s) 10 J/cm2の合計フルエンスの。青い光光次セル分析の準備が整いました。
4. コレクションと染色
- 製造元のガイドライン (表の材料を参照) によるとフロー バッファーを準備します。
- 吸引培養培地、2 ml の PBS のセルを洗浄します。
- 0.25% トリプシン-EDTA の 1 つの mL を追加し、約 3 〜 5 分のデタッチするセルします。細胞は、細胞の剥離を確認を顕微鏡下で調べることができます。
- 10% 牛胎児血清トリプシンを非アクティブ化すると培養液 (PBS) の 1 つの mL を追加します。
- ラベル付きの 5 mL のフロー チューブに細胞懸濁液を収集します。
- 細胞ペレットを削除せず 201 x gで 5 分吸引ソリューション間の遠心で 5 mL のフロー チューブをスピンします。
- 共役アネキシン V 抗体 (フロー バッファーの 39 μ L あたりアネキシン v 1 μ) フロー バッファーの 200 μ L を各サンプルに追加します。
- 細胞を再懸濁します、インキュベーター (37 ° C、5% CO2) 結合する annexin V を許可する 20 分間置きなさい。
- 7 AAD の 3 μ L を各サンプルに追加します。室温で 5 分間インキュベートします。
5 フローサイトメトリーによる解析
- セットアップの流れの cytometer メーカー ガイドラインに従う (材料の表を参照してください)。
- 収集し、フローサイトメトリーによるサンプルを分析します。13
- 治療法と分散分析 (ANOVA)14を使用してコントロール グループの統計的な比較を実行します。Dunnett のテスト投稿するアドホック分析とコントロールの意味する治療グループの平均を比較します。
結果
SCC 13 後セル 0、0.5、1、および 2 mM 5 ALA で 30 分インキュベートし、照射 1,000 s 青の光は、細胞のアポトーシスの線量依存性増加があったの。合計アポトーシス (平均の平均 ± 標準誤差) は 3.94 ± 0.34、7.90 ± 0.52、23.86 ± 0.52 と 38.33 ± 1.81 0、0.5、1、および 2 mM 5-ALA と孵化の 30 分後にそれぞれ、および青の 1000 秒の光 (図 1)。0、0.5、1、および分散分析を使用して 2 mM 5 ALA 培養グループの中でアポトーシス細胞の平均の割合を比較しました。1 と 2 mM 5 翼細胞 0 mM 5 ALA 処理細胞と比較して細胞のアポトーシスの重要な増加していた。図 2 aを示しています代表的なフロー フローサイト メーターは、インキュベートを 0、0.5、1、および 2 mM 5 アラバマ SCC 13 セルの側方散乱 (SSC) 対前方散乱 (FSC) のゲートSCC 13 セル人口を囲むサークル ゲートします。この実験のため 7500 イベントが収集され、SCC 13 セル人口ゲートのイベントの少なくとも 90% を捕獲しました。図 2 bは、x 軸と y 軸にアネキシン V 7 AAD の代表的なプロットを示しています。細胞集団は、4 つの象限にゲート (第 4 四半期に Q1) アポトーシス細胞を区別します。第 1 四半期 (高アネキシン v、低 7 AAD) を表すセル早期アポトーシスを受けます。Q2 (高アネキシン v、高 7 AAD) を表すセルを受けて後半 apoptosis か壊死します。第 3 四半期 (低アネキシン v、高 7 AAD) 表す細胞壊死を受けています。Q4 (低アネキシン v、低 7 AAD) 表す細胞 apoptosis か壊死を受けていません。アポトーシス細胞の割合を計算するには、我々 は第 1 四半期と第 2 四半期のセルの割合を追加しました。5 ALA 潜伏期間の長さ、孵化の温度、または光照射線量の矛盾は、PDT 効果を変更できます。図 3代表アネキシン V と 7 AAD 流れフローサイトメトリーによるプロットを示しますは、孵化の温度が変化するとき (すなわち27、36、または 42 ° C)。アポトーシスの温度依存増加があった。
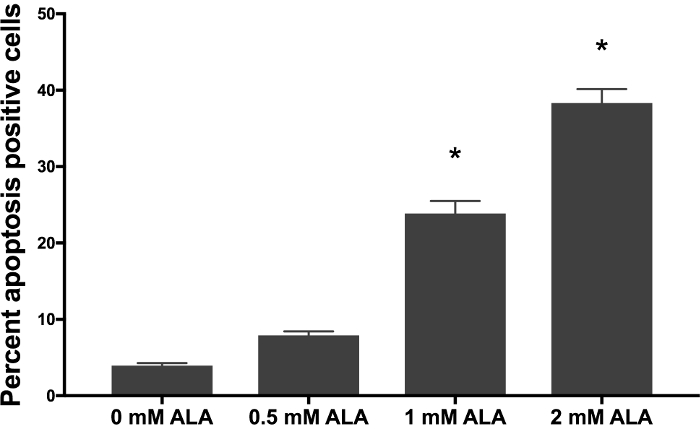
図 1: 5 アラバマ州の 30 分間インキュベーション後のアポトーシスの線量依存性に増加36 ° c の 1,000 に続いて 30 分インキュベート 5 ALA SCC 13 セルにおける青色光の s。バーは、それぞれの治療とコントロール群の平均パーセントのアネキシン V 陽性の細胞を表します。技術 3 通で実験を行った。統計的有意性はp 、分散分析によって決定された < 0.05 アスタリスク (*) で示されます。誤差範囲は、平均の平均 ± 標準誤差を表しています。この図の拡大版を表示するのにはここをクリックしてください。
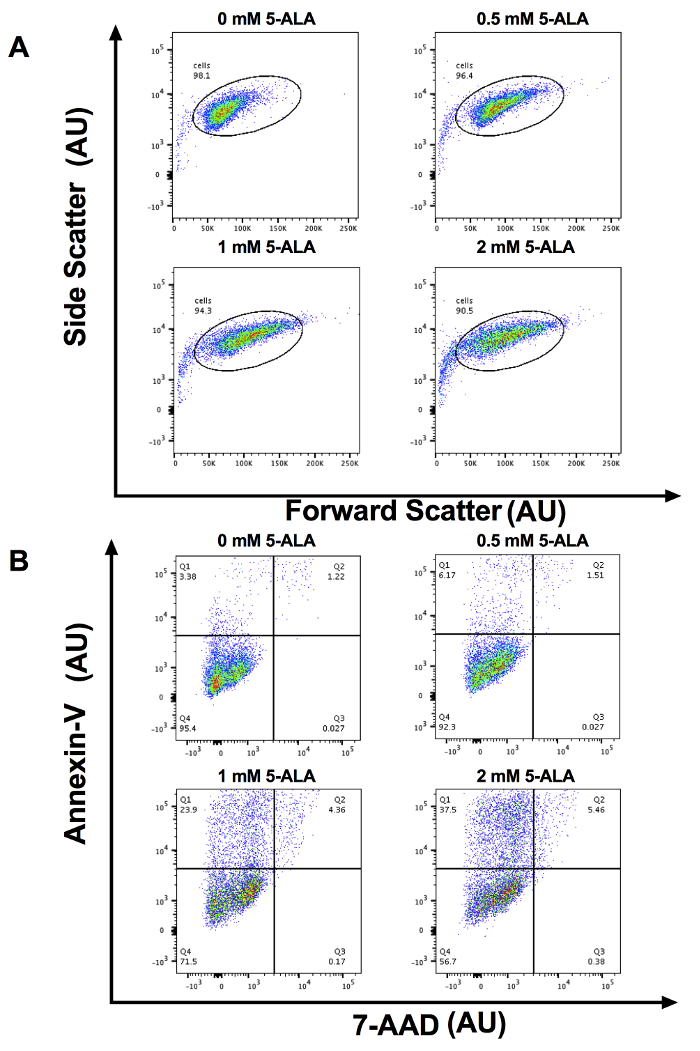
図 2: 代表フローサイトメトリー プロットします。(A) 代表的な前方散乱対側フローサイトメトリー散布任意単位 (AU) の x 軸と y 軸の 0、0.5、1、および 2 mM 5 ALA 培養細胞の。この実験の 7500 のイベントが収集され、SCC 13 セル人口ゲートがイベントの 90% を獲得します。(B)対代表アネキシン V 7 AAD フローサイトメトリー プロット AU の x 軸と y 軸の 0、0.5、1、および 2 mM 5 ALA 培養細胞の。Q1: 早期アポトーシス、Q2: 第 3 四半期後半アポトーシス/壊死細胞: 壊死細胞および第 4 四半期: 実行可能なセル。この図の拡大版を表示するのにはここをクリックしてください。
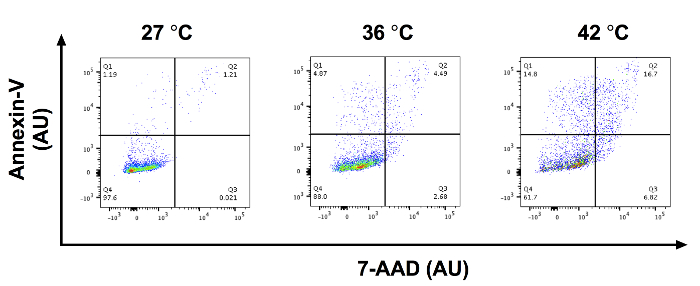
図 3: PDT 効果を変更可能性があります異なる温度で 5 ALA をインキュベートします。7 AAD フローサイトメトリー対代表アネキシン V プロット AU での x 軸と y 軸 0.5 mM 5-ALA 27、36、42 ° c. で孵化 SCC 13 セルのQ1: 早期アポトーシス、Q2: 第 3 四半期後半アポトーシス/壊死細胞: 壊死細胞および第 4 四半期: 実行可能なセル。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
SCC 13 アポートシス 0.5、1、および 2 mM 5-ALA 1,000 続いて 30 分孵化の大幅な増加があった青い光の s。これらの結果は 30 分青色光活性化によって続いての 5 翼の孵化を受けてアポトーシス12、線維芽細胞の割合で用量に依存して増加につながることを示す私たちの以前に発行された研究に一貫して 14。
勉強 PDT へのこの実験的アプローチには利点と制限。説明の方法は市販の PS として臨床に準拠し、光源が使用されました。研究者は、異なる種類の細胞、PSs、光源、照射パラメーターとメソッドをカスタマイズ可能性があります。ただし、このプロトコルは付着性細胞の単層培養向けにこの方法に制限があります。臨床において組織のアーキテクチャまたは病気の病理学 (すなわち、過角化症や線維症) の違いが低下する PS 吸収や浸透15光します。その結果、治療用量との実験結果が直接に対応しない臨床実習。回転楕円体腫瘍モデルとマイクロ流体チップより密接に腫瘍微小16,17,18をレプリケートする方法として研究されています。回転楕円体、感光を組み込むかもしれない差動異種腫瘍アーキテクチャを表す内側と外側の細胞ニッチがあります。他の研究者は、画面処理条件、光増感剤の血管配信にマイクロ流体チップを使用しています。ただし、マイクロ流体チップを開発する高価なまたは技術に馴染みのない研究者の実装することは困難があります。さらに、回転楕円体とマイクロ流体チップで光増感剤が血管普及せず腫瘍表面に直接適用される皮膚癌の臨床治療反映されません。研究者は異なった病気のシステムで勉強 PDT の単層培養法、回転楕円体腫瘍モデルおよびマイクロ流体チップの賛否両論を評価する必要があります。免疫細胞や細胞外マトリックスがない、ない PDT が複雑な細胞間相互作用に与える影響を判断することが可能です。研究者は動物モデルや臨床試験を用いた実験結果体外を確認する必要があります。高の間のテストの妥当性を達成するために体外実験を行う際に一貫性のあるインキュベーションと光源のパラメーターを維持するために重要です。
温度は、PDT19の効果を変更する知られています。1 つの研究は、細胞死、5 ALA 吸収, PP IX 形成およびサイトカインのリリースは、44 ° C19を温 5 ALA の細胞を培養によって強化される可能性があります示した。孵化温度 44 ° C の熱誘導細胞死につながる可能性があり、孵卵温度 20 ° C の下の重要な 5 ALA の吸収と蓄積19につながらない場合があります。研究者が熱の影響を潜在的交絡コントロールに一定した温度で温度調節可能な暖房のブロックで PS の孵化を実行することをお勧めします。また、5 ALA の PP IX への変換を許可するのに十分な時間、光増感剤をインキュベートすることが重要です。このプロトコルでは、正常に細胞のアポトーシスを誘発 30 分間 5 ALA に SCC 13 細胞培養。我々 は以前 5 ALA の 10 分インキュベーションが大幅無処理線維芽細胞11,14と比較して線維芽細胞のアポトーシスを増加しなかったことを示しています。PP IX は、5 ALA は 37 ° C で 6 分間インキュベートした後でマウス皮膚における蓄積開始します。したがって、5 ALA インキュベーションの 10 分後があります PP-IX20細胞アポトーシスを誘導するための十分な蓄積。私たちの以前の研究11,14に基づいて「ALA の 20 から 30 分の最小潜伏期間をお勧めします。研究者は、潜伏期間の設定、関心、セル型、および臨床徴候の光増感剤研究室に基づくを最適化する必要があります。製造業者の指針を使用して最良の結果のため、抗体の滴定および最適化の実験が行われます。興味の他のアッセイは、ROS の dihydroethidium フロー フローサイトメトリー法による定量化を含む青い光の photoactivation を次実行されるかもしれない。14
配布された表面積 (すなわち、放射照度) の単位あたりの光量変化と ROS 形成と細胞アポトーシス21総照射線量 (すなわちフルエンス) 光フェーズがあります。フルエンス、照度と時間との関係は以下の式で記述できます。
フルエンス (J/cm2) = 照度 (W/cm2) × 時間 (s)
フルエンスは時間に依存して、延長または短縮 photoactivation の段階は治療効果を変更できます。照度は光源と標的組織の間直交距離に比例します。その結果、光があまりにも遠くにある場合ができない場合があります十分な光エネルギーを刺激する対象の組織に配信される、PS の周囲の表面に反射する光の放射照度を増加可能性がありますまた。そのため、光の反射を防ぐために黒の表面に置かれた細胞培養皿で光照射を実行することをお勧めします。研究者が取得する商業的利用または FDA 承認された青色発光ダイオードと PDT の実験で使用する蛍光のデバイスが別の電源出力と光の電界均一性にこれらのデバイスがあります。特定の波長光度計は細胞表面と一貫性のある結果を得るのためのすべての実験の前に光のフィールドの均一性で照度を測定するために使わなければなりません。必要に応じて、電界均一性を強化する市販のディフューザーを使用する可能性があります。
要約すると、理論、実験方法、制限、潜在的な落とし穴と最適化のための推奨事項の詳細で PDT を調査する生体外でアプローチを説明しました。PDT は有用な臨床プロシージャおよび生体外での研究、新規 PSs、プロトコル、および PDT の新しい適応の最適化の開発できるようにします。
開示事項
DUSA/太陽製薬の場合は、5 ALA とブル U の光デバイスが用意されています。この原稿は、博士国の残留によって支えられた資金。内容は、米国退役軍人局やアメリカ合衆国政府の見解を表していません。
謝辞
著者の謝辞があります。
資料
| Name | Company | Catalog Number | Comments |
| Keratinocyte serum free medium | Thermofisher | 17005042 | Culture medium for SSC-13 cells |
| DMEM low glucose glutamax | Thermofisher | 10567022 | Possible culture medium for other cell types |
| 6-well culture plates | Thermofisher | 720083 | |
| PBS | Thermofisher | 14190250 | |
| 0.25% Trypsin-EDTA | Thermofisher | 25200056 | |
| Trypan Blue Solution, 0.4% | Thermofisher | 15250061 | For cell counting and plating |
| BLU-U light | DUSA | Request from manufacturer | Other blue LED, flourescent, or halogen lights may used |
| 5-ALA | DUSA | Request from manufacturer | |
| FBS | Atlanta Biologicals | C17032 | |
| FlowCellect Annexin Red Kit | Millipore Sigma | FCCH100108 | Propidium iodide may replace 7-AAD. Comes with annexin-V, 7-AAD, and flow buffer |
| FACSCanto II | BD | Request from manufacturer | Any flow cytometer may be used |
| Counting Chamber | Hausser | 3120 | For cell counting and plating |
| FlowJo | FlowJo | Request from manufacturer | Flow cytometry analysis software |
参考文献
- Morton, C., et al. European Dermatology Forum guidelines on topical photodynamic therapy. European Journal of Dermatology. 25 (4), 296-311 (2015).
- Ozog, D. M., et al. Photodynamic therapy: A clinical consensus guide. Dermatologic Surgery: Official Publication for American Society for Dermatologic Surgery. 42 (7), 804-827 (2016).
- Abrahamse, H., Hamblin, M. R. New photosensitizers for photodynamic therapy. Biochemical Journal. 473 (4), 347-364 (2016).
- Josefsen, L. B., Boyle, R. W. Photodynamic therapy and the development of metal-based photosensitisers. Metal-Based Drugs. 2008, 276109 (2008).
- Ohgari, Y., et al. Mechanisms involved in δ-aminolevulinic acid (ALA)-induced photosensitivity of tumor cells: Relation of ferrochelatase and uptake of ALA to the accumulation of protoporphyrin. Biochemical pharmacology. 71 (1-2), 42-49 (2005).
- Kessel, D., Luo, Y. Mitochondrial photodamage and PDT-induced apoptosis. Journal of Photochemistry and Photobiology B: Biology. 42 (2), 89-95 (1998).
- Goldberg, D. J. Photodynamic therapy in skin rejuvenation. Clinics in Dermatology. 26 (6), 608-613 (2008).
- Sakamoto, F. H., Lopes, J. D., Anderson, R. R. Photodynamic therapy for acne vulgaris: A critical review from basics to clinical practice: Part I. Acne vulgaris: When and why consider photodynamic therapy. Journal of the American Academy of Dermatology. 63 (2), 183-193 (2010).
- Boen, M., Brownell, J., Patel, P., Tsoukas, M. M. The role of photodynamic therapy in acne: An evidence-based review. American Journal of Clinical Dermatology. 18 (3), 311-321 (2017).
- Allison, R. R., Moghissi, K. Oncologic photodynamic therapy: Clinical strategies that modulate mechanisms of action. Photodiagnosis and Photodynamic Therapy. 10 (4), 331-341 (2013).
- Koo, E., Austin, E., Mamalis, A., Jagdeo, J., et al. Thermal ultra short photodynamic therapy: heating fibroblasts during sub-30-minute incubation of 5-aminolevulinic acid increases photodynamic therapy-induced cell death. Dermatologic Surgery: Official Publication for American Society for Dermatologic Surgery. , (2017).
- Koo, E., Austin, E., Mamalis, A., Jagdeo, J. Efficacy of ultra short sub-30 minute incubation of 5-aminolevulinic acid photodynamic therapy in vitro. Lasers in Surgery and Medicine. 49 (6), 592-598 (2017).
- JoVE Science Education Database. Cell Biology. Annexin V and Propidium Iodide Labeling. JoVE. , (2018).
- Mamalis, A., Koo, E., Sckisel, G., Siegel, D., Jagdeo, J. Temperature-dependent impact of thermal aminolaevulinic acid photodynamic therapy on apoptosis and reactive oxygen species generation in human dermal fibroblasts. British Journal of Dermatology. 175 (3), 512-519 (2016).
- Gilaberte, Y., et al. Cellular intrinsic factors involved in the resistance of squamous cell carcinoma to photodynamic therapy. Journal of Investigative Dermatology. 134 (9), 2428-2437 (2014).
- Yoon, H. K., et al. Nanophotosensitizers engineered to generate a tunable mix of reactive oxygen species, for optimizing photodynamic therapy, using a microfluidic device. Chemistry of Materials. 26 (4), 1592-1600 (2014).
- Chen, Y. -. C., Lou, X., Zhang, Z., Ingram, P., Yoon, E. High-throughput cancer cell sphere formation for characterizing the efficacy of photo dynamic therapy in 3D cell cultures. Scientific Reports. 5, 12175 (2015).
- Campos, C., Inada, N., Kurachi, C. Low-dose PDT on breast cancer spheroids. Optical Methods for Tumor Treatment and Detection: Mechanisms and Techniques in Photodynamic Therapy XXVII. , (2018).
- Yang, J., et al. The influence of temperature on 5-aminolevulinic acid-based photodynamic reaction in keratinocytes in vitro. Photodermatology, Photoimmunology & Photomedicine. 26 (2), 83-88 (2010).
- Juzeniene, A., Juzenas, P., Kaalhus, O., Iani, V., Moan, J. Temperature effect on Accumulation of protoporphyrin IX after topical application of 5-aminolevulinic acid and its methylester and hexylester derivatives in normal mouse skin. Photochemistry and Photobiology. 76 (4), 452-456 (2002).
- Novak, B., Heesen, L., Schary, N., Lubbert, H. The influence of different illumination parameters on protoporphyrin IX induced cell death in squamous cell carcinoma cells. Photodiagnosis and Photodynamic Therapy. 21, 385-392 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved