Method Article
H3 ・ H4 ヒストン蛋白質細胞および脳組織におけるアセチル化ヒストンの定量化の浄化
要約
この資料の目的は、ヒストン H3、H4 の効率的な精製と残基のアセチル化ヒストンの定量化に包括的、体系的なガイドを提供することです。
要約
すべての真核生物のクロマチン、すべての遺伝情報の生理学的なテンプレートは、遺伝に不可欠です。クロマチンは、多様な翻訳後修飾 (Ptm) 主 (すなわち、ヒストン尾部) ヒストン蛋白質のアミノ酸のテルミニで発生、アクセシビリティ、基になる DNA の機能状態を規制するの配列が必要です。ヒストンの尾はヌクレオソームのコアから拡張し、ヒストン コリンアセチルトランスフェラーゼ (帽子) によってアセチルのグループの追加および細胞増殖や分化の間にヒストン脱アセチル化酵素 (Hdac) によってアセチルのグループの削除があります。ヒストンの尾のリジン (K) 残基のアセチル化の特定パターンを決定 (1) 影響を及ぼすコアアセンブリ ヒストンの転写活性状態または転写抑圧されたクロマチン (2) 募集相乗効果と動的恒常性または転写サイトに拮抗クロマチン関連蛋白質。ヒストン尾部 Ptm の複雑な性質の基本的な規制メカニズムで細胞の成熟と分化正常および病的両方開発クロマチン テンプレート プロセスと変更の結果の大半に影響します。現在のレポートの目的は、コア ヒストン蛋白質細胞脳組織からを浄化して確実にアセチル化ヒストン H3、H4 のマークを定量化するための効率的な方法を初心者に提供することです。
概要
用語エピジェネティクスは、DNA シーケンス1,2の変化から独立して発生する遺伝子活動の遺伝的変化を指します。遺伝子の転写と抑圧 (1) (2 つの H2A、H2B、H3、H4 の各コピー) コア ヒストン蛋白質の八量体を包んだ染色体 DNA のアクセシビリティによって、(2) の転写因子の空室状況によって決定され、足場蛋白質特異的プロモーターのサイト3,4を採用しました。遺伝子の転写は、特定の DNA のプロモーター部位の酵素を介した変更、およびヒストンの尾5,6、7の Ptm によって規制されています。N 末端ヒストン H3 と H4 は真核生物3、知られている最も非常に節約されたシーケンスの間で、および、翻訳後修飾はクロマチン構造を決定する上で中心的な役割を再生する広く文書化されていると8,9を機能します。ヒストンの尾 (すなわち、アセチル化、メチル化、リン酸化、ユビキチン化) で Ptm 尾の相互作用の潜在性の変更、構造の状態に影響を与える、DNA アクセシビリティを規制する折りたたみクロマチン繊維とそれによって、4,10、11,12を処理します。アセチルのグループに追加され、特定ヒストン相互作用エピジェネティック酵素、すなわち帽子あり, それぞれ13のセットによってヒストンの尾 K 残基から削除されます。たとえば、メモリの獲得と統合の14に関連する遺伝子の転写をアクティブに以前リジン 12 で H4 ヒストンのアセチル化 (H4K12ac) を示されています。さらに、証拠のいくつかの行は、遺伝子転写の酵素を介したエピジェネティックな制御が健康な細胞の成長と分化6,15の重要な側面であることを提案します。エピジェネティック修飾 DNA または彼ら自身、エピジェネティック酵素の突然変異によって遺伝子発現のエピジェネティック制御の交替が、特定の遺伝子の活性の変化が特徴の人間の病気の調節不全に示されています。病理学 (例えば癌)6,16,17。したがって、コア ヒストンの変化の評価 Ptm は潜在的な治療上の介在のための価値の高いターゲットとして現れています。しかし、豊かさを判断するには、相互作用のパートナーおよびヒストン Ptm の固有の役割証明されている挑戦的な18。
現在のレポート内のセルおよび単一の分数とヒストン H3、H4 Ptm の定量化のための完全なプロトコルで脳組織からコアヒストンを浄化するために最適化された、媒体スループット戦略を説明します。注記のうち、現在出版酸ベースが浄化テクニックとヒストン抗体を用いた検出戦略を広くヒストン特性評価に採用されている、彼らは従ってプロシージャの重要なステップに関する詳細な説明を欠いています。迅速かつ複製可能なヒストン抽出と定量化を妨げます。たとえば、セルの処理を抽出し、組織生検摘出のためさまざまなツールや技術が必要です。また、現在の原稿で示される最適化されたプロトコルは、媒体スループットでの実用的なアプローチを示しています。コアヒストンは検出可能に信頼性の高い下流抗体 PTM 不純物から干渉されることがなく 1 つ、純粋な分数として抽出されます。さらに、現在の原稿の分子量が小さいためヒストン検出に関する課題が回避します。通常、精製、定量、ゲルの電気泳動のプロトコルとの互換性の欠如は、再現可能で、決定的な結果を得ることから科学者を妨げます。ここでは、セルおよびティッシュからコアヒストンを浄化し、下流 PTM 解析経由西部のしみのためにそれらを準備する最適化されたワークフローが表示されます。
現在のプロトコルのネイティブ翻訳後修飾 (すなわち、アセチル化、メチル化、リン酸化) を維持しながらコア ヒストン蛋白質の浄化ができます。図 1は、ヒストンの浄化のプロトコルのタイムラインを示しています。
プロトコル
すべてのマウスは、湿度と温度の制御 AAALAC 認定動物施設でマイアミ大学ミラー医学で収容されました。すべての実験はマイアミ ミラー学校の医学機関動物ケアおよび使用委員会 (IACUC) の大学によって承認され、NIH.の仕様に従って実施
1. サンプル抽出の準備
-
付着性のセル
- 適切な培養液 (1 x 106 〜 一次皮質ニューロンなど、初代培養細胞用ディッシュ 1015セル × 1、SH SY5Y、HEK 293、BV2 などの細胞ラインに皿あたり 1 x 10 の9セル) で 10 cm 料理のプレート細胞。セル板の表面全体に均等に分散でき、48 h (37 ° C、5% CO2) ~ 100% の合流点に到達するために成長する細胞を保証します。
- セルが目的の confluency に達したら、優しく培地を吸引し、洗浄セル 2 ティッシュ文化フードの下で prewarmed 血清無料メディアで x。
- お皿から血清フリー メディアを吸引、1 mL の氷冷抽出バッファーを追加 (0.4 M 硫酸、1 mM KCl、1 ミリメートル MgCl2、50 ミリメートル トリス-HCl [pH 8.0] とプロテアーゼ阻害剤のカクテル 1) それぞれの皿に。
- プラスチック電池スクレーパーを使用して、(こする) によって抽出バッファー内のすべてのセルを収集し、ラベル 1,000 μ L ピペット管 1.5 mL に転送します。セルを上下に均質化を容易にする 3 x ピペットで移しなさい。
- すべてのチューブを閉じるし、すぐに氷の上にそれらを置きます。
-
脳組織
- 凍結するティッシュを使用している場合 prechilled 1.5 mL チューブにティッシュを置き、簡単に氷の解凍。新鮮な組織を使用している場合は、1.2.2 をステップにすぐに進みます。
注: 現在のプロトコルは、冷凍マウスの脳およびマウス前頭前野のサンプルを使用して手順を説明します。 - 抽出バッファーの適切な量と推奨される (表 1) のストロークの数を使用してハンドヘルド Dounce ホモジナイザーを使用して組織をホモジナイズしてください。過剰なクロマチンの細断処理を避けるため、推奨されるストロークの数を超えないようにします。
- 単一チャネル 1,000 μ L ピペットを使用して、prechilled 1.5 mL チューブに磨砕液を転送します。すべてのチューブを閉じるし、すぐに氷の上にそれらを置きます。
- 凍結するティッシュを使用している場合 prechilled 1.5 mL チューブにティッシュを置き、簡単に氷の解凍。新鮮な組織を使用している場合は、1.2.2 をステップにすぐに進みます。
2. 原油ヒストン抽出物の準備
- 細胞または組織抽出バッファー回転プラットフォーム上で中断を含む 1.5 mL チューブを置き、原油のヒストンの抽出を許可する 4 ° C で 15 rpm で回転します。
注: 抽出時間別の細胞と組織型の異なる場合があります、各プロシージャ用に最適化する必要があります。現在のプロトコルは次の 15 分、2 h、24 h の抽出 (図 2図 3図 4、および図 5) 得られた結果を提示します。 - 4 ° C に遠心を prechill します。目的の抽出後時間が経過、4 ° C で 10 分間最大速度でチューブを遠心分離
- 新しい prechilled 1.5 mL チューブに原油のヒストンを含む上清を転送します。ペレットを破棄します。
- -80 ° C で上清を保存 (この段階で抽出を停止ことができます図 1の「停止手順」を参照してください) またはすぐ次ステップに進みます。
- 中和バッファー x 5 の 1/4 量を原油のヒストンを中和する (例えば、原油ヒストンの 1 mL に中和バッファー x 5 の 250 μ L を追加)。6 x 上下ピペッティングでよく混ぜます。
- PH のストリップとの混合物の pH をチェックします。調整 7 の pH に到達するためのより多くの中和バッファーを追加しています。
- ヒストンの存在を評価し、原油のヒストンのヒストン蛋白質抽出 (図 2) では次のようにします。
- (塩化物イオン) サンプル バッファー x 4 12.5 μ に 37.5 μ L のサンプルを追加し、99 ° c. で 10 分の変性
- SDS ページのゲルにサンプルをロードし、100 V で 1 時間のためのゲルを実行します。
- Coomassie ブリリアント ブルー R-250 染色液で一晩ゲルを染色し、3 連続洗浄 (1 h/ウォッシュ) 中 Coomassie ブリリアント ブルー R-250 脱染め色液をすすぐ。
注: 原油ヒストン (図 2) は、溶出、浄化されたヒストン (すなわち列の入力 [図 5 a]) と比較できます。
3. 精製コアヒストンの
-
回転カラムの平衡化
- 使用されている各スピン列に平衡バッファーの 500 μ L を追加します。列膜を触れないでください。
- 4 ° C で 800 x gで 3 分間遠心します。流れを破棄します。1 x を繰り返します。
-
ヒストン浄化
- 列にステップ 2.6 から目的の標本の 500 μ L を追加します。4 ° C で 800 x gで 3 分間遠心します。流れを収集します。
- 列にサンプル全体を読み込むに必要な回数だけこの手順を繰り返します。スピン列を入れすぎないではないです。
- 列バインディング効率 (図 3) を分析する各遠心分離のステップから流れを組み合わせ。
- 2.7 列の流れを分析するための手順に従ってください。
-
カラムの洗浄
- 洗浄バッファーの 500 μ L を各列に追加します。4 ° C で 800 x gで 3 分間遠心します。流水で洗い (#1) を収集します。
- 3.3.1 ステップ 3 洗浄の合計に対して繰り返します。#2、3 位の流水洗浄を収集します。連続列の流水洗浄をプールしません。
- さらに列のヒストン結合効率を評価、3 つのカラムの洗浄手順 2.7 (図 4) を分析します。
-
ヒストン溶出
- 新しいラベル 1.5 mL チューブに列を転送します。
- ヒストン溶出バッファーの 50 μ L を追加します。4 ° C で 800 x gで 3 分間遠心します。流れを含んでいるヒストン蛋白質を保存します。
- 追加の溶出の 3.4.2 のステップを繰り返します。ヒストン量と純度が異なります、最初と 2 番目の流れを通して波を結合しません。
4. コアヒストンの沈殿物
- 4% の最終濃度に精製されたヒストンに過塩素酸 (PCA) を追加 PCA (例えば70% の 3 μ L を追加手順 3.4.2 から精製したヒストンを 50 μ l 添加する PCA。
- 3 遠心分離機管の壁からすべての残留液体を収集する s。6 x 上下ピペッティングで混ぜます。
- ラックにチューブを置き、4 ° C で 24 時間インキュベート
- 次の日、prechill 4 ° C に遠心機と遠心分離機の 4 ° C で最大速度で 75 分のサンプル
- 遠心分離が完了すると、沈殿したヒストンを含む小さな白いペレットはチューブの下部に表示されます。ボルテックスにかけないでくださいサンプルです。
- 慎重に、上清を吸引し、ペレットを乱すことがなく追加冷えた 4% の 500 μ L のサンプルに PCA。
- 4 ° c の最高速度で 10 分間遠心します。慎重に上清を吸引します。
- 手順を繰り返します 2 4.7 x。
- ペレットを妨げないで、氷冷アセトン 500 μ L を追加します。4 ° c の最高速度で 10 分間遠心します。慎重に上清を吸引します。
- 手順を繰り返します 4.9 2 x。
- 慎重に、上清を吸引、脱帽、チューブのまま、すべての残留アセトンが蒸発した場合 30 分チェックのため氷の上乾燥するサンプルを許可します。
- 真空管は脱帽、室温 (RT) で乾燥するサンプルは、5 分を残す。
- 30 μ L の滅菌水にペレットを再懸濁します。ないピペットを上下に行います。指で軽くはじきます。
- すべてのチューブをキャップし、ペレットのサイズに応じて、30-50 分間氷の上を再構成するヒストンを許可します。ペレットは再停止されるかどうかチェックしてください。
- すべてのチューブをキャップし、さらに 5 分間室温で再懸濁しますにペレットを許可します。
注: このソリューション (ステップ 3.4.3 から最初と 2 番目の溶出) 精製、脱塩のヒストンを構成してさらに定量化とヒストンのアセチル化分析に使用可能性があります。
5. 溶出ヒストン蛋白質の定量
- 4.15 の手順で最終的な溶出後に得られた合計ヒストン蛋白質を定量化するのに製造元のプロトコルに従って分光光度計を使用します。230 で吸光度を測定 nm。A260/A280 比核酸のサンプルの汚染を示すものを記録します。
- ヒストンの濃度 (x) を計算する次の数式を使用します。
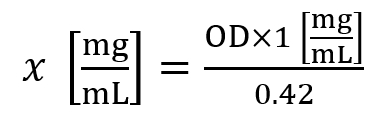
ここでは、OD は A230 nm で測定した光の密度です。 - ~1.5 mg/mL のヒストン濃度は ~5.0 mg/mL のヒストン濃度は組織の 30 ミリグラムの平均収量と見なされます細胞株の平均利回りを考慮されます。
6. 西部のしみの分析
- ヒストン蛋白質/サンプルのステップ 4.15 〜 10 μ g から精製され、溶出したヒストンを調整します。
- 読み込みのボリュームを調整する 4 x Laemmli サンプル バッファーや水の適切な量を追加します。
- 99 ° c. で 10 分のサンプルを変化させなさい。クール氷に。3 遠心分離機管の壁からすべての残留液と結露を収集する s。
- SDS ページのゲルにサンプルをロードし、100 V で 1 h のためのゲルを実行します。
- 合計ヒストン蛋白質を視覚化し、Coomassie ブリリアント ブルー R-250 染色液で一晩ゲルを染色中 3 回すすぐ連続洗浄 (1 h/ウォッシュ) Coomassie ブリリアント ブルー R-250 脱染め色液を。
注: 2 番目の溶出がヒストン (図 5 b) のないレベルに低含まれていますが、ヒストン蛋白質の最初の溶出に高品質ヒストン (図 5 a) が含まれます。 - ヒストン Ptm を定量化する転送システムを使用 (材料の表を参照) PVDF 膜に SDS ページのゲル (ステップ 6.4) からヒストン蛋白質を転送します。
- 転送サンドイッチを組み立て、転送システム カセットを開き、上向き膜をカセットの底に (下+ ラベル) PVDF 膜スタックを配置します。スタックの間から空気を削除するしみローラーで軽く膜と膜をロールバックします。
- 膜の上にゲルを置く、ロール膜の間の空気を抜くためのしみローラーで軽くゲル、ゲル、ゲル上のスタックに配置。もう一度挟みとカセット カバーをサンドイッチ上に置き、しっかりと押し下げ、ノブをロックを時計回りに回します。
- 転送システム スロットにカセットを挿入します。装置の画面では、ターボのプロトコルを選択します。単一ミニ ゲルまたは 2 つ以上のミニ ゲル 7 分プロトコル 3 分プロトコルを使用します。
- 5 分 Ponceau S 染色で膜を染色し、合計ヒストン蛋白質を可視化します。
- トリス緩衝生理食塩水 (TBS) 0.1% で × 1 で洗って 2 h およびブロック 1 h. 加温一次および二次抗体とのミルクの 5% のそれらのトゥイーン 20 (4 ° C または常温では、1 h でそれぞれ一晩) または前に最適化されたプロトコルに従って。
注: 現在のプロトコル、抗体アセチル化されたヒストン H4K12 (図 6および図 7) H3K27 で (図 8) 使用されました。
結果
ヒストンの浄化のプロトコルの進行と分析のすべての分数の組成を説明するために異なるヒストン BV2 人間ミクログリア細胞抽出物を評価されます。ヒストン H3、H4 Ptm (すなわち、アセチル化) の数量を示すためには、脳組織の溶解液を使用しました。
BV2 細胞 10 cm 培養処理料理の皿あたり 5 x 10 の6セルでメッキ, 48 h. の confluency に成長する細胞が収集し、そのヒストンは 0.4 M を含む抽出バッファー内培養によるクロマチンからリリースされた許可硫酸、1 mM KCl、1 mM MgCl2、50 ミリメートル トリス-HCl (pH 8.0)、プロテアーゼ阻害剤 × 1。抽出時間は、15 分と 24 h の間では、原油ヒストン エキス Coomassie ブリリアント ブルー (図 2) を染色によって決定される構図は影響しませんでした。次に、原油のヒストン釣合いヒストン列を通過していた、フローを通じて分析しました。高性能列バインディングは、フロースルー Coomassie ブリリアント ブルー染色により分析するときのヒストン蛋白質の不在によって決定されます。我々 は 100% 検出ヒストン蛋白質分析のフロースルー (図 3) の存在があったように列バインディング効率を決定しました。バインドされたヒストンとすべての膜は、シリカゲルにバインドされている唯一のヒストン蛋白質を残して、残りの不純物を削除するのに洗浄バッファーで 3 回を洗浄しました。我々 は、(すなわち、15 分 2 h、24 h) 回すべてのヒストン抽出の最初の膜洗浄は 2 番目と 3 番目の洗浄サンプル純度に影響しなかった間、列からヒストン汚染を削除する最も重要な決定。したがって、サンプルの種類によって最後の 2 つの洗浄を省略可能性があります。(1 mM の NaCl および EDTA を含む溶出バッファーを使用して)、列からヒストン蛋白質の最初の溶出、次ヒストンいた 4% 過塩素酸と一晩沈殿ペレット、洗浄し、精製されたヒストン H3 の濃縮を分析し、H4。抽出時間が増加し純化で H3 と H4 ヒストンの量に比べて 15 分して抽出時間が (図 5 a) の 2 h の 24 h を見ました。列から 2 番目の溶出では、高品質や高量のヒストン (図 5 b) されませんでした。
次に、ヒストン H3、H4 Ptm、すなわちアセチル化を定量化するのに脳組織乳剤を使用しました。野生型 (C57BL6/J) 男性マウス投与広く演技 HDAC 阻害剤 (トリブチリン) 3 d. 全体脳組織の経口 5 g/kg の用量で 4 日に採取し、原油のヒストンを説明プロトコルに従って抽出しました。対になっていないtを使用して-テスト、我々 はそのトリブチリン増加、粗野なエキスのヒストンのアセチル化決定 (t(6) = 6.184, P = 0.0004);ただし、抽出 (ヒストン バンドが明確に定義されていない) で不純物が検出されます。したがって、H4K12ac 抗体には高い特異性 (図 6) はありません。さらに小さいティッシュ セクションを提案するプロトコルの有効性を評価するためトリプル トランスジェニック アルツハイマー病から前頭前野を収集 (3 Tg AD x) マウス治療 10 mg/kg M344、クラスで毎日私と IIb HDAC 阻害剤、4 つのヶ月。ここに記述されたプロトコルに従ってヒストン浄化および沈殿物を行った。精製されたヒストン H3、H4 の割合を使用して、M344 2.4-fold H4K12 のアセチル化の増加ことを調べた (t(6) 13.03、 P = 0.0001 <)、H4K12ac 抗体 (図 7) の高い特異性を持つ。同様に、我々 は別 HDAC 阻害剤、すなわち選択 HDAC3 阻害剤の RGFP 966 BV2 細胞のヒストン H3 のアセチル化の増加を観察しました。RGFP 966 原因の 10 μ M、24 h 後治療のヒストン H3K27 でアセチル化の約二倍の増加。学生対になっていないt-テスト制御対扱われるセルを比較する使用されました。
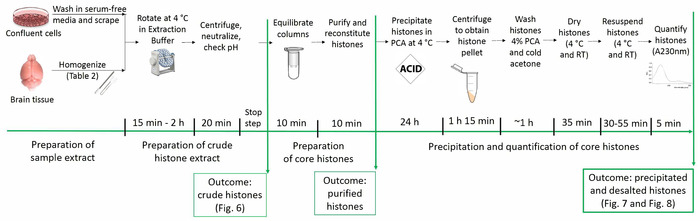
図 1: ヒストンの浄化のプロトコルのタイムライン。ヒストン解析のすべてのステップは、ステップごとに必要な推定時間と共に以下に示します。特定の手順の結果を描いた、原稿内に表示された数字は、括弧内に呼ばれます。この図の拡大版を表示するのにはここをクリックしてください。
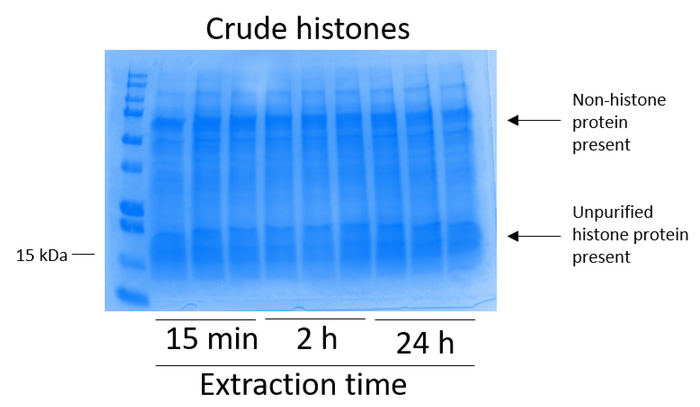
図 2: BV2 細胞から抽出した粗ヒストンを示す代表的な Coomassie ブリリアント ブルー染色ゲル。BV2 細胞ヒストンの抽出のプロトコルが始まる前に 48 時間培養。原油のヒストンを 3 つ複製し (これはまた図 3図 4、および図 5の場合である) 各時点で 15 分、2 h、24 h に抽出しました。ヒストンおよびヒストン蛋白質ヒストンの粗抽出物中に存在しています。この図の拡大版を表示するのにはここをクリックしてください。
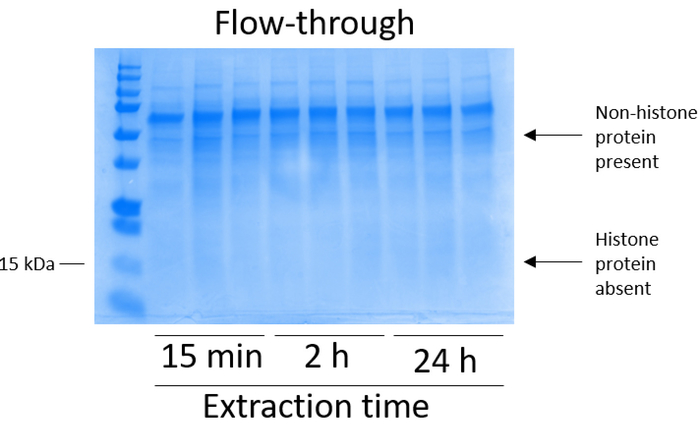
図 3: BV2 セルから次ヒストン浄化フローを介して列を示す代表的な Coomassie ブリリアント ブルー染色ゲルの手順です。原油ヒストン ヒストン結合列を通過、続いてヒストン蛋白質のみフローを通じて存在しています。ヒストン蛋白質が欠席しているこの画分に。この図の拡大版を表示するのにはここをクリックしてください。
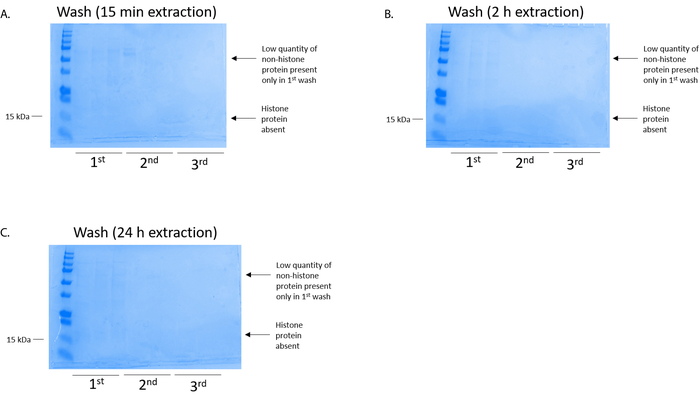
図 4: 代表 BV2 細胞からのヒストンの精製ステップを次の列の洗浄を示す Coomassie ブリリアント ブルー染色ゲル。ヒストン抽出時刻に関係なく (A) (B) 2 時間 15 分であった、または (C) 24 h、低量のヒストン蛋白質最初洗浄 histonebinding 列に存在していただけ。ヒストン蛋白質が欠席したすべての洗浄に。この図の拡大版を表示するのにはここをクリックしてください。
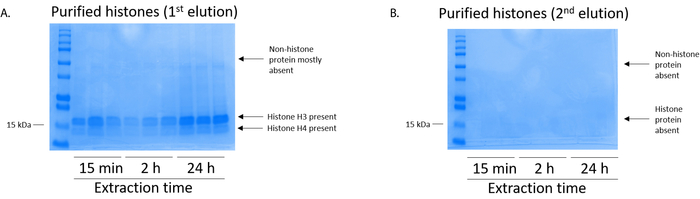
図 5: 有害 BV2 細胞からのヒストンの精製ステップを次の溶出を示す代表的な Coomassie ブリリアント ブルー染色ゲル。(A) 高品質精製、脱塩ヒストン H3、H4 ヒストン浄化列から最初の溶出後検出されました。(B) ヒストン精製溶出の 2 番目の列には、高品質やヒストン H3 や H4 の量はずはありません。この図の拡大版を表示するのにはここをクリックしてください。
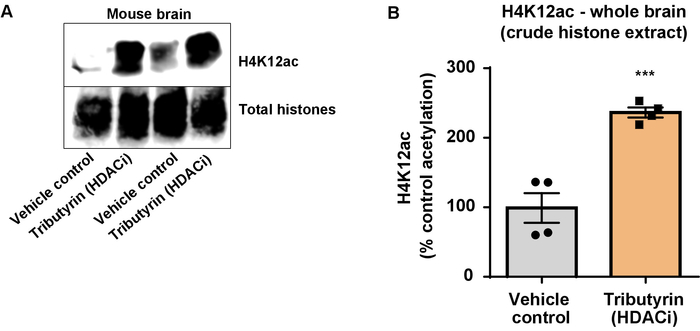
図 6: 広く演技 HDAC 阻害剤, トリブチリン、増加野生型マウスの脳全体で H4K12 のアセチル化します。(A) このパネルに表示されます代表西部広く機能 HDAC に対して野生型マウスの脳全体から収集したしみを描いた原油ヒストン H4K12 アセチル化の増加抽出阻害剤, トリブチリン。(B) このパネルは、H4K12 のアセチル化の生体内で増加の定量化を示しています。対になっていないt-テストがグループを比較に使用された (t(6) = 6.076、 P = 0.0005)。バーは、平均 ± (SEM) 平均値の標準誤差を表しています。N = 8。P 0.0001 <。この図の拡大版を表示するのにはここをクリックしてください。
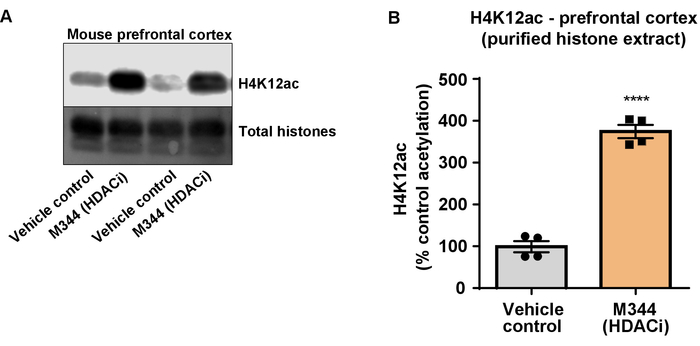
図 7: 私および IIb HDAC 阻害剤、M344 は、増加するトリプル トランスジェニック アルツハイマー病の前頭前野における H4K12 のアセチル化クラス (3 Tg AD x) マウスします。(A) このパネルを示し、代表西部しみ、精製 H4K12 アセチル化の増加を描いた M344 hdacs をした抑制への応答で Tg 広告マウス x 3 の前頭前野から脱塩ヒストン エキス集め。(B) このパネルは、M344 4 ヶ月間毎日 10 mg/kg の線量で管理に応えて H4K12 のアセチル化の増加の定量化を示しています。対になっていないt-テストがグループを比較に使用された (t(6) 13.30、 P = < 0.0001)。バーを表す平均 ± SEM. N = 8。P < 0.00001。この図の拡大版を表示するのにはここをクリックしてください。
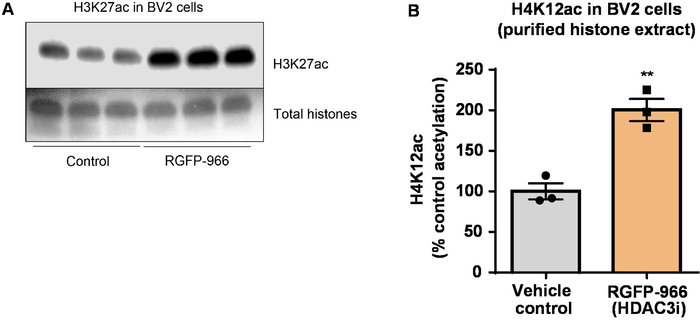
図 8: 選択的 HDAC3 阻害剤 RGFP-966 H3K27 アセチル化 BV2 ミクログリア細胞が増加します。RGFP 966 HDAC3 抑制 BV2 細胞から抽出精製、脱塩ヒストン H3K27 アセチル化の増加を描いた代表的な西部のしみ集め (A) このパネルを示しています。(B) RGFP-966 原因、アセチル化ヒストン H3 リジン (K) 27 24 h 後の治療での約二倍の増加。対になっていないt-テスト制御対扱われるセルを比較する使用された (t(4) = 5.981, P = 0.002)。バーを表す平均 ± SEM. N = 6。P < 0.01。この図の拡大版を表示するのにはここをクリックしてください。
| 代表的な組織 (1 つの半球) * | 平均組織重量 (mg) | 抽出バッファー (mL) | ストローク数 |
| マウス小脳 | 40 | 1 | 40 |
| マウス前頭皮質 | 30 | 0.3 | 20 |
| マウス海馬 | 27 | 0.3 | 18 |
| マウス嗅 | 19 | 0.3 | 17 |
| * 大人の雄マウスのすべての実験を行った。 | |||
| 平均年齢: 16 ヶ月。平均重量: 30 グラム。 | |||
表 1:、脳組織の均質化のための条件が最適化されています。
ディスカッション
現在の仕事では、コア ヒストン蛋白質を浄化し、ヒストン H3 と H4 Ptm (例えば、アセチル化) を数値化する最適化手法を示した。提案するプロトコルは、組み込まれた包括的なワークフロー最適化細胞脳組織準備、原油のヒストンの浄化、および詳細なヒストン沈殿物の溶出と、続いて定量化に関する手続きヒストン電気泳動および堅牢なヒストン PTM 定量化。ここで提供される詳細の大量ヒストン サンプルの長い操作の必要性があっても、高品質データのレプリケート可能な生成が可能です。
現在発行されている多くのプロトコル ヒストン H3、H419の純粋な分画を分離するための高速液体クロマトグラフィーの使用が必要です。高速液体クロマトグラフィーでは、強力な手法ですが、ほとんどの分子生物学者および頻繁な使用からうえの複雑さと低スループットが阻止します。確かに、HPLC は多くのラボには、楽器を操作する熟練労働者が必要があります。高速液体クロマトグラフィーは、しばしば時間のかかる、高価なと潜在的に危険。ここで紹介は高速液体クロマトグラフィーをバイパスと同様の品質の結果を達成するために安価な媒体スループット戦略です。報告された戦略もより実用的なほぼすべての実験室での使用に適して計器用特殊操作スキルを必要としない単純なスピン列アプローチを使用します。また、ヒストン H3 ・ H4 四量体は単一の純粋なと豊富な分数、各蛋白質の保存 Ptm の信頼性の定量化を可能に抽出されます。
Ptm は、酸化ストレスと pH20,21に変更に変更に非常に敏感。したがって、以前に公開された方法18と対照をなして、セルの最小の新陳代謝の妨害、ネイティブの Ptm の血清成分の干渉を避けるために血清自由な媒体のセルを洗浄の効率的な戦略を報告します。現在のプロトコルは、伝統的な核分離をバイパスするだけでなく、セル換散および原子力の集約を回避しながら核封筒の保全は、正確な組織の均質化手順の最適な時間をまた提供します。セル、セルの型、ポケットティッシュ サイズ等の数に基づいて抽出時間を操作することができますが、核 DNA リリースでは、サンプルを処理困難の換散に導くかもしれないよう拡張換散は望ましくありません。重要なは、成功したヒストン浄化 (例えば、手順 2.7 および 3.2.3) の検証プロトコル内で複数のチェックポイントが存在します。この戦略はまた、時間のかかるプロシージャ全体のトラブルシューティングを促進します。
提案するプロトコルの別の重要な機能は、欲深に下流の西部のしみの分析ツールとの完全な互換性。ヒストン蛋白質 〜 15 kDa13,22,23検出し、同様に他の小さな分子量の蛋白質に実証されている標準のイムノブロットによる検出に挑戦する.最適な解像度タンパク質ゲルとの組み合わせで高パフォーマンスと高スループット転送システムの使用により、タンパク質 (SDS の不在) のネイティブ確認と SDS と高い転送効率の不在での活動の維持のため低分子量ヒストン蛋白質の信頼性の高いヒストン PTM 数量を確保します。
開示事項
著者が明らかに何もありません。
謝辞
著者エド健康のフロリダ部とエセル ・ ムーア アルツハイマーの研究プログラム (助成金 6AZ08 と 7AZ26)、NIH NIAAA (グラント 5R01AA023781-03)、およびアメリカ心臓協会 (グラント 17PRE33660831) に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | ThermoFiser Scientific | 05-408-129 | or equivalent from other sources |
| Sterile water | Gibco | 15-230-204 | or equivalent from other sources |
| 70% perchloric acid | Sigma Aldrich | 311421 | or equivalent from other sources |
| 100% acetone | Sigma Aldrich | 270725 | or equivalent from other sources |
| pH-indicator strips, non-bleeding | Milliipore Sigma | 1095310001 | |
| 4x SDS sample buffer | BIO-RAD | 161-0747 | |
| Benchtop rotor | Cole-Parmer | UX-04397-34 | or equivalent from other sources |
| 1.5 mL tube rack | ThermoFiser Scientific | 05-541 | or equivalent from other sources |
| Histone purification mini kit | Active Motif | 40026 | spin columns included in the kit |
| Protease Inhibitor Cocktail | ThermoFiser Scientific | 78430 | or equivalent from other sources |
| Nanodrop instrument | ThermoFiser Scientific | ND-2000 | |
| Tissue culture dishes | VWR | 10062-880 | required for histone extraction from cultured cells |
| Tissue culute media | varies based on cell line used | varies based on cell line used | required for histone extraction from cultured cells |
| Low-serum media | ThermoFiser Scientific | 51985091 | required for histone extraction from cultured cells |
| Plastic cell scraper | Falcon | 353086 | required for histone extraction from cultured cells |
| SDS-PAGE gradient gel | BIO-RAD | 456-9035 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Staining Solution | BIO-RAD | 1610436 | required for histone extraction from cultured cells |
| Coomassie Brilliant Blue R-250 Destaining Solution | BIO-RAD | 1610438 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Mini PVDF Transfer Packs | BIO-RAD | 1704156 | required for histone extraction from cultured cells |
| Trans-Blot Turbo Transfer System | RIO-RAD | 1704150 | required for histone extraction from cultured cells |
| Ponceau S stain | CellSignalling | 59803S | required for histone extraction from cultured cells |
| Dounce homogenizer (size/cap sc 7mL) with a small size clearance | Kimble Chase | 885302-0007 | required for histone extraction from tissues |
| 100% bleach | Clorox | 68973 | required for histone extraction from tissues |
| H4K12ac antibody | Active Motif | 39166 | required for PTMs quantification via WB |
| H3K27ac antibody | Active Motif | 39134 | required for PTMs quantification via WB |
参考文献
- Holliday, R. Is there an Epigenetic Component in Long-term Memory? Journal of Theoretical Biology. 200, 339-341 (1999).
- DeWoskin, V. A., Million, R. P. The epigenetics pipeline. Nature Reviews Drug Discovery. 12, 661-662 (2013).
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO Reports. 3, 224-229 (2002).
- Grunstein, M. Histone acetylation in chromatin structure and transcription. Nature. 389, 349-352 (1997).
- Sartor, G. C., Powell, S. K., Brothers, S. P., Wahlestedt, C. Epigenetic Readers of Lysine Acetylation Regulate Cocaine-Induced Plasticity. The Journal of Neuroscience. 35, 15062-15072 (2015).
- Komatsu, N., et al. SAHA, a HDAC inhibitor, has profound anti-growth activity against non-small cell lung cancer cells. Oncology Reports. 15, 187-191 (2006).
- Bahari-Javan, S., Sananbenesi, F., Fischer, A. Histone-acetylation: a link between Alzheimer's disease and post-traumatic stress disorder. Frontiers in Neuroscience. 8, 160(2014).
- Roh, T. -Y., Cuddapah, S., Zhao, K. Active chromatin domains are defined by acetylation islands revealed by genome-wide mapping. Genes & Development. 19, 542-552 (2005).
- Mutskov, V., Felsenfeld, G. Silencing of transgene transcription precedes methylation of promoter DNA and histone H3 lysine 9. The EMBO Journal. 23, 138-149 (2004).
- Howe, L., Brown, C. E., Lechner, T., Workman, J. L. Histone acetyltransferase complexes and their link to transcription. Critical Reviews in Eukaryotic Gene Expression. 9, 231-243 (1999).
- Jenuwein, T., Allis, C. D. Translating the histone code. Science. 293, 1074-1080 (2001).
- Bowman, G. D., Poirier, M. G. Post-Translational Modifications of Histones That Influence Nucleosome Dynamics. Chemical Reviews. 115, 2274-2295 (2015).
- Volmar, C. -H., Wahlestedt, C. Histone deacetylases (HDACs) and brain function. Neuroepigenetics. 1, 20-27 (2015).
- Plagg, B., Ehrlich, D., Kniewallner, K. M., Marksteiner, J., Humpel, C. Increased Acetylation of Histone H4 at Lysine 12 (H4K12) in Monocytes of Transgenic Alzheimer's Mice and in Human Patients. Current Alzheimer Research. 12, 752-760 (2015).
- Bhaskara, S., et al. Hdac3 is essential for the maintenance of chromatin structure and genome stability. Cancer Cell. 18, 436-447 (2010).
- Mottamal, M., Zheng, S., Huang, T. L., Wang, G. Histone Deacetylase Inhibitors in Clinical Studies as Templates for New Anticancer Agents. Molecules. 20, 3898-3941 (2015).
- Ramakrishnan, S., et al. HDAC 1 and 6 modulate cell invasion and migration in clear cell renal cell carcinoma. BMC Cancer. 16, 617(2016).
- Wapenaar, H., Dekker, F. J. Histone acetyltransferases: challenges in targeting bi-substrate enzymes. Clinical Epigenetics. 8, 59(2016).
- Klinker, H., Haas, C., Harrer, N., Becker, P. B., Mueller-Planitz, F. Rapid Purification of Recombinant Histones. PLoS ONE. 9, e104029(2014).
- Chen, K., et al. Neurodegenerative Disease Proteinopathies Are Connected to Distinct Histone Post-translational Modification Landscapes. ACS Chemical Neuroscience. 9, 838-848 (2018).
- Simithy, J., Sidoli, S., Garcia, B. A. Integrating Proteomics and Targeted Metabolomics to Understand Global Changes in Histone Modifications. Proteomics. , e1700309 (2018).
- Volmar, C. -H., et al. An Epigenetic Approach for the Modulation of Amyloid Precursor Protein (APP) Processing and Improvement of Memory in Alzheimer's Disease. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. 40, S470(2015).
- Volmar, C. -H., et al. M344 promotes nonamyloidogenic amyloid precursor protein processing while normalizing Alzheimer’s disease genes and improving memory. Proceedings of the National Academy of Sciences. 114 (43), E9135-E9144 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved