Method Article
蛍光プロテアーゼ アッセイプラット フォームとそのゲルの下で遺伝子組換えの融合蛋白質の使用
要約
ここでは、N 末端 hexahistidine/マルトース結合蛋白質とニッケル ニトリロ三の表面に付着した蛍光タンパク質融合組換え基板を利用した最近開発されたプロテアーゼ アッセイプラット フォームの詳細な手順を提案します。酸の磁気アガロース ビーズ。ナトリウム dodecyl 硫酸塩ポリアクリルアミド ゲル電気泳動で区切られた検体の後のゲルの分析について述べる。
要約
プロテアーゼは生きている有機体のいくつかの生物学的経路と病態の本質的な役割により集中的に調査の酵素したがって、彼らは重要な創薬ターゲットであります。組換えの融合蛋白質の基質の使用に基づいているプロテアーゼ活性の調査のための磁気アガロース ビーズ-ベースのアッセイ プラットフォームを開発しました。このアッセイ システムの使用を示すために、プロトコルでは、1 (hiv-1) プロテアーゼをひと免疫不全ウイルスの種類の例に提示されます。プロテアーゼ、変異、キネティック、阻害、または特異性の研究、酵素活性測定などの生化学的解析の導入アッセイプラット フォームを効率的に利用できる、高スループットに適してことがあります。基板スクリーニングまたは他のタンパク質分解酵素に適応することがあります。
このアッセイ システムで応用基板は N 末端 hexahistidine (彼の6) マルトース結合タンパク質 (MBP) タグが含まれている、タバコの胸の谷間サイト エッチ (TEV) ウイルスおよび HIV 1 プロテアーゼと C 末端蛍光タンパク質。基板は、大腸菌細胞に効率的に生産できるし、ニッケル (Ni) - キレート - コーティングを施したビーズを使用して簡単に浄化します。アッセイ中ビーズ付属基板の蛋白質分解開裂は二測定できる蛍光胸の谷間フラグメントのリリースに します。さらに、胸の谷間の反応はナトリウム dodecyl 硫酸塩-ポリアクリルアミドゲル電気泳動 (SDS-PAGE) によって分析できます。蛍光タンパク質の部分画により分子量と蛍光の検出も、分析コンポーネントのゲルの下のプロトコルは記述されています。
概要
蛋白分解酵素は、代謝経路と同様、産業用アプリケーションの重要性のため最も集中的に調査した酵素グループに属する。ウイルス性疾患で重要な役割、血液凝固、がんの規制と心血管および神経変性疾患の創薬の分野で著名なターゲット プロテアーゼになります。したがって、基質特異性の解析と興味のプロテアーゼ (PR) の阻害剤のプロファイリングは極めて重要です、迅速でコスト効率の高い、かつ堅牢な生化学的アッセイ1,2、実行できれば 3。
今日では、化合物プロファイリングの創薬の分野でも適用体外プロテアーゼの試金の大半が同質で、蛍光ペプチド ベースと高スループット スクリーニング (HTS)-互換性のあるプラットフォーム4。また、標識ペプチドのみライブラリ スクリーニングに適したが彼らはまた選択した基板上への速度論的パラメーターの酵素の定量のための素晴らしいツールを提供します。基板のラベリングが可能な他のケースで分離に基づく試金蛋白質分解反応3の動力学的特性を評価するために可能な解決策があります。
一般的には、in vitro におけるプロテアーゼの試金は基板の 2 つのタイプの使用に基づいています: 短いペプチドまたは蛋白質の全体。次の標準的な方法で短いペプチッド シーケンスの胸の谷間は十分に胸の谷間プロパティを反映、これらのケースで当てはまる: (i) 標準タンパク質基質酸化インスリン B 鎖、(ii) などテストを調べる市販の基板他のプロテアーゼ、(iii) のコンビナトリアル ・ ケミストリー、または (iv) によって作成された合成と蛍光標識ペプチド ライブラリーをスクリーニング遺伝的メソッドを使用して、例えば、生物学的表示技術5、 6。従来の分類のほかその他新規プラットフォームは、また基板生成のため (例えばの形成プロテオーム由来ペプチド ライブラリ7または遺伝的組換えの融合のような特別なサブタイプタンパク質ベース基板8,9,10、11,12)。
すべての上記基板タイプとの試金がある独自の利点と制限、およびアッセイ フォーマットを組み合わせることおよび/または知られているプラットフォームの利点の改善の開発はまだ需要。ここで、遺伝子組換えの基板を利用して分離に基づく蛍光プロテアーゼの試金のためのプロトコルについて述べる.これらの融合蛋白質は、彼の6と C 末端蛍光タンパク質 (FP) (図 1 a) に直接接続されている興味の基板シーケンスが続いている TEV PR のコントロール胸の谷間サイトへ融合 MBP タグで構成されます。クローン カセットに興味のある胸の谷間サイトのコーディング dna のクローニングは、制限酵素による切断以前線形補間されている発現プラスミドに単一の ligation の反作用によって実行できます。
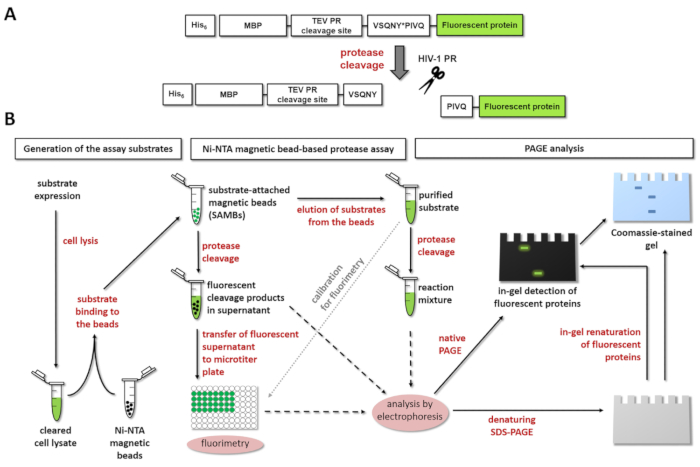
図 1:蛍光プロテアーゼ アッセイの原理。(A) 蛍光基板とそのひと免疫不全ウイルス 1 型による胸の谷間の略図 (HIV-1) プロテアーゼが表示されます。矢印は、hiv-1 プロテアーゼのマトリックス/キャプシド胸の谷間サイト シーケンス内で胸の谷間の位置を示します (VSQNY * PIVQ)。(B) 蛍光基板同様、ワークフロー ダイアグラムで示すように、Ni NTA 磁気ビーズによるアッセイし、ポリアクリルアミドゲル電気泳動による酵素反応を分析する使用できます。この図の拡大版を表示するのにはここをクリックしてください。
基板を含む関係タグ、蛋白質分解開裂サイト、および蛍光タンパク質-持っている既に同様の組換えタンパク質を用いたタンパク質アッセイされて説明が8,9,10, システム提示ここで統合し、これらの方法の利点を改善しようとします。重要な違いは、このアッセイのプラットフォームに融合蛋白基質がタンパク質溶解度13を強化し、TEV PRs の胸の谷間にある、コントロールのサイトを含む MBP 備わっているです。さらに、基板には、基板の凝集を予防する単量体のフォームを持っている、非常に安定した新世代蛍光タンパク質が含まれています。MTurquoise2 とマップル融合フォーム14の以前に発行されたアプリケーション、ほかも紹介、単量体を含む組換え基板の使用により得られる強化黄色蛍光タンパク質 (mEYFP) 蛍光タグ。ここ我々 は他の蛍光タンパク質を用いたシステムの互換性を示す、プロテアーゼ法によって得ることができる結果のいくつかの一般的な種類を表します。
組換えの融合蛋白質エシェリヒア属大腸菌BL21(DE3) セルで表されます、ニッケル ニトリロ三酢酸 (Ni 国税庁) の試金のため基板として使用されます-磁気-アガロース-ビーズ-添付フォームをコーティングします。C ターミナル開裂製品は、関心のプロテアーゼによる培養上清を胸の谷間にビード表面から解放され。磁気ビーズから上清 (酵素と開裂製品含む) の分離、酵素の胸の谷間のプロパティを決定する蛍光を測定できます。上記の方法とは対照的、ここで提示システム基板と C 末端開裂製品の量が一意に定量化詳細基板の校正手順に基づきます。検体; の SDS-PAGE 解析によるアッセイ システムをサポートできます。電気泳動後すぐにまたはそれぞれ14nondenatured と変性蛍光成分のゲルの下後その後蛍光ゲルの可視化を適用できます。
柔軟性とクローニング カセットの構造時間とコスト効率の高いさまざまなシーケンスを構造体に挿入を許可して、したがって、基板ライブラリの生成を促進します。以来、すべての試金のステップがオートメーションと互換高温超伝導、システムすることができます、特に魅力的な例えば、プロテアーゼ特異性測定や突然変異誘発の研究が効果的に活用も産業プロテアーゼ阻害剤スクリーニングや、抗ウイルス薬の開発。
開発の分離に基づくアッセイ; によって酵素の速度論的パラメーター (k猫、 Km) が指定します。したがって、それは時間コース ・基質依存的阻害研究などの各酵素キネティック測定を実行するが適さない場合があります。これは組換えの融合蛋白基質頻繁利用合成ペプチド基質の良い選択肢を提供するポリタンパク質基材への高い類似性による自然発生を表すを証明します。酵素-基質相互作用より正確に。
プロトコル
1. 基板コーディング発現プラスミドの世代
- パーチと NheI の制限酵素によって pDest 彼6- MBP FP 発現プラスミドをリニア化します。PDest 彼6- MBP FP の世代、Bozóki ら14を参照してください。
- PDest 彼6- MBP FP 発現プラスミドの 1,500-2,000 μ g、パーチの 2 μ を追加し、NheI 制限エンドヌクレアーゼ、10 μ L の 10 x バッファー (材料の表を参照)、ヌクレアーゼ フリー水 (NFW) 微量遠心チューブに 100 μ L を。
- 1 h の 37 ° C で反応混合物を孵化させなさい。
- 反応混合物にローディングの染料 DNA パープル x 6 の 20 μ L を追加、1% のアガロースゲルを用いる電気泳動で開裂製品を区切ります。1 kB の DNA ラダーを標準として適用します。
- 15 分のためのゲルを TAE バッファー (40 mM トリス、20 mM 酢酸、1 ミリメートルの EDTA、pH 8.5) 含む 20 μ l SYBR グリーン溶液 20 mL でリンスし、シャープなツールを使用して agarose のゲルから線形プラスミッドのバンドをします。
注: 暗い読書ブルー transilluminator (DRBT) によるゲルを照明しながら線形 pDest 彼6- MBP FP プラスミドは 7-8 kB のまわりで離散、明るいバンドとして表示されます。 - 製造元の指示に従ってゲル抽出キットを使用してゲルのスライスから一直線に並べられた発現プラスミドを浄化します。
- 線形 pDest 彼6- MBP FP 発現プラスミドに基板のシーケンスを挿入します。
- フォワード (FWD) と興味の基板シーケンスを符号化逆 (REV)エシェリヒア属大腸菌コドン最適化のオリゴヌクレオチドのプライマーをアニールします。
注: アニールされたプライマーは、パーチと NheI の制限の endonuclease 胸の谷間部位 (図 2) に対応する粘着性がある端に補強されます。- 200 で一直線に並べられた発現プラスミドのミックス 150 ng の FWD と 200 ng REV オリゴヌクレオチドのプライマー 0.2 mL ポリメラーゼの連鎖反応 (PCR) のチューブし、地上デジタルを追加することにより 17 μ L にボリュームを調整の ng。
- 混合物は 2 分の 65 ° c とし、少なくとも 2 分のための 4 ° C で孵化させなさい。
- 結紮アニールされたプライマーの線形プラスミッドへの挿入を実行します。
- T4 リガーゼ バッファー (10 倍) の 2 μ L と T4 リガーゼの 1 μ L を線形プラスミッドおよびアニールされたプライマーを含んでいる混合物に追加します。
- 16 h 16 ° C で結紮混合物を孵化させなさい。
- フォワード (FWD) と興味の基板シーケンスを符号化逆 (REV)エシェリヒア属大腸菌コドン最適化のオリゴヌクレオチドのプライマーをアニールします。

図 2: 蛋白質分解開裂のためのコーディングのオリゴヌクレオチドのプライマー サイト シーケンス。前方および逆プライマーをエンコード、VSQNY * HIV 1 PR の PIVQ 胸の谷間サイト シーケンス相補的なオリゴヌクレオチドのプライマーをアニール後短い二本鎖 DNA はパーチと NheI の制限酵素のそれに対応する粘着末端を含まれています。この図の拡大版を表示するのにはここをクリックしてください。
- 結紮の混合物を 5 μ l 添加による BL21(DE3) の有能なセルの 100 μ L を変換し、アンピシリンを含むホストゲノム スープ (LB) 寒天培地プレート上のセルを広めます。
注: 蛍光タンパク質の N 末端融合タグと、同じ開いたリーディング ・ フレームに、結紮後のみとなります。変換した後、数日 (関心のある挿入された胸の谷間サイトのコーディング発現プラスミドを含む) 植民地が可視蛍光または、DRBT を使用しなくても表示されます。 - 描かれた植民地からのグリセロール ストックを準備します。
- (最終濃度 100 μ G/ml) にアンピシリンを含む LB 培地の 5 μ L を含む 50 mL の遠心管に離散コロニーを洗います。
- 継続的に 220 rpm で揺れながら 37 ° C 8 時間インキュベートします。その後、室温で 5 分間 1,000 × gで遠心分離によってセルを収穫します。
- 優しく (蒸留水で希釈) 80% グリセロールの解決の 1 mL の細胞を中断し、懸濁液 500 μ L の 10 mM MgCl2ソリューションを追加します。
- 凍結管に懸濁液を移し、-70 ° C で在庫を保管
- DNA シーケンスによって生成されたプラスミドのシーケンスを確認します。
- 50 mL の遠心管中 100 μ g/mL アンピシリンを含む LB 培地 5 ml (1.7 の手順で準備) グリセロール ストックの 10 μ L を追加します。
- 継続的に 220 rpm で揺れながら 16 h の 37 ° C の懸濁液を孵化させなさいその後、4 ° C で 10 分間 2,000 × gで遠心分離によって細胞を収穫します。
- 分離発現プラスミド プラスミド miniprep によって細胞ペレットからキット (材料の表を参照してください) 製造元の指示によると、DNA シークエンシングのため精製プラスミドを使用します。
注: のシーケンス、5'-GATGAAGCCCTGAAAGACGCGCAG-3' (フォワード) と 5'-GCAAGGCGATTAAGTTGGGTAACGC-3' (逆方向) のオリゴヌクレオチドのプライマーを使用することがあります。
2. 蛍光基質の発現
- スターターを準備します。
- 50 mL の遠心管中 100 μ g/mL アンピシリンを含む LB 培地 5 ml (1.7 の手順で準備) グリセロール ストックの 10 μ L を追加します。
- 継続的に 220 rpm で振りながら 15 h の 37 ° C の懸濁液を孵化させなさい。
- 細菌培養 (5 mL) を 500 mL 滅菌三角フラスコ中 100 μ g/mL アンピシリンを含む新鮮な LB 培地 50 mL に転送します。
- 37 ° C で細胞を継続的に 220 rpm で揺れながら 0.6 から 0.8 600 nm の波長での吸光度に成長します。
注: テトラサイクリン治療ステップ 2.5 で適用する場合は、勧めできません 600 0.6 以上の吸光度に細胞を成長する nm。 - タンパク質の発現を誘導する 1 mM の最終濃度にイソプロピル β-D-1-thiogalactopyranoside (IPTG) を追加します。
- テトラサイクリン治療は適用されません 220 rpm で継続的に揺れながら 37 ° C で 3 h の文化をインキュベートして 2.6 の手順とプロトコルを続行します。テトラサイクリン治療が適用される場合は、手順 2.5.1-2.5.3 でプロトコルを続行します。
メモ:エシェリヒア属大腸菌の細胞によって生成されるいくつかの FPs が付いて長い成熟時間 (前作参照)16,17;これらの場合、タンパク質翻訳は必要に応じて基板の解決の蛍光の収率を高めるためにテトラサイクリン治療によって逮捕することができますされます。- 継続的に 220 rpm で揺れながら 37 ° C で 2 h の細胞懸濁液を孵化させなさい(最終濃度 200 μ G/ml) にテトラサイクリン ソリューションを追加します。
- 220 回転で継続的に揺れながら 37 ° C で好みの蛍光タンパク質の成熟の時間に従って細胞培養を孵化させなさい。
- 50 mL 遠沈管をきれいにし、4 ° C で 15 分間 4,000 x gで遠心分離によって細胞を収穫する文化の 2 x 25 mL を転送します。
- 上澄みを廃棄し、-70 ° c 少なくとも 1 h で細菌の細胞ペレットを格納します。
注: セル表現蛍光基板表示可視蛍光または、DRBT を使用しなくても。
3. セル中断
- 氷の上凍結細胞ペレットを置き、15 分のために解凍しましょう。
- ペレットに 2 mL の溶解バッファー (50 mM NaH2PO4, 300 mM の NaCl、10 mM のイミダゾール、0.05% Tween 20、pH 8) を追加し、セルを中断します。
- 懸濁液に作りたて phenylmethanesulfonyl-フッ化物 (PMSF) プロテアーゼ阻害剤溶液 (8.7 mg/mL、エタノールに溶解) の 10 μ L を追加します。
- 懸濁液にリゾチーム 2 mg と DNase の 20 単位を追加し、それを中断します。
- 15 分と渦の氷の懸濁液を孵化させなさいそれは時折。
- 1.5 mL 遠心チューブに懸濁液の 2 x 1 mL を転送し、10 回のラウンドで、3 分間懸濁液を超音波超音波処理と 5 s の s。
- 部屋の温度で 20 分間 10,000 x gでチューブを遠心分離します。各チューブから慎重に蛍光清 (クリア細菌細胞ライセート) を削除し、新しいマイクロ遠心チューブ用にそれを転送します。
注: 蛍光性基質の溶解液をクリアまたは、DRBT を使用しなくても目に見える蛍光を示し 4 ° C で 2 週間まで保存できます。凍結しないでください。クリア lysates はプロテアーゼの試金 (セクション 4.1 参照) のサンプル準備のために直接利用できるまたはまた基板の浄化のために使用できます (手順 4.5.1 参照)。
4. Ni NTA 磁気ビーズによるプロテアーゼの試金
注: 分析プラットフォームの柔軟性のためそれを最適化できます研究の多くの異なる種類に。この理由と好みの酵素の活動率の違いにより、(どこにそれが表されます) アッセイ パラメーターの一部明示的に記述することはできませんが、個々 の目的と実験的なデザインを最適化する必要があります。ガイダンス、として研究のいくつかの型のパラメーターは特定のステップで示されます。
- サンプル準備
- 磁気ビーズの基板接続の生成
- 閉じた 2 mL 低タンパク結合 (材料の表を参照) 微量遠心チューブまたは新しいを含む磁気コンセントレーター (MPC) で (4.7 節を参照) Ni NTA 磁気アガロース ビーズをリサイクルを配置します。
注: 応用ビーズ懸濁液の量は実験的なデザインに基づいて設定します。各実験で 5% (v/v) 磁気ビーズ溶液 1 mL を使いました。 - 遠心管のふたおよび/または壁にビーズが付いていますしたがって、裏返して MPC ビーズのすべてを収集できるかどうかを確認するすべての方向で。
- 上澄みを除去し、それを破棄します。
- 換散バッファーによってビーズを洗浄します。
- ビーズに 1.8 mL の溶解バッファーを追加し、MPC から閉じた管を削除します。
- 管の振動および/またはサンプルが完全に均一になるまでチューブを逆さま回すビーズを中断します。
- MPC に戻しチューブ、ビーズを収集するために逆さまにそれを回します。
- 管を開き、上澄みを廃棄します。
- ビーズに (3.7 の手順で準備) ライセートのクリアの 1.0 1.8 mL を追加、MPC からチューブを取り外します。
- 裏返して閉じたチューブ ビーズは完全に同質なゆっくりと 30 分間室温で回転子によってチューブを回転させてまで。
- MPC に入れます、ビーズと蓋からクリア細胞ライセートを削除します。
注: オフになって細胞ライセートが破棄されるかそれ以上の使用のために保存 (3.7 の手順の後のメモを参照)。 - 1% 追加基板に接続された磁気ビーズ (SAMBs) にトゥイーン 20 (pH 7)。
注: SAMBs はまたは、DRBT を使用しなくても目に見える蛍光を表示します。
- 閉じた 2 mL 低タンパク結合 (材料の表を参照) 微量遠心チューブまたは新しいを含む磁気コンセントレーター (MPC) で (4.7 節を参照) Ni NTA 磁気アガロース ビーズをリサイクルを配置します。
- SAMBs の洗浄
- MPC に SAMB 懸濁液管を置き、上澄みを廃棄します。
- SAMBs 3 を洗って各バッファーに x: i) 1.8 mL の 1% Tween 20 (pH 7);ii) 1.8 mL の洗浄バッファー (50 mM NaH2PO4、300 mM の NaCl、5 mM のイミダゾール、0.05% Tween 20、pH 7);iii) 1.8 mL の胸の谷間バッファー (50 mM NaH2PO4, 300 mM の NaCl、0.05% Tween 20、pH 7)。
注: 洗濯の手順ステップ 4.1.1.4 を参照してください。実験ニーズに合わせて胸の谷間バッファーを変更可能性がありますが、互換性を判断する Ni NTA 磁気ビーズのマニュアルをチェックをお勧めします。
- SAMB ストック溶液の調製
- 胸の谷間のバッファーを洗浄 SAMBs SAMB 在庫ソリューションを作成するに追加します。
注: バッファーの添加後、振るかチューブを裏返ししないします。胸の谷間バッファーのボリュームは、個々 の実験的デザインによって左右 4.1.4.2 の手順で使用するボリュームに (手順 4.1.1.1 参照) 磁気ビーズの数に基づいて計算する必要があります。2 mL 管応用のボリュームは最大 1,900 μ L (表 1参照)。SAMB 原液の推奨される磁性体粒子密度は 2%-10% (v/v) です。研究の種類 胸の谷間のバッファー (μ L) のボリューム S 依存測定 (図 4) 1600 経時的測定 (図 5 a) 1600 阻害試験 (図 5 b) 1900 pH 依存性の解明 (図 6) 1400
表 1: 量の測定の種類に SAMB ストック溶液を調製するために使用胸の谷間バッファー。 - MPC から閉じた管を削除します。すぐに SAMB 原液を使用または 24 h まで 4 ° C で保存します。
- 胸の谷間のバッファーを洗浄 SAMBs SAMB 在庫ソリューションを作成するに追加します。
- SAMB 原液を使用して検体の世代
注: 試金のこの部分の詳細は、個々 の実験計画 (サンプルの種類は、表 2に示す) に強く依存します。サンプルの種類 ノート 反作用のサンプル (R) -胸の谷間プロパティを評価するために使用
-胸の谷間バッファーの基質と酵素が含まれています基板ブランク サンプル (B) -自発的な基板解離を評価するために使用 (手順 4.6.2 参照)
-胸の谷間バッファー基板のみが含まれています基板のコントロールのサンプル (C) -組織基質濃度の (手順 4.6.3 参照)
-溶出バッファー基板のみが含まれています
表 2: サンプル タイプの Ni NTA 磁気ビーズによるプロテアーゼの試金。- 試験サンプルの低タンパク結合マイクロ遠心チューブ用の 2 mL を準備します。
注: 他の低蛋白プラスチックの構造を結合を使用もことがあります。SAMBs の自由な移動を確保するためには、ラウンドまたはフラット底チューブを使用します。テーブル 3の中の管の推奨数を参照してください。研究の種類 R B C S 依存測定 (図 4) 5 5 2 経時的測定 (図 5 a) 6 6 2 阻害試験 (図 5 b) 7 7 1 pH 依存性の解明 (図 6) 5 5 1
表 3: 実証研究のサンプルの種類ごとの必要な 2 mL マイクロ遠心チューブ用の数です。 - 均質性まで SAMB 原液を中断し、サンプル瓶にすぐに反応で分析する基板の量を転送します。推奨されるボリュームは 25 300 μ L、だ、個々 の実験計画 (表 4) によると設定します。
注: は、すべて SAMBs をチューブの底に測定されているかどうかを確認します。SAMBs が分析結果を歪めることができる管の壁に固執します。別のボリュームを連続的に測定する場合は、早かったから始まる最高のボリューム、ピペット、ピペット チップの変更を最小限にしようとします。研究の種類 R B C S 依存測定 (図 4) 25-50-100-150-250 25-50-100-150-250 25 経時的測定 (図 5 a) 25 25 25 阻害試験 (図 5 b) 120 120 120 pH 依存性の解明 (図 6) 100 100 100
表 4: SAMB 溶液の量は、実証研究のサンプルの種類ごとのサンプル瓶で測定されます。 - MPC に検体 SAMB 懸濁液を含むサンプル チューブを置き、少し MPC を前後移動します。
- 慎重に、SAMBs から上澄みを除去し、それを破棄します。
- MPC からチューブを削除し、SAMBs に慎重に計算量の反応バッファー (胸の谷間や溶出バッファー [100 mM EDTA、0.05% Tween 20、pH 7]) を追加します。
注: は、個々 の実験計画 (表 5) によるとバッファー量を計算します。2 mL 管反応混合物 (この手順で追加する反作用バッファーのボリューム + 4.2.3 の手順で追加する溶液の量) の推奨最終巻は 50-150 μ L.、SAMBs のすべてが追加されたバッファーで洗浄を確認してください。溶出バッファーは、基板制御 (C) 試料の場合胸の谷間バッファーの代わりに使用されます。抑制の研究では、このステップで追加する選択の阻害剤を使用することをお勧めします。研究の種類 量の反応バッファー (μ L) S 依存測定 (図 4) 68 μ L 胸の谷間バッファー 経時的測定 (図 5 a) 68 μ L 胸の谷間バッファー 阻害試験 (図 5 b) 67.3 μ L 胸の谷間バッファー + 0.7 μ L 阻害剤在庫ソリューション * pH 依存性の解明 (図 6) 69.5 μ L 胸の谷間バッファー * *
表 5: 実証研究の反応バッファーのボリューム。* アンプレナビル ジメチルスルホキシド; で解けたアンプレナビル原液 (1 から 1 μ M の濃度に nM) 抑制実験に適用された (図 5 b参照)。* * PH 6.0 8.5 から応用胸の谷間バッファーの pH。 - チューブの蓋を閉じる。今サンプルは、アッセイのため準備ができています。
注: サンプルは 24 h まで 4 ° C で保存できますが、ストレージ、SAMB 原液は調製後直ちに使用された場合のみ (4.1.3.2 の手順を参照してください)。
- 試験サンプルの低タンパク結合マイクロ遠心チューブ用の 2 mL を準備します。
- 磁気ビーズの基板接続の生成
- タンパク質分解反応の開始
- 実験のニーズによると蛋白分解酵素液を準備します。
注: 溶解および/または酵素を希釈する胸の谷間のバッファーを使用することをお勧めします。HIV 114 TEV PRs18の浄化のためのプロトコルは、以前公開されています。 - Thermoshaker の攪拌速度 (600 rpm) および培養温度 (表 6) を設定します。
研究の種類 孵化の温度 (° C) S 依存測定 (図 4) 37 経時的測定 (図 5 a) 37 阻害試験 (図 5 b) 37 pH 依存性の解明 (図 6) 30
表 6: 培養温度別の研究の種類に適用されます。TEV 広報のため 30 ° C を推奨しながら HIV 1 PR のため 37 ° C が推奨です。 - 反作用のサンプル蛋白質分解反応を初期化するために酵素液を追加します。
注: 基板空白 (B) と C サンプルの場合胸の谷間 (酵素バッファー) と溶出バッファー、それぞれ追加します。ボリュームは、個々 の実験的ニーズ (表 7) に従って計算することです。反応混合物 (4.1.4.5 の手順で追加反応バッファーのボリューム + この手順で追加する溶液の量) の推奨最終巻は、2 mL チューブ、50-150 μ L です。研究の種類 酵素ソリューション/酵素バッファー/溶出バッファー (μ L) のボリューム S 依存測定 (図 4) 2 経時的測定 (図 5 a) 2 阻害試験 (図 5 b) 2 pH 依存性の解明 (図 6) 0.5
表 7: 実証研究の場合検体の初期化中に追加酵素ソリューション/酵素バッファー/溶出バッファーのボリューム。 - 軽くチューブを移動することによって慎重にビーズをかき立てるし、既に振動の thermoshaker にすぐにチューブを配置します。
注: マニュアル サンプル終了開始で少し時間がかかります (セクション 4.3 を参照)したがって、反応のイニシエーションの間は、少なくとも 2 分の登録の遅延の使用をお勧めします。 - 実験的なデザイン (表 8) に従ってサンプルをインキュベートします。
研究の種類 潜伏時間 (分) S 依存測定 (図 4 a) 7 S 依存測定 (図 4 b) 120 経時的測定 (図 5 a) 0-2.5-5-10-15-20 阻害試験 (図 5 b) 10 pH 依存性の解明 (図 6) 60
表 8: インキュベーション時間が異なる測定検体に適用されます。
- 実験のニーズによると蛋白分解酵素液を準備します。
- タンパク質分解反応のTermin情報
- シェーカー、インキュベーション、末 30 秒前からサンプルを取るし、速やかにそれを回します。
- MPC にチューブを置き、放置 15 s、少し MPC を前後移動と。
- 蓋を開き、プレートまたは新しいチューブに上清を慎重に転送します。
注: は、ピペットの先端を集中してビーズを触れないでください。C と胸の谷間の高度で R サンプルが収集された清は、可視蛍光の有無も、DRBT を使用してを表示ことがあります。
- 蛍光検出
- 黒半部のマイクロ プレートに分割サンプル上清の 2 x 30 μ L を転送します。
- 適切な刺激および放出フィルターを使用して蛍光を測定します。
注: は、胸の谷間のバッファーおよび溶出バッファーの基本的な蛍光を測定します。フィルターの組み合わせを選択する必要は、測定された蛍光タンパク質 (表 9) に基づいています。蛍光タンパク質 励起フィルター (nm) 排ガス浄化装置 (nm) mTurqiouse2 355/40 460/25 mEYFP 544/15 590/10 マップル 544/15 590/10
表 9: 刺激および放出フィルター異なった蛍光蛋白質を検出するために使用します。
- 校正
注: 4.6.1、蛍光強度値の胸の谷間- や溶出-バッファー-解決の手順で較正曲線を生成するには、異なる濃度で精製された基板の測定する必要があります。- 蛍光基質を浄化します。
注: 浄化、プロテアーゼ アッセイを収集ことがあります後、基板・空白 (B) サンプルの SAMBs または新しい SAMB の懸濁液も用意できます (を参照してくださいセクション 4.1.1 と 4.1.2)。- SAMBs 胸の谷間バッファー (2%-10%; v/v) MPC の 1 mL 中に浮遊とチューブを置き、MPC をあらゆる方向に逆さまに回して磁気ビーズを収集します。
- 管を開き、胸の谷間のバッファー、チューブと蓋の両方を削除します。
- MPC からチューブを削除し、SAMBs に 400-600 μ L の溶出バッファーを追加します。
- ゆっくり 5 分間室温で回転子を閉じた管を回転させます。
- MPC にチューブを置き、MPC を逆さま回すことによってビーズを収集します。
- 精製されたそのままの蛍光性基質 (溶出) を含む上清を除去し、新しい低タンパク結合遠心チューブに転送。
注: 溶出液または、DRBT を使用しなくてもはっきり見える蛍光を示しています。
- 2 つの 0.5 mL 10 K 限外濾過装置を用いて並列バッファー交換を実行します。
- 限外ろ過デバイスごとに準備された溶出液 (200-300 μ L) の半分の量を測定します。
- 後各遠心分離のステップで希釈する最初の溶出バッファーと胸の谷間のバッファー、2 番目の限外ろ過デバイス集中溶出液それぞれ。
- リカバリ後 120-200 μ L の間の同じボリュームに異なるバッファー解決集中されたサンプルを調整します。
注意: 今胸の谷間バッファー解決基板のタンパク質含有量は溶出バッファー解決基板と同じです。したがって、それは蛋白質の集中を測定するために使用されるメソッドが EDTA と干渉する場合手順セクション 4.5.3 で後者の 1 つのコンテンツのタンパク質を決定するため必要ではありません。
- 基板のタンパク質含有量は 280 で吸光度を測定することによって溶解溶出や胸の谷間のバッファーのいずれかを決定する nm。
注: 他の方法 (例えば、ブラッドフォードまたはビシンコニン酸 (BCA) の試金) もタンパク質濃度を測定する使用できますが、電気的な妨害の EDTA (溶出バッファーの現在) または蛍光性基質の吸光度は、する必要があります。見なされます。4.5.4 の手順で適用される基板の解決の最初の蛋白質内容は 0.4 から 2.0 の間にある推奨 mg/mL の校正を生成するために適切な範囲の曲線します。消散係数は、表 10を参照してください。基板 分子の重量
(ダ)消散係数
(M-1 cm-1、280 nm の水の測定)彼の6- MBP-VSQNY * PIVQ mTurquoise2 72101.7 96845 彼の6- MBP-KARVL * AEAM mTurquoise2 72042.7 95355 彼の6- MBP-VSQNY * PIVQ mEYFP 72367.1 94325 彼の6- MBP-VSQNY * PIVQ マップル 72145.9 105200
表 10: 分子量と異なった組換え蛍光融合タンパク質基質の消散係数。 - 少なくとも 8 つのステップ、溶出からとそれぞれ溶出や胸の谷間のバッファーを使用して希釈では胸の谷間バッファー解決基板ソリューションからの両方の二重シリアル希釈を準備します。
- 黒半部マイクロ プレートに希釈の各ポイントの 30 μ L を転送します。
- 4.4.2 の手順で適用された設定を使用して、蛍光、蛍光を測定します。
注: は、胸の谷間と溶出バッファーの基本的な蛍光を測定します。
- 蛍光基質を浄化します。
- アッセイの評価
- 較正曲線をプロットします。
- 4.5.3 のステップで決定したタンパク質のコンテンツに基づいて (4.5.4 のステップで使用される)、精製された基板ソリューション (mM) の濃度を計算します。
- (胸の谷間バッファーまたは溶出バッファー) 応用希釈バッファーの基本的な RFU 値によってシリアル希釈ポイントの相対的な蛍光強度値 (RFU) を修正します。
- 胸の谷間- や溶出-バッファー-解決精製された基質のモル濃度に対する修正 RFU の値をプロットし、線形回帰 (力ゼロとの交点) を実行します。
注: 高 R2値 (˃0.97) は、蛍光と蛍光タンパク質の濃度と良い相関を示します。この例では、回帰直線の傾きは、4.6.2 と 4.6.3 の手順で調べた範囲の分析成分濃度を評価するために使用できます。実験でエラーとデータのポイント配分は、校正の信頼性に影響を与えるしたがって、R2や傾斜角の値がデータに影響されてかどうかを確認するためにグラフィカルな評価がズームのグラフ (図 3に示す) としての助けを借りて行われます。
- 反作用のサンプルの C 末端蛍光胸の谷間プロダクトの量を計算します。
- 各 R サンプルの RFU 値と対応する B サンプルの RFU の値を修正します。
- 反作用のサンプルで (mM) で胸の谷間製品の濃度を計算する修正を割る胸の谷間バッファー ベースのキャリブレーションの斜面によって RFU 値曲線 (4.6.1.3 の手順を参照してください)。
- 反作用のサンプルに適用される基質の濃度を計算します。
- 基本的な溶出バッファーの RFU の値を持つ C サンプルの RFU の値を修正します。
- C サンプルの上清中に (mM) の溶出の基質の濃度を計算する彼らの修正を割る溶出バッファー ベースのキャリブレーションの斜面によって RFU 値曲線 (4.6.1.3 の手順を参照してください)。
- SAMB 原液次方程式に基づく 4.1.4.2 の手順で試験サンプルを作成するための (mM) で基質濃度を決定します。
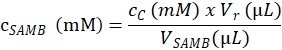
ここでは、 cSAMBはセクション 4.1.3; を用意して SAMB ストック溶液のモル濃度です。 cは溶出ステップ 4.6.3.3; で計算され C サンプル基板のモル濃度です。Vrはステップ 4.1.4.5 反応バッファーと 4.2.3 の手順で酵素のバッファーの追加によって作成された反応混合物のボリューム;。VSAMB C のサンプル (ステップ 4.1.4.2) SAMB 原液の量です。 - SAMB 原液 (mM) で (μ L) の量に応じてステップ 4.1.4.2 である反応の各サンプル管で測定のモル濃度に基づく各 R サンプル基板のモル濃度を計算します。
- データ処理を実行します。
注: データの分析は、実験の目的によって異なります。ビデオは彼6- MBP VSQNY を使用して HIV 1 PR の基板依存性の速度論的研究のデータ処理の例を示します * PIVQ mTurquoise2 基板。初期速度値は胸の谷間の C 末端フラグメントの数から計算され、応用基板濃度に対してプロットされます。速度論的パラメーターは、ミカエリス-メンテン型非線形回帰分析によって決定されます。
- 較正曲線をプロットします。
- 磁気ビーズのリサイクル
注: 実行後アッセイ、磁気アガロース ビーズできます収集、リサイクルします。- MPC で使用される磁気ビーズを収集し、上澄みを廃棄します。
- 所定の順序で次のバッファーの 1.8 ml ビーズを洗浄: 再生バッファー A (0.05% Tween 20、0.5 M NaOH)、再生バッファー B (0.05% Tween 20)、再生バッファー C (0.05% Tween 20 100 ミリメートルの EDTA、pH 8)、再生バッファー B、再生バッファー D (0.05% Tween 20 100 mM ニーソ4pH 8)、再生バッファー B、および再生バッファー E (0.5 のトゥイーン 20%、30% のエタノール、pH 7)。
注: 洗濯の手順ステップ 4.1.1.4 を参照してください。
- 所定の順序で次のバッファーの 1.8 ml ビーズを洗浄: 再生バッファー A (0.05% Tween 20、0.5 M NaOH)、再生バッファー B (0.05% Tween 20)、再生バッファー C (0.05% Tween 20 100 ミリメートルの EDTA、pH 8)、再生バッファー B、再生バッファー D (0.05% Tween 20 100 mM ニーソ4pH 8)、再生バッファー B、および再生バッファー E (0.5 のトゥイーン 20%、30% のエタノール、pH 7)。
- 4 ° C で再生成バッファー E リサイクル ビーズに格納します。
- MPC で使用される磁気ビーズを収集し、上澄みを廃棄します。
5. ページの分析
-
サンプル準備
メモ: Ni NTA 磁気ビーズによる分析を実行した後培養上清のアッセイはページによって分析できます。この場合、5.1.1、5.1.2 の手順をスキップします。しかし、それも興味のプロテアーゼとソリューションで消化後精製蛍光基板ソリューションおよび/または彼らの胸の谷間の断片を分析する可能です。この場合、5.1.1 の手順とプロトコルを続けます。- 4.5.1 のステップに従って精製蛍光基板ソリューションを準備します。
- ソリューションで消化を実行します。
- 1.5 mL 遠心チューブに消化されるべきサンプル 0.5 mL 10 K 限外濾過装置そして因数で胸の谷間バッファーとの溶出バッファーを交換します。
注: ページの分析、我々 は検体の個々 の実験デザインによると 68 μ L の各基板、サンプル チューブの数や基板ソリューションをして、検体量を最適化できます。 - 酵素液をサンプルに追加します。
注: ページ解析のため我々 適用 2 μ L HIV 1 PR、Bozóki ら14で説明されているが、個々 の実験デザインによるとボリュームを最適化可能性があります。胸の谷間のバッファーを使用して溶解および/または酵素を希釈することをお勧めします。 - 実験デザインによるとサンプルをインキュベートします。
注: ページ分析、私たち培養 37 ° C、しかし、インキュベーション時間の 45 分の反応混合物と温度を実験計画に従って設定する必要があります。 - 5.1.3 のステップを実行することで反応を停止させます。
- 1.5 mL 遠心チューブに消化されるべきサンプル 0.5 mL 10 K 限外濾過装置そして因数で胸の谷間バッファーとの溶出バッファーを交換します。
- ページのサンプルを準備します。
注: nondenaturing または変性法による蛍光基質を含むサンプルが準備ページの可能性があります。Nondenaturing または変性の条件の使用のためそれぞれ 5.1.3.1 または 5.1.3.2 の手順に従います。- Nondenatured サンプルの準備: nondenaturing サンプル読み込みバッファー (300 mM トリス、20% グリセロール、0.05% ブロモフェノール ブルー、pH 6.8) x 6 の 6 μ L で 30 μ L のサンプルをミックスします。
- 変性のサンプルを準備: 変化サンプル読み込みバッファー (300 mM トリス、20% グリセロール、0.05% ブロモフェノール ブルー、12% SDS 100 mM β-メルカプトエタノール、pH 6.8) x 6 の 6 μ L でサンプルの 30 μ L を混合し、95 ° c 10 分のサンプルを加熱します。
-
SDS ページの分析
注: 必要に応じて、nondenatured (の準備ステップ 5.1.3.1) サンプルは分析するが、場合にのみネイティブ ページも実行できます。この場合、セクション 5.3 をスキップします。- SDS ポリアクリルアミドのゲル (スタッキングのゲルの分離 14% と 4% 使用) を準備し、電気泳動バッファー (2.5 mM トリス、グリシン 19.2 mM、0.01 %sds) でタンクを満たします。
- ポリアクリルアミド ゲルの井戸にサンプル (5.1.3.1 または 5.1.3.2 の手順で準備) を追加し、120 V の電圧で電気泳動を実行します。
- 実行中のモジュールからゲル カセットを取り外し、洗浄槽にゲルを置きます。
注: Nondenatured サンプル既にゲル、肉眼でもまたは、DRBT で表示されています。
-
ゲルの下と蛍光タンパク質の検出
注: 変性サンプル (ステップ 5.1.3.2 の準備)、DRBT の蛍光タンパク質を検出するには、SDS の、ゲルからタンパク質の renature 部分的に洗浄する必要があります。- 〜 100 mL の蒸留水を加えるゲル、ゲルを少なくとも 30 分間すすぎ。
注: SDS の除去を改善するために水の 10 分毎を交換または 60 分をすすいでください。 - DRBT を使用して、または紫外イメージングは、蛍光タンパク質を可視化します。
- 〜 100 mL の蒸留水を加えるゲル、ゲルを少なくとも 30 分間すすぎ。
-
従来クマシー染色ゲルの
- 無蛍光蛋白質を視覚化する Coomassie ブリリアント ブルーの染料でゲルを染色します。
結果
図 1 aは、サイトにあるその特定の胸の谷間のシーケンスで HIV 1 PR によって処理することができます代表蛍光遺伝子組換え蛋白質の基質の構造を示しています。図 1 bは、基板生産とプロテアーゼの試金、Ni NTA 磁気ビーズによるアッセイやページなどでその応用を表します。
二信頼性の高いデータを取得するには、校正手順が蛍光基板と開裂製品の量を決定するために、必要です。このため、別のバッファー条件の異なる基板上の蛍光強度の値を測定する必要し、測定濃度範囲 (図 3) 濃度と相関することが必要があります。基板と、検体の開裂製品の量を決定する較正曲線の勾配値を適用できます。検量線の斜面は基板 (表 11) に挿入される胸の谷間サイト系列の独立して同じ種類の蛍光タンパク質を融合した基板のシリーズされる可能性がありますすることができます。ズームでグラフ同様低い濃度範囲を拡大するため、すべての線形回帰 (図 3) のとおりです。キャリブレーションがデータ ポイントの適切な分布が信頼性の高い校正に必要なために、慎重に実行する必要があることに注意してくださいすることが重要です。R2値は蛍光タンパク質の濃度と蛍光データ ポイント数が足りない場合にのみ良い相関を示すために二重シリアル希釈を校正サンプルを準備する適用この理由全体の濃度範囲をカバーするのに使用されています。さらに、実験誤差校正; の確度に影響する高したがって、回帰直線のグラフィカルな評価は必要もあります。
反応速度 (図 4 a) に基質濃度の効果の検討を含むプロテアーゼ法によって様々 な酵素の計測を実行できます。非線形回帰によって酵素の速度論的パラメータ ( vmaxとKmなど) を決定するデータを使用できます。不足ビーズ懸濁、分散と不適切な反応終了は、最適ではない結果は、信頼性の高い酵素の速度論的値を計算するのには適していません (図 4 b) を引き起こす可能性があります。
(例えば中胸の谷間反応パラメーターの最適化) (図 5 a) の定量による時間プロダクト形成の依存性を決定できます。酵素阻害剤の存在下ですることができます活性酵素濃度と阻害定数の測定 (図 5 b) を検討しました。同じ方法論を使用して、他の阻害剤の効果は、アッセイによって上映されることができます。
プロテアーゼのアッセイは、酵素活性に及ぼす pH の調査に便利です。図 6 aは、全体最適の pH 範囲 (pH 6-9) のある TEV PR の例による pH 依存性酵素活性を表します。酵素活性の pH 依存性の検討 (または酸性 pH 最適を持つ酵素を測定する必要)、ビーズに組換え基板の親和性結合がわずかに酸性 pH で制限されていることを考慮する必要は。ビーズ (図 6 b) から基板の高解離試験結果の歪みが生じる。ビーズから自発的な基板解離を考慮するために反作用のサンプルの測定値は、B サンプルのものに修正する必要があります。
図 7は、青い光透視 (図 7 a) を使用して、色に基づいてゲルの nondenatured 蛍光蛋白質を区別できることを示します。基板/胸の谷間の断片の分子量の測定が必要な場合、条件の変化も使えるサンプル準備のため蛍光蛋白質部分的にゲルで renatured をすることができ、UV 照射によって検出することができますので(図 7 b)、Coomassie の染色 (図 7)。R サンプルを分析した場合 C ターミナル胸の谷間の製品のみが表示されます (図 7)、N 端末胸の谷間断片と分解されていない基板ビーズに接続されたまま。時折、蛋白質は、nondenaturing 条件 (図 7) を使っていても部分的に変性する可能性があります、nondenatured 蛋白質が多い中、変性フォームもサンプルで検出可能です。この現象は蛋白質分解開裂の検出には影響しませんが、nondenatured サンプルの定量的密度測定の場合考慮する必要があります。
詳細な説明は、2 mL チューブ ベースの試金のためにだけ示されていますが、アッセイが 96 ウェル プレート ベース システム (図 8)、(表示されていません) 当研究室で正常にテストされて既にために適応させることができます。96 ウェル プレートに適合した形式は蛍光光度法による電気泳動分析、同様と完全に互換性のある、このペーパーで説明する方法に基づいて、得られたデータを評価できます。
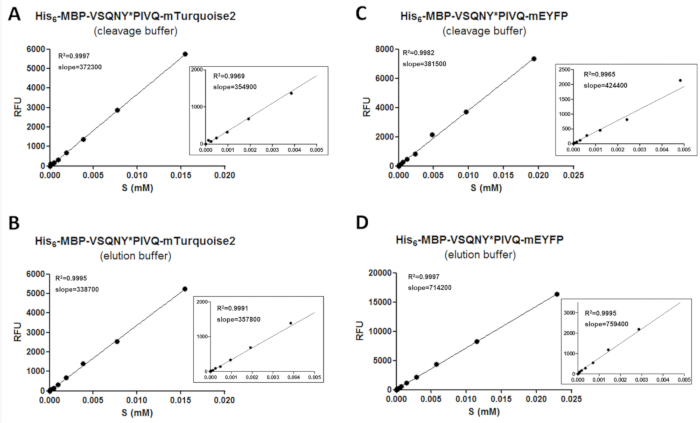
図 3:検量線。代表的な基板較正曲線が別の C 末端蛍光タグに融合組換え基板上の 2 つの例で示されて: (AとB) 彼の6- MBP-VSQNY * PIVQ mTurquoise2、Cおよび D ) 彼の6- MBP-VSQNY * PIVQ mEYFP。0 0.005 のデータ ポイントの線形回帰を表すためにズームで台数を表示また mM 基板濃度範囲。この図の拡大版を表示するのにはここをクリックしてください。
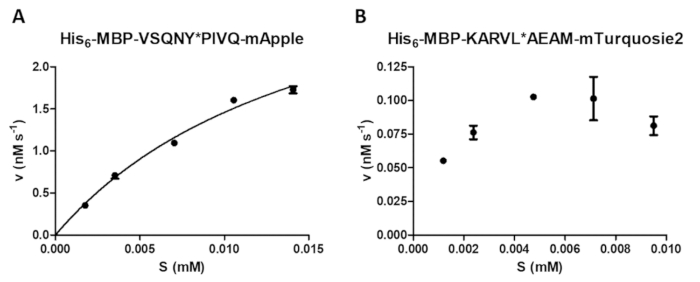
図 4: 酵素の速度論的パラメーターの測定。基板依存性運動測定を行った HIV 1 PR (41.2 の最終的なアクティブな濃度で nM)。初速値は基質の濃度に対してプロットした、ミカエリス-メンテン型非線形回帰分析を行った。誤差範囲を表す SD (n = 2)。彼の6- MBP-VSQNY の例 A (A) 代表的な最適な結果が表示されます * PIVQ マップル融合タンパク質基質。(B) A 代表的な最適ではない結果をまた示します彼6- MBP KARVL * AEAM mTurquoise2 基板、適切な基質濃度の設定は SAMB 原液の不十分な均質化による問題、一方、比較的高いエラーが不適切な反応終了によって引き起こされました。この図の拡大版を表示するのにはここをクリックしてください。
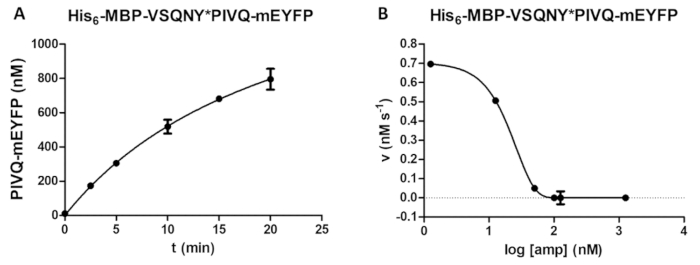
図 5: 経時的抑制研究。(A)彼6- MBP VSQNY * PIVQ mEYFP (0.00326 mM の最終的な集中) で組換えの融合蛋白質の基板が HIV 1 PR による開裂 (41.2 の最終的なアクティブな濃度で nM)、蛍光 PIVQ mEYFP の消化フラグメントのリリースを測定したと経時的解析を実行します。測定値は、5 つの異なる時点で行われました。誤差範囲を表す SD (n = 2)。(B) 彼の6- MBP-VSQNY * PIVQ mEYFP は、アンプレナビルの HIV-1 広報の活動抑制効果を決定する (0.0015 mM) の基板として使用された (163.8 の濃度で nM)。半最大阻害濃度 (IC50)、データを評価できるプロットと活性酵素濃度 (41.2 の最終的なアクティブ濃度 nM) 応用の HIV-1 広報の可能性がまたに基づいて算出されます阻害曲線。誤差範囲を表す SD (n = 3)。この図の拡大版を表示するのにはここをクリックしてください。
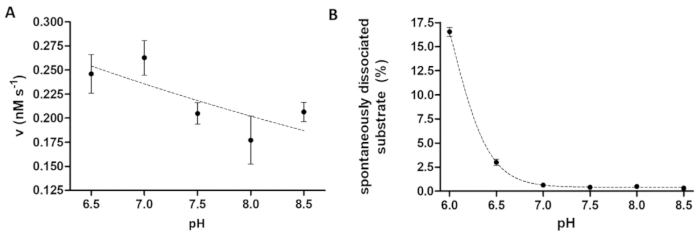
図 6: 依存性酵素活性と博士に自発的な基板解離を勉強(A)、彼の6- MBP-VSQNY * TEV PR の酵素活性を測定する使用された (で 0.033 mM) PIVQ mTurquoise2 基板 (91.42 の最終濃度で nM) 6.5 8.5 の範囲間の異なる pH に設定されて胸の谷間バッファー内。誤差範囲を表す SD (n = 2)。プロットされたデータがされている14は、以前公開します。(B) 彼の自発性の解離基板ブランク試料の相対蛍光強度値に基づいて6- MBP VSQNY * PIVQ mTurquoise2 基板 (0.033 mM) 磁気ビーズを胸の谷間のバッファーを使用して検討しました。異なる ph は、6.0 8.5 間。プロットされたデータがされている14は、以前公開します。この図の拡大版を表示するのにはここをクリックしてください。
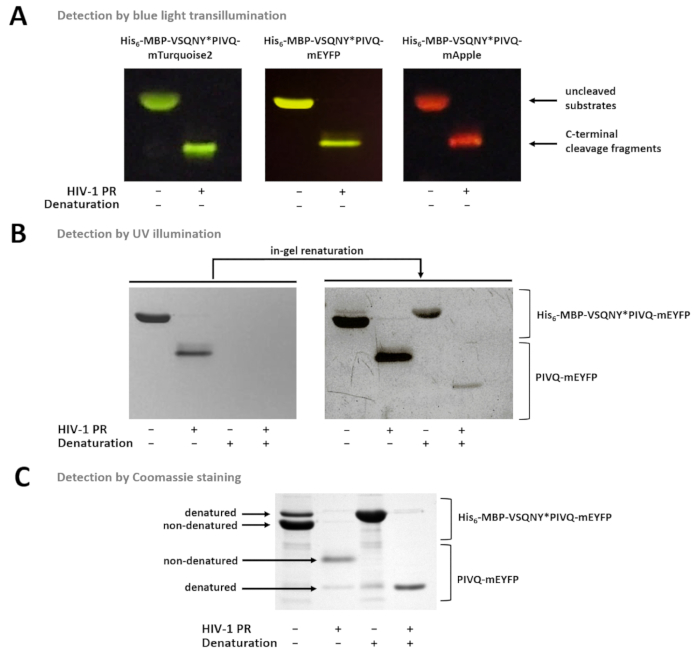
図 7:ゲルの別の方法で蛋白質を検出します。(A) 分解されていないと nondenaturing のサンプル準備の後 HIV 1 PR 消化融合蛋白基質は SDS ページの後青い光透視によって想像されたもの。ソリューションの消化によって開裂反応を行った。(B) ページの直後にのみ nondenatured タンパク質検出できるゲルで SDS の除去後、紫外線の照射によって以前変性蛍光タンパク質の一部となった renatured と検知します。Ni NTA 磁気ビーズによるアッセイの培養上清から調製。(C) クマシー染色も、ゲルの下後のタンパク質検出用使用することができます。ゲル、SDS 現在ネイティブ蛋白質の部分的な変性がネイティブのサンプルで nondenatured フォームが多い。Ni NTA 磁気ビーズによるアッセイの培養上清から調製。この図の拡大版を表示するのにはここをクリックしてください。

図 8:アッセイプラット フォームの 96 ウェル プレート ベース適応します。2 mL 管は 96 ウェル プレートの井戸だけでなく、試金 (A) を実行できます。野生型 (wt) または変異 (mut-1 mut 4) を含んだ蛍光基板の一連を使用して架空のプロテアーゼの特異性を研究するアッセイのアプリケーションの概略を示す胸の谷間サイト シーケンス。磁気ビーズを処理、96 ウェル対応磁気コンセントレーター (MPC) は、実験で使用されます。示されているすべてのボリュームは、単一の井戸に関連しています。異なる基板の開裂の効率を比較するため基質変換基板空白修正 RFU 値関連の RFU の基板ブランク補正値を考慮した反作用のサンプルの割合から評価できます。基板 100 としてコントロールのサンプル。 (B)/蛍光定量、サンプルはページ、および蛍光タンパク質成分によっても分析できるアッセイの分離培養上清は、直接または nondenaturing と変化させるサンプルの場合ゲルの下後分析することができます後準備、それぞれ。3 つの異なる測定サンプル タイプは各図にも示されている: C B 基板の制御を = = 空白、基板と R = 反応。基板制御サンプルは空白の基板中の溶出バッファーで、反作用のサンプルは胸の谷間のバッファー。この図の拡大版を表示するのにはここをクリックしてください。
| バッファー | 蛍光タンパク質 | 勾配 (%) の CV % |
| 溶出 | mTurquoise2 | 6.04 |
| 胸の谷間 | 9.11 | |
| 溶出 | マップル | 10.92 |
| 胸の谷間 | 12.68 |
表 11: 基板較正曲線の斜面の差異 (CV % 値) 値の係数。組換え蛋白質の基質の蛍光が挿入された胸の谷間サイトに依存しているかどうかをテストするための校正は縮合マップルと mTurquoise2 基板 (六つのバリエーションごとに、異なる胸の谷間サイトを含む一連によって行われました。hiv-1 プロテアーゼのシーケンス)、胸の谷間と溶出バッファーの両方。斜面の CV % 値が下単一基板校正同じ蛍光タグを含む基板バリエーションによって実行されるさまざまな測定値の評価のために利用できることを意味するすべての場合、15% であることがわかった。
ディスカッション
蛋白分解酵素の集中的な産業および学術調査と HTS 互換プロテアーゼ分析プラットフォームを迅速かつ手頃な価格の一定の需要のためにそれに応じて、我々 は、磁気ビーズによる蛍光プロテアーゼを開発しました。試金。アッセイは、組換えの融合蛋白質を用いた広く利用合成ペプチド基質に新しい選択肢をすることができますに基づいています。
開発試験形式で融合蛋白基質は Ni キレート コーティング磁気アガロース ビーズの表面に固定しました。基板添付ファイルは彼の6親和性タグ折りたたみを容易にするし、基板13の水への溶解度を高めるために MBP タグに直接融合融合蛋白質の N 末端によって提供されます。MBP には TEV PR の胸の谷間サイトや関心のプロテアーゼが続きます。前者として役立つかもしれない、アッセイのコントロール胸の谷間サイト一方、後者は調査するプロテアーゼで処理できます。胸の谷間のサイトは交換可能です。興味のある胸の谷間サイトの短い dsDNA 系列符号化は結紮の発現プラスミドの柔軟な 'クローニング カセット' に挿入することができます。組換えの融合蛋白質には C ターミナル蛋白質分解開裂 (にリリース酵素解放、蛍光灯、胸の谷間の C ターミナルの製品のエンドポイントの検出を可能にする非常に安定した、単量体の蛍光タンパク質タグが含まれて図 1 a)。精製された蛍光そのまま基板上の異なるバッファー解決は校正用基板と開裂製品のモル濃度を評価するためにも使用されます。さらに後/蛍光定量、分析コンポーネントごとに分析できます SDS-PAGE、同様。(Nondenatured) 両方のネイティブおよび変性の蛍光タンパク質で視覚化すること、ゲル電気泳動後すぐにまたはそれ以降のゲルの下後それぞれ。この追加手順との組み合わせ、従来 Coomassie ブリリアント ブルー染色-5 月は、アッセイ結果 (図 1 b) の検証を効率的に使用します。
試金プロシージャは、高スループットの自動環境に完全に適合させることができる低ボリューム形式の単純な簡単に実行の手順から成ります。しかし、独立して手動または自動化システムと分析の実行、アッセイの次の部分と考えられる重要であるし、しながら手順特別な注意が必要があります。i)磁気ビーズ ソリューションの均質性。均一磁気ビーズ ソリューションは、分析、浄化、洗浄の手順の両方で使用する必要があります。特に、プロテアーゼの試金の信頼性に依存正しく早かった基板に接続された磁気ビーズ (SAMB) 原液。懸濁液の分散効果を高めるためには、2% から 10% (v/v) ビーズ濃度を設定することをお勧めします。サンプル調製、使用時まで (トリトン X-100 トゥイーン 20 など) 非イオン性洗剤を添加したバッファーの 2% が磁気ビーズのプラスチック表面への付着を低下も。ビーズ懸濁液はサンプル チューブの壁の代わりにバイアルの底に慎重に適用される場合、ビーズのサンプル瓶の壁への付着を避けることが。酵素反応における磁気ビーズの均一性も重要であり継続的にサンプルを 600 rpm で潜伏中に揺することによって確保することができます。ビーズは正しく円形または平底プラスチック用品と同様の分散した V 底のバイアルの使用は推奨されません。不適切なビーズの均質化による最適な結果は、図 4 bで表されます。ii) 反作用のサンプルの終了。 メソッドのもう一つの利点は、酵素反応を熱変性治療または任意の潜在的干渉の化学薬品15を使用せず終了できること。終了は、反応混合物は、従来の磁気コンセントレーターを使用してから磁気ビーズを分離するだけで実施できます。削除された反応バッファーには、活性酵素と生成された C 末端蛍光開裂製品が含まれますが、分解されていない基板はビーズに接続されたまま。活性酵素反応バッファー内の存在のために分離のプロシージャは信頼性の高いエンドポイントの検出に対して慎重に実行する必要があります。コンセントレーターにサンプル瓶を置く前に、短いスピンの遠心分離を適用することをお勧めします。コンセントレーターにチューブを配置した後、少なくとも 15 を提供収集するビーズの s。区切り記号と前後のわずかな動きは、ビーズのコレクションを促進するかもしれない。手動で行っていた分離終了通常より時間かかります、反応の開始を検討してください。したがって、同じインキュベーション時間はすべてのサンプルに適用する必要がある場合、約 2 分登録遅延は、イニシエーションの間推奨します。
記載されているタンパク質アッセイの原理は比較的簡単です。ただし、システムの汎用性は、柔軟かつ安定した基板構造によって保証されます。アッセイの個々 の最適化は、適用条件、試薬、添加剤との親和性のビーズの互換性によってのみ制限される可能性があります。製造元のプロトコルに一致して、Ni NTA ビード表面に基板の親和性結合大幅に弱める pH ≦ で 6.515分かったしています。したがって、反応試料に平行基板の空白のサンプルに適用するお勧め、自発的な基板解離のレートが結果の評価時に考慮する必要があります。
どこビーズ-互換性のないコンポーネントまたは低 pH の使用による磁気ビーズ アッセイを実行できません、これらのケースでは、精製組換え基板のソリューションで消化も適用できます。これらの場合、反応混合物を電気泳動によって分析できるし、タンパク質は、記述されているプロトコルに基づいてゲルで視覚化することができます。プロテアーゼ活性を調べるためには、ソリューションの消化と蛋白質のゲルの検出もあります/蛍光定量の代替ツール。設計された基板システムの目新しさは、SDS ページの変化後ゲルの下のステップのアプリケーションです。ネイティブ (nondenatured) 蛍光タンパク質の電気泳動の間に彼らの蛍光を保持、蛍光プロパティを変性 (図 7 b) 時に廃止します。ただし、変性タンパク質の蛍光は SDS のゲルからの除去によって部分的に回復しました。したがって、変化の条件を用いた反応成分の分離が可能だけでなく蛍光ベース、重量ベースでは分子識別。Coomassie 染色ゲルの分析と比較して蛍光ゲルの検出のもう一つの利点は、蛍光値によるゲル内 (ネイティブまたは renatured) の蛍光タンパク質を簡単に識別できます (図 7参照)。これは、胸の谷間の反応は無蛍光の汚染物質を含む試料で実行されて場合または高分子量互いに似た蛋白質重要かもしれません。
同様に設計された基板を用いたプロテアーゼの試金はすでに8,9,10は、以前公開と胸の谷間サイトこれらのケースで興味のあった親和性タグの間にも、蛍光タンパク質アッセイ システムを提示ここで記述されているアイデアを繰り返すだけでなく、以前のプラットフォームの別の利点を組み合わせた、また更にそれらを完了: i) で MBP の融合パートナーの利用 ii)TEV PR コントロール胸の谷間サイト iii の存在)、新設計の単量体 FPs と iv の使用) ユニークな基板校正手順のアプリケーション。自体アッセイは、酵素特異性と安全で高価な機器を必要とせず、時間とコスト効率の高い方法論に有用特に設計されました。メソッドは両方の産業と学術研究目的のため適切かつ手頃なツールであること目指しています。発現プラスミドの複製カセットの柔軟性のためシステムが高速かつ安価な世代の組換え基板・ ライブラリの適さない場合があります。ここに記述されたアッセイは基質特異性、酵素の突然変異誘発の実施のための実行可能なツール、抑制研究し、また、酵素反応速度論を実行する代替ツールを提供します。(から速度論的パラメーターの決定に細菌セル中断) アッセイプラット フォーム HTS およびオートメーション ベースの環境に適応することができ、潜在的に、産業プロテアーゼ阻害剤のスクリーニングおよび/または抗ウイルス薬に適用される可能性があります。開発。さらに、競争力の分解のためのアッセイの適応は、将来的に当研究室の範囲ではまたです。このような競争力のある分析では、異なる C 末端蛍光タグ-が同じの開裂反応の研究優先順位を調査するため同時に使用するために融合 2 つ異なる基板各サイトを含む異なる胸の谷間指定されたターゲット シーケンスの酵素。さらに、96 ウェル プレート適応アッセイ フォーム (図 8) の使用も最適化されている変異のスクリーニングのシステインのプロテアーゼの場合変更された胸の谷間サイト シーケンスによる基板のシリーズ。
開示事項
著者が明らかに何もありません。
謝辞
この作品は GINOP-2.3.2-15-2016-00044「PHARMPROT チーミング」プロジェクトによって一部にはサポート、またが融資し、高等教育制度の卓越性プログラム人間容量省ハンガリー、の枠組みの中で、デブレツェン大学のバイオ テクノロジーのテーマ別プログラム。著者らは、研究所のレトロ ウイルス生化学アッセイ開発の間に彼らの科学的な助け、(特に、ノルベルト Kassay、Krisztina Joóné Matúz、バンダ トルディ アッセイを撮影中に彼らの忍耐のメンバーに感謝して、します。人に登場しているビデオの背景)。著者は博士トート Urbányi Beáta Bozóki の生化学および分子生物学客員研究員としての仕事をできるようにするために特に特別なのおかげでジェデオン リヒター Plc 等を言うにも思います。作者がマルチ メディアとデブレツェン大学の E ラーニング テクニカル センターからオーディオとビデオの専門家の支援をトート Király、軸 Pöstényi 軸 Tőgyi ダグラスフィッチ Zsadányi に感謝の意を拡張したいも生産。
資料
| Name | Company | Catalog Number | Comments |
| 10K Amicon tubes | Merck-Millipore | UFC501096 | |
| 2-Mercaptoethanol (β-ME) | Sigma-Aldrich (St Louis, MO, USA) | M6250 | |
| 40% Acrylamide/Bis solution 37.5:1 | Bio-Rad | 1610148 | |
| Acetic acid | Merck | 100063 | |
| Agarose | SERVA | 11404.04 | |
| Alpha Imager HP gel documentation system | ProteinSimple | ||
| Ammonium persulfate (APS) | Sigma-Aldrich (St Louis, MO, USA) | A3678 | |
| Ampicillin sodium salt | Sigma-Aldrich (St Louis, MO, USA) | A9518 | |
| Beckman Coulter Allegra X-22 centrifuge | Beckman Coulter | 392185 | |
| Black half-area plates | Greiner bio-One | 675086 | |
| Bromophenol blue | Sigma-Aldrich (St Louis, MO, USA) | B0126 | |
| CutSmart buffer (10x) | New England Biolabs | B7204S | For plasmid linearization (step 1.1.1) |
| Dark Reader transilluminator | Clare Chemical Research | DR-45M | |
| DNase I | New England Biolabs | M0303L | |
| Dynamag-2 magnetic particle concentrator | Thermo Fischer Scientific | 12321D | |
| Escherichia coli BL21(DE3) competent cells | Thermo Fischer Scientific (Invitrogen) | C600003 | |
| Ethanol | Merc-Millipore | 100983 | |
| Ethylenediaminetetraacetic acid (EDTA) | Sigma-Aldrich (St Louis, MO, USA) | 798681 | |
| Gel Loading Dye, Purple (6X) | New England Biolabs | B7024S | |
| Glycerol | Merck | 356350 | |
| Glycine | Sigma-Aldrich (St Louis, MO, USA) | G7126 | |
| High-Speed Plasmid Mini Kit | GeneAid | PD300 | |
| Imidazole | Sigma-Aldrich (St Louis, MO, USA) | 56750 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fischer Scientific (Invitrogen) | AM9464 | |
| Jouan CR 412 centrifuge | Jouan | CR412 | |
| Labinco LD-76 Rotator | Labinco | 7600 | |
| Luria-Bertani (LB) broth | Sigma-Aldrich (St Louis, MO, USA) | L3022 | |
| Lysozyme | Sigma-Aldrich (St Louis, MO, USA) | L6876 | |
| Magnesium chloride | Scharlau | MA0036 | |
| MERCK eurolab ultrasonic bath | MERCK | USR54H | |
| Millifuge Eppendorf spin centrifuge | Millipore | CT10 | |
| Mini-PROTEAN 3 Electrophoresis Cell | Bio-Rad | ||
| N,N,N′,N′-Tetramethylethylenediamine (TEMED) | Sigma-Aldrich (St Louis, MO, USA) | T9281 | |
| NanoDrop 2000 | Thermo Fischer Scientific | ||
| NheI-HF restriction endonuclease | New England Biolabs | R3131L | |
| Nickel(II) sulfate (NiSO4) | Sigma-Aldrich (St Louis, MO, USA) | 656895 | |
| Ni-NTA magnetic agarose beads | Qiagen | 36113 | |
| Orbital shaker | Biosan | OS-20 | |
| PacI restriction endonuclease | New England Biolabs | R0547L | |
| PageBlue Protein Staining Solution | Thermo Fischer Scientific | 24620 | |
| Phenylmethanesulfonyl-fluoride (PMSF) | Sigma-Aldrich (St Louis, MO, USA) | P7626 | |
| Protein Lobind Micro-centrifuge tubes | Eppendorf | 22431102 | |
| QIAquick Gel Extraction Kit | QIAGEN | 28704 | |
| Snijders Press-to-Mix shaker | Gemini | 34524 | |
| Sodium-acetate trihydrate | Sigma-Aldrich (St Louis, MO, USA) | S7670 | |
| Sodium-chloride | Sigma-Aldrich (St Louis, MO, USA) | S9888 | |
| Sodium-hydroxide | Sigma-Aldrich (St Louis, MO, USA) | S5881 | |
| SYBR Green I Nucleic Acid Gel Stain | Thermo Fischer Scientific | S7563 | |
| T4 DNA ligase | Promega | M180A | |
| Thermo shaker | Biosan | TS-100 | with SC-24 accessory block |
| Tris | Sigma-Aldrich (St Louis, MO, USA) | T1503 | |
| Tween 20 | Sigma-Aldrich (St Louis, MO, USA) | P2287 | |
| WALLAC VICTOR2 1420 multilabel counter | Wallac Oy, Turku, Finland |
参考文献
- Meldal, M. Smart Combinatorial Assays for the Determination of Protease Activity and Inhibition. Molecular Informatics. 24 (10), 1141-1148 (2005).
- Rao, M. B., Tanksale, A. M., Ghatge, M. S., Deshpande, V. V. Molecular and biotechnological aspects of microbial proteases. Microbiology and Molecular Biology Reviews. 62 (3), 597-635 (1998).
- Zhang, G., Sittampalam, G. S., et al. Protease assays. The Assay Guidance Manual. , (2012).
- Woelcke, J., Hassiepen, U., Chen, T. Fluorescence-based biochemical assay formats. A Practical Guide to Assay Development and High-Throughput Screening in Drug Discovery. , (2010).
- Richardson, P. L. The determination and use of optimized protease substrates in drug discovery and development. Current Pharmaceutical Design. 8 (28), 2559-2581 (2002).
- Diamond, S. L. Methods for mapping protease specificity. Current Opinion in Chemical Biology. 11 (1), 46-51 (2007).
- Schilling, O., Overall, C. M. Proteome-derived, database-searchable peptide libraries for identifying protease cleavage sites. Nature Biotechnology. 26 (6), 685-694 (2008).
- Askin, S. P., Morin, I., Schaeffer, P. M. Development of a protease activity assay using heat-sensitive Tus-GFP fusion protein substrates. Analytical Biochemistry. 415 (2), 126-133 (2011).
- Chaparro-Riggers, J. F., Breves, R., Michels, A., Maurer, K. H., Bornscheuer, U. A GFP based assay for the determination of hydrolytic activity and substrate specificity of subtilisins under washing conditions. Journal of Molecular Catalysis B: Enzymatic. 35, 74-77 (2005).
- Patel, D., Frelinger, J., Goudsmit, J., Kim, B. In vitro assay for site-specific proteases using bead-attached GFP substrate. Biotechniques. 31 (5), 1194-1198 (2001).
- Branchini, B. R., et al. Sequential bioluminescence resonance energy transfer-fluorescence resonance energy transfer-based ratiometric protease assays with fusion proteins of firefly luciferase and red fluorescent protein. Analytical Biochemistry. 414 (2), 239-245 (2011).
- Zhou, C., Yan, Y., Fang, J., Cheng, B., Fan, J. A new fusion protein platform for quantitatively measuring activity of multiple proteases. Microbial Cell Factories. 13 (1), 44 (2014).
- Fox, J. D., Waugh, D. S. Maltose-binding protein as a solubility enhancer. Methods in Molecular Biology. 205, 99-117 (2003).
- Bozóki, B., et al. A recombinant fusion protein-based, fluorescent protease assay for high throughput-compatible substrate screening. Analytical Biochemistry. 540-541, 52-63 (2018).
- Mótyán, J. A., Miczi, M., Bozóki, B., Tözsér, J. Data supporting Ni-NTA magnetic bead-based fluorescent protease assay using recombinant fusion protein substrates. Data in Brief. 18, 203-208 (2018).
- Balleza, E., Kim, J. M., Cluzel, P. Systematic characterization of maturation time of fluorescent proteins in living cells. Nature Methods. 15, 47-51 (2018).
- Hebisch, E., Knebel, J., Landsberg, J., Frey, E., Leisner, M. High variation of fluorescence protein maturation times in closely related Escherichia coli strains. PLoS One. 8, e75991 (2013).
- Kapust, R. B., et al. Tobacco etch virus protease: mechanism of autolysis and rational design of stable mutants with wild-type catalytic proficiency. Protein Engineering, Design and Selection. 14, 993-1000 (2001).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved