Method Article
下流の単一細胞分析のため尿路感染症のマウスモデルから生成された単一細胞内細菌群集の分離
要約
このプロトコルでは、単純な尿路感染症のマウスモデルからの単一、感染して膀胱の上皮細胞を分離する方法について説明します。
要約
この記事で、私たちは実験的尿路感染しているマウスから個々 の細胞内細菌群集を分離するために使用手順を概説します。プロトコルは 3 つのセクションに広く分けることが: 感染症、膀胱上皮細胞の収穫、および個々 の感染した上皮細胞を分離するための口 micropipetting。孤立した上皮細胞細菌の生菌が含まれています、ほぼ無料汚染細胞細菌、下流の単一細胞解析に最適です。感染症の開始から単一細胞内細菌群集を取得するのにかかる時間は約 8 時間です。このプロトコルは導入コストが高く、広く利用可能な材料を使用して、我々 はそれはまた、場合でも、これらの感染した細胞はまれに細胞の混合物からの 1 つの感染した細胞を分離する他の感染モデルで利用することが予想されます。ただし、口 micropipetting の潜在的なリスク、この手順勧めできません高い感染性病原体のため。
概要
尿路感染症 (Uti) は、最も一般的な細菌感染症の一つです。女性の 40-50% は、その有効期間の1の間に少なくとも 1 つの尿路感染症 (UTI) を体験する予定です。ウチのメインの代理店の 1 つは、尿路合併症のない UTIs2の 70% 以上を占める (UPEC)、エシェリヒア属大腸菌です。さらに、UTI がある人の約 4 分の 13適切な抗生物質による治療にもかかわらず、同じひずみによる、再発感染しているが。尿路感染症の発生率が高い医療システム、以上 $ 20 億米国4年の原価計算への実質的な負担を表します。さらに、Uti の治療に抗生物質の使用は、また主要な公衆衛生の懸念5が上昇の抗生の抵抗率につながります。
したがって、再発性感染症6,7、8を引き起こすことと同様に、尿路に感染する UPEC がメカニズムの理解に多大な労力を配置されています。特に、ウチの8に寄与する細菌およびホストの特性を検討する感染症のマウスモデルを使用されています。このマウスのモデル人間の患者から分離された変更されていない臨床系統に適用できるという利点があります。このモデルは、1 型線毛9と鉄獲得システム10など尿路感染症の確立の重要な潜在的 druggable 細菌経路の発見にもつながっています。
尿路感染症の初期イベントの勉強にこれらの成功と比較して、再発性 UTI の発生メカニズムの知識はまだ11に欠けています。1 つの仮説は、UPEC が抗生物質治療を拒み、膀胱上皮細胞内の細胞内細菌群集 (IBCs) を形成することにより膀胱内再発性感染症を引き起こすことです。IBCs は、感染症のマウスモデルと人間尿路感染症患者12,13の両方に同定されています。小児の尿路感染症患者の尿サンプル中の Ibc の存在は再発14,15の率が高いに関連付けられています。しかし、IBCs を分離し、それらの内で細菌を勉強してその希少性のために技術的に挑戦する実証してその感染したマウス膀胱の通常のみが 10-100 IBCs16と推定されます。また、膀胱の上皮細胞が比較的大きい (50-120 μ m)17、それは蛍光を展開する挑戦を作る支援細胞選別 (FACS) 典型的な FACS、ノズル直径 100 μ m または 70 μ m のことを考える。したがって、膀胱上皮細胞と同じ大きさのセルを FACS、流体を目詰まりを避けるために前に濾過により除去がしばしば。
私たちの研究室は、最近膀胱18の研ぎ出しの上皮細胞などの混合物から珍しい感染細胞を分離する一般的で経済的な方法を説明します。IBCs を効果的に特定するには、伝統的な口ピペッティングを使用しました。口 micropipetting は長い単一細胞および下流解析19,20,21,22,23,のための胚のマイクロマニピュレーション用に使用されている技術24,25します多くの場合の原因となっている伝統的な口 (ミリリットル) で大量液体分注研究室関連事故と手法が伝統的な発生学の外の研究コミュニティの多くによって敬遠されて当然と。単一電池への応用。我々 のプロトコルは、大きなバッファーを提供することによってリスクを軽減するこの手法19,20の単一セルのバージョンに触発され (> 2 mL) 研究者と液体の体積と比較してサンプル間の空気の転送 (< 1Μ L)。このメソッドも活用して細かい制御の口周辺転送ソリューションと隔離されたセルの高純度の低い最終巻に変換する、micropipetting を提供します。安価な材料を用いる (<$ 50)、およびこうしてすべてのラボで実現する必要があります。
このビジュアルのプロトコルでは、この手法を複製しようとすると、他の研究者を支援するために参照を提供する、私たちの IBC 分離手法について説明します。研究者は、ライブ イメージング、micropipetting のオープンでアクセス可能なイメージングの段階の間に個々 の上皮細胞と蛍光細菌を視覚化するために使用できる蛍光管の内径 (または同じような装置) へのアクセスを必要があります。(他の同等の計測器モデルを使用することも、使用する顕微鏡の詳細テーブルの材料を参照)このプロトコルは尿路感染症のマウスモデルにおける Ibc に焦点を当てる、感染症の他のモデルの細胞懸濁液から感染した細胞を分離に適用される同様のメソッド必要があります。
プロトコル
動物の取り扱いについてここで説明したすべてのメソッドは、科学、技術、研究、シンガポールの機関動物ケアおよび使用委員会 (IACUC) シンガポールのゲノム研究所と代理店の生物学的リソース センターのによって承認されています。
1. マウス感染
-
ガラス管の準備
- 火気ソース (ブンゼン バーナーまたはアルコール バーナー) を点灯します。
- 両方の端をしっかりとつまんで両手毛細管ガラスを保持し、ガラスにソフト出るまで管の中を均等に加熱します。優しく前後もガラスの加熱で支援するためにその軸に沿って毛管を回転します。
- ガラス管を熱源から外し、すぐに管の両端のグリップを維持しながらの手を離れて、引っ張る。引っ張られた毛細血管の理想的な最終的な長さは 3-5 cm シングル膀胱上皮細胞を分離するための適切な内部径を確保するため unpulled の毛細血管よりも長いです。
注意:チューブはまだ時間の期間のための非常に熱いまま、ので次のステップに進む前に冷却するために数分間熱安全表面に毛細血管をおきます。 - チェック ガラス管の中間となっているかどうかを参照してくださいに狭い (図 1A)、チューブの内部はまだ中空 (図 1B)。Ibc の分離、200-400 μ m の穴径は使用可能です。
- 片方の手で引っ張られた毛細血管の一方の端を拾います。一方、鉗子のペアを押しの狭いポイントで引っ張られたガラスキャピラリをピックアップするために使用します。それを粉砕することがなくしっかりと毛細血管をグリップに十分な力鉗子を振るったことを確認します。
- 鉗子を持つ手によって急速なひねりを使用して毛細血管の口 micropipetting を作成するのに最も狭いポイントで引っ張られた毛細血管をスナップします。
注:ガラス破片から十分な保護を使用する限り、鉗子の代わりに指を使用は許容も。 - 手順 1.1.2-1.1.6 を繰り返し、少なくとも 4 倍以上十分な予備 micropipetting 毛細血管を生産し、IBC の分離のための直径の範囲を提供します。感染症グループの 1 つ以上が予想される場合は、グループごとに付加的な伝染 5 追加 micropipetting 毛細血管を準備します。
注意:開いた炎を遮断することを忘れないでください。 - 100 mm のペトリ皿に引っ張られた毛細血管を配置し、毛細血管を殺菌する 30 分間紫外線に料理を公開します。
- UV 殺菌後、シャーレの蓋を交換し、室温で毛細血管にペトリ皿を格納します。
-
感染する前にカテーテルの準備
- 尿カテーテルを感染感染する前に、少なくとも 1 日洪ら8コノバーら26で説明したように備えます。
-
蛍光尿路大腸菌培養の準備
- 選択した蛍光体を表現する尿路の細菌成長確立されたプロトコルに従ってひずみ。
注:ひずみと蛍光体の選択は、顕微鏡と各施設で利用可能な系統によって大きく異なります。この例では、当初再発性膀胱炎患者からの臨床分離株である UTI89 から派生したひずみを使用します。これは、株は、SLC-638、運ぶプラスミド (労協-77) vsfGFP 9、カナマイシンの抵抗18を表す。SLC 638 は、流体培養基 LB の 50 μ g/mL カナマイシンを添加した 37 ° c で栽培されています。 - 縞のひずみ SLC 638 ルリア ベルターニカミラ (LB) に-50 μ G/ml カナマイシンを添加した寒天培地プレート。37 ° C でプレートを一晩インキュベートします。
- (省略可能)植民地を選択する前に蛍光マーカーの発現を確認する解剖顕微鏡のプレートを表示します。
- 細菌接種ループを使用して、流体培養基 LB の 50 μ g/mL カナマイシンを添加した 10 mL と 125 mL の三角フラスコに選択したコロニーを転送します。24 h の 37 ° C で静的にフラスコを孵化させなさい。
- サブカルチャーこのフラスコ フラスコから文化の 10 μ L をとり、流体培養基 LB の 10 mL で希釈してから細菌を新鮮な 125 mL フラスコ (1: 1000 希釈) で 50 μ g/mL カナマイシンを補った。別の 24 h の 37 ° C で静的にこの 2 番目のフラスコを孵化させなさい。
- スピン ・ ダウン 5,000 × gで 5 分間、4 ° C の細菌文化
- 上清をデカントし、OD600 0.5 冷 PBS で細菌のペレットを再懸濁します。
注:カルチャが異なる場合、通常静的文化の 1 mL を与える外径600の 4 ~ 5 mL 約 0.5 の細菌培養を =。それぞれのひずみは次のように計算できるために必要な菌量: 50 μ L が各マウス必須ですが、50 μ L が針の頭を埋めるために必要です。接種の追加の 10-20% (最低 50 μ L) をシリンジのデッド ボリュームを考慮して推奨します。 - 残りの細菌の混合物を使用すると、洪ら8に示す感染価を決定します。
注:このステップは 4 ° C で細菌の混合物を格納することによって、数時間遅れる
- 選択した蛍光体を表現する尿路の細菌成長確立されたプロトコルに従ってひずみ。
-
尿路感染症のマウスモデル
- 前述の洪ら8、セクション 1.3 で培養されたエシェリヒア属大腸菌蛍光のそれぞれの株に 1 つの実験グループをマウスに感染します。
注:また視覚補助のコノバーら26を参照してください。 - マウスまたはケージの細菌の接種までの時間に注意してください。
- 全体の実験グループに感染を繰り返します。
注:感染症カテーテルは、同じグループ内のすべてのマウスの再利用があります。 - 各実験群の手順 1.4.1-1.4.3 計画、新鮮なカテーテルと新しい潤滑剤ゲルをグループごと用意があることを確認します。
注:多数の動物実験、動物を 5 つのグループに分割することをお勧め、各グループは、その感染症を驚異的な感染 1 時間に離れて約 30 分。これは次の手順 (セクション 2 および 3) に十分な時間を提供します。
- 前述の洪ら8、セクション 1.3 で培養されたエシェリヒア属大腸菌蛍光のそれぞれの株に 1 つの実験グループをマウスに感染します。
2. 膀胱上皮細胞の細胞懸濁液を入手するために収穫
-
収穫とマウス膀胱を反転
- 3 つの 50 mL の円錐管滅菌手術用機器の 70% エタノール 45 ml を準備します。
- 2.1.1 準備したチューブの 2 つ、はさみのペアと各ピンセットのペアを配置します。3 管に鉗子 (できれば狭いと膀胱の転位のための丸みを帯びた先端の 1) の 2 つのペアを配置します。
注:最初のチューブでツールを使用して、外部の地域に、膀胱が収穫で使用する 2 番目のツールおよび膀胱反転で使用される最後の管に鉗子の 2 つのペア。 - 6 h で感染症の記事、機関の確立した IACUC プロトコルによると感染マウスを安楽死させます。
注:マウス麻酔 (イソフルラン) 中に実行する頚部転位による安楽死のため私たち IACUC プロトコルを呼び出します。 - フラットに背中の動物を置くし、彼らの腹部領域を消毒する 70% のエタノールでいっぱいスプレー ボトルを使用します。
- 鉗子と (2.1.2 の手順で準備) 最初のチューブから外科はさみのペアを使用して、お肌、尿道の上約 1 cm の小さな横切開を開きます。マウス腹膜の内容を公開するの前部全体に沿って V 字カットの作成、マウスの上肢に向かって斜めに切開を展開します。このプロセス中にはさみカットしないでください (図 2a、B) マウスの腸の中を確認します。
- (2.1.2 の手順で準備) ツールの 2 番目のセットに切り替えます。はさみの刃または鉗子のシャフトを使用して、優しく押し、マウスの骨盤領域の近くの脂肪パッド。
注:この手順は外側に突出してに膀胱が発生し、収穫の可視性を保証します。 - 鉗子 (図 2C) のペアで頂点に露出した膀胱をグリップします。
- 切り取って (尿道や尿管を離れて切断) 動物の残りの部分から膀胱を無料鉗子を膀胱アペックスのしっかりしたグリップを維持し、手術用のはさみを使用して。膀胱をまだ保持鉗子を解放しません。
- はさみから第三に円錐形から狭い丸い鉗子への切り替え (ステップ 2.1.2) からチューブは、それがちょうど前の手順 (図 2D) でカットされた場所膀胱の開口部に丸い鉗子の一方の軸の先端を挿入します。膀胱の開口部に安全に挿入丸い鉗子の先端、膀胱の頂点を把持鉗子のペアを解放し、2 番目の円錐管に戻る。
- 3 番目の管から鉗子の 2 番目のペアを使用して、そっと裏返し膀胱""、最初丸い鉗子 (図 2D矢印 1) から膀胱の口の外側の端を引っ張ってくると、周りの他の先端の上を指導丸みを帯びた鉗子 (図 2D矢印 2)。
注:アクションは、片方の足から靴下を削除し、他の上引きに例えることができます。- 反転過程では、最初の丸みを帯びたほぼ完全に閉じた鉗子のペアを保持します。これは丸い鉗子の第一のシャフトから膀胱をやってのけるに移動の十分な自由を提供していますがまた最初に近い丸みを帯びた鉗子の 2 つ目のシャフトをもたらすし、膀胱を簡単に転送することができます。この手順の最終的な結果が反転されていると鉗子 (図 2E) の最初のペアの 2 番目の軸の先端に、膀胱を終了します。
- 1 mL の冷 PBS に鉗子の先端から逆の膀胱をなだめすかす鉗子の 2 番目のペアを使用して、優しく。
注:(省略可能)これは、逆にあれば一般的な頻度と、Ibc の分布を観察する感染した膀胱全体の画像を撮影する絶好のタイミングです。
- (最大 5 匹の動物) に実験グループの各膀胱の手順 2.1.1-2.1.10 を繰り返します。
-
膀胱上皮細胞をこする
- 2 つの使用きれいに鉗子のペア、(ある内部上皮細胞層) 倒立膀胱の外側を優しくこすり。周囲の PBS が収入をこすると cloudier 表示されます、上皮細胞が PBS 溶液に解放されます。
- (省略可能)視覚的に膀胱の削りが解剖顕微鏡を用いたソリューションに細胞をリリースしたことを確認します。図 3A、B)PBS は肉眼に目に曇りが表示され、掻き個々 膀胱上皮細胞は 10 倍の倍率で見ることができます。
- ステップ 2.1 から各収穫の膀胱の手順 2.2.1-2.2.2 を繰り返します。
3. 細胞内細菌コミュニティ (IBC) 分離: IBCs の口ピペッティング
注:このセクションで説明されているすべてのメソッドは、機関のリスク評価を受けています。口ピペッティングが転送されているソリューションの摂取の固有の危険を運ぶ。このプロトコルを使用して、ナノリットル ボリュームによってこのリスクを軽減主とプロトコルの支払のすべてのユーザーに予防的に耳を傾けると実務ノートここで議論するをお勧めします。
-
セル後口 micropipetting 装置 (図 3C) を設定、PBS にスクレイプされて持っています。
- 吸引管のゴム栓 (白い側) に引っ張られたガラス管 (unpulled エンド) の厚い端を挿入します。
- タイトなフィット感があること、吸引チューブの他のオープン (赤) の端に 1 mL ピペット チップの狭い端を挿入します。
- 2 mL のピペットを 1 mL ピペット チップの端に開いて、広い吸引の狭い端を挿入、フィット タイトながあることを再確認します。
注:結果として得られるセットアップはキャピラリー チューブ装置のもう一方の端の狭い端から穏やかな吸引力を作成する吸引ピペットの広い、オープン エンドから口ピペットに研究者を許可します。 - 新鮮な純水を含む 100 mm ペトリ皿を使用して最終的な口 micropipetting 装置をテストします。吸引ピペット (ストローで飲み物を飲みながらに似ています) の開放端にわずかな吸引作用がキャピラリー内の液体のレベルを上げるが、脱イオン水に吸引チューブにオーバーフローを引き起こさない。ペトリ皿の位置を調整するのに他の手を使用している間キャピラリー チューブを制御するのに 1 つの手を使用します。
注:口ピペッティング単一 IBC に必要な吸引力は、研究者の間で異なります。ただし、この手法を試みている各研究員が弱い吸引から開始し、毛細血管を流れている液体がない場合、それを徐々 に増やすことをお勧めします。飲料用缶にストローを吸うより大きい力の必要はありません。3.1.4 のステップでテスト中に液体を拾うことに毛細血管が表示されない場合毛細血管や吸引管が妨げられていると交換が必要です。さらには、水を用いた口分注装置の吸引を制御するすべての新しい研究者最初練習に殺菌をお勧めします。なお、研究者の舌を使用して口の分注装置によってとらボリュームのコントロールであります。舌が細かく適用、吸引の強さを調整し同様緊急停止として機能します。 - 液体の正常な吸収を達成した後に、優しく吸引ピペットの開放端に吹くことによって毛細血管からそれを追放する能力をテストします。3.5 段階、IBCs の汚染を防ぐために液体を追放の過程で気泡が作成されないことを確認します。
注:として吸引、遠心管に、IBC を追放する研究者によって適用される肯定的な圧力の強さは変わるでしょう研究者の間で。このプロトコルに新しい研究者は、実践手順 3.1 数日実際感染前にそれをお勧めします。練習の口 micropipetting の 1 つの提案は少量の滅菌水を数滴口ピペット装置を用いた食品色素 (可視化) のための混合を転送する練習です。
- 解剖顕微鏡の下で掻き細胞懸濁液を置き、大きな蛍光凝集体 (図 3A, B) として、IBCs を識別します。倍率の理想的な範囲は、20-40 x です。1 のための PBS の新鮮な管に細かいガラス管末を浸して毛細管を通じて不要なボリュームの取り込みを抑える s。
- 顕微鏡を通して見る、興味の IBC を識別し、ゆっくり、IBC へキャピラリー チューブの開放端をもたらします。2 つ以上のセルの吸引を防ぐため、細胞の大きな集合体離れてを破る各 IBC に近い余分な細胞を一掃するのに微細ガラス管末を使用します。
- 顕微鏡をのぞきながらガラス毛細管に IBC を導くための口 micropipetting 装置の遠端 (吸引ピペット) に非常に小さな吸引力を適用します。
- IBC を拾って後、空の 1.5 mL 遠心チューブにキャピラリーを移動し、遠心分離機管 (図 3D) に液滴と IBC を追放するわずかな肯定的な圧力を適用します。
- 多く IBCs が次の膀胱に進む前に、現在の膀胱から必要に応じてに 3.3 3.6 の手順を繰り返します。吸引ピペットと頻繁、唾のビルドアップを防ぐため毛細血管を変更します。
注意:細菌の菌の伝染 (または臨床) を操作する場合は、キャピラリーのソリューションのレベルを常に監視します。液体が吸引チューブに毛細血管の縁からのオーバーフローの戻のレベルをさせてください。この場合、すぐに別の吸引チューブに切り替えて、アップ前のセットを破棄します。 - 3.2 3.6 すべて収穫した膀胱または実験群の生物試料の十分な数が収集されてまでの手順を繰り返します。
- (省略可能)手順 3.6、3.7 を繰り返しているされて安楽死させすべて実験グループ (またはマウス)、十分な生物試料が各グループから収穫されています。
結果
解剖顕微鏡を介してコレクション管内単一孤立した IBC の存在を確認 (図 3D) から離れては、共焦点顕微鏡による分離の IBC の純度を確認できます。図 4Aのように、隔離されたセルエシェリヒア属大腸菌、uroplakin、染色する必要があります、IBCs (50-120 μ m)17の予想されるサイズです。さらに、大腸菌の染色が周囲の液体に存在しません。当社のデータに基づき、この手法で分離した細胞の 90% 以上は、IBCs18です。分離後存在と IBC の個々 の細菌細胞をコロニー形成単位 (CFU) 列挙 (図 4B) またはゲノム等価物 (量的なポリメラーゼの連鎖反応 (qPCR) を確認できます。図 4C).図 4Cも同じプロトコルで感染していない上皮細胞が細菌の定量化可能な量を持っていないことを示します。これらのデータに基づき、102-103尿路感染症のマウスモデルでは、単一の IBC で CFUs の範囲を推定する.単一の IBC の分離の主な目標の 1 つは RNA シーケンスなど下流解析を行うことです。分離手法が IBCs の分析のための細菌から RNA を取得することができることを確認、実施 (16 s、 cyoB、 ・ frdA) 3 つの遺伝子の定量的逆転写ポリメラーゼ連鎖反応 (qRT PCR) 定量化、個別に分離し、プールされた Ibc (図 4D) の範囲です。図 4に示すようにすべてのデータは、Duraiswamy ら18から許可を適応されています。当社 IBC の隔離のプロトコルの概要図は、図 5Duraiswamy ら18から再現された見ることができます。

図 1: 毛細血管の手を引っ張って狭い開口部を保持します。キャピラリー チューブの手を引っ張ったの (A) 試料がコントラストの黒の背景に表示されます。トップ、unpulled キャピラリー、十分な範囲に引っ張られていない毛細血管に下から単一膀胱上皮細胞収穫用キャピラリーと薄すぎる (およびこうして 2 つの部分に区切られた) に引っ張られた毛細血管が表示されます。15 cm 定規は、スケールの画像の下に配置されます。使用可能なキャピラリーをオフにスナップの推定点図赤い矢印で示されます。(B) 引っ張られた毛細血管 (下) の中空内部の直径を確認する解剖顕微鏡で撮影した画像。Unpulled キャピラリーは上記配置 2 毛細血管の相対的なサイズの相違を示します。スケール バー = 4.0 mm.この図の拡大版を表示するのにはここをクリックしてください。
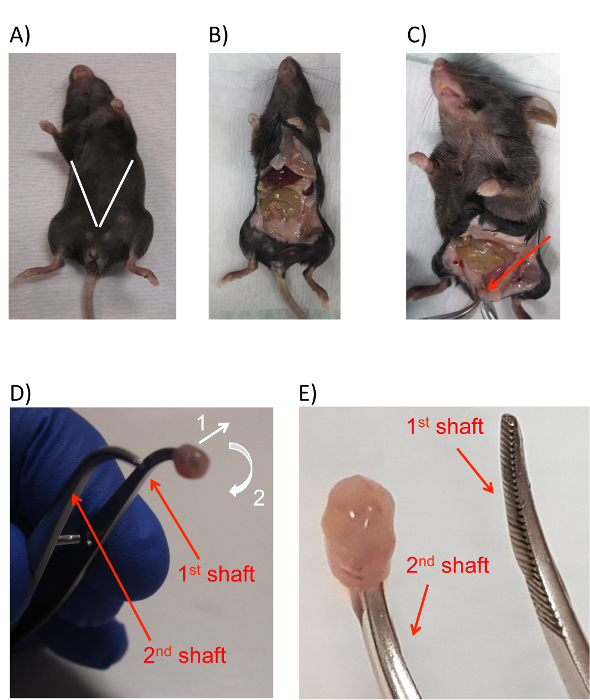
図 2: 膀胱上皮細胞を収穫するマウスの解剖します。(A) 白い線の推定位置を示し、切開の角度に追加でマウスの画像マウス腹腔内と膀胱を公開します。露出画像 (B) マウス腹膜腔の後切開。(C) 露出の画像膀胱 (赤矢印) が脂肪パッドの間から突き出ています。(D) 運動の方向を示す矢印と、内腔に挿入鉗子の先端でマウス膀胱のイメージは、膀胱を反転するのには必要です。若干外側膀胱は最初に引っ張られるし周りと鉗子の最初のシャフトを。両方のアクションの運動の方向は、番号 1 と 2 の白い矢印で示されます。(E) 図は鉗子の 2 つ目のシャフトに挿入する逆の膀胱の最終的な位置を示しています。鉗子のシャフトは、赤い矢印とテキストの両方のパネル D と E で表示されます。この図の拡大版を表示するのにはここをクリックしてください。
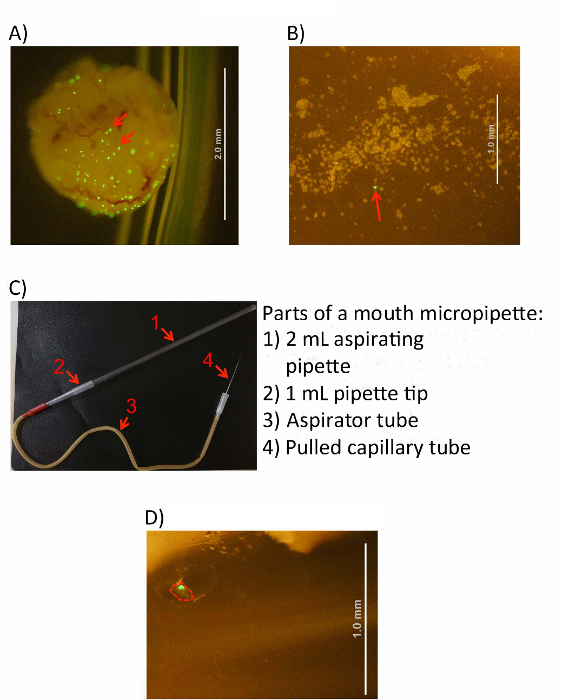
図 3: 膀胱細胞から収穫 IBC 。(A) 細胞をこする前に冷 PBS 溶液で感染し、倒立膀胱。(B) を示す画像盗用膀胱細胞顕微鏡下で見られる。IBCs は、(赤い矢印を参照) 両方の画像で大きな緑蛍光凝集体として識別できます。(C) 完了したイメージの口 micropipetting 装置。吸引ピペット、ピペット チップ、吸引チューブ、およびプル キャピラリー チューブは、右側に示されているように番号付きの矢印で示されます。(D) 単一のイメージは、コレクションの 1.5 mL チューブ (赤で示す) 内 IBC を分離しました。スケール バー (として示される)、A、B、および D のパネルに白い線で表されるこの図の拡大版を表示するのにはここをクリックしてください。
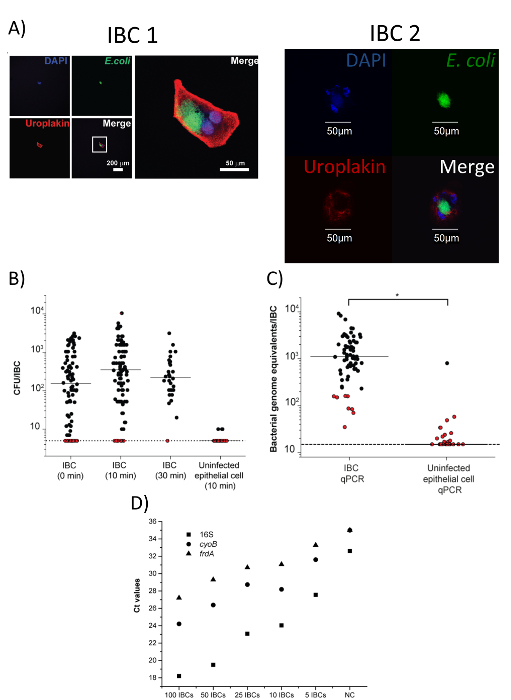
図 4: 収穫 IBCs は純粋であり、下流の分析に使用することができます。この図は、Duraiswamy et al18からの許可と変更されています。(A) 抗 uroplakin と抗大腸菌抗体で染色した 2 つの孤立した GFP 陽性細胞の画像。(IBC 1) の最初のセルは、左 (低倍率) で個々 のチャンネルの画像と高倍率のマージされた画像は右上にあります。(IBC 2) の 2 番目のセルは、結合と個々 のチャンネルの高倍率で表示されます。スケール バーは、とおりです。DNA 4 ', 6-diamidino-2-phenylindole (DAPI) で染色し、青のチャネルで表されます。かに (FITC) に共役し、緑のチャネルで表される二次抗体と抗大腸菌は黒ずんでいます。反 uroplakin は tetramethylrhodamine イソチオ シアン酸 (TRITC) に共役し、赤のチャネルで表される二次抗体と汚れます。(B) 分離 IBCs から細菌 CFUs。IBCs は、すぐに処理されたり、n から分離された個々 の Ibc の 10 または 30 分プール CFU カウント トリトン X 0.1% で培養 = 3 の個別の実験が示されています。検出限界 0.7 ログ10 CFUs/IBC を =。赤い点の検出限界でプロットを示すサンプルの植民地を回復してないです。すべての IBC を含むサンプル有意な差がない (p > 0.05、マンホイットニー検定)感染していない上皮細胞は IBC (10 分) データ (p < 0.001、マンホイットニー検定) と異なっています。0.1% で 10 分インキュベーション後個々 IBCs と感染していない上皮細胞に細菌の (C) qPCR 定量化トリトン X (*、 p < 0.0001、マンホイットニー検定、n = 4)。検出限界 1.18 ログ10細菌ゲノム同等/IBC を =。赤い点線サンプルをコロニーに回復されましたありませんパネル個別に分離し、プールされた Ibc のさまざまな数の 16S rRNA、 cyoB、およびfrdA遺伝子の B. (D) の定量化である (n = 1 実験; 各ポイントを示します 3 技術的複製の意味)。NC = DNA ネガティブ コントロールはありません。この図の拡大版を表示するのにはここをクリックしてください。
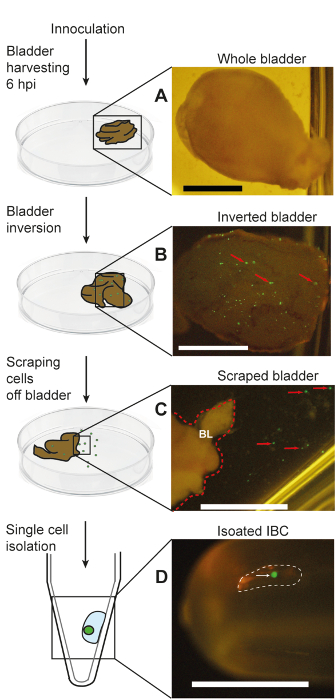
図 5: 回路図と口から micropipetting 経由で Ibc の分離を表す、関連付けられた写真感染マウス膀胱。この図は Duraiswamy ら18から再現します。(A) A 収穫全体の膀胱。(B) 逆全体膀胱 IBCs; を表現する GFP を公開(C) 隣接するバッファーのサスペンションの個々 IBCs を示す掻き膀胱部のクローズ アップ(D) 単一分離管に戻 IBC です。パネル B の赤の矢印は、膀胱の内腔に GFP 陽性 IBCs の例を示します。パネル C の赤い点線を示します ("BL"として示される); 反転膀胱の右側の境界線パネル C の赤矢印は、膀胱表面に塗りつけられた明白なかの個々 の GFP 陽性を上皮細胞を示しています。パネル D の白い点線は、白の矢印によって示されますが、孤立した IBC を含む植物病原菌感染サブ 1 マイクロリットル液滴を示します。スケール バー = 2 mm.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
プロトコルについては尿路感染症のマウスモデルから単一 IBCs を分離できます。このプロトコルは、CFU の培養によって確認することができます実行可能な細胞内細菌を含む IBCs を分離します。可能にする細胞外の細菌による汚染性が少ないと IBCs から細胞内細菌のプロトコル結果は両方の細菌の特徴をさらにし、(図 4C) IBC からセルをホストします。また, 単一 IBC から細菌が qPCR (図 4C) などの下流のアプリケーションで使える他の in vitro 解析プロセス IBCs に私たちの技術が使えることを示唆.5 IBCs から収穫される細菌をプールすることによってさらに示す 3 つの細菌の遺伝子の qRT PCR 分析を実行する当社の能力私たちの孤立した Ibc (図 4D) 中の細菌から質の良い RNA を収穫できることを示唆している.組み合わせることで、示されているデータは、単一 IBCs にゲノム RNA 分析 (RNA シーケンス) などを実行する可能性がありますこの分離方法を使用可能なことを示します。
このプロトコルでした 6 h の時点で IBC 番号黒 6 マウス UTI8927に感染して膀胱のピーク時であるので。さらに、我々 はまた UTI89 で 1 型線毛の表現のレベルを向上させる静的培養システムを使用しています。1 型線毛の表現は、アタッチおよび膀胱上皮細胞28に感染するエシェリヒア属大腸菌のため重要です。ただし、この表現は厳しく規制された29 、30を変更する環境手がかりが知られています。一貫性のある感染症の表現型と IBCs の十分な数を維持するために大腸菌以前に作成してテストしたとき (ハングら8からわずかに変更) 2 x 24 h 静的細菌培養と 6 h 感染時点を使用してをお勧めします。NU14 と UTI8928,29などの緊張。ただし、これらの変数が他の尿路感染症系統またはそれぞれの感染から IBCs の理想的な数を取得する他のマウスの系統で調整する必要があります不可能です。
洪ら8からプロトコルは、雌マウスのみを使用して、雄マウスにおける尿路感染を確立するための他の確立したプロトコルは報告された31をされています。雄マウス膀胱炎はこのモデルで、IBC 経路も続いた。雌雄マウスのぼうこうのサイズに似ているとおり、感染した雄マウスと同様に私たちの IBC の隔離のプロトコルを使えることを期待しています。
このプロトコルで利用される比較的単純な技術も確実にほとんどの実験室で展開できます。このプロトコルで重要な手順の 1 つは興味のセルの種類を選択するための microcapillaries を作成するガラス管の引きです。この手順により作成された、microcapillaries の直径で柔軟、したがってメソッドは複数の異なるターゲット細胞の種類に拡張できます。ただし、これらの毛細血管の作成に固有の変化による注意が必要最終径は、使用可能な範囲にあることを確認します。毛細血管が狭すぎるなら、彼らは興味のセルをピックアップする失敗が、単一の試みで複数のセルを選択ことができる彼らはあまりにも広い作られて場合、。さらに、キャピラリーを引っ張ってのプロセス中に火気の使用は、microcapillaries を作成しようとすると、研究者は、このようなイベントが発生するを防ぐように注意が必要であるので火傷や火災の危険性を運ぶ。変動としてオープンの火災危険を減らすためにこれらの毛細血管を作るに関与する研究者が作る伝統的なマイクロ ピペットの引上げ装置、電気生理学的実験 (例えば、PC 100、ナリシゲ グループ) で使われるものを使用。これらのマシンを作る、毛細血管をプルする重力またはロボットのプラットフォームのいずれかの使用、感染モデルのニーズを満たすためにカスタマイズできます。ただし、利用可能なマシンを引っ張ってマイクロ ピペットの広い範囲は個々 の研究者がこのプロトコルで使用するための適切な最終的な毛細血管径を決定するためにいくつかの試行錯誤を通過する必要があることを意味します。
提示プロトコル蛍光タグを表現する細菌の IBC を視覚的に識別するために使用します。したがって、この手法は、感染微生物を遺伝子変更する研究者の能力によって制限されます。CFT073 や NU14 などの系統の IBC 形成用 UPEC、gfp 発現するプラスミド32,33,34; 正常に変換されています。これらしたがって同じプロトコルで使用する必要があります。マウス膀胱 (70 mm2)35、個々 の上皮細胞 (50-120 μ m)17日の長さおよび単一膀胱16IBCs の周波数の領域に基づいて、IBCs の率の見積もりは 1 で 1,000セル (または 0.1%)。この見積もりは、まれな事象を対象とする当社のセル隔離のプロトコルのユーティリティを展示します。我々 のプロトコルを介してセル選択の精度と径が引っ張ることができる幅広い細胞内細菌感染の他の生体内および生体外モデルを分離するこのプロトコルを使用することができることをお勧めします。確かに、正常に感染した培養膀胱上皮細胞 (データは示されていない) を分離するのにこの技法を使用しました。
膀胱上皮細胞をこするを公開する 1 つ以上のプロトコルの手順を技術的に困難な反転する事です。私たちがあることそれまたこするため腰掛けるに膀胱を切開することが可能。しかしそれを開いてカットのプロセス中に膀胱粘膜上皮細胞へのダメージを軽減する注意が必要理想的にはスプレー膀胱オープン シングル カットを活用すべき。さらに、プロセス中に細胞や膀胱組織の偶発的な損失を防ぐために冷 PBS でカットを作成する必要があります。
口の中は、このプロトコルでは Ibc のピペッティング セルとともに移転ソリューションの最終巻の制限し同様、セル選択プロセスをより細かく制御を提供します。細かい制御と研究者の口からソリューションの大規模な分離、転送ボリューム ナノリットル、1 マイクロリットルの範囲内としても、研究者の安全性を最大化します。対照的に、現代マイクロ ピペットと私たちの経験より周囲液および細胞外腔細菌汚染につながる可能性があります, ibc のセルを転送する傾向があることです。口ピペッティングを提供する高性能他の単一セルの上分離方法私達の見つけることは、他のラボ22,23,24で報告されています。別に単一のセルの分離、口ピペッティングもで使用されています単細胞エレクトロポレーション ニューロン25、さらにユーティリティと訓練を受けた研究者は、技術と達成できる分のコントロールを示します。ただし、安全性が最優先とされる病原体によって取ることができる潜在的な追加措置を提案: (i) 研究者と生物材料、たとえば、吸引を使用して空気バッファーの拡張大きいボリューム (例えば、5 mL)、または (ii) とピペット防壁として機能する吸引ピペットに綿のような物理的なフィルターを追加します。
リスク アセスメントが口のピペッティングはまだ危険すぎる結論につながる場合、市販のロボット設定 (nanoinjections の使用など) と組み合わせて使用できますのより安全な方法を提供するために当社の技術の他のセクション混合集団から感染した細胞を分離します。ロボットのマニピュレーターを用いた経験が IBC の分離は、膀胱上皮細胞サイズの大きな変動は内実験的挑戦的なユーザーの口のピペットと比較して減少率を示していることに注意してください。単一 IBCs をピックアップに必要な力を決定するロボット アーム。それにもかかわらず、これらの疾患の感染性の高いエージェントと作業より高価なしかし、可能なオプションが残っています。
開示事項
著者が明らかに何もありません。
謝辞
この研究は、国立研究財団、総理大臣のオフィス、シンガポール、その NRF 研究フェローシップ制度の下で支えられた (NRF 賞なし。NRF-RF2010-10);シンガポール保健省国立医療研究評議会 (ナノ材研/CIRG/1358/2013);シンガポールのゲノム研究所 (GIS)/科学技術研究庁 (A * 星)。
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL eppendorf tube | For static bacterial culture and OD measurement | ||
| 100% ethanol | For Alcohol Burner | ||
| 15 mL conical tube | For static bacterial culture and OD measurement | ||
| 1 mL Tuberculin Syringe | BD Biosciences | 302100 | |
| 3% Bacterial Agar | For static bacterial culture and OD measurement | ||
| 70% ethanol | For static bacterial culture and OD measurement | ||
| Aesculap anatomic forceps | Braun/Kruuse | BD222R | For initial dissection of mouse (skin, fascia) |
| Alcohol Burner | Wheaton | 237070 | |
| Aspirating pipette | BD Biosciences | 357558 | |
| Aspirator tube | Sigma-Aldrich | A5177 | |
| Bacterial loops | For static bacterial culture and OD measurement | ||
| Benchtop centrifuge | Eppendorf | 5424 | Any centrifuge for 1.5ml eppendorf tubes |
| Conical flasks | For static bacterial culture and OD measurement | ||
| Digital camera for microscope | Olympus | DP71 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Glass Capillaries | Kimax | 6148K07 | |
| Iris Scissors STR SS 110MM | Braun | BC110R | |
| Isoflurane (Isothesia) | Henry Schein Animal Health | 29405 | |
| Kanamycin Sulfate | Calbiochem | 420311 | For static bacterial culture and OD measurement |
| LB broth (Miller) | Thermo/Gibco | 10855021 | For static bacterial culture and OD measurement |
| Light source unit for microscope | Olympus | LG-PS2 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Lubricant | KY | Any similar commercial medical lubricant will suffice | |
| Macro fluorescence microscope | Olympus | MVX10 | For image capture and harvesting of IBCs. Any other fluorescent microscope with a GFP channel will suffice |
| Micropipette + micropipette tips | For static bacterial culture and OD measurement | ||
| PBS 1x | For static bacterial culture and OD measurement | ||
| Pipette controller + Pipettes | For static bacterial culture and OD measurement | ||
| Polyethylene Tubing | BD Intramedic | 427401 | |
| Precision Glide needle 30 G | BD Biosciences | 305107 | Possibly under new catalogue number (305106) |
| Splinter forceps curved | Braun | BD312R | |
| Spray bottle (for ethanol) | For static bacterial culture and OD measurement | ||
| Square cuvettes | Elkay | 127-1010-400 | For static bacterial culture and OD measurement |
| Sterilgard III Advance Safety Cabinet | Baker | SG403 | Any biosafety cabinet with a UV irridiator |
| Sterilin 90mm Standard Petri Dish | Thermo | 101VR20 | Any sterile petri dish |
| Stevens, vascular and tendon scissors, curved, delicate, 110 mm | Braun | OK366R | Recommended for harvesting of bladder |
| Surgical Scissors STR S/B 105MM | Braun | BC320R | |
| Tabletop Centrifuge | Eppendorf | 5810R | Any refridgerated centrifuge for 15ml conicals |
| WPA C08000 cell density meter | Biowave (Biochrom) | 80-3000-45 | For static bacterial culture and OD measurement |
参考文献
- Barber, A. E., Norton, P. J., Spivak, A. M., Mulvey, M. A. Urinary Tract Infections: Current and Emerging Management Strategies. Clinical Infectious Diseases. 57 (5), 719-724 (2013).
- Flores-Mireles, A. L., Walker, J. N., Caparon, M., Hultgren, S. J. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nature Reviews Microbiology. 13, 269-284 (2015).
- Foxman, B. Recurring urinary tract infection: incidence and risk factors. American Journal of Public Health. 80, 331-333 (1990).
- Foxman, B., Barlow, R., D'Arcy, H., Gillespie, B., Sobel, J. D. Urinary tract infection: self-reported incidence and associated costs. Annals of Epidemiology. 10 (8), 509-515 (2000).
- Zowawi, H. M., et al. The emerging threat of multidrug-resistant Gram-negative bacteria in urology. Nature Reviews Urology. 12, 570-584 (2015).
- Silverman, J. A., Schreiber, H. L., Hooton, T. M., Hultgren, S. J. From physiology to pharmacy: developments in the pathogenesis and treatment of recurrent urinary tract infections. Current Urology Reports. 14, 448-456 (2013).
- Sivick, K. E., Mobley, H. L. T. Waging war against uropathogenic Escherichia coli: winning back the urinary tract. Infection and Immunity. 78, 568-585 (2010).
- Hung, C. -S., Dodson, K. W., Hultgren, S. J. A murine model of urinary tract infection. Nature Protocols. 4, 1230-1243 (2009).
- Cusumano, C. K., et al. Treatment and prevention of urinary tract infection with orally active FimH inhibitors. Science Translational Medicine. , (2011).
- Alteri, C. J., Hagan, E. C., Sivick, K. E., Smith, S. N., Mobley, H. L. T. Mucosal Immunization with Iron Receptor Antigens Protects against Urinary Tract Infection. PLoS Pathogens. , (2009).
- Mysorekar, I. U., Hultgren, S. J. Mechanisms of uropathogenic Escherichia coli persistence and eradication from the urinary tract. Proceedings of the National Academy of Sciences of the United States of America. , (2006).
- Hunstad, D. A., Justice, S. S. Intracellular lifestyles and immune evasion strategies of uropathogenic Escherichia coli. Annual Review of Microbiology. 64, 203-221 (2010).
- Rosen, D. A., Hooton, T. M., Stamm, W. E., Humphrey, P. A., Hultgren, S. J. Detection of intracellular bacterial communities in human urinary tract infection. PLoS Medicine. , (2007).
- Robino, L., et al. Detection of intracellular bacterial communities in a child with Escherichia coli recurrent urinary tract infections. Pathogens and Disease. 68 (3), 78-81 (2013).
- Robino, L., et al. Intracellular bacteria in the pathogenesis of Escherichia coli urinary tract infection in children. Clinical Infectious Diseases. 59 (11), 158-164 (2014).
- Schwartz, D. J., Chen, S. L., Hultgren, S. J., Seed, P. C. Population dynamics and niche distribution of uropathogenic Escherichia coli during acute and chronic urinary tract infection. Infection and Immunity. 79, 4250-4259 (2011).
- Keshtkar, A., Keshtkar, A., Lawford, P. Cellular morphological parameters of the human urinary bladder (malignant and normal). International Journal of Experimental Pathology. 88, 185-190 (2007).
- Duraiswamy, S., Chee, J. L. Y., Chen, S., Yang, E., Lees, K., Chen, S. L. Purification of Intracellular Bacterial Communities during Experimental Urinary Tract Infection Reveals an Abundant and Viable Bacterial Reservoir. Infection and Immunity. , (2018).
- Kurimoto, K., Yabuta, Y., Ohinata, Y., Saitou, M. Global single-cell cDNA amplification to provide a template for representative high-density oligonucleotide microarray analysis. Nature Protocols. 2, 739-752 (2007).
- Tang, F., et al. Deterministic and stochastic allele specific gene expression in single mouse blastomeres. PLoS One. , (2011).
- Wells, J. M., Melton, D. A. Early mouse endoderm is patterned by soluble factors from adjacent germ layers. Development. 127, 1563-1572 (2000).
- Guo, H., et al. Profiling DNA methylome landscapes of mammalian cells with single-cell reduced-representation bisulfite sequencing. Nature Protocols. 10 (5), 645-659 (2015).
- Zhao, R., et al. The establishment of clonally derived chicken embryonic fibroblast cell line (CSC) with high transfection efficiency and ability as a feeder cell. Journal of Cellular Biochemistry. , (2018).
- Tang, F., et al. RNA-Seq analysis to capture the transcriptome landscape of a single cell. Nature Protocols. 5 (3), 516-535 (2010).
- Wiegert, J. S., Gee, C. E., Oertner, T. G. Single-Cell Electroporation of Neurons. Cold Spring Harbor Protocols. , (2017).
- Conover, M. S., Flores-Mireles, A. L., Hibbing, M. E., Dodson, K., Hultgren, S. J. Establishment and Characterization of UTI and CAUTI in a Mouse Model. Journal of Visualized Experiments. (100), 52892(2015).
- Justice, S. S., et al. Differentiation and developmental pathways of uropathogenic Escherichia coli in urinary tract pathogenesis. Proceedings of the National Academy of Sciences of the United States of America. 101 (5), 1333-1338 (2004).
- Mulvey, M. A., et al. Induction and Evasion of Host Defenses by Type 1-Piliated Uropathogenic Escherichia coli. Science. 282 (5393), 1494-1497 (1998).
- Zhang, H., Susanto, T. T., Wan, Y., Chen, S. L. Comprehensive mutagenesis of the fimS promoter regulatory switch reveals novel regulation of type 1 pili in uropathogenic Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 113 (15), 4182-4187 (2016).
- Gally, D. L., Bogan, J. A., Eisenstein, B. I., Blomfield, I. C. Environmental regulation of the fim switch controlling type 1 fimbrial phase variation in Escherichia coli K-12: effects of temperature and media. Journal of Bacteriology. 175 (19), 6186-6193 (1993).
- Olson, P. D., Hruska, K. A., Hunstad, D. A. Androgens Enhance Male Urinary Tract Infection Severity in a New Model. Journal of the American Society of Nephrology. 27 (6), 1625-1634 (2016).
- Garofalo, C. K., et al. Escherichia coli from Urine of Female Patients with Urinary Tract Infections Is Competent for Intracellular Bacterial Community Formation. Infection and Immunity. 75 (1), 52-60 (2007).
- Berry, R. E., Klumpp, D. J., Schaeffer, A. J. Urothelial cultures support intracellular bacterial community formation by uropathogenic Escherichia coli. Infection and Immunity. 77 (7), 2762-2772 (2009).
- Holden, N., Totsika, M., Dixon, L., Catherwood, K., Gally, D. L. Regulation of P-fimbrial phase variation frequencies in Escherichia coli CFT073. Infection and Immunity. 75 (7), 3325-3334 (2007).
- Jost, S. P. Postnatal growth of the mouse bladder. Journal of Anatomy. 143, 39-43 (1985).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved