Method Article
緑膿菌自動の高スループット マイクロ流体システムを使用して上のせん断応力のライブ細胞解析
* これらの著者は同等に貢献しました
要約
ここでは、楽器を含め、緑の蛍光蛋白質を表現する緑膿菌バイオ フィルムに対するせん断応力効果の分析のための蛍光顕微鏡と相まって高いスループット マイクロ バイオリアクターの使用について述べるバイオ フィルムのカバレッジ、成長率および形態的特性の測定を設定します。
要約
蛍光顕微鏡と相まってバイオリアクター体外より高いスループット マイクロは細菌のバイオ フィルムの成長と形態、緑膿菌(P. aeruginosa) などを研究に使用されています。ここでは、システムを使用して成長カイネティクスと表面粗さと膿ひずみ強化された緑色蛍光タンパク質 (PA01 EGFP を表す PA01 のテクスチャ エントロピーなど形態学的性質を検討する方法について述べます).詳しいプロトコルは成長し、PA01 EGFP 文化をシードする方法を記述する、設定する方法顕微鏡と自動実行と成長率とせん断力によって制御されるさまざまな使用形態の特性を決定する画像解析を行う、マイクロ流体デバイス。この記事では、最終的に、マイクロ流体プラットフォームを使用して細菌、菌類や藻類のバイオ フィルムの他の系統へ適用できる PA01 EGFP バイオ フィルムの研究を改善する技術の詳細な説明を与えます。
概要
ここでは、デモンストレーションを蛍光の形成に及ぼすせん断応力の測定方法マイクロ流体高スループット自動化されたシステムを使用して緑膿菌(P. aeruginosa) PA01 バイオ フィルム。
バイオ フィルム主催、サポートにアタッチされており、液体と固体の表面1間のインターフェイスでは、通常発見する細胞外高分子物質、細菌などの微生物のコミュニティであります。これらのバイオ フィルムのコミュニティは、水質改善水の供給ラインおよびバイオレメディエーション難分解性化合物2,3など、環境に有益なことができます。ただし、バイオ フィルムは、高い望ましくない結果と人間の健康に有害なことができます。たとえば、股関節および膝関節インプラントなどの医療機器、バイオ フィルム蓄積の挑戦されている重度医療の合併症4,5を引き起こす表面の一種です。バイオ フィルムは川や湖などの自然の水システムを入力し、感染6,7,8で飲料水の細菌汚染につながる水道管に侵入できます。海洋環境で形成されたバイオ フィルムは船や他の人工基質に付着し、高められた摩擦増加燃料消費9,10につながる主要な経済と環境の問題を提示します。抗菌コーティング、トリブチルスズなどこれらの問題を防ぐために開発されているが、海洋生物11に有毒であります。
膿は、さまざまな環境および nutrimental 条件12の高の盛んな機能を持つグラム陰性菌です。膿はコミュニティと院内感染の一般的な原因し、密接にするに関連付けられている重度のやけどや易感染宿主などの怪我など、嚢胞性線維症 (CF)5,12、発見 13、エイズおよび癌患者5,13。P. 緑膿菌バイオ フィルムの形成は、最も深刻な慢性肺感染症がこの病気の5のための死の主要な原因を CF に接続されています。
膿PA01、参照株はこのレポートで使用され、強化された緑色蛍光タンパク質 (PA EGFP) を表現する遺伝子組み換えです。EGFP は蛍光顕微鏡14,15,16を用いたバイオ フィルム解析その場を可能にする大きい蛍光特性と GFP の変異フォームを表します。このタイプの蛍光分析は、細胞の成長と機能17GFP が大幅に干渉しないためにバイオ フィルムの調査のため便利です。たとえば、GFP をタグ付けされたエシェリヒア属大腸菌細胞制御細菌17と比較して任意の毒性の影響を被ったなしも継続的で成長。他のレポートは、この請求項18,19,20を立証します。なお、EGFP など蛍光レポーターの使用は迅速かつ簡単なしかし、死んだ細胞はすぐに21の蛍光を発するすることをやめるためにのみ生きているセルが測定されます。
バイオ フィルムは、流量が異なるとのそれらを含む様々 な環境条件下で育てることができます。たとえば、映画は河川、高水分の流れが大きい微生物多様性22につながるよう高剪断応力で育てることが。これに反して、池や口腔バイオ フィルムの淀んだ水は、大いに低いせん断力23を経験します。流量、に加えてバイオ フィルム接着、表面粗さ、疎水性、メディアの構成などに影響を与えるその他の要因があるし、細菌も細胞表面1,4,7, 24. 条件空間構造やバイオ フィルムの形態の変化を引き起こす可能性がも。これは流体によって加えられるせん断応力などの環境条件が含まれていますまたはシステム、細胞の運動性と特定の蛋白質が、細胞外に存在に存在する栄養アベイラビリティと種など生物学的要因でグラデーション高分子物質25,26,27。いくつかの条件の下で、バイオ フィルムになる芝生のようなバイオ フィルムが大まかな、ふわふわ、あるいはキノコのような28の他の条件の下で (滑らかでフラット), しばらくの間。体系的かつ定量的な顕微鏡画像でバイオ フィルムの芝生とマッシュルーム構造の質的な違いが明確に見られる、膜構造と映画内で生物学的過程との関係を理解することが必要です。形態を記述するための方法。気孔率、フラクタル次元、拡散長下地、コロニーのボリューム、粗度係数、およびテクスチャ エントロピー29,30 のコロニー領域などの研究のための研究者によって提案された形態の特性.
バイオリアクターは、現実の生活条件31を模倣するバイオ フィルムの研究に使用されます。点滴流反応器 (DFR) は、メディアの栄養素が高い細胞密度32バイオ フィルムを形成するため時間の経過とともに表面に添付のセルにゆっくり流れる低剪断環境を表します。CDC 原子炉、バイオリアクター メディア内で回転が継続的に攪拌棒の制御による高せん断応力流体環境を作成する満ちているタンク33。バイオリアクターのこれらのタイプは、設定が簡単ですが比較的低いサンプル サイズ、メディア、メディア滴り流れ 125 μ L/分ドリップ フロー炉に至るからバイオハザード廃棄物の大量の高消費電力のためスコープ内に制限されます。以上 1 mL/分 CDC 原子炉のガラス製品や廃棄物のメディアのための34のオートクレーブ大量に必要。バイオ フィルムは点滴フロー炉の表面を横切ってメディアの低剪断を引き起こすため緑膿菌大型コングロマリットを引きずって、バイオ フィルムの成長は非常に滑らかではありません、不均一なサンプルをすることはできませんので均等に成長しません。蛍光顕微鏡35,36を使用して分析します。
いくつかの一般的なバイオリアクターの制限事項は、マイクロ流体媒体スループット バイオリアクター、メディアのミリリットルのみは必須で、オートクレーブ37後リアクション プレートが小さく、容易に使い捨てを使用によって克服します。さらに、実行すると、意味のある統計解析を行うデータの十分な量を提供するちょうど 1 つの原子炉で、井戸の数、に応じて多くのレプリケーションを実行できます。図 1に温度を含む制御の条件およびフロー率3839,40,,マイクロ顕微鏡システムのさまざまなコンポーネントが表示されます。バイオリアクター下 PA01 に EGFP タグの蛍光性を可視化する蛍光顕微鏡低環境または生物医学分野が発生したより現実的なシナリオを模した高剪断条件によって適用された結合されます。
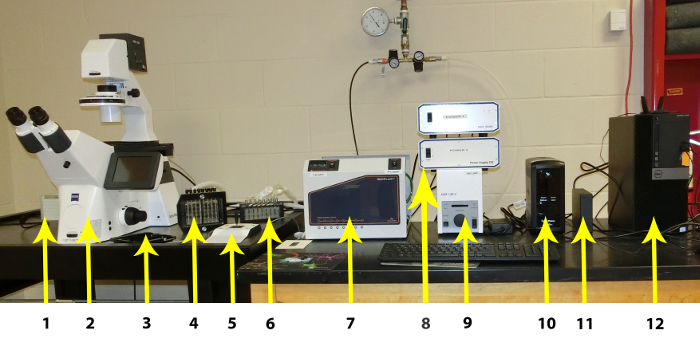
図 1: マイクロ流体システムの個々 のコンポーネントです。個々 のコンポーネントが左から右に表示されます: 1 CCD カメラ 2。 自動ステージ、自動蛍光モジュール、およびオート フォーカス モジュール、3 と高解像度倒立顕微鏡。 プレート ステージ、4: イメージング システム インターフェイス、5: マニュアル顕微鏡ステージ。コントロール、6: 蒸気トラップ、7: イメージング システム コント ローラー (含む温度コント ローラー)、8: ハードウェア コント ローラー、9: 蛍光コント ローラー、10: 無停電電源装置、11: 12 画像ストレージ外付けハード ドライブ: PC ワークステーション。この図の拡大版を表示するのにはここをクリックしてください。
マイクロ プレートの抜粋を図 2に示します。最も一般的に使用される板は 48 井戸から成っています。1 つの実験では、1 つの入口と一つの出口の井戸、2 井戸の合計を必要があります。これにより細菌の緊張など、さまざまな実験条件で実行できる 24 の同時の実験抗菌処理とメディア様々 なチャンネルからチャンネルへと六つのチャネルの各列のせん断流れを制御できます。実験の温度も、プレート全体で 1 つの温度設定で制御されます。マイクロ流路は、各チャンネルが十分な背圧と制御を提供する蛇紋岩地域であることを示します。
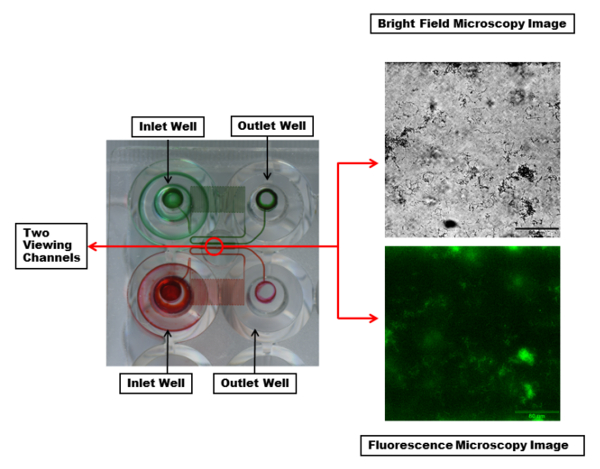
図 2:マイクロ チャンネルと表示ウィンドウの可視化します。それらを接続するマイクロ チャンネルの 2 つの入口と出口の井戸は、赤と緑の染料で強調表示されます。染料は、流体の流れの中に十分な背圧制御を作成する各チャンネルでの蛇紋岩地域を表示にします。(赤円内) 各表示チャンネルご希望の波長とイメージを作成することができます。例は、明るいフィールド (上) と (下) 蛍光顕微鏡 20 × 対物を用いた PA01 EGFP バイオ フィルムの単一チャネルの画像。スケール バー = 80 μ m.この図の拡大版を表示するのにはここをクリックしてください。
ステップバイ ステップ ガイドは、異なるせん断環境を使用して新規バイオ実験を行うための蛍光顕微鏡と結合されているマイクロ バイオリアクターのユーザーを許可するように提供しています。このメソッドは、細菌、菌類、藻類、医療と環境のアプリケーション41,42,43などのほかに他の微生物を含む実験の拡大のためになります。詳細なアプローチは PA01 EGFP を文化し 48 ウェル プレートに接種、マイクロ流体デバイスとソフトウェアを設定、蛍光顕微鏡を設定し、バイオ フィルムのカバレッジ、成長率を取得するソフトウェアの分析を示す方法を説明しますと表面粗さなどの形態学的プロパティ。
プロトコル
1. メディアの準備
- 最小媒体 (MM) 0.25% グルコースを準備します。0.25% グルコースと行うと MM の 1 L、1 L の最終巻で水 (dH2O) に 200 mL 滅菌 M9 塩溶液、滅菌 1 M MgSO4の 2 mL、100 μ L 滅菌 1 M CaCl2の滅菌 20% (w/v) グルコースの 12.5 mL を追加します。
- 生殖不能の技術を使用して滅菌ボトルに必要なメディアを転送します。使用されているチャンネル数に応じて必要な量を準備します。通常、各チャンネルでは、プライミング、24 時間実験のため播種と 1300 μ L を 300 μ L の 200 μ L が必要です。
- 実験的な温度ではインキュベーターや水風呂にボトルを置きます。メディアは、マイクロ流路内の気泡を避けるために使用する前に実験温度にする必要があります。
2. PA01 EGFP の一晩で実験的文化の準備。
- 滅菌 sidearm フラスコ実験的メディアの 15 mL を置き、PA01 EGFP まじり寒天プレートから 1 つまたは 2 つの植民地で接種します。37 ° C で 180-220 rpm/インキュベーター シェーカー テーブルに 12-16 h の文化を展開します。
- 一晩かけて培養の OD600を測定します。外径600が 0.80 より大きい場合は、希釈 0.8 マイクロ チャンネルをシードに必要になるまでの 37 ° C で新鮮な mm プレース インキュベーターや水浴の実験的文化を使用して最終的な OD に一晩かけて培養します。なく大幅な変更がターゲットから外径 φ600、0.8 この場合ように播種する前にすぐに OD600をもう一度チェックしてください。
3. 機器起動
- ユーザー ガイドは、図 1の設定と同様によるとシステム ステーションをセットアップします。ソフトウェア計測器の接続にエラーを避けるためには、次の順序で計測器をオンに。
PC ワークステーション
蛍光モジュール。蛍光シャッター (シャッター ボタンによって青色光) のあることを確認します。
ハードウェア コント ローラー
イメージング システム コント ローラー (材料の表を参照)
CCD カメラ
イメージング ステーション (顕微鏡)
注意: 加熱面の温度は目的実験温度に調整する必要があります。 - コントロール アプリケーションを起動し、プレート側にラベルにナンバー プレートの番号を入力します。
注: コントロール アプリケーション起動後がある顕微鏡/イメージング ソフトウェアを制御するソフトウェア用とポンプともプレート境界を制御する制御モジュールの 2 つの別々 のアプリケーション ウィンドウ。これは、図の S1、「マルチ次元取得」メニューが上に開いて、コントロール モジュール下部に自動実行の設定に表示されます。
4. プライミングおよびマイクロ プレートに播種
注: プライミング、播種、細菌の付着・増殖は図 3に示します。
- プレートの下部にガラスの表面には触れないようにして包装から 48 ウェル マイクロ プレートを取り外します。レンズの組織、けばのない布または低リント ワイプもプレートの下部にスライド ガラスをクリーニングします。
- マイクロ流路を首相ピペット 37 ° c MM 200 μ L 出力にも、泡を避けるために注意しています。プレート ステージにプレートを置き、エタノール、プレート ステージ上に密閉する前に乾燥することができますインターフェイスを拭いてください。
- 制御モジュールのマニュアル モードで 5.00 ダイン/cm2で 37 ° C および最大せん断で LB として流体を設定します。プライミング チャンネル出力井戸も、出力から入力へのフローを有効にするをクリックします。プライミング 5 分後に、播種の準備への流れを一時停止します。慎重にステージからプレートを削除し、ピペットの残留メディア出力がないマイクロ流路につながるインナー サークルからメディアのいずれかを削除するから。
- 実験的チャンネルをシードするには、最初よく細菌文化の 300 μ L 分注も出力にも出力に続いて入力に MM の 300 μ L をピペットします。プレート上に配置する前にインターフェイスを拭くようにしてプレート ステージにプレートを配置します。
- 制御モジュールの顕微鏡ステージ プレート ステージを配置した後のライブカメラを使用して 1 つのチャネルに焦点を当てます。ライブ フィードによって視覚的に監視している間 1.00 2.00 ダイン/cm2細胞実験水路を入力するを許可するように約 2-4 s の蛇紋岩のチャンネルではなく、フローを再開します。温度制御を可能にする細胞接着 1 h 壇上プレートを残してください。1 時間孵化の間には、制御モジュールとモンタージュのソフトウェアを自動実行 (手順 5) を設定できます。
メモ: シード処理に必要な時間の量、によって異なりますメディア生物、ライブフィードを最適化し、大まかな時間枠として使用によって密接に監視する必要がありますように。プレート全体でシードは完全なシードのチャンネルの特定の列に適用された流れの時間しなければならなくなるを異なる場合があります。 - 添付ファイル期間後優しく段階からプレートを削除し、出力チャネルの妨害を回避最初から細菌をピペットします。新しいピペット チップと入力の井戸からメディアを削除します。
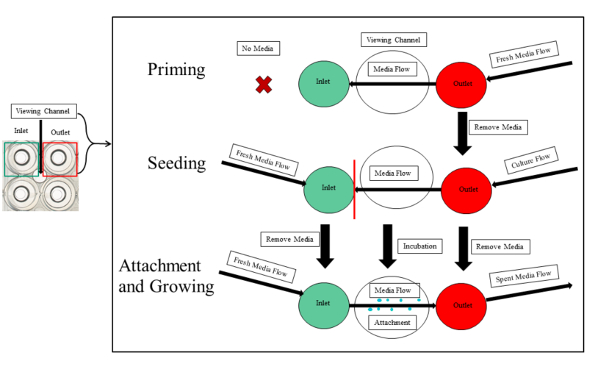
図 3: 実験概要プライミング、播種、マイクロ流路の PA01 EGFP の添付ファイルと。プライミング、シード、および添付ファイルの通りです。プライミングの最初のステップには、出力に導入された新鮮なメディアが必要です。シードが伴います入力におけるメディアと細菌文化のボリュームを等しいし、井戸をそれぞれ出力します。文化は、蛇紋岩のチャンネルを目詰まりを避けるために実験水路 (赤線) の表示セグメントを渡さないでください。潜伏期間が終わった後新鮮なメディア連続入力に流れるから、閲覧室に、コンセントに。これは、添付ファイルおよび細菌のバイオ フィルムの成長を開始します。この図の拡大版を表示するのにはここをクリックしてください。
5. ソフトウェアの設定
- ソフトウェアで、顕微鏡画像集録を制御する「複数次元買収」を開きます。「メイン」メニューの下には、「タイムラプス」、「複数ステージ位置」、「複数の波長」(図 S1A) を選択します。
- 保存設定を設定、簡単な作成基本名、増分ベース名ファイルが存在する場合は、チェックされているかどうかを確かめます。すべてのファイルを保存するフォルダーを選択するディレクトリの選択]をクリックします。実験の本質的な詳細を説明に含めます。
- タイムラプス] タブで、[24 時間実験の時間の期間を調整します。画像を取得する頻度を制御する、画像取得実験中 5 分ごと、時間間隔を設定します。時間ポイントの数は、設定されているパラメーターを自動的に調整します。
- 正しい配置とフォーカスを可能にする、明るいフィールド顕微鏡でライブカメラを使用してステージの位置を設定します。プレートに刻まれているチャネル番号の上下にあるチャネルの中心に焦点を当てる対物レンズ 10 倍を始まります。最適な表示エリア、チャネル内で焦点面を見つけること、20 × 対物に切り替えます。位置をリストに追加または新しい設定とプリセット チャンネル位置を置き換えます。
- 波長のメニューの下の波長数を 3 に設定します。波長 1 (W1)、10 ms の露光時間で FITC 100% カムを選択します。2 (W2)、波長選択フィルターをすべてクローズとして設定波長 3 (W3) 3 さんの最小限の露出時間と明視野 50% カム 50 %vi のだから光に残る集録時間の間最後のチャネル。
- 制御モジュールを設定する場合は、マニュアルを実行が停止されていることを確認を確認します。
- [プロトコルの設定] タブで自動実行の編集メニューで 24 h 目的の剪断速度で順方向に流れる時間のための新しいプロトコルを設定します。剪断速度が剪断速度でのバイオ フィルムの成長の影響を研究する変化します。名前を付けて保存、プロトコルの追加とをクリックします。
- 順序の設定タブの下には、すべてのチャンネルの流体を既定としてLB@37degreesを選択することによって新しいシーケンスを作成します。ステップ イテレーション1、チャンネル 1-12 の下ですべてのチャンネル希望せん断速度と有効にするプロトコルを選択します。チャンネル 13-24、第 2 希望のせん断速度と有効にするプロトコルのすべてのチャネルを選択します。[適用] と [名前付けて保存シーケンス。
- 自動実行メニューの自動実行に使用される保存されたシーケンスを選択します。
6. バイオ フィルムの成長実験セットアップのタイムアウト
- ピペット滅菌 mm 1,300 μ L の最大のマイクロ プレートの入力に。プレートのステージに戻ってプレートを置き、エタノール、プレートをシールする前に、完全に乾燥し、エタノールを許可するインターフェイスを拭いてください。
- 顕微鏡ステージ上にステージ プレートを配置し、ことを確認、プロトコル、シーケンスが正しく設定されています。直後、顕微鏡画像のコレクションを開始する取得をクリックして自動実行を開始する開始を選択します。
- フォーカスと学識を備えた画像間のすべてのステージ位置の配置を調整します。一時停止を選択し移動する各ステージの位置を表示する明視野波長でライブ イメージ モードを使用して、選択します。新しい設定を設定するには、現在の設定を選択します。次の取得予定時間の前に再開をクリックします。
7. 確認し、タイミングのバイオ フィルムの成長実験後像を分析
- 各チャンネルの 24 h、次を確認するには、自動実行、ソフトウェアで、多次元のデータを確認、分析ツールの下にあるを開きます。基本ファイルを選択をクリックして |ディレクトリを選択興味の実験の画像シーケンスを含むフォルダーに移動します。表示されるフォルダー内のデータ セットの一覧で、目的のデータの基本名を選択します。
- 関心のあるデータを選択すると、このデータを確認するビューをクリックします。波長ウィンドウ (図 S2) の下でそのデータを確認する波長を選択します。
- ステージ位置の下のチャネル番号を選択し 289 時間のデータを分析するビデオ コントロールを使用して各チャンネルのイメージ シーケンス ポイントの (と仮定すると、画像は、24 時間の時間枠で 5 分ごとが取得されます) を確認します。使用可能な成長データの注意してください。
注: 各チャンネルは、空気の泡やデータに影響を与えず、チャネル内でバイオ フィルムの成長を妨げる下駄の開発を探します。ただし、これらの後にこのような状況の前に実行、データ発生する場合があります役に立つ。 - 見直しと分析に必要なデータを選択し後の各チャンネルの画像のスタックを作成します。ファイル] メニューの [開いている特別なを選択 |スタックを構築 |名前の番号です。ビルドのスタックウィンドウで最初の画像を選択] ボタンを選択し、ファイル フォルダーのスタックの最初の画像を選択最後の画像を選択] ボタンを選択し、最後に対応するスタック内の画像ファイルを選択します。年代順にチャネルのすべての画像をスタックを開くには[ok]をクリックします。スタックは、[ファイル] メニューの [名前を付けて保存の tiff ファイルとして保存できます。
注: は、親指のイメージとスタックを作成しないでください。これらのファイルは、非常に有用ではないと、ハード ドライブ上の部屋を保存する削除することができます。また、イメージ ファイルが次のよう。
基本 NAME_WAVELENGTH_sCHANNEL #_tIMAGE #。
たとえば、07062018_W1FITC 100_s12_t112 はチャネル 12、時点 112、基本名「07062018」を持つ最初の波長 FITC 100% のカメラのデータのイメージ。 - 最後に、tiff スタックとしてシーケンスを保存するファイルのドロップ ダウン メニューから名前を付けて保存を選択します。スタック オーバーレイし、ムービーとして保存できます。これは、手順 9 で扱われます。
- % の表面被覆率を定量化する前に画像の距離を調整します。[分析ツール] には、距離の調整をクリックします。適切な校正測定を選択し、開いているすべての画像に適用] をクリックします。
- スタックは、シーケンスの最初のイメージでは、しきい値] ボタンをクリックします。明視野でのしきい値しきい値に暗いオブジェクトの自動しきい値と蛍光信号 (FITC 波長) の光オブジェクトの自動しきい値を使用します。画像の範囲を表すカバレッジにしきい値を調整します。
- 蛍光のしきい値、バック グラウンド信号と信号測定を確保するため細胞はこれらの非蛍光性を含むチャンネルに信号を除外する最小しきい値検出セットを確立する非蛍光性細胞とチャネルを活用します。蛍光部を過大評価しません。これは、異なるかもしれない実行する非蛍光性のコントロール チャンネルより多くでない場合、少なくとも 1 つを使用することをお勧めです。
- 明視野のしきい値として、すべてのセルは、オレンジ色のしきい値署名によってカバーされていない場合、は、スライド ツールバーまたはしきい値画像([分析ツールが見つかりません) を使用するすべてのセルが最大しきい値値を調整します。覆われているが、任意の背景は除外。
注: スタック内のすべての画像とすべてのチャンネルこれらのしきい値理想的に使用すると、1 つの画像/チャネルの選択のしきい値適さない場合があります。 その他の画像のチャンネル、したがってユーザーがしきい値の範囲を調整する必要があります。定期的に。このため、それは常に最大値を記録しておくと使用される最小しきい値値データの後で検討する必要があります。
- [分析ツール]、範囲を定量化するには、地域統計を表示をクリックします。しきい値を使用するがチェックし、イメージ全体が選択されていることを確認し、得られたデータの下で目的の測定/設定が選択されていることを確認します (のしきい値] 領域、平均、標準偏差、min、max、および % のしきい値エリア)。ログを開く]をクリックして、DDE ファイルが[ok]をクリックする前に選択されていることを確認します。Microsoft Excelを選択し、 [ok]をクリックします。スプレッドシートを開き、[ログ データを自動的に分析するイメージの測定を記録します。
- 同じシートを使用して、単一のスタックのすべてのイメージ分析データを収集このスプレッドシートを開いたまま。スタック 4 番目のイメージとしきい値を最適な設定に移動します。地域の統計の表示画面でログ データをクリックし、スプレッドシートに値が記録されます。この画像の解析には 15 分毎に繰り返します。
8 バイオ フィルム形態組曲その他の分析を含む形態と表面カバレッジ メジャーを使用して Python スクリプト
- アナコンダ、https://www.anaconda.com/download で利用できるなど標準的な科学的な Python 配布を使用して、標準的な科学的なモジュールを含む Python 3.6 のディストリビューションをインストールします。
- Https://github.com/cdwentworth/Biofilm-Morphology-Suite.git に移動して、ブラウザーで GitHub からバイオ フィルムの形態のスイートを取得、複製またはダウンロード(緑のボタン) を選択し、 Zip ダウンロードを選択します。ファイルを解凍し、コード フォルダーを作業ディレクトリに移動します。
- 「カバレッジ」フォルダー画像スタックをコピーしてパーセントどちらられるカバレッジを測定します。ターミナル ウィンドウを使用して、そのフォルダーに移動し、コマンドでスクリプトを実行するには
python bfCoverage.py tiffStackName.tif
tiffStackName.tifが画像の tiff スタックを含むファイルの名前をコマンド ライン インターフェイス。時間の関数を名前で作成されますと名前tiffStackName.txtとカバレッジのプロットとグラフィックス ファイル各時点でカバレッジの測定を含むテキスト ファイルが作成されますtiffStackName.png. - 他の形態学的特性の測定を 8.3 の手順で指定された同じプロシージャを使用: バイオ フィルムの蓄積、粗度係数、およびテクスチャ エントロピー。テクスチャのエントロピー測定蓄積測定用 bfAcc.py スクリプト、粗度係数測定のための roughCoef.py スクリプトおよび TEvsTime.py スクリプトを使用します。
9. 他のソフトウェア アプリケーション - オーバーレイと映画
- 複数の波長を使用している場合は、これらの波長を含むオーバーレイ スタックを作成します。関心のすべてのスタックを開き、7.6 のステップで距離を調整します。
- [分析ツール] には、オーバーレイ イメージを選択します。興味のスタックとして、ソースを設定します。FITC スタックで虹の輪をクリックし、この波長を強調するために追加する緑のカラー フィルターを選択します。
- バルを使用すると、画像で明らかに FITC スタックされるようにオーバーレイを調整できます。すべての調整が完了したら、両方のスタックのすべての平面を選択、適用をクリックします。7.5 の手順で説明したスタック、または 9.2 の手順に従ってムービーとして同じ方法でオーバーレイを保存します。
- スタックまたはオーバーレイMM 標準およびスタックの下のタイムラプス ムービーとして保存するには、ムービーの作成をクリックします。スタックまたはが必要なオーバーレイとしてソースを選択します。保存をクリックし、70-80 の間質とMicrosoft ビデオ 1として保存します。
結果
図 4示しますパーセントどちらられるエリア時間をかけて 0.2、0.5、および 1.0 のダイン/cm2のせん断流れで実行 24 h から。バイオ フィルム カバレッジまたはパーセントしきい値表面積 (C [%]) はすべての 3 つの耐震設定違っていた。バイオ フィルム報道だった 1.0 ダイン/cm2せん断で最速 100 2-5% から増加したしきい値] 領域の成長の 200 分後 %400 分後静止した段階に達したと。0.5 ダイン/cm2、バイオ フィルム取材が遅れたし、400 分の 800 分後 100% の範囲に達し増加し始めた。0.2 ダイン/cm2で最も低いせん断パーセント適用範囲が 500 分増加し始め、65% のしきい値領域を越えて達したことはなかったバイオ フィルム取材で最も遅い増加が明らかになった。せん断は、バイオ フィルム表面被覆率に直接影響を与えたと推察されました。高いせん断メディアが提供したより多くの栄養素を持つ細菌バイオ フィルムより速く増殖できるという事実のために、バイオ フィルムの成長のより最適な状態となるように見えた。
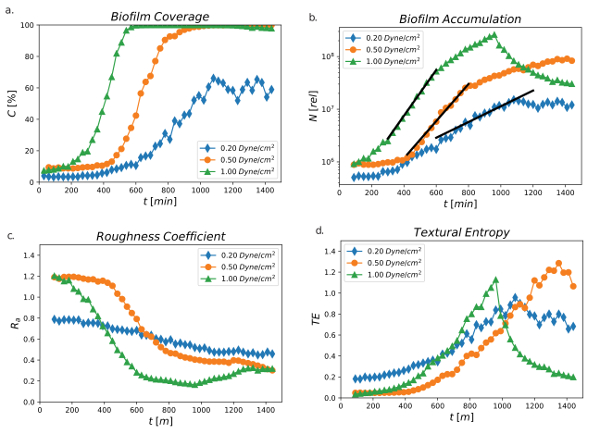
図 4: 期間 24 h 以上 0.2、0.5、および 1.0 のダイン/cm の2を使用して時間をかけて) パーセントしきい値領域 (C [%]) をパーセントしきい値] 領域、合計バイオ蓄積、粗度係数、およびテクスチャ エントロピー。 。せん断条件ごとに 1 つのチャネルから取得したデータ。b) 期間 24 h 以上 0.2、0.5、および 1.0 のダイン/cm の2を使用して時間の関数としてバイオ フィルム蓄積 (相対値) の合計します。黒い線は指数関数モデルに最小二乗フィットです。せん断条件ごとに 1 つのチャネルから取得したデータ。PA01 EGFP の c) 粗度係数 0.2、0.5、および 1.0 のダイン/cm のせん断応力値を使用して2以上 24 時間データを監視は、せん断条件ごとに 1 つのチャネルから得られました。PA01 EGFP の d) テクスチャ エントロピー 0.2、0.5、および 1.0 のダイン/cm2.のせん断応力値を使用してせん断条件ごとに 1 つのチャネルから取得したデータ (Valquier ・ フリン、h.、Sutlief、アダムローリー、ウェントワース、C.D.、2018)。この図の拡大版を表示するのにはここをクリックしてください。
図 4b 図 4で示されている結果と一致。バイオ フィルムの蓄積 (N[rel]) は、イメージの時点で GFP シグナルはその位置にある生細胞密度に比例したという前提に基づいて測定しました。合計相対測定バイオ フィルム蓄積増加期間、24 h 以上 0.2、0.5、および 1.0 のダイン/cm2の使用時間の関数として、最低のせん断応力をせん断応力の最大値から減少した成長率を示します。量的成長率を計算できる指数関数的成長を与える明確な期間があります。
図 4cは、0.2、0.5、および 1.0 のダイン/cm2のせん断流れの粗度係数 (Rを) を示します。粗、粗度係数によって量を示されるフィルムの厚さプロファイルの差異を計測します。正式な定義は、します。
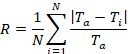
平均厚さは、 Tは私がある私-th 厚さ測定、 T、 N厚み測定30数。この調査で説明されている手順は、生きている細胞に関連した厚みを測定します。セルのフラット配置の厚さは平均値からの変動が大きいが 1 より大きい粗度係数をもたらすながらゼロの粗度係数が得られます。成長率とフィルムのパーセントしきい値カバレッジのせん断の影響と同様に、バイオ フィルムは、時間の経過とともに異なる地形を展示しました。全体的にみて、R、減少したすべてのサーフェスが滑らかになってきたことを示すすべての剪断条件の期間。ただし、0.2 ダイン/cm の低い剪断と比較して 0.5 と 1.0 ダイン/cm2の高耐震設定の高速剪断流れがスムーズかつよりも表面との最も高いせん断力を寄与していることを示す時間の経過とともに表面がなめらかで結果1.0 ダイン/cm2 0.2 Rを下に達する。
滑らかさ、規則性、または表面の粗さは、テクスチャのエントロピー (TE) で表すこともできます。TE は、2次元画像のランダム性の度合いを測定する画像解析で使用されるプロパティです。その計算が Haralickらによって定義された灰色レベル共起行列に基づきます。、別場所44ピクセル値を持つ 1 つの場所でピクセル値を相関するかどうかを見ています。相関関係の高度は、低エントロピーに します。図 4dは、0.2、0.5、および 1.0 のダイン/cm2のせん断流れで TE を示しています。TE は、すべて耐震条件が 1.0 ダイン/cm 最大テ (1.0) 900 分で低いせん断応力よりも以前に達した最高の剪断応力のための時間で増加。0.2 ダイン/cm2の最低のせん断強度は、1,000 分後に最大値に達し低 TE (0.8) を持っていた。ただし、0.5 ダイン/cm2の中間のせん断応力高または低擅断応力状態よりもずっと後の最大のテ (1.2) に達した。
粗度係数と TE は、さまざまな機能を測定します。フラット フィルム低粗度係数と低エントロピーを持っているだろう、厚さの大幅な変化とフィルム高粗度係数を持っていると思いますが低エントロピー変化は正弦波ではなく、ランダムな場合。この場合、R、減少増加剪断応力および時間と剪断応力が時間の経過とともにバイオ フィルム形成に適用される直接テ傾向を関連付けることができません。
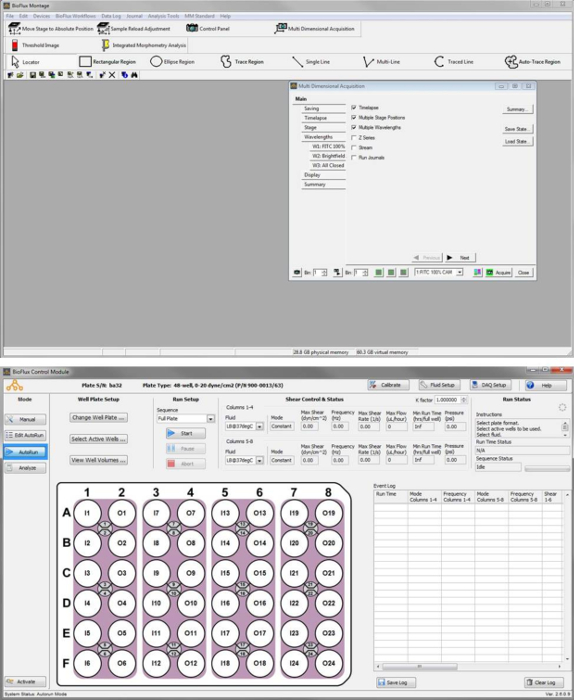
図 S1: イメージ コントロール ソフトウェア windows のキャプチャします。マルチ次元取得メニューのソフトウェアには、(上) が開きます。制御モジュールは、自動実行 (下) に設定します。この図の拡大版を表示するのにはここをクリックしてください。
図 S2画像データを確認するためのソフトウェアのキャプチャします。分析ツールメニューからレビュー多次元データツールを使用して目的のデータ セットを選択した後アプリケーション ウィンドウ。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
マイクロ流体システムと画像解析の手順は共焦点から通常のフル三次元情報を必要としない形態の特性を決定するためのマイクロ流体バイオ実験の実行に焦点を当ててここで説明顕微鏡的研究。これらには、コロニー下地カバレッジ (パーセント適用範囲)、粗度係数、およびテクスチャ エントロピー表面粗さが含まれています。相ログにどの成長率から計算できる合計相対バイオ フィルム細胞蓄積を推定する方法について述べる。
この方法で強調する必要がありますいくつかの小さいが重要なステップがあります。アルコールとのインタ フェースを拭く行く実験から実験するが、井戸に井戸からも 1 つの実験で他の細菌の汚染を避けるために役立ちます。プライミングとシードは、非常にプライミングが乱れる事なくチャンネルを通過するメディアを許可しているチャネルを決定するユーザーを可能にするため重要なまたは目詰まり。チャンネルはありませんする必要があります空気泡無しで実験が成功の可能性を高めるためにプライミングや目詰まり後邪魔 (すなわち彼らは媒体の常に完全にする必要があります、)。シードのステップは、細菌の種類によると変えることができるし、ので細胞付着のために最適化する必要があります。たとえば、細胞が接続する場合は、表面改質は、播種前にマイクロ プレート上で発生する必要があります。 または長い孵化時間が必要であります。また、顕微鏡焦点でイメージを取得する多くの場所が正しく設定されて、品質の画像が得られることを保証するために実験を通して定期的に監視する必要があることを確認しますが重要です。フォーカスがオフの場合、顕微鏡ができ実験が続くように調整する必要があります。画像の取込時間時に、フィルターと画像関連の買収の間に発生した待機時間中に 1 つだけのチャネルに照明の暴露を避けるためにすべてを閉じるに設定最後の波長。また、モンタージュ ソフトウェア マニュアルはプロシージャを明示的に記述しませんでしたので % 表面被覆率を決定する画像解析を家の中に設計されました。さらに、画像解析を展開し、表面粗さなどの他の特性を決定するために.、オープン ソース Python ベースのコード45は gitHub のレポジトリに家の中で共有を開発しました。また、どのくらいのデータを格納およびサイヴァース46など外付けハード ドライブまたはオンラインでのデータ共有が必要なのでローカルのハード ドライブで管理することができます制限されます。
CDC 原子炉や点滴フロー炉34などの従来型バイオリアクター多くのメディアが必要、少ないサンプル サイズを提供し、機器の殺菌の高い金額を要求します。対照的に、この高いスループット プラットフォームの利点は、流量制御断能力を体外実験密接にことを前提として生体内での条件のようにあります。複数の付属品システムのデメリットし、綿密な設定が必要なソフトウェアは、イベントの正しい順序で行う必要があります。さらに、機器に用意されているマニュアルは完全に実験やソフトウェア コマンドの各ステップを説明し、チャンネル、成長または添付ファイルの欠如の目詰まりを含む、実験中にその結果、多くのミスの発生不足高品質の顕微鏡画像またはムービー。楽器自体、マイクロ プレートなどの消耗品もプレートあたり 200 ドル以上の価格のタグが比較的高価な再利用可能なは。したがって、技術は、強力な結果を貸す、一方その使用に必要な技術的な専門知識が比較的高い、分野の専門家によって繰り返し訓練が必要です。このレポートは、バイオ フィルムの特性を研究するこれらのバイオリアクターの新しいユーザーにガイドを提供することによってこの問題を解決しようとします。
細胞解析を実行することであるマイクロ流体システムの微生物学、免疫学、血液学、腫瘍学、幹細胞研究など様々 な科学的なモダリティの脚光を浴びてきてください。具体的には、技術の医療応用37,47, 口腔微生物の付着は48の決定の影響に関連性の高いトピックを記述する多くの出版物になりました緑膿菌、黄色ブドウ球菌49,50, のバイオサーファクタント ホスト病原体相互作用大腸菌51、連鎖球菌の付着52、および治療嚢胞性線維症53.のこのマイクロ システムは非常に汎用性の高い事実を考えると、ますますシステム世界全体に分散されることも予想されます。
いくつかの特定のプロトコルの手順は慎重に考慮する必要があります。メディアは dH2O 泡、目詰まりを防ぐために 50% に希釈することができますが、この場合は不要であった。外径600シードに使用の特定の値は、成長実験の試験実行を使用して特定の一連の使用条件に最適なものを参照してください決定する必要があります。シーリング前に井戸に泡マイクロ流路における気泡につながることができます、ポップまたはピペットの先端を吸い出さどちらかによって削除する必要があります。小さな蛇紋岩チャネルから細菌を保つために重要です。シード処理中に入力と出力メディアの平等なボリュームを持っていること、によってフローがシステムから圧力のためにだけ、液量からの圧力によりフローが制御されます。校正間隔は、会社代表者がインストール時にセットアップする必要があります。これらの設定は、カメラごとに固有です。
イメージの最も代表的なしきい値を見つけるときに発生するいくつかの課題があります。最大閾値の設定は背景の地域間で平均輝度、一致しないチャネルまたはプレート上の破片からセンターではないステージ位置を選択するかによって引き起こされる場合は難しいでしょう。MM 標準、プロセスをクリックし、これらの不整合を補正する背景とシェーディング補正ツールを選択します。ただし、このツールは役に立つユーザーが播種する前にチャネルの参照画像として使用できる画像を撮影している場合一般的にのみ。または、もし参照/網かけの背景画像はありません、ユーザーは、全体のイメージの背景を含むことがなく、ほとんどセル領域をカバーするしきい値を設定するのには彼らの判断を使用する必要があります。また、矩形領域のクリックによって矛盾、楕円領域、または領域を選択し、全体ではなく、アクティブな領域を選択するトレース領域の領域を除外するを測定する代表的なエリアを選択します。画像地域統計を表示ウィンドウ (分析ツール) の下で。代表的な地域が活用された場合しきい値明視野イメージ、同じ地域は対応する FITC イメージの測定の使用必要があります。特定空間統計 (左、上、幅、高さ、エリア、境界) 同じ地域が発見されるので、その代表的な地域に関連付けられていると便利だし、対応する FITC イメージで測定されます。
遅くコンピューターは、ハード ドライブ上のデータの蓄積を防ぐためには、外付けハード ドライブは、データ ストレージの購入できます。データ ストレージとデータ共有促進のための別のオプションは、サイヴァース バイオインフォマティクス プラットフォームです。サイヴァース システムにアカウントを作成するには、http://www.cyverse.org/ に行きます。ログインすると、探索環境を起動し、「サイヴァースのログ」を選択します。「データ」を選択しフォルダーをしています。画像のスタックがローカル コンピューターにある場合は、「アップロード」し、「デスクトップからシンプルなアップロード」を選択します。画像のスタック ファイルを検索し、アップロードを選択します。もし彼らがサイヴァース アカウントとアクセス許可が付与されます、ファイルまたはフォルダーを共同編集者と共有できます。一般にデータのフォルダーの共有には、メタデータを使用して各ファイルのサイヴァース承認された規格追加する必要があります。この仕事の範囲内ではありませんのでこの手順はここで説明しません。
開示事項
著者が明らかに何もありません。
謝辞
この作業によってできた助成金国立研究所からの一般的な医療科学 (日の出) (5P20GM103427)、健康国立研究所 (NIH) のコンポーネント
資料
| Name | Company | Catalog Number | Comments |
| Ammonium Chloride, ACS | VWR | BDH9208-500G | Part of the minimal media composition |
| BioFlux 1000 48 Well Low Shear Plate | Fluxion Biosciences | 910-0047 | |
| BioFlux 1000Z Microfluidic Imaging System | Fluxion Biosciences | BF 1000Z | |
| Calcium Chloride Dihydride, ACD Grade | VWR | 97061-904 | Part of the minimal media composition |
| Dextrose, Anhydrous, ACS | VWR | BDH9230-500G | Part of the minimal media composition |
| Magnesium Sulfate ACS Grade | VWR | EM-MX0070-1 | Part of the minimal media composition |
| Potassium Phosphate Monobasic, ACS Grade | VWR | BDH9268-500G | Part of the minimal media composition |
| Pseudomonas Aeurginosa GFP | ATCC | 15692GFP | Pseudomonas aeurinosa bacterial strain PA01 with GFP modification used for this study. |
| Sodium Chloride, ACS | VWR | BDH9286-500G | Part of the minimal media composition |
| Sodium Phosphate, Monobasic, Anhydrous, Reagent Grade | VWR | 97061-942 | Part of the minimal media composition |
参考文献
- Donlan, R. M., et al. Model System for Growing and Quantifying Streptococcus pneumoniae Biofilms In Situ and in Real Time. Applied and Environmental Microbiology. 70 (8), 4980-4988 (2004).
- Lührig, K., et al. Bacterial Community Analysis of Drinking Water Biofilms in Southern Sweden. Microbes and Environments. 30 (1), 99-107 (2015).
- Singh, R., Paul, D., Jain, R. Biofilms: implications in bioremediation. Trends in Microbiology. 14 (9), 389-397 (2006).
- Veerachamy, S., et al. Bacterial adherence and biofilm formation on medical implants: A review. Proceedings of the Institution of Mechanical Engineers, Part H: Journal of Engineering in Medicine. 228 (10), 1083-1099 (2014).
- Lyczak, J. B., Cannon, C. L., Pier, G. B. Establishment of Pseudomonas aeruginosa infection: lessons from a versatile opportunist. Microbes and Infection. 2 (9), 1051-1060 (2000).
- Percival, S. L., Knapp, J. S., Edyvean, R., Wales, D. S. Biofilm Development On Stainless Steel In Mains Water. Water Research. 32 (1), 243-253 (1998).
- Percival, S. L., Knapp, J. S., Wales, D. S., Edyvean, R. G. J. The effect of turbulent flow and surface roughness on biofilm formation in drinking water. Journal of Industrial Microbiology and Biotechnology. 22 (3), 152-159 (1999).
- Ling, F., Whitaker, R., LeChevallier, M. W., Liu, W. -T. Drinking water microbiome assembly induced by water stagnation. The ISME Journal. , 1(2018).
- Moss, B. Water pollution by agriculture. Philosophical Transactions of the Royal Society B: Biological Sciences. 363 (1491), 659-666 (2008).
- Schultz, M. P., Bendick, J. A., Holm, E. R., Hertel, W. M. Economic impact of biofouling on a naval surface ship. Biofouling. 27 (1), 87-98 (2011).
- Tornero, V., Hanke, G. Chemical contaminants entering the marine environment from sea-based sources: A review with a focus on European seas. Marine Pollution Bulletin. 112 (1-2), 17-38 (2016).
- LaBauve, A. E., Wargo, M. J. Growth and Laboratory Maintenance of Pseudomonas aeruginosa. Current Protocols in Microbiology. 25 (1), 1-8 (2012).
- He, J., et al. The broad host range pathogen Pseudomonas aeruginosa strain PA14 carries two pathogenicity islands harboring plant and animal virulence genes. Proceedings of the National Academy of Sciences of the United States of America. 101 (8), 2530-2535 (2004).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Zhang, G., Gurtu, V., Kain, S. R. An Enhanced Green Fluorescent Protein Allows Sensitive Detection of Gene Transfer in Mammalian Cells. Biochemical and Biophysical Research Communications. 227 (3), 707-711 (1996).
- Patterson, G. H., Knobel, S. M., Sharif, W. D., Kain, S. R., Piston, D. W. Use of the green fluorescent protein and its mutants in quantitative fluorescence microscopy. Biophysical Journal. 73 (5), 2782-2790 (1997).
- Chalfie, M., Tu, Y., Euskirche, G., Ward, W. W., Prashert, D. C. Green fluorescent protein as a marker for gene expression. Science. 263 (5148), 802-805 (1994).
- Heim, R., Prasher, D., Tsien, R. Wavelength mutations and posttranslational autoxidation of green fluorescent protein. Proceedings of the National Academy of Sciences of the United States of America. 91, 12501-12504 (1994).
- Bakke, R., Kommedal, R., Kalvenes, S. Quantification of biofilm accumulation by an optical approach. Journal of Microbiological Methods. 44 (1), 13-26 (2001).
- Heydorn, A., et al. Statistical analysis of Pseudomonas aeruginosa biofilm development: impact of mutations in genes involved in twitching motility, cell-to-cell signaling, and stationary-phase sigma factor expression. Applied and Environmental Microbiology. 68 (4), 2008-2017 (2002).
- Wilson, E., et al. Using Fluorescence Intensity of Enhanced Green Fluorescent Protein to Quantify Pseudomonas aeruginosa. Chemosensors. 6 (21), (2018).
- Fang, H., Chen, Y., Huang, L., He, G. Analysis of biofilm bacterial communities under different shear stresses using size-fractionated sediment. Scientific Reports. 7 (1), 1299(2017).
- Saunders, K. A., Greenman, J. The formation of mixed culture biofilms of oral species along a gradient of shear stress. Journal of Applied Microbiology. 89 (4), 564-572 (2001).
- Valquier-Flynn, H., Wilson, C. L., Holmes, A. E., Wentworth, C. D. Growth Rate of Pseudomonas aeruginosa Biofilms on Slippery Butyl Methacrylate-Co-Ethylene Dimethacrylate (BMA-EDMA), Glass and Polycarbonate Surfaces. Journal of Biotechnology & Biomaterials. 7 (4), (2017).
- Trulear, M. G., Characklis, W. G. Dynamics of biofilm processes. Journal (Water Pollution Control Federation). 54 (9), 1288-1301 (1982).
- Machineni, L., Rajapantul, A., Nandamuri, V., Pawar, P. D. Influence of Nutrient Availability and Quorum Sensing on the Formation of Metabolically Inactive Microcolonies Within Structurally Heterogeneous Bacterial Biofilms: An Individual-Based 3D Cellular Automata Model. Bulletin of Mathematical Biology. 79 (3), 594-618 (2017).
- Jiao, Y., et al. Identification of Biofilm Matrix-Associated Proteins from an Acid Mine Drainage Microbial Community. Applied and Environmental Microbiology. 77 (15), 5230-5237 (2011).
- Flemming, H. C., Wingender, J. The Biofilm Matrix. Nature Reviews Microbiology. 8 (9), 632-633 (2010).
- Yang, X., Beyenal, H., Harkin, G., Lewandowski, Z. Quantifying biofilm structure using image analysis. Journal of Microbiological Methods. 39 (2), 109-119 (2000).
- Heydorn, A., et al. Quantification of biofilm structures by the novel computer program COMSTAT. Microbiology. 146 (10), 2395-2407 (2000).
- Azeredo, J., et al. Critical review on biofilm methods. Critical Reviews in Microbiology. 43 (3), 313-351 (2017).
- Goeres, D. M., et al. A method for growing a biofilm under low shear at the air liquid interface using the drip flow biofilm reactor. Nature Protocols. 4 (3), 783-788 (2009).
- Goeres, D. M., et al. Statistical assessment of a laboratory method for growing biofilms. Microbiology. 151, 757-762 (2005).
- Swartz, K., Stephenson, R., Hernandez, M., Jambang, N., Boles, B. R. The use of Drip Flow and Rotating Disk Reactors for Staphylococcus aureus biofilm analysis. Journal of Visual Experiments. (46), e2470(2010).
- Werner, E., et al. Stratified Growth in Pseudomonas aeruginosa Biofilms. Applied and Environmental Microbiology. 70 (10), 6188-6196 (2004).
- Wilson, C., et al. The Quantitative Assessment of Pseudomonas aeruginosa (PA)14 Biofilm Surface Coverage on Slippery Liquid Infused Polymer Surfaces (SLIPS). International Journal of Nanotechnology in Medicine & Engineering. 3 (3), 35-42 (2018).
- Samarian, D. S., Jakubovics, N. S., Luo, T. L., Rickard, A. H. Use of a High-throughput In Vitro Microfluidic System to Develop Oral Multi-species Biofilms. Journal of Visualized Experiments. (94), 52467(2014).
- Rusconi, R., Garren, M., Stocker, R. Microfluidics Expanding the Frontiers of Microbial Ecology. Annual Review of Biophysics. 43, 65-91 (2014).
- Kim, J., Park, H. -D., Chung, S. Microfluidic Approaches to Bacterial Biofilm Formation. Molecules. 17 (8), 9818-9834 (2012).
- Mosier, A. P., Cady, N. C. Analysis of bacterial surface interactions using microfluidic systems. Science Progress. 94 (4), 431-450 (2011).
- Nobile, C. J., Johnson, A. D. Candida albicans Biofilms and Human Disease. Annual Review of Microbiology. 69, 71-92 (2015).
- Chandra, J., Kuhn, D. M., Mukherjee, P. K., Hoyer, L. L., McCormick, T., Ghannoum, M. A. Biofilm Formation by the Fungal Pathogen Candida albicans: Development, Architecture, and Drug Resistance. Journal of Bacteriology. 183 (18), 5385-5394 (2001).
- Vasconcelos, M. A., et al. Effect of Algae and Plant Lectins on Planktonic Growth and Biofilm Formation in Clinically Relevant Bacteria and Yeasts. BioMed Research International. 2014, 9(2014).
- Haralick, R. M., Shanmugam, K., Dinstein, I. Textural Features for Image Classification. IEEE Transactions on Systems, Man, and Cybernetics. 3 (6), 610-621 (1973).
- Wentworth, C. D. Biofilm Morphology Suite. , Available from: https://github.com/cdwentworth/Biofilm-Morphology-Suite.git (2018).
- Cyverse. , Available from: https://user.cyverse.org/services/mine (2018).
- Benoit, M. R., Conant, C. G., Ionescu-Zanetti, C., Schwartz, M., Matin, A. New Device for High-Throughput Viability Screening of Flow Biofilms. Applied and Environmental Microbiology. 76 (13), 4136-4142 (2010).
- Ding, A. M., Palmer, R. J., Cisar, J. O., Kolenbrander, P. E. Shear-Enhanced Oral Microbial Adhesion. Applied and Environmental Microbiology. 76 (4), 1294-1297 (2010).
- Diaz De Rienzo, M. A., Stevenson, P. S., Marchant, R., Banat, I. M. Effect of biosurfactants on Pseudomonas aeruginosa and Staphylococcus aureus biofilms in a BioFlux channel. Applied Microbiology and Biotechnology. 100 (13), 5773-5779 (2016).
- Moormeier, D. E., Bayles, K. W. Staphylococcus aureus Biofilm: A Complex Developmental Organism. Molecular Microbiology. 104 (3), 365-376 (2017).
- Tremblay, Y. D. N., Vogeleer, P., Jacques, M., Harel, J. High-Throughput Microfluidic Method To Study Biofilm Formation and Host-Pathogen Interactions in Pathogenic Escherichia coli. Applied and Environmental Microbiology. 81 (8), 2827-2840 (2015).
- Nobbs, A. H., Lamont, R. J., Jenkinson, H. F. Streptococcus Adherence and Colonization. Microbiology and Molecular Biology Reviews. 73 (3), 407-450 (2009).
- Díez-Aguilar, M., Morosini, M. I., Köksal, E., Oliver, A., Ekkelenkamp, M., Cantón, R. Use of Calgary and Microfluidic BioFlux Systems To Test the Activity of Fosfomycin and Tobramycin Alone and in Combination against Cystic Fibrosis Pseudomonas aeruginosa Biofilms. Antimicrobial Agents and Chemotherapy. 62 (1), 01650-01717 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved