このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
トランスミッションベースのノマルスキー型差動干渉造影顕微鏡を用いたプラズモニックナノ粒子の分光法の実行
要約
このプロトコルの目的は、プラズモニックナノ粒子サンプルの調製のための実績のあるアプローチを詳述し、差動干渉コントラスト (DIC) 顕微鏡でそれらに単一粒子分光法を行うことです。
要約
差動干渉の対照 (DIC) 顕微鏡法は可視範囲ライトを使用してマイクロスケールの目的を撮影するために最も一般に採用される強力なイメージ投射用具である。このプロトコルの目的は、プラズモニックナノ粒子サンプルを調製し、DIC 顕微鏡で単一の粒子分光法を実行するための実証済みの方法を詳述することです。反復可能な分光学実験を行うためには、いくつかの重要ステップを注意深く守らなければならない。まず、ランドマークはサンプル基板にエッチングすることができ、サンプル表面を特定し、実験中に目的の領域を追跡するのに役立ちます。次に、基板は、それ以外の場合には、サンプルの検査を妨げるか、不明瞭な破片や汚染物質を適切に洗浄しなければなりません。試料が適切に調製されたら、コーラー照明を使用して顕微鏡の光路を整列させる必要があります。標準のノマルスキースタイル DIC 顕微鏡では、特にプラズモニックナノ粒子が配向に依存する光学的特性を示す場合、サンプルの回転が必要になることがあります。DIC 顕微鏡検査は、2つの固有の直交偏波フィールドを有するため、波長依存性 DIC 造影パターンは、棒状プラズモニックナノ粒子の配向を明らかにする。最後に、データ収集とデータ分析を慎重に実行する必要があります。DIC ベースの分光データを対比値として表現することが一般的であるが、それを強度データとして提示することも可能である。単粒子分光法における DIC のこのデモでは、球状と棒状の金ナノ粒子に着目しています。
概要
1980年代以降、差動干渉コントラスト (DIC) 顕微鏡は、主に生物科学の中のマイクロスケール物のために確保された重要なイメージング手法として見られるようになった。しかし、1950年代と1960年代の開発の間に、材料科学1のための技術として意図されていました。近年、プラズモニックナノ粒子に関連する材料科学の進歩に伴い、光学顕微鏡による材料の特性評価への関心が高まっています。
ナノ材料特性評価 (例えば、暗視野、明視野、偏光、蛍光など) には、多くの光学技術が確実に利用可能です。ダークフィールドは、ナノ粒子研究で広く普及しているが、それは散乱の収集にのみ依存し、複雑なサンプル2に関する限られた情報を提供します。蛍光は有用であるが、luminesce または適切に染色することができるサンプルでのみ可能である。DIC 顕微鏡検査は、ナノ粒子の分析のための貴重なツールにするいくつかの特徴を持っています。他の方法およびプラズモニックナノ粒子に関して、DIC の最も頻繁に述べられている利点は、サンプル染色は不要、ハロー効果、浅い被写界深度、高い横方向の解像度3です。また、DIC にはプラズモニックナノ粒子研究に価値のある付加的な強みがあります。まず第一に、2つの固有および直交偏波フィールドが存在し、それらは分光法の目的2のために同時に測定することができる。第二に、ナノ粒子の脱分極しシグナルは最終画像2に捕捉されず、これは暗視野分光測定において重大な懸念の原因となり得る。
本稿の目的は、透過光ノマルスキー DIC 顕微鏡を用いて、プラズモニックナノ粒子の分光分析を行うための明確な方法論を提供することである。DIC は、非常に多様な素材に応用できる力強い技術ですが、ナノ粒子をイメージングする際には、優れた技術と理解を必要とする技術でもあります。トランスミッションベースのノマルスキーには、ここでは簡単に確認できる複雑な光路1があります。DIC の光学列車が図 1に表示されます。光は、最初に偏光子を通過させることによって顕微鏡を透過し、試料面上に凝縮器によって集束される前にビーム分割ノマルスキープリズム。目的を通過した後、光は、検出器に出る前にビーム結合ノマルスキープリズムとアナライザに遭遇する。2つの偏光子とノマルスキープリズムは DIC 画像の形成に重要であり、DIC の2つの直交偏波フィールド1を生産するための責任があります。ノマルスキー DIC 顕微鏡の作業原理と光路についての詳細を知りたい読者のために、またはノマルスキー DIC と他のスタイルとの違いについては、これらのトピック1の他のよく書かれたアカウントを参照してください。4,5,6,7.
それはノマルスキー DIC、暗視野、または他の顕微鏡技術のいずれかであるかどうか、それらに分光を実行しようとする前に、プラズモニックナノ粒子の基本的な性質を理解することも同様に重要です。プラズモニクスの分野では、ナノ粒子は 10-100 nm8,9のスケールの寸法を有する微粒子として定義されています。ナノ粒子は、多くの形状 (例えば、球、棒、星、ダンベルなど) を取ることができ、その重要な特性のほとんどは、電磁スペクトルの紫外可視近赤外領域における光との相互作用に起因します。用語「プラズモニック」は、ナノ粒子10に限定されない。しかしながら、ナノ粒子について論じる際には、局在化した表面プラズモン共鳴 (LSPR) に関して用いられる。LSPR は、ナノ粒子中の伝導電子が、高度に特異的で比較的狭い周波数帯8の電磁放射とのクーロン相互作用によって振動する現象である。これらの同じ周波数で、プラズモニックナノ粒子は光の吸収と散乱を増加させ、光学顕微鏡で観察することができます。多くの場合、凝縮器2の前にバンドパスフィルタを配置しながらナノ粒子を観察し、画像化コントラストを改善し、LSPR 効果を誘導しない光を除去することが好ましい。フィルタを用いて、単一粒子分光分析実験を行うこともできる。
LSPR 関連の光学的挙動は、ナノ粒子の大きさや形状に大きく依存し、多くの光学顕微鏡技術で調べることができます。しかしながら、異方性 (すなわち、非球面) 形状のプラズモニックナノ粒子の配向情報を復号するためには、光場の偏光を利用する必要がある。偏光場または試料基板を小さな増分で注意深く回転させることにより、個々のナノ粒子の配向依存性分光特性を監視することができる。回転と偏波は、スペクトル特徴がナノ粒子の表面電子のからまたはより高い次数振動によるものであるかどうかを判断するのにも役立ちます。しかし、等方性 (すなわち球状) ナノ粒子の場合、偏光下で試料を回転させても、スペクトルプロファイルは本質的に変化しないままである。
DIC 顕微鏡を通して見た場合 (図 2)、ナノ粒子は、灰色の背景に影キャスト白と黒の外観と風通しのディスクを持っています。球状ナノ粒子は、回転とバンドパスフィルタの変更でこの外観を保持します。しかし、フィルタの中心波長が球体の唯一のから LSPR 波長11からさらに分離されるにつれて、粒子は徐々に視界から消えていく。ナノロッドの外観は、2を回転させるにつれて劇的に変化することがあります。ナノロッドにはからの動作を持つ2つの LSPR バンドがあり、その位置はナノロッドの物理的寸法に基づいています。ナノロッドの長手方向の軸が DIC 偏波フィールドの1つに平行に配向されている場合、その LSPR 波長に関連付けられたバンドパスフィルタを使用している場合、風通しのいいディスクはすべて白または黒で表示されます。サンプル90°を回転させた後、それは反対の色を取るでしょう。あるいは、ナノロッドの横方向の軸が縦軸に対して垂直であるため、2つの軸の LSPR 波長に一致するフィルターを切り替えるときにロッドは反対の色をとります。他の向きやフィルター設定では、ナノロッドはより球体のように見え、さまざまなシャドウキャスト風通しのいいディスクパターンを提示します。横軸 < ナノロッドの場合、DIC 顕微鏡を用いてその LSPR の波長での信号を検出することは困難です。
単一粒子分光法を実行するには、正しい光学部品を使用し、それらを適切に位置合わせすることが重要です。DIC 顕微鏡検査が可能な目標を使用する必要があります。単一の粒子の実験のために、80x または100x オイルの目的は理想的である。DIC ノマルスキープリズム通常、標準、ハイコントラスト、高解像度の3種類があります。理想的な型は、実験の目的とナノ粒子の大きさに大きく依存する。標準的なプリズムは多くの実験のために罰金である;しかし、より小さいナノ粒子 (< 50 nm) で作業する場合、粒子のコントラストはサイズ11の減少につれて減少するため、ハイコントラストプリズムは有益です。DIC コントラストの調整は、偏光子を回転させるか、または、顕微鏡のブランドまたはモデル6に応じて、dic プリズムのいずれかを翻訳することによって達成される。
コーラー照明と偏光子の設定を設定した後、分光データを収集しながらこれらの設定を再調整しないことが重要です。さらに、フィルターと角度の設定を切り替える場合でも、データ収集中は常に一定の平均バックグラウンドシグナルを維持する必要があります。実際の理想的な背景値は、科学カメラのダイナミックレンジに依存しますが、一般に、背景は、カメラの最大検出レベルの 15% ~ 40% の範囲内でなければなりません。これにより、最適なパーティクルコントラストを実現しながら、カメラセンサーが飽和する可能性を低減できます。分光分析データを収集するには、カラーカメラとは対照的に、白黒で画像をキャプチャする科学的なカメラを使用する必要があります。
試料調製は、プラズモニックナノ粒子の画像化のもう一つの重要な側面である。DIC 顕微鏡検査のオペレータは、サンプルの光学特性とサンプルの基板を理解していることが不可欠です。「プレクリーニング」顕微鏡ガラスは、画像化ナノ粒子に十分に調製されておらず、試料の遮るもののない観察を確実にするために試料蒸着前に適切に再洗浄されなければならない。顕微鏡スライドのための多くのクリーニングプロトコルは以前に文書化されています12, しかし、それは通常、実験的研究で報告されているステップではないです。.
最後に、データ分析法は、単一粒子分光法の最終成分である。各ナノ粒子の最大および最小強度を、局所的な背景平均と同様に測定する必要があります。対象となるパーティクルは、背景破片、基板欠陥、または不均一な照明のないエリアに配置する必要があります。ナノ粒子のスペクトルプロファイルを決定するための1つの方法は、各波長で粒子のコントラストを計算することによって、11,13,14,15以下の式を使用する。

あるいは、単一の粒子のスペクトルを、DIC の2つの偏波フィールドを表す個々の最大および最小信号成分に分割することができ、それによって2つの同時に収集された方向依存性スペクトルを表示し、2つの式を通して:
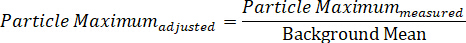
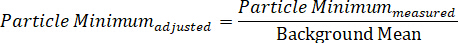
プロトコル
1. 標準的なガラス顕微鏡のスライドとのサンプル準備
- サンプル蒸着用のガラス顕微鏡スライドを準備します。
注: 状況によっては、ガラスをエタノールの代わりに超純水に保存する方が適切な場合があります。しかし、水または空気中に貯蔵することは、時間の経過とともにガラスを疎水性にする。- 最良の結果を得られるように、ガラスまたは石英顕微鏡のスライドとカバーガラスを購入します。
- スクライビングペンを使用して、各ガラスカバースリップの中央に浅い、短いスクラッチマークを置きます。
- 「予備洗浄」を購入した場合でも、すべての顕微鏡ガラスを洗浄し、ガラス破片、ほこり、粉末、有機残渣、およびイメージング品質またはサンプル堆積に影響を与えるその他の汚染物質を除去します。
注: 以下のこの洗浄方法は、ここに記載されているサンプルの種類に適しており、過酷な化学薬品の使用を回避します。過酷な化学薬品はガラスをエッチングすることができ、取り扱いや廃棄により多くの注意を必要とします。- 保管ラックに顕微鏡ガラスを置き、ビーカーに、または染色瓶の中に入れます。顕微鏡ガラスの各部分と表面を洗浄剤に完全に暴露する必要があるため、ビーカーおよび他のラボのガラス製品の底部に顕微鏡ガラスを置くことはできません。
- ~ 1ml の液体洗剤 (材料表) を容器に注ぎ、容器の上から水で外します。超音波処理30分
注: クリーニングプロセスが開始されると、ガラスに指紋残渣が残るのを避けるために、手袋を装着した状態でのみガラスを処理します。 - 洗浄容器の液体内容物を流しに注ぎます。超純水で容器を数回リンスし、洗剤の外観をすべて除去します。容器に超純水を補充します。超音波処理は、別の30分の顕微鏡ガラスで容器を使用します。
- 前の手順を少なくとももう一度繰り返します。それは洗剤のすべての痕跡が除去されていることが明らかになるまで水に超音波処理の追加のラウンドを実行します。
- 洗浄容器の中身を注ぎます。超純水で容器をすすいでください。容器にエタノールを補充する。超音波処理顕微鏡用ガラスを30分間使用
- 洗浄容器の中身をゴミ箱に注ぎます。エタノールで補充する。蒸発によるエタノールの損失を防ぐために容器を覆います。実験の時間まで、この容器に顕微鏡ガラスを保管してください。スライドは、覆われた容器の中でエタノールに水没している限り、清潔で使用可能なままです。
-
ナノ粒子溶液の調製
- マイクロピペットを使用して、0.05 mg/mL の金ナノ粒子溶液を元の貯蔵容器から100μ l アリコートを取り出し、溶液を 1.5 mL の遠心管に排出します。
- サンプルを 6000 x gで10分間遠心します。
- 過剰な界面活性剤を除去するために、マイクロピペットで上清を除去します。
- マイクロピペットを使用して、超純水を遠心管に100μ l を置きます。
注: 最初の試行ですべての上清を除去できる場合は、遠心分離および再懸濁ステップを繰り返します。 - ペレットを再懸濁ためにサンプルを簡単に渦を流します。その後すぐに20分間超音波処理て、ナノ粒子凝集体を完全に再懸濁して分解する。
注: サンプルがすぐに使用されない場合は、顕微鏡ガラス上に溶液を堆積させる前に、20分間再び超音波処理する必要があります。
-
サンプル蒸着
- クリーニング済みカバー・スリップと顕微鏡スライドを保管容器から取り外します。加圧窒素またはアルゴンでガラスを吹き乾かす。
- マイクロピペットを使用して、ステップ1.2.5 からカバースリップにナノ粒子溶液をドロップキャスト6μ l した。液滴を均一に広げるために、2番目のカバースリップの上に顕微鏡ガラスの大きな部分を慎重に配置します。ガラスの2つの部分の間に閉じ込められた気泡を得ることは避けてください。
- サンプル基板を裏返して、中溶液の蒸発を防ぐために、マニキュアの狭いラインでカバースリップの端を密封します。
- あるいは、サンプルを「乾燥」してイメージするために、溶液をカバースリップに5〜15分間放置し、ガラスの不要な小片を除去する。加圧窒素またはアルゴンで乾燥したカバースリップを軽く吹きます。
- 可能であれば、調製直後の画像サンプル。それが不可能な場合は、撮像するまでペトリ皿などの覆われた容器にサンプルを保存する。
2. DIC イメージング
- 対物レンズとコンデンサーを合わせます。
- 顕微鏡上に試料を置いた後、その上に試料を有する焦点面を見つけます。まず、前に作成したスクラッチマークを探してフォーカスを設定します。その後、ナノ粒子が視界に入るまでピントを微調整します。
- 凝縮器の正確な配置を決定するために、コーラー照明法を利用する。高倍率 (80x、100x) での5 つのコーラー照明は、最初にコーラー照明を20x などのより低い倍率で設定することによってより容易に達成される。
注: 通常、コーラーイルミネーションは、1つのサンプルの撮像時に再調整する必要はありません。しかし、新しい顕微鏡スライドに切り替えるとき、コーラー照明が適切に設定されていることを確認するのは良い習慣です。
- コントラスト設定を最適化します。
- イメージング用サンプル内の対象領域を選択します。カメラの視野に合わせて領域を中央に表示し、必要に応じてフォーカスを調整します。
- 顕微鏡が de Senarmont の設計を持っている場合、最大の背景の絶滅に近い偏光子セットから始め、徐々に背景の絶滅の減少に向けて偏光子を回転させます。背景の強度が徐々に増加します。
- 顕微鏡が de Senarmont の設計を持っていない場合は、最大の背景絶滅で設定された光学列車から始めてください。この場合、徐々に背景の絶滅の減少に向けて客観的なプリズム位置を調整します。
注: 理想的な設定は、ナノ粒子が平均局所背景値から最大の強度差 (すなわち、コントラスト) に達すると達成されます。プラズモニックナノ粒子の場合、最適なコントラストは、通常、比較的暗い背景で達成され、したがって、最大の背景絶滅の近くの設定で行われる。
- イメージング用サンプル内の対象領域を選択します。カメラの視野に合わせて領域を中央に表示し、必要に応じてフォーカスを調整します。
- サンプルをイメージします。
- 部屋の照明をオフにして、浮遊照明がプロセスと相互作用するのを防ぎます。
- 科学技術イメージングカメラでナノ粒子を見ながら、最適な背景レベルを決定します。最大で 10 nm の全幅 (FWHM) バンドパス・フィルターを使用して、中央の波長を主な LSPR 波長と共に配置し、関心のある領域を表示します。バックグラウンドレベルがカメラの最大容量レベルの 15% ~ 40% の範囲内になるまでランプ強度または露光時間を調整し、対象領域内のオブジェクトには、カメラの最大強度レベルの 90% を超える信号強度が示されます。
注: ステップ2.3.2 の目標は、フィルタの切り替え時にセンサーが飽和しないようにすることです。理想的な背景レベルは、サンプルとカメラの間で異なります。このステップが完了すると、露光時間を調整することができますが、ランプの強度ではありません。 - それぞれが 10 nm の FWHM を持っていて、全体として対象の全波長範囲を渡るイメージ投射を可能にする一連のバンドパスフィルターとサンプルをイメージしなさい。露光時間を調整することにより、背景の強度が画像間の一貫性 (相互の約 5% 以内) に保たれていることを確認します。フィルタを切り替えた後、イメージをキャプチャする前にサンプルを再フォーカスします。
- すべての情報を保持するために、イメージを非圧縮 TIFF ファイルまたはソフトウェアのネイティブファイル形式で保存します。
- サンプルを回転させます。
- 元の位置でサンプルの画像を収集した後、サンプルを回転させ、ライトパスの追加の向きでイメージすることができます。180°または360°の範囲で、一定の間隔 (10 °または15°など) で回転を実行します。
注: 回転には、回転可能なサンプルステージが必要です。 - セクション 2.1-2.3 のように、イメージからイメージに一貫した背景レベルを提供するためにカメラの設定を調節しなさい。
注: コーラーの照明への調節はなされるべきではない。
- 元の位置でサンプルの画像を収集した後、サンプルを回転させ、ライトパスの追加の向きでイメージすることができます。180°または360°の範囲で、一定の間隔 (10 °または15°など) で回転を実行します。
3. ImageJ を用いたデータ解析
注: 以下の計算は、さまざまなソフトウェア・パッケージや、場合によってはイメージの収集に使用されるネイティブ・プログラムで実行できます。ImageJ は、国立衛生研究所 (NIH) から自由に入手可能なソフトウェアです。
- パーティクルのコントラストまたは強度を計算します。
- ImageJ で画像を開きます。
- 矩形ツールを選択し、対象のメイン領域の周囲に四角形を描画します。
- ツールバーで、[イメージ] を選択してから、[ズーム]を選択します。[イメージング] ウィンドウは、選択した領域を拡大表示します。
- ツールバーの [画像] を選択し、明るさ/コントラストを調整します。新しいウィンドウが表示されます。サンプル領域をよりよく表示できるようにするには、[最小]、[最大]、[明るさ]、[コントラスト] の4つの設定を調整します。これらの調整は、科学的なデータを変更するものではなく、単にサンプル領域の視認性を向上させるだけです。
注: ステップ3.1.3 および3.1.4 は、複数回、逆の順序で実行されてもよい。 - 矩形ツールを再度使用して、測定する最初のナノ粒子の周囲にボックスを描画します。ボックスは、ナノ粒子の風通しの良いディスクよりもわずかに大きい必要があります。
- ツールバーで [解析] を選択し、[測定] をクリックします。新しいウィンドウが表示され、選択したボックスの中にあるピクセルの最小値、最大値、平均強度をレポートします。
- 粒子に隣接する領域にナノ粒子を測定するために使用するボックスをドラッグし、背景のコントラストが比較的均一であり、粒子や汚染物質が存在しない場合。ボックスの元のサイズを保持します。
- [計測] ツールを使用して、背景領域の平均強度を決定します。
- 残りのパーティクルと、それぞれの隣接するバックグラウンド領域を測定します。
- シリーズ内のすべてのイメージの各パーティクルに対して、このプロセスを繰り返します。
- データをスプレッドシートにエクスポートして、すべての波長と角度にわたって各パーティクルのコントラストまたは強度を計算します。
- 次の式13、14、15を使用して、各パーティクルのコントラストを計算します。

注: この式を使用する場合、パーティクルのコントラストは常に 0 > する必要があります。 - 測定された最大パーティクルの強度をバックグラウンド平均で除算して、パーティクルのバックグラウンドで調整された最大値を計算します。
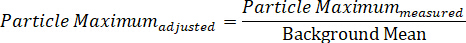
- 同様に、測定された最小粒子強度をバックグラウンド平均で除算することにより、バックグラウンドで調整された最小値を計算します。
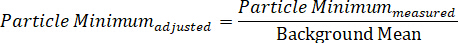
注: 計算されると、最大値は1より大きく、最小は1より小さくなります。各値を「1」で減算して、平均バックグラウンドが実質的にゼロになるようにし、最大値を正の値として表し、最小の数値に負の値16を割り当てることができます。この後者の方法では、分析者はそれぞれの偏波フィールドに沿って何が起こっているかを個別に検討することができ、異方性粒子の研究に役立ちます。 - 特定のナノ粒子位置でスペクトルプロファイルをグラフ化するには、x 軸に沿った波長と、y 軸に沿ったコントラストまたは強度を使用してデータをプロットします。
- 指定した波長の回転プロファイルをグラフ化するには、x 軸に沿って回転角度をプロットし、y 軸に沿ってコントラストまたは強度を描画します。
結果
肉眼で見られるほどの大きさのサンプルを扱う場合、通常はガラス基板上にランドマークを配置する必要はありません。しかし、ナノ材料で作業する場合やサンプルの回転が必要な場合は、ランドマークを使用すると、サンプルの向きを見つけたり、区別したり、追跡したりするための簡単な方法を得ることができます。ガラス基板17上のランドマ?...
ディスカッション
DIC 顕微鏡で撮像する場合、データを収集する前に光学部品を最適化することが重要です。実験の最中に偏光子を微調整しても、最終データ6に大きな影響を与えることがある。さらに、異なる材料は、異なる偏光子設定を必要とする。ここでは大きなステップサイズが偏光角の効果を実証するために利用されていましたが、実際の実験では、最適なコントラスト設定の1° ~ 2 ...
開示事項
作者は何も開示することはありません。
謝辞
アンソニー・ S ・ Stender 博士は、オハイオ大学のナノスケール・量子現象研究所 (NQPI) を通じて、技術支援の承認を希望しています。この記事は、オハイオ大学によって Stender 博士に提供されたスタートアップ資金を通じて可能になりました。
資料
| Name | Company | Catalog Number | Comments |
| Contrad 70 | Decon Labs, Inc. | 1002 | For cleaning microscope glass, Available through many chemical suppliers |
| Ethanol | Fisher Scientific | A962-4 | For cleaning and storing microscope glass |
| Glass microscope cover slips | Ted Pella | 260148 | |
| Glass microscope slides | Ted Pella | 26007 | |
| Gold nanorods | Nanopartz | DIAM-SPR-25-650 | |
| Gold nanospheres (80 nm) | Sigma Aldrich | 742023-25ML | |
| ImageJ | NIH | N/A | Free Software availabe for data analysis from NIJ |
| Nail polish | Electron Microscopy Sciences | 72180 | |
| Nikon Ti-E microscope | Nikon | N/A | |
| Nitrogen gas | Airgas | N/A | |
| ORCA Flash 4.0 V2+ digital sCMOS camera | Hamamatsu | 77054098 | |
| Scribing pen | Amazon | N/A | Many options available online for under $10. Not necessary to buy an expensive version. |
| Ultrapure water | 18 megaohm |
参考文献
- Pluta, M. Ch 7: Differential Interference Contrast in. Advanced Light Microscopy. 2, 146-197 (1989).
- Stender, A. S., Wang, G., Sun, W., Fang, N. Influence of Gold Nanorod Geometry on Optical Response. ACS Nano. 4 (12), 7667-7675 (2010).
- Stender, A. S., et al. Single Cell Optical Imaging and Spectroscopy. Chemical Reviews. 113 (4), 2469-2527 (2013).
- Mehta, S. B., Sheppard, C. J. R. Partially coherent image formation in differential interference contrast (DIC) microscope. Optics Express. 16 (24), 19462-19479 (2008).
- Murphy, D. B., Davidson, M. W. Ch 1: Fundamentals of Light Microscopy. Fundamentals of Light Microscopy and Electronic Imaging, Second edition. , 1-20 (2012).
- Stender, A. S., Augspurger, A. E., Wang, G., Fang, N. Influence of Polarization Setting on Gold Nanorod Signal at Nonplasmonic Wavelengths Under Differential Interference Contrast Microscopy. Analytical Chemistry. 84 (12), 5210-5215 (2012).
- Wang, G., Sun, W., Luo, Y., Fang, N. Resolving Rotational Motions of Nano-objects in Engineered Environments and Live Cells with Gold Nanorods and Differential Interference Contrast Microscopy. Journal of the American Chemical Society. 132 (46), 16417-16422 (2010).
- Kelly, K. L., Coronado, E., Zhao, L. L., Schatz, G. C. The Optical Properties of Metal Nanoparticles: The Influence of Size, Shape, and Dielectric Environment. The Journal of Physical Chemistry B. 107 (3), 668-677 (2003).
- Mulvaney, P. Not All That's Gold Does Glitter. MRS Bulletin. 26 (12), 1009-1014 (2012).
- Maier, S. A. . Plasmonics: Fundamentals and Applications. , (2007).
- Sun, W., Wang, G., Fang, N., Yeung, E. S. Wavelength-Dependent Differential Interference Contrast Microscopy: Selectively Imaging Nanoparticle Probes in Live Cells. Analytical Chemistry. 81 (22), 9203-9208 (2009).
- Cras, J. J., Rowe-Taitt, C. A., Nivens, D. A., Ligler, F. S. Comparison of chemical cleaning methods of glass in preparation for silanization. Biosensors and Bioelectronics. 14 (8), 683-688 (1999).
- Augspurger, A. E., Sun, X., Trewyn, B. G., Fang, N., Stender, A. S. Monitoring the Stimulated Uncapping Process of Gold-Capped Mesoporous Silica Nanoparticles. Analytical Chemistry. 90 (5), 3183-3188 (2018).
- Murphy, D. B., Davidson, M. W. Ch 2: Light and Color. Fundamentals of Light Microscopy and Electronic Imaging, Second Edition. , 21-33 (2012).
- Wayne, R. Ch 3: The Dependence of Image Formation on the Nature of Light. Light and Video Microscopy (Second Edition). , 43-78 (2014).
- Stender, A. S., Wei, X., Augspurger, A. E., Fang, N. Plasmonic Behavior of Single Gold Dumbbells and Simple Dumbbell Geometries. The Journal of Physical Chemistry C. 117 (31), 16195-16202 (2013).
- Hu, M., et al. Dark-field microscopy studies of single metal nanoparticles: understanding the factors that influence the linewidth of the localized surface plasmon resonance. Journal of Materials Chemistry. 18 (17), 1949-1960 (2008).
- Choo, P., et al. Wavelength-Dependent Differential Interference Contrast Inversion of Anisotropic Gold Nanoparticles. The Journal of Physical Chemistry C. 122 (47), 27024-27031 (2018).
- Funston, A. M., Novo, C., Davis, T. J., Mulvaney, P. Plasmon Coupling of Gold Nanorods at Short Distances and in Different Geometries. Nano Letters. 9 (4), 1651-1658 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved